【化学】:专题2 第一单元第1课时 氯气的生产原理和性质(苏教版必修1)
文档属性
| 名称 | 【化学】:专题2 第一单元第1课时 氯气的生产原理和性质(苏教版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-08 10:09:41 | ||
图片预览








文档简介
(共56张PPT)
专题2 从海水中获得的化学物质
第一单元 氯、溴、碘及其化合物
第1课时 氯气的生产原理和性质
1.知道氯气的生产原理和实验室制备方法。
2.知道氯气的主要物理性质,并能举例说明。
3.说出氯气的化学性质并能用化学方程式熟练表示。
4.能够说出氯水中存在的微粒并能设计实验加以验证。
5.能够列举氯气及其化合物在生产和生活中的重要应用。
18世纪,世界上许多大城市的污水未经处理就直接排入河流,同时河流还用作饮用水。泰晤士河畔的人们将大部分的污水排入了泰晤士河,这使泰晤士河发出难闻的气味。1848年伦敦发生了大规模的霍乱,这提醒了人们要对饮用水进行消毒。在接下来的十年中,霍乱造成了25000人死亡。因为没有污水处理系统,人们对此无能为力。1855年,伦敦成为世界上最早拥有污水处理的城市,它使用的是什么消毒剂呢?
含氯消毒剂
泰晤士河畔的霍乱
舍勒 【瑞典】 1742一1786
18世纪,人们致力于采矿事业, 瑞典化学家舍勒也把精力放在了软锰矿(主要成分是MnO2)的研究上。
1774年的一天当他把软锰矿粉末和浓盐酸混合加热时,惊奇的看到一种黄绿色的气体冒出。这种呛人的气体不但能使染料褪色,还有许多奇特的性质。
直到1807年,英国化学家戴维对这种气体进行了细致的研究,并于1810年11月在英国皇家学会上正式定名确认上述黄绿色气体是由一种新元素组成,英文定名为“Chlorine”,希腊文的意思是“绿色的”。
化学史实
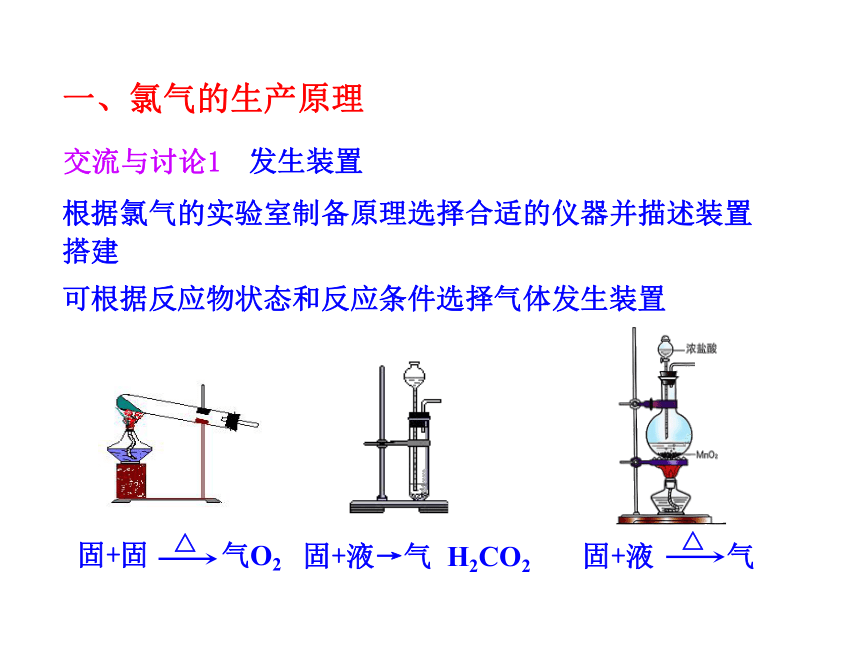
根据氯气的实验室制备原理选择合适的仪器并描述装置搭建
可根据反应物状态和反应条件选择气体发生装置
发生装置
交流与讨论1
固+液→气 H2CO2
一、氯气的生产原理
固+固 气O2
△
固+液 气
△
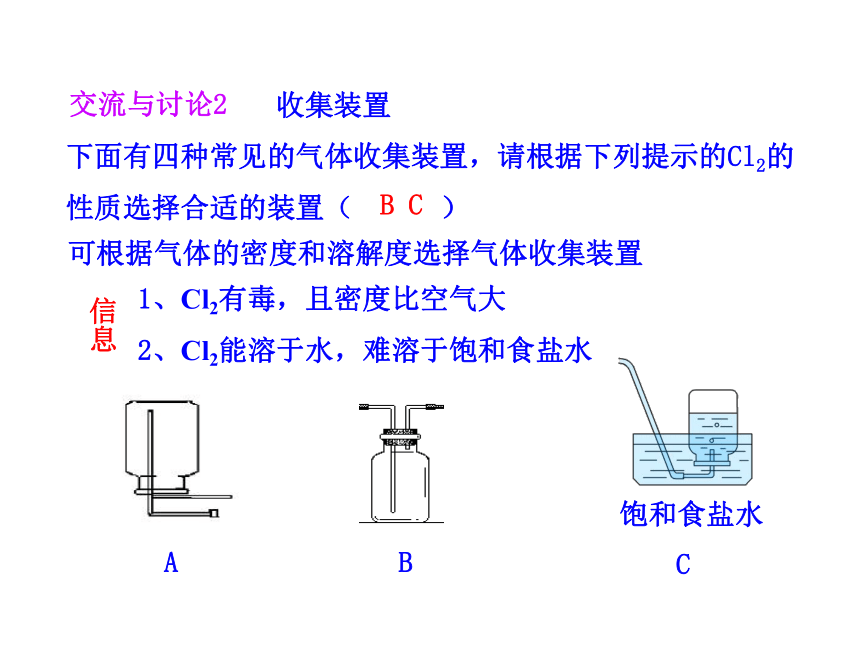
下面有四种常见的气体收集装置,请根据下列提示的Cl2的性质选择合适的装置( )
1、Cl2有毒,且密度比空气大
2、Cl2能溶于水,难溶于饱和食盐水
A
B
可根据气体的密度和溶解度选择气体收集装置
B C
收集装置
饱和食盐水
C
交流与讨论2
信息
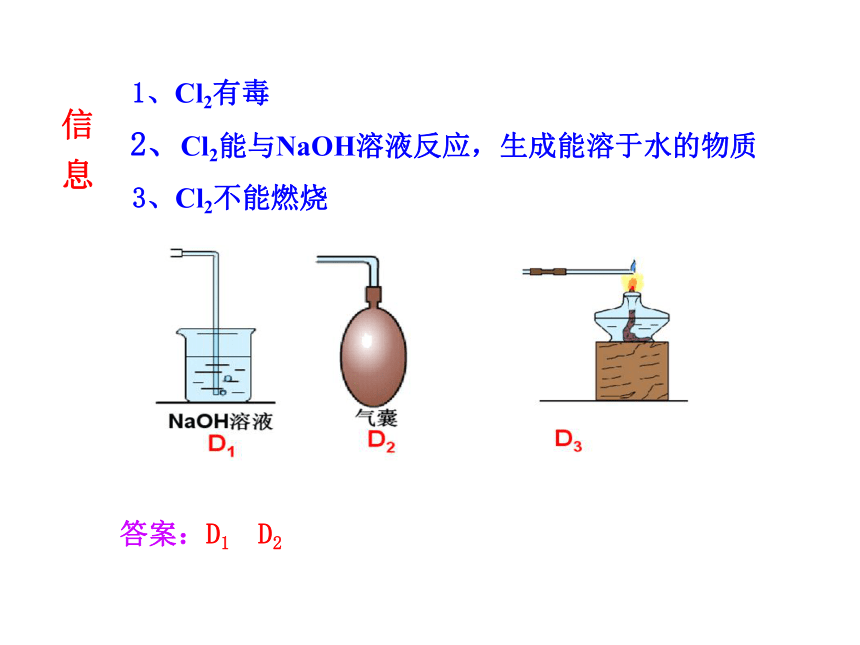
实验室制得的多余氯气可以直接排到空气中去吗?如果不可以,应如何处理?请选择合适的装置( )
可根据气体的性质选择尾气吸收装置
尾气处理装置
交流与讨论3
信 息
1、Cl2有毒
2、Cl2能与NaOH溶液反应,生成能溶于水的物质
3、Cl2不能燃烧
答案:D1 D2
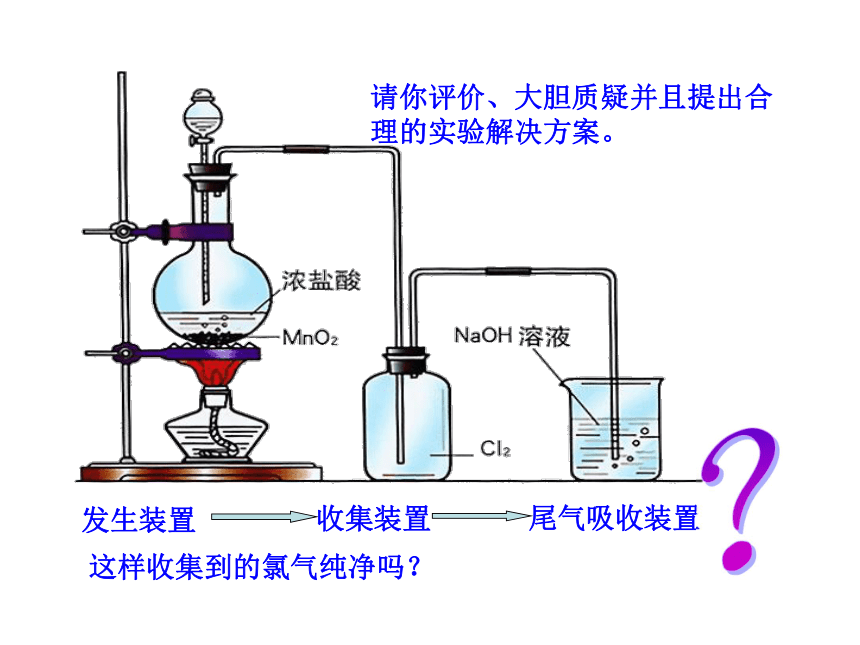
发生装置
收集装置
尾气吸收装置
这样收集到的氯气纯净吗?
请你评价、大胆质疑并且提出合理的实验解决方案。
可根据杂质的性质选择气体净化装置.
1、Cl2能溶于水,难溶于饱和食盐水, HCl易溶于饱和食盐水
2、Cl2能与NaOH反应,生成能溶于水的物质
若想制得纯净、干燥的氯气,请根据提示信息选择合适的装置。
净化装置
交流与讨论4
信 息
Cl2
HCl气体
水蒸气
无水CaCl2
C5
( C2 )
( C4 C5)
实验室制备氯气装置的改进
启示:根据反应反应物的状态、反应条件、生成气体的性质等因素综合考虑而决定。
实验室制气装置的选取需要考虑哪些因素?
发生装置
收集装置
尾气吸收装置
净化装置
除去HCl
除去水蒸气
操作过程:
连接装置
检查气密性
加药品
后期处理(先停止加热)
加热制气
如何连
检查方法
先加 后加
1、为什么用分液漏斗装盐酸?又让盐酸缓慢地注入,而不是一次将浓盐酸注入烧瓶里?
答:用分液漏斗可以控制液体的用量,避免生成的氯气过多。
问题讨论
2、为什么用浓盐酸和二氧化锰制取氯气时,要缓缓加热,不能强热?
答: 浓盐酸有很强的挥发性,强热时能挥发出大量的氯化氢气体和水蒸气,而使制得的氯气中含有大量的杂质;另一方面,又降低了HCl的利用率。
问题2:您知道两支试管中产生的气泡是什么物质吗?
问题1:通电后,我们能看到什么现象呢?
两极上都产生气泡,并体 积上维持1:2
知识回顾:
水的电解
氢气
氧气
问题3:将水换成饱和食盐水后再通直流电会有什么现象呢?
肥皂液
NaOH溶液
1、接通电源,观察U型管内的变化
2、探究a管是什么气体(阴极)
3、探究b管是什么气体?(阳极)
4、滴加酚酞观察电极附近的溶液现象?
信息提示:
氢气:点燃肥皂泡有爆鸣声
氧气:带火星的小木条复燃
氯气:使湿润的KI淀粉试纸变蓝
实验现象
结论
a棒和b棒上通电后有气泡产生
通电后有新的气
体物质生成
通电源
验证气体
点燃火柴靠近肥皂泡,有爆鸣声
有H2生成
b棒气体使湿润淀粉碘化
钾试纸变蓝,黄绿色气
体,闻到有刺激性气味
有Cl2生成
a管和b管加酚酞1~2滴
a棒周围的颜色变红
有碱性物质(NaOH)
生成
操作
2NaCl+2H2O==== 2NaOH +H2↑+ Cl2↑
通电
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”。
氯碱工业产品用途
电解饱和食盐水
NaOH
Cl2
H2
有机合成、造纸、玻璃、肥皂、纺织、印染
有机合成、氯化物合成、农药
有机合成、金属冶炼
HCl
盐酸
若将海水中的盐结晶后平铺于陆地上,地球将增高150米。
问题4:氯碱工业的原料氯化钠主要来源于哪里?
每千克海水几种氯化物的含量
27.2
人们是如何从海水中获得氯化钠的?
海水晒盐过程
海水
蒸发池
粗盐
母液
纯净的NaCl
过滤
提纯
蒸发,结晶
1、工业上利用电解饱和食盐水的方法制取 、 和 。在电源正极上方收集到的气体能使湿润的
变蓝色,证明是 ;在电源负极上方收集到的气体是 ,在电极附近的水溶液中滴几滴酚酞溶液,则溶液 ,证明有 生成。
NaOH
H2、
淀粉碘化钾试纸
Cl2
Cl2
H2
变红
NaOH
知识应用
2、某学生设计如下实验装置用于制备纯净的氯气。装置中有六处错误,请指出。
3、使用浓盐酸与足量的MnO2共热制Cl2,实际产生的Cl2总比理论值低,其主要原因是什么?
稀盐酸与MnO2不反应,随着反应的进行,浓盐酸的物质的量浓度逐渐变小。
C
4、实验室制氯气时有如下操作,操作顺序正确的是( )
①连接好装置,检查气密性
②缓缓加热,加快反应,使气体均匀逸出
③在烧瓶中加入二氧化锰粉末
④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中
⑤用向上排空气法收集氯气,尾气导入吸收剂中
A、①②③④⑤ B、④③①②⑤
C、①③④②⑤ D、①④③②⑤
5、某学生设计如下实验装置用于制备纯净的氯气。
(1)装置中有六处错误,请指出。
① ,
② ,
③ ,
④ ,
⑤ ,
⑥ 。
烧瓶下面缺石棉网
铁圈下面缺酒精灯
原料使用了稀盐酸
不应使用长颈漏斗
盛浓硫酸的洗气瓶和盛饱和食盐水的洗气瓶位置颠倒了
洗气瓶D的气体入口导管应深插在液面下,而出口导管应靠近瓶塞
二、知道了2种制法
MnO2 + 4HCl(浓) ==== MnCl2 +Cl2↑+2H2O
2NaCl+2H2O ====2NaOH+H2↑+Cl2↑
通电
发生装置→净化装置→收集装置→尾气吸收装置
一、总结了1种思路
一套完整的制取气体的实验装置
三、锻炼了3种能力
观察分析能力 推理归纳能力 信息应用能力
发生装置→净化装置→收集装置→尾气吸收装置
一套完整的制取气体的实验装置
史料:第一次世界大战期间,德军与英、法军在比利时伊普尔对峙。德军动用了世界上第一支专业的毒气部队,5分钟释放了180吨毒气,使15000人中毒,三分之一的人死去。这是1915年4月22日发生的令人发指的事件。
图为德军士兵正在投掷毒气弹
二、氯气的性质
一、氯气的物理性质
颜色 状态 密度 气味 熔沸点 溶解性
黄绿色
气态
刺激性气味
比空气大
较低
可溶于水(1:2)
二、氯气的化学性质
氯的原子结构
1、与金属的反应
实验现象:铜丝燃烧,产生大量的棕黄色的烟,溶于水得到蓝绿色的溶液
实验结论:
点燃
Cu + Cl2 ==== CuCl2
点燃
2Na + Cl2 ==== 2NaCl (白色的烟)
点燃
2Fe + 3Cl2 ====2FeCl3
思考:
某同学用铜丝在灯焰上长时间加热再伸入氯气中,未见到棕色烟生成,试分析其可能原因
2、与H2反应
产生苍白色火焰;
瓶口有白雾产生
爆炸
点燃
H2 + Cl2 ==== 2HCl
思考: 可燃物质燃烧的条件有哪些?铜、氢气在氯气中的燃烧又说明了什么?
H2 + Cl2 ==== 2HCl
光照
实验操作 干燥的红色纸片放入氯气瓶 潮湿的红色纸片放入氯气瓶
实验现象
实验结论
纸片由红变白
红色纸片无变化
潮湿的氯气有漂白性
干燥的氯气没有漂白性
3、与水的反应
Cl2 + H2O ====HCl + HClO(次氯酸)
2HClO ==== 2HCl + O2↑
光照
HClO性质: 弱酸性 强氧化性 不稳定性
思考:新制的氯水的成分有哪些
完成下列表格:
类别 状态 粒子 漂白性
氯气
液氯
新制氯水
久置氯水
气态
液态
液态
Cl2分子
纯净物
纯净物
混合物
Cl2分子
无
无
有
H2O、 Cl2、HClO
Cl-、 H+、 ClO-
混合物
液态
H2O、 Cl-、 H+
无
OH-
OH-
次氯酸的性质小结
次氯酸的氧化性很强,
能杀死水中的细菌,
也能使染料等有机色素褪色,
在光照下易分解放出氧气。
4.与碱反应
Cl2 + 2NaOH ==== NaCl + NaClO +H2O
次氯酸钠
2Cl2 + 2Ca(OH)2 ====Ca(ClO)2 + CaCl2 + 2H2O
次氯酸钙
处理实验多余氯气,避免污染。
Ca(ClO)2 + CO2 + H2O ==== CaCO3 + 2HClO
二氧化氯
氯气是一种非常重要的工业原料。但它的储存与运输过程中若操作不当或钢瓶故障等,可能会发生泄漏事件。
假如你在氯气泄漏现场,你会怎么办?
学以致用
生活中的化学
泄漏现场向空中不断喷出碱性水幕,以防止氯气扩散。
抢险人员穿着防化服进入现场
将槽罐车浸入碱性水溶液中
漂白粉
漂粉精
含氯制品
聚氯乙烯塑料
药品
农药
盐酸——
氯化氢的水溶液
1、若一瓶氯水在阳光下放置很久,那么此时氯水的成分是什么?与新制氯水有何区别?
由于氯气与水反应生成次氯酸,而次氯酸见光易分解,
Cl2 HClO HCl 这个过程不断进行,使氯水中的氯气,以及次氯酸最终全转化为HCl,所以在阳光下久置后的氯水的主要成分应是HCl。
2、市场上销售的“84”消毒液,其商品标识上注明( )
①本品为无色液体呈碱性,
②使用时应加水稀释,
③可对餐具,衣物进行消毒可漂白浅色衣物。则其有效成分为:
A、Cl2 B、SO2 C、NaClO D、KMnO4
A
3、在新制的氯水中滴入紫色石蕊试液,则溶液( )
A、变成红色
B、呈紫色
C、先变红后褪色
D、先变蓝后褪色
C
4、用滴管将新制的氯水慢慢滴入石蕊试液,请预测将看到的实验现象。
由于氯水中含有氢离子,所以石蕊试液会先变红,然后由于次氯酸的漂白作用,又会使石蕊试液褪色。
5、下列说法正确的是:( )
A、Cl-的半径比Cl的半径大
B、Cl2有毒,Cl-也有毒
C、Cl和Cl-的化学性质一样
D、Cl2和Cl-都是黄绿色
A
1.氯气是黄绿色气体;密度比空气大;能溶于水,1体积
水能溶2体积氯气;氯气有毒。
2.氯气的化学性质极为活泼,氯气可以和绝大多数的
金属反应,也可以和许多非金属反应。
3.新制氯水成分HClO 、HCl、 H2O
4.久制氯水成分稀盐酸
专题2 从海水中获得的化学物质
第一单元 氯、溴、碘及其化合物
第1课时 氯气的生产原理和性质
1.知道氯气的生产原理和实验室制备方法。
2.知道氯气的主要物理性质,并能举例说明。
3.说出氯气的化学性质并能用化学方程式熟练表示。
4.能够说出氯水中存在的微粒并能设计实验加以验证。
5.能够列举氯气及其化合物在生产和生活中的重要应用。
18世纪,世界上许多大城市的污水未经处理就直接排入河流,同时河流还用作饮用水。泰晤士河畔的人们将大部分的污水排入了泰晤士河,这使泰晤士河发出难闻的气味。1848年伦敦发生了大规模的霍乱,这提醒了人们要对饮用水进行消毒。在接下来的十年中,霍乱造成了25000人死亡。因为没有污水处理系统,人们对此无能为力。1855年,伦敦成为世界上最早拥有污水处理的城市,它使用的是什么消毒剂呢?
含氯消毒剂
泰晤士河畔的霍乱
舍勒 【瑞典】 1742一1786
18世纪,人们致力于采矿事业, 瑞典化学家舍勒也把精力放在了软锰矿(主要成分是MnO2)的研究上。
1774年的一天当他把软锰矿粉末和浓盐酸混合加热时,惊奇的看到一种黄绿色的气体冒出。这种呛人的气体不但能使染料褪色,还有许多奇特的性质。
直到1807年,英国化学家戴维对这种气体进行了细致的研究,并于1810年11月在英国皇家学会上正式定名确认上述黄绿色气体是由一种新元素组成,英文定名为“Chlorine”,希腊文的意思是“绿色的”。
化学史实
根据氯气的实验室制备原理选择合适的仪器并描述装置搭建
可根据反应物状态和反应条件选择气体发生装置
发生装置
交流与讨论1
固+液→气 H2CO2
一、氯气的生产原理
固+固 气O2
△
固+液 气
△
下面有四种常见的气体收集装置,请根据下列提示的Cl2的性质选择合适的装置( )
1、Cl2有毒,且密度比空气大
2、Cl2能溶于水,难溶于饱和食盐水
A
B
可根据气体的密度和溶解度选择气体收集装置
B C
收集装置
饱和食盐水
C
交流与讨论2
信息
实验室制得的多余氯气可以直接排到空气中去吗?如果不可以,应如何处理?请选择合适的装置( )
可根据气体的性质选择尾气吸收装置
尾气处理装置
交流与讨论3
信 息
1、Cl2有毒
2、Cl2能与NaOH溶液反应,生成能溶于水的物质
3、Cl2不能燃烧
答案:D1 D2
发生装置
收集装置
尾气吸收装置
这样收集到的氯气纯净吗?
请你评价、大胆质疑并且提出合理的实验解决方案。
可根据杂质的性质选择气体净化装置.
1、Cl2能溶于水,难溶于饱和食盐水, HCl易溶于饱和食盐水
2、Cl2能与NaOH反应,生成能溶于水的物质
若想制得纯净、干燥的氯气,请根据提示信息选择合适的装置。
净化装置
交流与讨论4
信 息
Cl2
HCl气体
水蒸气
无水CaCl2
C5
( C2 )
( C4 C5)
实验室制备氯气装置的改进
启示:根据反应反应物的状态、反应条件、生成气体的性质等因素综合考虑而决定。
实验室制气装置的选取需要考虑哪些因素?
发生装置
收集装置
尾气吸收装置
净化装置
除去HCl
除去水蒸气
操作过程:
连接装置
检查气密性
加药品
后期处理(先停止加热)
加热制气
如何连
检查方法
先加 后加
1、为什么用分液漏斗装盐酸?又让盐酸缓慢地注入,而不是一次将浓盐酸注入烧瓶里?
答:用分液漏斗可以控制液体的用量,避免生成的氯气过多。
问题讨论
2、为什么用浓盐酸和二氧化锰制取氯气时,要缓缓加热,不能强热?
答: 浓盐酸有很强的挥发性,强热时能挥发出大量的氯化氢气体和水蒸气,而使制得的氯气中含有大量的杂质;另一方面,又降低了HCl的利用率。
问题2:您知道两支试管中产生的气泡是什么物质吗?
问题1:通电后,我们能看到什么现象呢?
两极上都产生气泡,并体 积上维持1:2
知识回顾:
水的电解
氢气
氧气
问题3:将水换成饱和食盐水后再通直流电会有什么现象呢?
肥皂液
NaOH溶液
1、接通电源,观察U型管内的变化
2、探究a管是什么气体(阴极)
3、探究b管是什么气体?(阳极)
4、滴加酚酞观察电极附近的溶液现象?
信息提示:
氢气:点燃肥皂泡有爆鸣声
氧气:带火星的小木条复燃
氯气:使湿润的KI淀粉试纸变蓝
实验现象
结论
a棒和b棒上通电后有气泡产生
通电后有新的气
体物质生成
通电源
验证气体
点燃火柴靠近肥皂泡,有爆鸣声
有H2生成
b棒气体使湿润淀粉碘化
钾试纸变蓝,黄绿色气
体,闻到有刺激性气味
有Cl2生成
a管和b管加酚酞1~2滴
a棒周围的颜色变红
有碱性物质(NaOH)
生成
操作
2NaCl+2H2O==== 2NaOH +H2↑+ Cl2↑
通电
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”。
氯碱工业产品用途
电解饱和食盐水
NaOH
Cl2
H2
有机合成、造纸、玻璃、肥皂、纺织、印染
有机合成、氯化物合成、农药
有机合成、金属冶炼
HCl
盐酸
若将海水中的盐结晶后平铺于陆地上,地球将增高150米。
问题4:氯碱工业的原料氯化钠主要来源于哪里?
每千克海水几种氯化物的含量
27.2
人们是如何从海水中获得氯化钠的?
海水晒盐过程
海水
蒸发池
粗盐
母液
纯净的NaCl
过滤
提纯
蒸发,结晶
1、工业上利用电解饱和食盐水的方法制取 、 和 。在电源正极上方收集到的气体能使湿润的
变蓝色,证明是 ;在电源负极上方收集到的气体是 ,在电极附近的水溶液中滴几滴酚酞溶液,则溶液 ,证明有 生成。
NaOH
H2、
淀粉碘化钾试纸
Cl2
Cl2
H2
变红
NaOH
知识应用
2、某学生设计如下实验装置用于制备纯净的氯气。装置中有六处错误,请指出。
3、使用浓盐酸与足量的MnO2共热制Cl2,实际产生的Cl2总比理论值低,其主要原因是什么?
稀盐酸与MnO2不反应,随着反应的进行,浓盐酸的物质的量浓度逐渐变小。
C
4、实验室制氯气时有如下操作,操作顺序正确的是( )
①连接好装置,检查气密性
②缓缓加热,加快反应,使气体均匀逸出
③在烧瓶中加入二氧化锰粉末
④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中
⑤用向上排空气法收集氯气,尾气导入吸收剂中
A、①②③④⑤ B、④③①②⑤
C、①③④②⑤ D、①④③②⑤
5、某学生设计如下实验装置用于制备纯净的氯气。
(1)装置中有六处错误,请指出。
① ,
② ,
③ ,
④ ,
⑤ ,
⑥ 。
烧瓶下面缺石棉网
铁圈下面缺酒精灯
原料使用了稀盐酸
不应使用长颈漏斗
盛浓硫酸的洗气瓶和盛饱和食盐水的洗气瓶位置颠倒了
洗气瓶D的气体入口导管应深插在液面下,而出口导管应靠近瓶塞
二、知道了2种制法
MnO2 + 4HCl(浓) ==== MnCl2 +Cl2↑+2H2O
2NaCl+2H2O ====2NaOH+H2↑+Cl2↑
通电
发生装置→净化装置→收集装置→尾气吸收装置
一、总结了1种思路
一套完整的制取气体的实验装置
三、锻炼了3种能力
观察分析能力 推理归纳能力 信息应用能力
发生装置→净化装置→收集装置→尾气吸收装置
一套完整的制取气体的实验装置
史料:第一次世界大战期间,德军与英、法军在比利时伊普尔对峙。德军动用了世界上第一支专业的毒气部队,5分钟释放了180吨毒气,使15000人中毒,三分之一的人死去。这是1915年4月22日发生的令人发指的事件。
图为德军士兵正在投掷毒气弹
二、氯气的性质
一、氯气的物理性质
颜色 状态 密度 气味 熔沸点 溶解性
黄绿色
气态
刺激性气味
比空气大
较低
可溶于水(1:2)
二、氯气的化学性质
氯的原子结构
1、与金属的反应
实验现象:铜丝燃烧,产生大量的棕黄色的烟,溶于水得到蓝绿色的溶液
实验结论:
点燃
Cu + Cl2 ==== CuCl2
点燃
2Na + Cl2 ==== 2NaCl (白色的烟)
点燃
2Fe + 3Cl2 ====2FeCl3
思考:
某同学用铜丝在灯焰上长时间加热再伸入氯气中,未见到棕色烟生成,试分析其可能原因
2、与H2反应
产生苍白色火焰;
瓶口有白雾产生
爆炸
点燃
H2 + Cl2 ==== 2HCl
思考: 可燃物质燃烧的条件有哪些?铜、氢气在氯气中的燃烧又说明了什么?
H2 + Cl2 ==== 2HCl
光照
实验操作 干燥的红色纸片放入氯气瓶 潮湿的红色纸片放入氯气瓶
实验现象
实验结论
纸片由红变白
红色纸片无变化
潮湿的氯气有漂白性
干燥的氯气没有漂白性
3、与水的反应
Cl2 + H2O ====HCl + HClO(次氯酸)
2HClO ==== 2HCl + O2↑
光照
HClO性质: 弱酸性 强氧化性 不稳定性
思考:新制的氯水的成分有哪些
完成下列表格:
类别 状态 粒子 漂白性
氯气
液氯
新制氯水
久置氯水
气态
液态
液态
Cl2分子
纯净物
纯净物
混合物
Cl2分子
无
无
有
H2O、 Cl2、HClO
Cl-、 H+、 ClO-
混合物
液态
H2O、 Cl-、 H+
无
OH-
OH-
次氯酸的性质小结
次氯酸的氧化性很强,
能杀死水中的细菌,
也能使染料等有机色素褪色,
在光照下易分解放出氧气。
4.与碱反应
Cl2 + 2NaOH ==== NaCl + NaClO +H2O
次氯酸钠
2Cl2 + 2Ca(OH)2 ====Ca(ClO)2 + CaCl2 + 2H2O
次氯酸钙
处理实验多余氯气,避免污染。
Ca(ClO)2 + CO2 + H2O ==== CaCO3 + 2HClO
二氧化氯
氯气是一种非常重要的工业原料。但它的储存与运输过程中若操作不当或钢瓶故障等,可能会发生泄漏事件。
假如你在氯气泄漏现场,你会怎么办?
学以致用
生活中的化学
泄漏现场向空中不断喷出碱性水幕,以防止氯气扩散。
抢险人员穿着防化服进入现场
将槽罐车浸入碱性水溶液中
漂白粉
漂粉精
含氯制品
聚氯乙烯塑料
药品
农药
盐酸——
氯化氢的水溶液
1、若一瓶氯水在阳光下放置很久,那么此时氯水的成分是什么?与新制氯水有何区别?
由于氯气与水反应生成次氯酸,而次氯酸见光易分解,
Cl2 HClO HCl 这个过程不断进行,使氯水中的氯气,以及次氯酸最终全转化为HCl,所以在阳光下久置后的氯水的主要成分应是HCl。
2、市场上销售的“84”消毒液,其商品标识上注明( )
①本品为无色液体呈碱性,
②使用时应加水稀释,
③可对餐具,衣物进行消毒可漂白浅色衣物。则其有效成分为:
A、Cl2 B、SO2 C、NaClO D、KMnO4
A
3、在新制的氯水中滴入紫色石蕊试液,则溶液( )
A、变成红色
B、呈紫色
C、先变红后褪色
D、先变蓝后褪色
C
4、用滴管将新制的氯水慢慢滴入石蕊试液,请预测将看到的实验现象。
由于氯水中含有氢离子,所以石蕊试液会先变红,然后由于次氯酸的漂白作用,又会使石蕊试液褪色。
5、下列说法正确的是:( )
A、Cl-的半径比Cl的半径大
B、Cl2有毒,Cl-也有毒
C、Cl和Cl-的化学性质一样
D、Cl2和Cl-都是黄绿色
A
1.氯气是黄绿色气体;密度比空气大;能溶于水,1体积
水能溶2体积氯气;氯气有毒。
2.氯气的化学性质极为活泼,氯气可以和绝大多数的
金属反应,也可以和许多非金属反应。
3.新制氯水成分HClO 、HCl、 H2O
4.久制氯水成分稀盐酸
