【化学】:专题1 第3单元 人类对原子结构的认识(苏教版必修1)
文档属性
| 名称 | 【化学】:专题1 第3单元 人类对原子结构的认识(苏教版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-08 00:00:00 | ||
图片预览










文档简介
(共46张PPT)
第三单元 人类对原子结构的认识
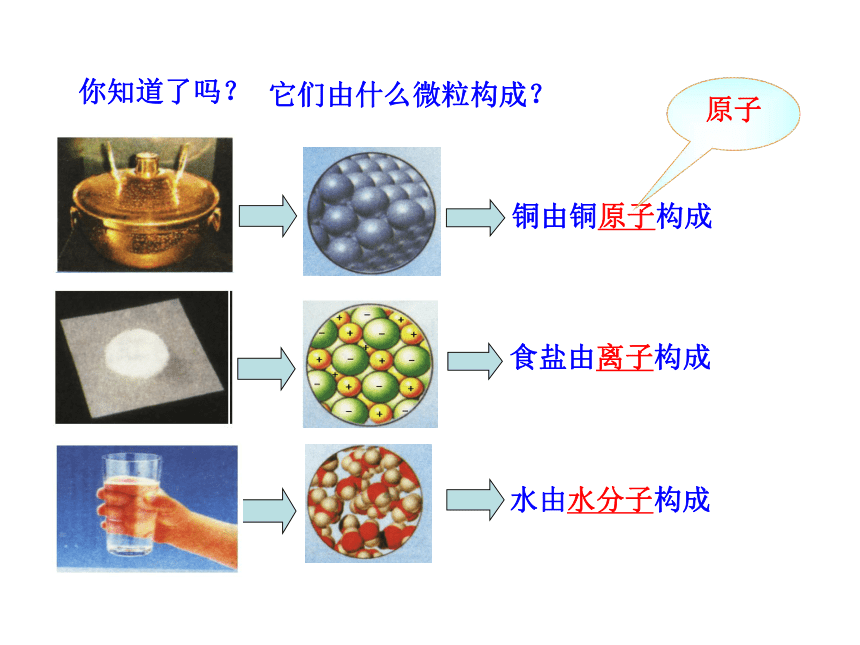
在你眼中… 在化学家眼中…
水由水分子构成
食盐由离子构成
它们由什么微粒构成?
铜由铜原子构成
原子
你知道了吗?
古希腊哲学家 德谟克利特
物质是由不可分割的微粒即“原子”构成的。
历史瞬间
世界之最
1993年8月,我国科学家利用超真空扫描隧道显微镜,在一块晶体硅的表面通过探针的作用搬走原子,写下了“中国”两个字。
英国超级显微镜
世界之最
请大家结合以前学过的知识及教材P27-28的“交流与讨论”,思考下列几个问题。
1、原子结构模型的演变经历了哪几个重要阶段?
2、用简洁的语言表达各阶段(道尔顿、汤姆生、卢瑟福、波尔)对原子结构模型的认识特点?
3、请你谈谈从原子结构的演变得到什么启示?
主要观点
物质由原子组成。
原子不能被创造和毁灭。
原子是不可分割的实心球体。
历史回眸
原子中正电荷均匀地分布在整个球体中,而带负电荷的电子则镶嵌在其中。
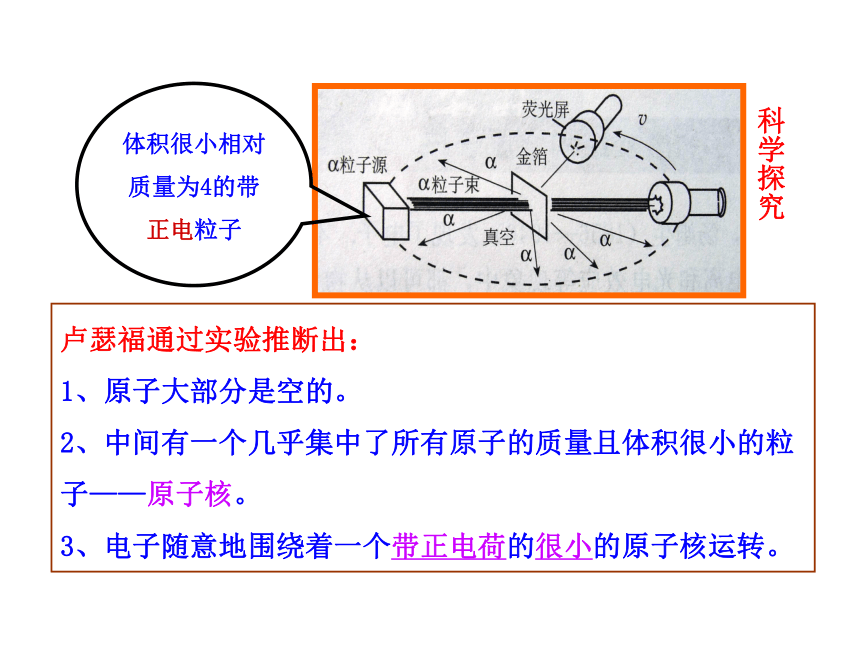
α粒子散射实验
体积很小相对质量为4的带正电粒子
现象:
1、大部分α粒子穿过薄的金箔
2、极少数α粒子好象打在坚硬的东西上,完全反弹回来。
3、少数α粒子穿过薄的金箔时,发生了偏转。
科学探究
卢瑟福通过实验推断出:
1、原子大部分是空的。
2、中间有一个几乎集中了所有原子的质量且体积很小的粒子——原子核。
3、电子随意地围绕着一个带正电荷的很小的原子核运转。
体积很小相对质量为4的带正电粒子
科学探究
质子 中子 电子
质量/kg 1.673×10-27 1.675×10-27 9.109×10-31
相对质量 1.007 1.008 1/1836
⑴原子的质量与质子、中子的质量关系
⑵原子的相对原子质量与质子、中子的相对质量的关系
相对质量:质子、中子的质量与C-12原子质量的1/12相比较所得的数值。
信息提示
质子 中子 电子
质量/kg 1.673×10-27 1.675×10-27 9.109×10-31
相对质量 1.007 1.008 1/1836
质量数:将原子核内所有的质子和中子的相对质量取整数,加起来所得到的数值。
⑶ 原子中质子数、中子数、质量数和原子的相对原子质量之间的关系
原子 质子数
(Z) 中子数
(N) 质子数+中子数(A) 相对原子质量
F 9 10 18.998
Na 11 12 22.990
Al 13 14 26.982
19
23
27
原子的质量相关问题
质量数(A)=质子数(Z)+中子数(N)
核电荷数=核内质子数=核外电子数
A
Z
X
X表示元素符号
Z表示原子的质子数
A表示原子的质量数
原子的组成表示法
O
8
16
问题解决: 元素、核素和同位素的关系
同位素
核素1
核素2
同种元素
元素:具有相同质子数的同一类原子的总称。
核素:具有一定质子数和一定中子数的一种原子。
同位素:同种元素的不同种核素间的互称。即质子数相同,质量数(或中子数)不同的核素的互称。
问题解决:元素、核素和同位素的关系
同一种元素
同一种元素
三种不同核素(原子)
三种不同核素(原子)
互称为同位素
互称为同位素
质子数相同,质量数(或中子数)不同的核素互称为同位素。
元素
(同位素)
核素
核素
。。。。。
元素:具有相同质子数的同一类原子的总称。
核素:具有一定质子数和一定中子数的一种原子。
1913年 玻尔 [丹麦]:“核外电子分层”模型
历史回眸
人类认识原子的历史是漫长的,也是无止境的…
夸克
电子云
历史回眸
一、原子结构模型的演变
汤姆生原子模型(1904年):
道尔顿原子模型(1803年):
原子是实心球
“葡萄干面包式”原子结构模型
带核的原子结构模型
原子轨道模型
实践
认识
再实践
再认识
……
认知过程
人类认识原子的历史是漫长的,也是无止境的……
电子云模型
卢瑟福原子模型(1911年):
玻尔原子模型(1913年):
现代原子模型:
感悟历史
?
人类认识原子的历史是漫长的,也是无止境的…
现代量子力学原子结构模型(电子云模型)①原子由原子核和核外电子构成②电子运动的规律跟宏观物体运动的规律截然不同;③对于多电子的原子,电子在核外一定的空间近似于分层排布。
?
+2
He
+18
Ar
二、原子核外电子的分层排布
+10
Ne
+1
H
+8
O
+12
Mg
该电子层上的电子
核电荷数
原子核
电子层
1、原子结构示意图
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
18
第1层
第2层
第3层
K层
L层
M层
2
8
8
原子核
原子核带正电
核电荷数
该电子层上的电子
原子核
+18
Ar
核电荷数
电子层
该电子层上的电子数
+
M
L
N
K
C
碳
6
N
氮
7
O
氧
8
F
氟
9
Ne
氖
10
B
硼
5
Be
铍
4
Li
锂
3
He
氦
2
H
氢
1
各电子层的电子数
元素符号
元素名称
核电荷数
核电荷数为1~10的元素原子核外电子层排布
1
2
2
1
2
2
2
2
2
2
2
2
3
4
5
6
7
8
核电荷数为11~20的元素原子核外电子层排布
M
L
N
K
S
硫
16
Cl
氯
17
Ar
氩
18
K
钾
19
Ca
钙
20
P
磷
15
Si
硅
14
Al
铝
13
Mg
镁
12
Na
钠
11
各电子层的电子数
元素符号
元素名称
核电荷数
2
2
2
2
2
2
2
2
2
2
8
8
8
8
8
8
8
8
8
8
8
8
8
7
6
5
4
3
2
1
2
1
2、原子核外电子排布的一般规律
①电子总是尽先排布在能量最低的电子层里, 然后由里往外,依次排在能量逐步升高的电子层里(能量最低原理),先排K层,排满K层后再排L层,排满L层后再排M层。
②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)
上述规律相互制约,相互联系。
稀有气体元素原子电子层排布
元素
名称 元素
符号 各电子层的电子数
K
1 L
2 M
3 N
4 O
5 P
6 最外层电子数
氦 He 2 2
氖 Ne 2 8 8
氩 Ar 2 8 8 8
氪 Kr 2 8 18 8 8
氙 Xe 2 8 18 18 8 8
氡 Rn 2 8 18 32 18 8 8
分析稀有气体的核外电子排布与其性质有什么联系?
1、对比稀有气体的结构,分析Mg、O核外电子排布特点?
2、Mg、O为什么容易形成Mg2+、O2-?在变化过程中改变的是什么微粒?
3、由Mg、O你分别想到了哪些类似的原子,它们在结构上有什么共同点?性质上呢?
+12
2
8
2
失去电子
+12
2
8
Mg
Mg2+
+8
2
6
+8
2
8
得到电子
O
O2-
氧化镁的形成
宏观:氧气和金属镁反应生成氧化镁,氧化镁是氧元素与镁元素相结合的产物。
微观:每个Mg失去2个电子形成与Ne一样的稳定电子层结构的Mg2+,每个O得到2个电子形成与Ne一样的稳定电子层结构的O2-,带正电荷的Mg2+与带负电荷的O2-相互发生电性作用,形成稳定的MgO.
2Mg+O2 ==== 2MgO
△
+12
Mg
+8
O
+12
+8
Mg2+
O2-
结论:原子最外层的电子数小于8个时,在化学反应中总是得到或失去电子而达到最外层8电子的稳定结构。
MgO
如下图:
1-18号元素的核外电子排布——原子结构示意图
3、原子结构与元素性质的关系(结构决定性质)
(1)稳定结构:原子既不容易失去电子又不容易得到电子,即原子最外层有8个电子(He为2)处于稳定状态
(如He、Ne、Ar等)。
(2)不稳定结构:原子容易失去电子或容易得到电子转化为最外电子层上为8(有些为2)个电子的稳定结构。
(如,失去:Na、Mg、Al 得到:F、O、Cl)
金属元素 非金属元素
最外层电子数: <4 ≥4
得失电子趋势: 易失 易得
元素性质: 金属性 非金属性
Na、Mg、Al等活泼金属单质与F2、O2、Cl2等活泼非金属单质发生反应生成的化合物中,金属元素和非金属元素的化合价与其在反应中失去或得到电子的数目存在一定的关系。请与同学共同探讨下列问题 :
问题解决:
1.金属单质Na、Mg能分别与非金属单质O2、Cl2发生反应生成氧化物和氯化物,请写出化学式.
Na2O、MgO、NaCl、MgCl2
2.根据Na、Mg、O、Cl原子在反应过程中失去或者得到电子的数目和该原子的最外层电子数目,推断其氧化物和氯化物中元素化合价.
元素 化合价 原子最外层电子数目 失去(或得到)电子数目
Na
Mg
O
Cl
+1
1
失e-
+2
2
失2e-
-2
6
得2e-
-1
7
得e-
①最外层电子数﹤4时,容易失去电子
(化合价=+失去的电子数目)
原子
②最外层电子数≥4时,容易得到电子
(化合价=最外层电子数-8)
关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)
4、原子核外电子数与元素化合价的关系
一、原子结构模型的演变
道尔顿→汤姆生→卢瑟福 →玻尔→量子力学
二、原子核外电子的分层排布
1、原子结构示意图
2、原子核外电子排布一般规律
3、原子结构与元素性质的关系(结构决定性质)
4、原子核外电子数与元素化合价的关系
1、已知最外层电子数相等的元素原子具有相似的化学性质。下列原子中,与氧元素原子的化学性质相似的是
( )
A、Ne B、Mg C、S D、C
C
2、用下面的结构示意图的字母填空:
(1)属于金属原子的是____________;
(2)属于非金属原子的是__________;
(3)属于离子结构示意图的是___________;
(4)具有稳定结构的是__________。
A
B
C
C
3、填空
1)、原子核外电子是 排布的
2)、金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构)。
3)、非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)。
4)、化学反应中,原子核不发生变化,但原子的
发生变化,元素的化学性质主要决定于原子结构中的 。
分层
<4
≥4
得到
失去
最外层电子数目
最外层电子数
4、X、Y、Z、R分别代表四种元素,若aXm+、bYn+、cZn-、dRm-四种离子的核外电子排布相同,且m>n,则下列关系正确的是( )
A、a-c=m-n
B、b-d=m+n
C、a>b>d>c
D、a>c>b>d
B
第三单元 人类对原子结构的认识
在你眼中… 在化学家眼中…
水由水分子构成
食盐由离子构成
它们由什么微粒构成?
铜由铜原子构成
原子
你知道了吗?
古希腊哲学家 德谟克利特
物质是由不可分割的微粒即“原子”构成的。
历史瞬间
世界之最
1993年8月,我国科学家利用超真空扫描隧道显微镜,在一块晶体硅的表面通过探针的作用搬走原子,写下了“中国”两个字。
英国超级显微镜
世界之最
请大家结合以前学过的知识及教材P27-28的“交流与讨论”,思考下列几个问题。
1、原子结构模型的演变经历了哪几个重要阶段?
2、用简洁的语言表达各阶段(道尔顿、汤姆生、卢瑟福、波尔)对原子结构模型的认识特点?
3、请你谈谈从原子结构的演变得到什么启示?
主要观点
物质由原子组成。
原子不能被创造和毁灭。
原子是不可分割的实心球体。
历史回眸
原子中正电荷均匀地分布在整个球体中,而带负电荷的电子则镶嵌在其中。
α粒子散射实验
体积很小相对质量为4的带正电粒子
现象:
1、大部分α粒子穿过薄的金箔
2、极少数α粒子好象打在坚硬的东西上,完全反弹回来。
3、少数α粒子穿过薄的金箔时,发生了偏转。
科学探究
卢瑟福通过实验推断出:
1、原子大部分是空的。
2、中间有一个几乎集中了所有原子的质量且体积很小的粒子——原子核。
3、电子随意地围绕着一个带正电荷的很小的原子核运转。
体积很小相对质量为4的带正电粒子
科学探究
质子 中子 电子
质量/kg 1.673×10-27 1.675×10-27 9.109×10-31
相对质量 1.007 1.008 1/1836
⑴原子的质量与质子、中子的质量关系
⑵原子的相对原子质量与质子、中子的相对质量的关系
相对质量:质子、中子的质量与C-12原子质量的1/12相比较所得的数值。
信息提示
质子 中子 电子
质量/kg 1.673×10-27 1.675×10-27 9.109×10-31
相对质量 1.007 1.008 1/1836
质量数:将原子核内所有的质子和中子的相对质量取整数,加起来所得到的数值。
⑶ 原子中质子数、中子数、质量数和原子的相对原子质量之间的关系
原子 质子数
(Z) 中子数
(N) 质子数+中子数(A) 相对原子质量
F 9 10 18.998
Na 11 12 22.990
Al 13 14 26.982
19
23
27
原子的质量相关问题
质量数(A)=质子数(Z)+中子数(N)
核电荷数=核内质子数=核外电子数
A
Z
X
X表示元素符号
Z表示原子的质子数
A表示原子的质量数
原子的组成表示法
O
8
16
问题解决: 元素、核素和同位素的关系
同位素
核素1
核素2
同种元素
元素:具有相同质子数的同一类原子的总称。
核素:具有一定质子数和一定中子数的一种原子。
同位素:同种元素的不同种核素间的互称。即质子数相同,质量数(或中子数)不同的核素的互称。
问题解决:元素、核素和同位素的关系
同一种元素
同一种元素
三种不同核素(原子)
三种不同核素(原子)
互称为同位素
互称为同位素
质子数相同,质量数(或中子数)不同的核素互称为同位素。
元素
(同位素)
核素
核素
。。。。。
元素:具有相同质子数的同一类原子的总称。
核素:具有一定质子数和一定中子数的一种原子。
1913年 玻尔 [丹麦]:“核外电子分层”模型
历史回眸
人类认识原子的历史是漫长的,也是无止境的…
夸克
电子云
历史回眸
一、原子结构模型的演变
汤姆生原子模型(1904年):
道尔顿原子模型(1803年):
原子是实心球
“葡萄干面包式”原子结构模型
带核的原子结构模型
原子轨道模型
实践
认识
再实践
再认识
……
认知过程
人类认识原子的历史是漫长的,也是无止境的……
电子云模型
卢瑟福原子模型(1911年):
玻尔原子模型(1913年):
现代原子模型:
感悟历史
?
人类认识原子的历史是漫长的,也是无止境的…
现代量子力学原子结构模型(电子云模型)①原子由原子核和核外电子构成②电子运动的规律跟宏观物体运动的规律截然不同;③对于多电子的原子,电子在核外一定的空间近似于分层排布。
?
+2
He
+18
Ar
二、原子核外电子的分层排布
+10
Ne
+1
H
+8
O
+12
Mg
该电子层上的电子
核电荷数
原子核
电子层
1、原子结构示意图
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
18
第1层
第2层
第3层
K层
L层
M层
2
8
8
原子核
原子核带正电
核电荷数
该电子层上的电子
原子核
+18
Ar
核电荷数
电子层
该电子层上的电子数
+
M
L
N
K
C
碳
6
N
氮
7
O
氧
8
F
氟
9
Ne
氖
10
B
硼
5
Be
铍
4
Li
锂
3
He
氦
2
H
氢
1
各电子层的电子数
元素符号
元素名称
核电荷数
核电荷数为1~10的元素原子核外电子层排布
1
2
2
1
2
2
2
2
2
2
2
2
3
4
5
6
7
8
核电荷数为11~20的元素原子核外电子层排布
M
L
N
K
S
硫
16
Cl
氯
17
Ar
氩
18
K
钾
19
Ca
钙
20
P
磷
15
Si
硅
14
Al
铝
13
Mg
镁
12
Na
钠
11
各电子层的电子数
元素符号
元素名称
核电荷数
2
2
2
2
2
2
2
2
2
2
8
8
8
8
8
8
8
8
8
8
8
8
8
7
6
5
4
3
2
1
2
1
2、原子核外电子排布的一般规律
①电子总是尽先排布在能量最低的电子层里, 然后由里往外,依次排在能量逐步升高的电子层里(能量最低原理),先排K层,排满K层后再排L层,排满L层后再排M层。
②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)
上述规律相互制约,相互联系。
稀有气体元素原子电子层排布
元素
名称 元素
符号 各电子层的电子数
K
1 L
2 M
3 N
4 O
5 P
6 最外层电子数
氦 He 2 2
氖 Ne 2 8 8
氩 Ar 2 8 8 8
氪 Kr 2 8 18 8 8
氙 Xe 2 8 18 18 8 8
氡 Rn 2 8 18 32 18 8 8
分析稀有气体的核外电子排布与其性质有什么联系?
1、对比稀有气体的结构,分析Mg、O核外电子排布特点?
2、Mg、O为什么容易形成Mg2+、O2-?在变化过程中改变的是什么微粒?
3、由Mg、O你分别想到了哪些类似的原子,它们在结构上有什么共同点?性质上呢?
+12
2
8
2
失去电子
+12
2
8
Mg
Mg2+
+8
2
6
+8
2
8
得到电子
O
O2-
氧化镁的形成
宏观:氧气和金属镁反应生成氧化镁,氧化镁是氧元素与镁元素相结合的产物。
微观:每个Mg失去2个电子形成与Ne一样的稳定电子层结构的Mg2+,每个O得到2个电子形成与Ne一样的稳定电子层结构的O2-,带正电荷的Mg2+与带负电荷的O2-相互发生电性作用,形成稳定的MgO.
2Mg+O2 ==== 2MgO
△
+12
Mg
+8
O
+12
+8
Mg2+
O2-
结论:原子最外层的电子数小于8个时,在化学反应中总是得到或失去电子而达到最外层8电子的稳定结构。
MgO
如下图:
1-18号元素的核外电子排布——原子结构示意图
3、原子结构与元素性质的关系(结构决定性质)
(1)稳定结构:原子既不容易失去电子又不容易得到电子,即原子最外层有8个电子(He为2)处于稳定状态
(如He、Ne、Ar等)。
(2)不稳定结构:原子容易失去电子或容易得到电子转化为最外电子层上为8(有些为2)个电子的稳定结构。
(如,失去:Na、Mg、Al 得到:F、O、Cl)
金属元素 非金属元素
最外层电子数: <4 ≥4
得失电子趋势: 易失 易得
元素性质: 金属性 非金属性
Na、Mg、Al等活泼金属单质与F2、O2、Cl2等活泼非金属单质发生反应生成的化合物中,金属元素和非金属元素的化合价与其在反应中失去或得到电子的数目存在一定的关系。请与同学共同探讨下列问题 :
问题解决:
1.金属单质Na、Mg能分别与非金属单质O2、Cl2发生反应生成氧化物和氯化物,请写出化学式.
Na2O、MgO、NaCl、MgCl2
2.根据Na、Mg、O、Cl原子在反应过程中失去或者得到电子的数目和该原子的最外层电子数目,推断其氧化物和氯化物中元素化合价.
元素 化合价 原子最外层电子数目 失去(或得到)电子数目
Na
Mg
O
Cl
+1
1
失e-
+2
2
失2e-
-2
6
得2e-
-1
7
得e-
①最外层电子数﹤4时,容易失去电子
(化合价=+失去的电子数目)
原子
②最外层电子数≥4时,容易得到电子
(化合价=最外层电子数-8)
关系:元素化合价在数值上等于原子失去或得到的电子数目(失为正,得为负)
4、原子核外电子数与元素化合价的关系
一、原子结构模型的演变
道尔顿→汤姆生→卢瑟福 →玻尔→量子力学
二、原子核外电子的分层排布
1、原子结构示意图
2、原子核外电子排布一般规律
3、原子结构与元素性质的关系(结构决定性质)
4、原子核外电子数与元素化合价的关系
1、已知最外层电子数相等的元素原子具有相似的化学性质。下列原子中,与氧元素原子的化学性质相似的是
( )
A、Ne B、Mg C、S D、C
C
2、用下面的结构示意图的字母填空:
(1)属于金属原子的是____________;
(2)属于非金属原子的是__________;
(3)属于离子结构示意图的是___________;
(4)具有稳定结构的是__________。
A
B
C
C
3、填空
1)、原子核外电子是 排布的
2)、金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构)。
3)、非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)。
4)、化学反应中,原子核不发生变化,但原子的
发生变化,元素的化学性质主要决定于原子结构中的 。
分层
<4
≥4
得到
失去
最外层电子数目
最外层电子数
4、X、Y、Z、R分别代表四种元素,若aXm+、bYn+、cZn-、dRm-四种离子的核外电子排布相同,且m>n,则下列关系正确的是( )
A、a-c=m-n
B、b-d=m+n
C、a>b>d>c
D、a>c>b>d
B
