11-12版高中化学新课标同步授课课件:第4章第1节 硅 无机非金属材料(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学新课标同步授课课件:第4章第1节 硅 无机非金属材料(鲁科版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 5.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-08 00:00:00 | ||
图片预览








文档简介
(共57张PPT)
第4章 材料家族中的元素
第1节 硅 无机非金属材料
1、了解硅的主要性质;
2、了解二氧化硅的主要性质。
硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。
半导体材料
导电能力介于导体和绝缘体之间的一类材料。
一、单质硅与半导体材料
最早使用的半导体材料 ,现在最广泛使用的半导体材料 。
锗
硅
硅在自然界的存在形态:
无游离态,只有化合态。
常见存在物质形式:二氧化硅和硅酸盐等。
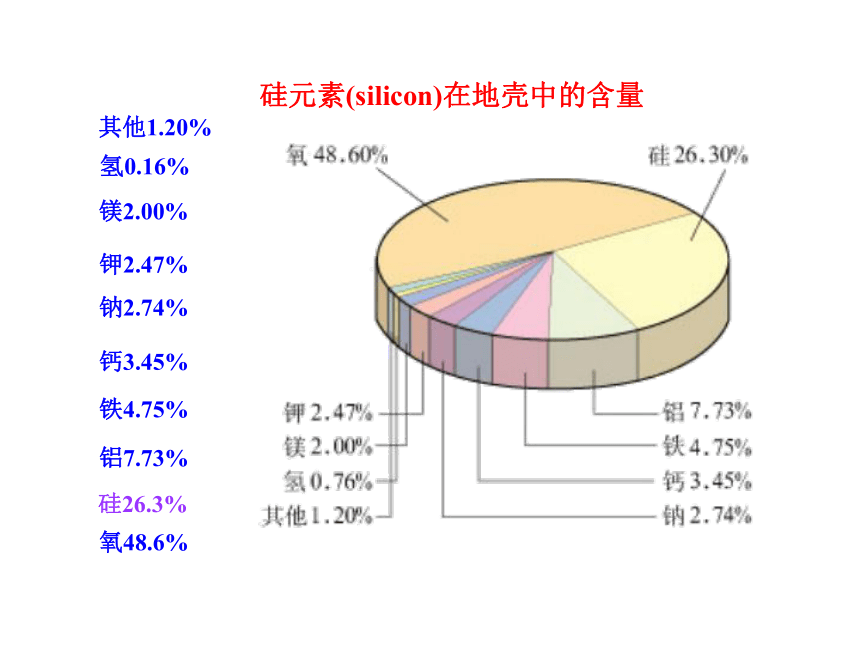
硅在地壳中的含量仅次于氧,储量丰富,现已成为应用广泛的半导体材料。
氧48.6%
硅26.3%
铝7.73%
铁4.75%
钙3.45%
钠2.74%
钾2.47%
镁2.00%
氢0.16%
其他1.20%
硅元素(silicon)在地壳中的含量
观察硅单质的实物图片
并阅读教材P104第一段,总结硅的物理性质
硅有晶体硅和无定形硅两种。晶体硅是灰黑色、有金属光泽、硬而脆的固体。
晶体硅的结构类似于金刚石,熔点和沸点都很高,硬度大。
导电性介于导体和绝缘体之间,是重要的半导体材料。
物理性质
1、硅单质的物理性质
Si
最外层电子数是4,碳也是。
思考2:碳、硅原子主要显几价?
正四价(+4价)
思考1:硅原子最外层电子数是多少?我们很熟悉的哪种元素最外层电子数与它相同?
+14
2 8 4
碳族元素在元素周期表中的位置
晶体硅的结构
(不易与H2、O2、Cl2、硫酸、硝酸、盐酸等物质反应)
加热,Si能与某些非金属单质反应
(燃烧,放出大量的热)
Si+O2=====SiO2
△
①
Si+2Cl2======SiCl4
②
高温
2、硅单质的化学性质
(1)常温下,化学性质稳定
(2)常温下只与强碱、氢氟酸、氟气反应
Si+2NaOH+H2O ==== Na2SiO3+2H2↑
Si+2F2 ==== SiF4
Si+4HF ==== SiF4↑+2H2 ↑
制粗硅:
硅铁
硅锰合金
硅钡合金
(粗硅)
粗硅提纯后可以得到高纯硅,作为半导体材料。
SiO2 +2C ====Si + 2CO↑
高温
氧化剂:SiO2 得到电子发生还原反应
还原剂: C 失去电子发生氧化反应
3、硅的工业制法
硅芯片、大规模集成电路及相应的计算机技术都需要有高纯度的硅才能实现,所以需要对粗硅进行提纯:
高温
Si+2Cl2====SiCl4
(粗硅)
高温
SiCl4+2H2====Si+4HCl
(高纯硅)
提纯:
碳( C ) 硅(Si)
常温下很稳定,在高温或点燃的条件下有较强还原性。 常温下很稳定,高温时也能发生反应。
Si+O2 ==== SiO2
Si+2F2====SiF4
Si+2NaOH+H2O====
Na2SiO3+ 2H2↑
Si+4HF====SiF4↑+2H2↑
Si+2Cl2====SiCl4
4、硅与碳的化学性质比较
点燃
C+O2 ==== CO2
2C+O2 ==== 2CO
C+CuO ==== Cu+CO
C+H2O ==== H2+CO
点燃
高温
C+CO2 ==== 2CO
高温
C+O2 ==== CO2
4、硅的用途
(1)硅芯片;半导体材料
(2)制集成电路、晶体管、硅整流器等半导体材料
(3)含硅4%的钢可制变压器铁芯
(4)含硅15%的钢具有耐酸性,制耐酸设备
硅芯片的使用,使计算机的体积已缩小到笔记本一样大小了。
太阳能电池
电脑的中央处理器(CPU)
硅光电池
大规模集成电路
硅的用途非常广泛,可用来制造集成电路、晶体管、硅整流器等半导体器件,还可以制太阳能电池,制铝合金、铁合金等多种合金。
1、下列关于硅的叙述,不正确的是( )
A、硅是非金属元素,但其单质是灰黑色有金属光泽的固体
B、硅的导电性介于导体和绝缘体之间,是良好的半导体材料
C、硅的化学性质不活泼,常温下不与任何物质反应
D、当加热到一定温度时,硅能与氧气、氢气等非金属单质反应
C
2、下列关于Si的化学性质中正确的是( )
A、常温下能与任何酸反应
B、常温下可与强碱溶液反应
C、常温下可与氧气反应
D、常温下不与任何酸反应
B
二氧化硅广泛存在于自然界中,与其他矿物共同构成了岩石。是一种坚硬难熔的固体。
硅石
硅矿山
一、二氧化硅
1、二氧化硅的存在
硅石(天然)
结晶形
无定形
晶体二氧化硅
Si
O
2、二氧化硅的结构
SiO2属于原子晶体
SiO2是正四面体的空间网状结构,因此性质很稳定
无色,沸点高、硬度大、不溶于水、不导电的晶体.
3、二氧化硅的物理性质
(2)不能与水反应
SiO2+2NaOH====Na2SiO3+H2O
SiO2+CaO====CaSiO3
高温
(1)是酸性氧化物
SiO2 + 2OH— ====SiO3 2-+ H2O
4、二氧化硅的化学性质
(3)在高温下与碳酸盐的反应
SiO2+Na2CO3====CO2 +Na2SiO3
高温
SiO2+CaCO3====CO2 +CaSiO3
高温
(4)不与酸反应(除氢氟酸以外)
SiO2 + 4HF ==== SiF4 + 2H2O
(5)弱的氧化性
SiO2+2C==== Si+2CO
高温
二氧化碳CO2 二氧化硅SiO2
物质分类
与碱性氧化物反应
与碱反应
与水反应
与HF反应
均属于酸性氧化物
CO2 + CaO====CaCO3
CaO+SiO2====CaSiO3
高温
CO2 +2NaOH====
Na2CO3+H2O
SiO2 +2NaOH====
Na2SiO3+H2O
CO2 + H2O====H2CO3
不反应
不反应
SiO2+4HF====
SiF4↑+2H2O
二氧化硅与二氧化碳的比较
5、二氧化硅的用途
由于SiO2具有优良的物理化学性能,加上SiO2在自然界的广泛存在,因此从古到今都被人类广泛地应用。
光学纤维胃镜
水晶、玛瑙
二氧化硅用来制光导纤维
光导纤维就是比头发丝还细的、能传导光信号的玻璃丝。制造光导纤维的材料就是二氧化硅。光导纤维主要用于通讯、传感、测量等,光纤通讯的优点就是通信容量大,一对光纤上可同时传送3万门电话。
1、下列各组物质有关性质关系的比较,正确的是( )
A、溶解性:CO2B、酸性:H2SiO3 > H2CO3
C、熔点:SiO2 > CO2(干冰)
D、硬度: SiO22、下列物质中,不能用玻璃瓶来盛装的是( )
A、烧碱溶液 B、浓硫酸
C、氢氟酸 D、碳酸钠溶液
C
C
3、要除去SiO2中的CaO杂质,最适宜的试剂是( )
A、纯碱溶液 B、盐酸
C、硫酸 D、苛性钠溶液
B
硅酸盐是结构复杂的固态化合物,一般都不溶于水。
1.含义:
硅酸盐是由硅、氧和金属元素组成的化合物的总称
二、硅酸盐
2.硅酸盐的表示方法:
(1)化学式法:
(2)氧化物法:
硅酸钠:Na2SiO3
硅酸钙:CaSiO3
硅酸钠:Na2O · SiO2
硅酸钙: CaO· SiO2
高岭石:Al2O3 · 2SiO2 ·2H2O
石棉:CaO · 3MgO· 4SiO2
沸石:Na2 O · Al2O3 · 3SiO2· 2H2O
云母: K2O· 3Al2O3 · 6SiO2· 2H2O
长石:K2O · Al2O3 · 6SiO2
水泥:3CaO · SiO2 · 2CaO· SiO2
玻璃:Na2 O · CaO· 6SiO2
粘土:Al2O3 · 2SiO2· 2H2O
最简单的硅酸盐是硅酸钠(Na2SiO3),其水溶液俗称为水玻璃,硅酸钠不能燃烧且不易受腐蚀,可用作肥皂填料、木材防火剂等 。
3.硅酸钠(Na2SiO3)
关于硅酸盐说明:
1.除硅酸钾、硅酸钠、硅酸铵以外均难溶于水
2.硅酸钠是常见的可溶性硅酸盐之一,俗称泡花碱;它的水溶液俗称水玻璃,是一种粘合剂;
硅酸和二氧化硅的制备:
[水玻璃可保存在玻璃瓶中,但不能使用玻璃塞,要用橡胶塞]
较强酸和可溶性硅酸盐反应制硅酸
2HCl + Na2SiO3 + H2O ==== H4SiO4↓+ 2NaCl
H4SiO4 H2SiO3 SiO2
常温分解
受热分解
无机非金属材料
硅酸盐产品
陶瓷
水泥
玻璃
三、硅酸盐工业
t
水泥是一种非常重要的建筑材料。万丈高楼平地起,穿针引线是水泥。
(2)生产过程:
黏土和石灰石
两磨、一烧。
研磨→煅烧→再磨成细粉;
硅酸三钙(3CaO·SiO2)
硅酸二钙(2CaO·SiO2) 混合物
铝酸三钙(3CaO·Al2O3)
(1)水泥的生产原料:
(3)普通硅酸盐水泥的成分:
1、水泥
(4)水泥的性能:
水泥具有水硬性。
水泥、沙子和水的混合物——建筑黏合剂。
水泥、沙子和碎石的混合物。
混凝土:
水泥砂浆:
2、玻璃:
(2)生产过程:
纯碱、石灰石和石英。
Na2CO3+SiO2====Na2SiO3+CO2↑
CaCO3 +SiO2====CaSiO3 + CO2↑
高温
高温
⑴玻璃的生产原料:
(3)普通玻璃的成分:
Na2SiO3、CaSiO3和SiO2组成的混合物。
或Na2O·CaO·6SiO2;
玻璃无固定的熔沸点,在一定温度范围内软化。
(4)玻璃的性能:
普通玻璃的生产过程
3、陶瓷:
陶瓷具有抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等许多优点,因此,陶瓷制品一直为人们所喜爱。
家用陶瓷
江苏宜兴,
有陶都之称。
隋代烧制的三彩陶骆驼
瓷器是中华文明的象征。
在许多拉丁语系国家中,“瓷器”和“中国”都以“CHINA”用同一字母拼音表示。
江西景德镇所烧制的薄胎瓷器被誉为:“洁如玉、明如镜、薄如纸、声如罄。”
我国江西景德镇素有“瓷都”之称
江西景德镇所烧制的瓷器
传统无机非金属材料:
陶瓷、玻璃、水泥
新型无机非金属材料:
新型陶瓷
高温结构陶瓷、压电陶瓷
透明陶瓷、超导陶瓷等
新型无机非金属材料:
1、新型无机非金属材料的特征:
(1)耐高温、强度高;
(2)具有电学性质;
(3)具有光学性质;
(4)具有生物功能;
2、结构材料——高温结构陶瓷:
氧化铝陶瓷
氧化铝透明陶瓷管
氧化铝陶瓷制品
1.下列物质中属于纯净物的是( )
A、Na2CO3·10H2O B、水泥
C、纯净的盐酸 D、普通玻璃
A
2、下列叙述正确的是( )
A、酸均不能与酸性氧化物反应
B、玻璃、陶瓷、水泥容器都不能贮存氢氟酸
C、石灰抹墙、水泥砌墙过程的硬化原理相同
D、石灰窑、玻璃熔炉出来的气体主要成分相同
3、下列物质有固定熔点的是( )
A、水泥 B、玻璃
C、Na2O·SiO2 D、水玻璃
BD
C
第4章 材料家族中的元素
第1节 硅 无机非金属材料
1、了解硅的主要性质;
2、了解二氧化硅的主要性质。
硅的氧化物及硅酸盐构成了地壳中大部分的岩石、沙子和土壤、约占地壳总量的90%以上。
半导体材料
导电能力介于导体和绝缘体之间的一类材料。
一、单质硅与半导体材料
最早使用的半导体材料 ,现在最广泛使用的半导体材料 。
锗
硅
硅在自然界的存在形态:
无游离态,只有化合态。
常见存在物质形式:二氧化硅和硅酸盐等。
硅在地壳中的含量仅次于氧,储量丰富,现已成为应用广泛的半导体材料。
氧48.6%
硅26.3%
铝7.73%
铁4.75%
钙3.45%
钠2.74%
钾2.47%
镁2.00%
氢0.16%
其他1.20%
硅元素(silicon)在地壳中的含量
观察硅单质的实物图片
并阅读教材P104第一段,总结硅的物理性质
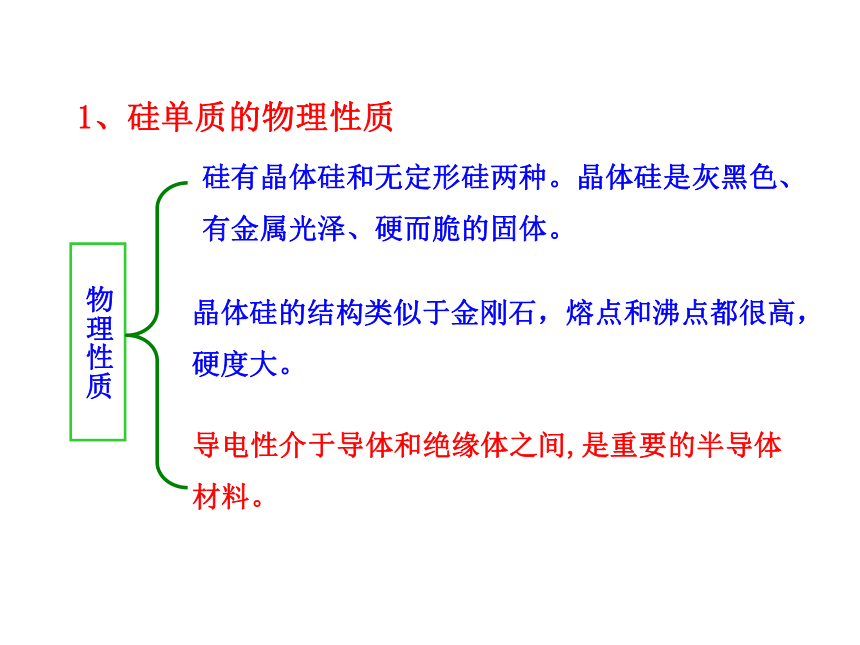
硅有晶体硅和无定形硅两种。晶体硅是灰黑色、有金属光泽、硬而脆的固体。
晶体硅的结构类似于金刚石,熔点和沸点都很高,硬度大。
导电性介于导体和绝缘体之间,是重要的半导体材料。
物理性质
1、硅单质的物理性质
Si
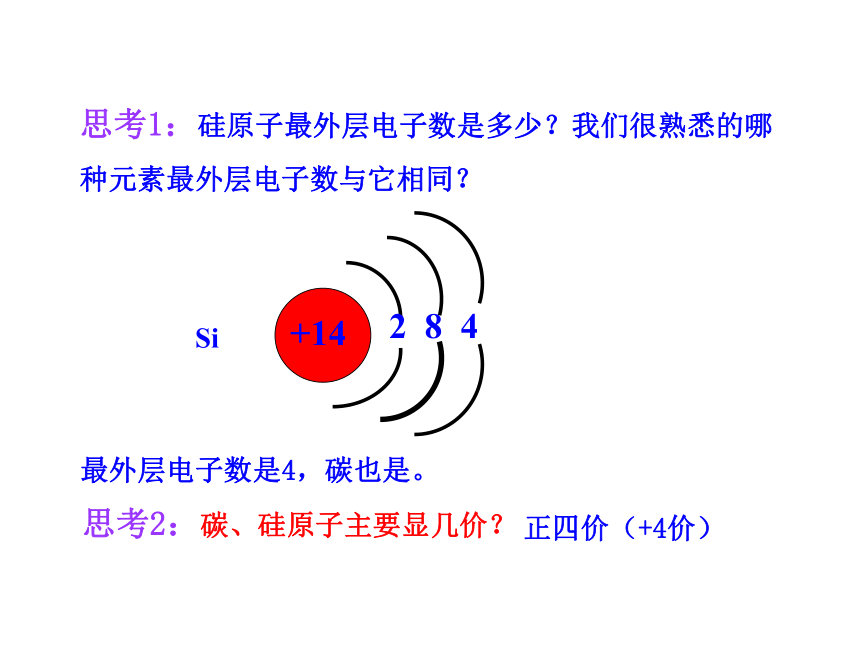
最外层电子数是4,碳也是。
思考2:碳、硅原子主要显几价?
正四价(+4价)
思考1:硅原子最外层电子数是多少?我们很熟悉的哪种元素最外层电子数与它相同?
+14
2 8 4
碳族元素在元素周期表中的位置
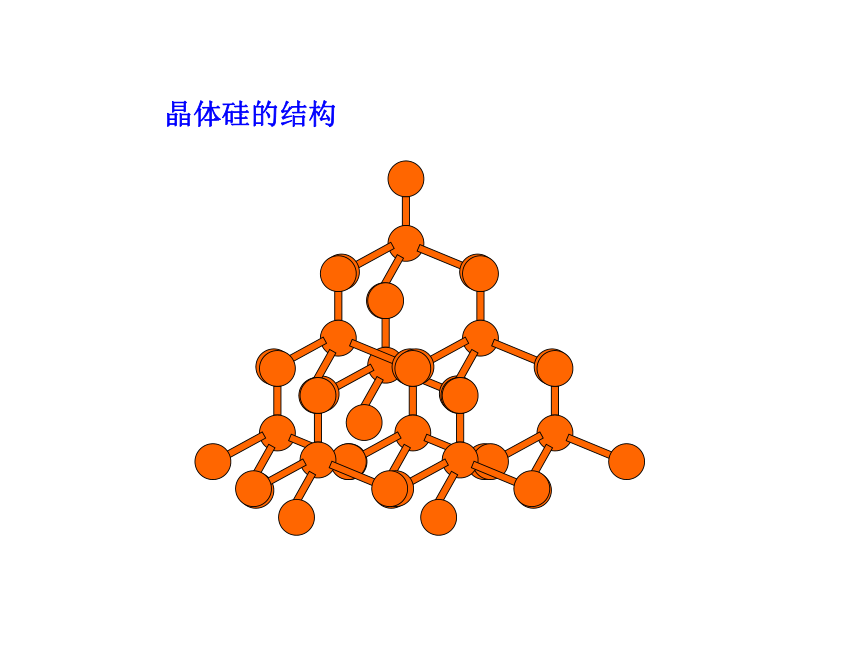
晶体硅的结构
(不易与H2、O2、Cl2、硫酸、硝酸、盐酸等物质反应)
加热,Si能与某些非金属单质反应
(燃烧,放出大量的热)
Si+O2=====SiO2
△
①
Si+2Cl2======SiCl4
②
高温
2、硅单质的化学性质
(1)常温下,化学性质稳定
(2)常温下只与强碱、氢氟酸、氟气反应
Si+2NaOH+H2O ==== Na2SiO3+2H2↑
Si+2F2 ==== SiF4
Si+4HF ==== SiF4↑+2H2 ↑
制粗硅:
硅铁
硅锰合金
硅钡合金
(粗硅)
粗硅提纯后可以得到高纯硅,作为半导体材料。
SiO2 +2C ====Si + 2CO↑
高温
氧化剂:SiO2 得到电子发生还原反应
还原剂: C 失去电子发生氧化反应
3、硅的工业制法
硅芯片、大规模集成电路及相应的计算机技术都需要有高纯度的硅才能实现,所以需要对粗硅进行提纯:
高温
Si+2Cl2====SiCl4
(粗硅)
高温
SiCl4+2H2====Si+4HCl
(高纯硅)
提纯:
碳( C ) 硅(Si)
常温下很稳定,在高温或点燃的条件下有较强还原性。 常温下很稳定,高温时也能发生反应。
Si+O2 ==== SiO2
Si+2F2====SiF4
Si+2NaOH+H2O====
Na2SiO3+ 2H2↑
Si+4HF====SiF4↑+2H2↑
Si+2Cl2====SiCl4
4、硅与碳的化学性质比较
点燃
C+O2 ==== CO2
2C+O2 ==== 2CO
C+CuO ==== Cu+CO
C+H2O ==== H2+CO
点燃
高温
C+CO2 ==== 2CO
高温
C+O2 ==== CO2
4、硅的用途
(1)硅芯片;半导体材料
(2)制集成电路、晶体管、硅整流器等半导体材料
(3)含硅4%的钢可制变压器铁芯
(4)含硅15%的钢具有耐酸性,制耐酸设备
硅芯片的使用,使计算机的体积已缩小到笔记本一样大小了。
太阳能电池
电脑的中央处理器(CPU)
硅光电池
大规模集成电路
硅的用途非常广泛,可用来制造集成电路、晶体管、硅整流器等半导体器件,还可以制太阳能电池,制铝合金、铁合金等多种合金。
1、下列关于硅的叙述,不正确的是( )
A、硅是非金属元素,但其单质是灰黑色有金属光泽的固体
B、硅的导电性介于导体和绝缘体之间,是良好的半导体材料
C、硅的化学性质不活泼,常温下不与任何物质反应
D、当加热到一定温度时,硅能与氧气、氢气等非金属单质反应
C
2、下列关于Si的化学性质中正确的是( )
A、常温下能与任何酸反应
B、常温下可与强碱溶液反应
C、常温下可与氧气反应
D、常温下不与任何酸反应
B
二氧化硅广泛存在于自然界中,与其他矿物共同构成了岩石。是一种坚硬难熔的固体。
硅石
硅矿山
一、二氧化硅
1、二氧化硅的存在
硅石(天然)
结晶形
无定形
晶体二氧化硅
Si
O
2、二氧化硅的结构
SiO2属于原子晶体
SiO2是正四面体的空间网状结构,因此性质很稳定
无色,沸点高、硬度大、不溶于水、不导电的晶体.
3、二氧化硅的物理性质
(2)不能与水反应
SiO2+2NaOH====Na2SiO3+H2O
SiO2+CaO====CaSiO3
高温
(1)是酸性氧化物
SiO2 + 2OH— ====SiO3 2-+ H2O
4、二氧化硅的化学性质
(3)在高温下与碳酸盐的反应
SiO2+Na2CO3====CO2 +Na2SiO3
高温
SiO2+CaCO3====CO2 +CaSiO3
高温
(4)不与酸反应(除氢氟酸以外)
SiO2 + 4HF ==== SiF4 + 2H2O
(5)弱的氧化性
SiO2+2C==== Si+2CO
高温
二氧化碳CO2 二氧化硅SiO2
物质分类
与碱性氧化物反应
与碱反应
与水反应
与HF反应
均属于酸性氧化物
CO2 + CaO====CaCO3
CaO+SiO2====CaSiO3
高温
CO2 +2NaOH====
Na2CO3+H2O
SiO2 +2NaOH====
Na2SiO3+H2O
CO2 + H2O====H2CO3
不反应
不反应
SiO2+4HF====
SiF4↑+2H2O
二氧化硅与二氧化碳的比较
5、二氧化硅的用途
由于SiO2具有优良的物理化学性能,加上SiO2在自然界的广泛存在,因此从古到今都被人类广泛地应用。
光学纤维胃镜
水晶、玛瑙
二氧化硅用来制光导纤维
光导纤维就是比头发丝还细的、能传导光信号的玻璃丝。制造光导纤维的材料就是二氧化硅。光导纤维主要用于通讯、传感、测量等,光纤通讯的优点就是通信容量大,一对光纤上可同时传送3万门电话。
1、下列各组物质有关性质关系的比较,正确的是( )
A、溶解性:CO2
C、熔点:SiO2 > CO2(干冰)
D、硬度: SiO2
A、烧碱溶液 B、浓硫酸
C、氢氟酸 D、碳酸钠溶液
C
C
3、要除去SiO2中的CaO杂质,最适宜的试剂是( )
A、纯碱溶液 B、盐酸
C、硫酸 D、苛性钠溶液
B
硅酸盐是结构复杂的固态化合物,一般都不溶于水。
1.含义:
硅酸盐是由硅、氧和金属元素组成的化合物的总称
二、硅酸盐
2.硅酸盐的表示方法:
(1)化学式法:
(2)氧化物法:
硅酸钠:Na2SiO3
硅酸钙:CaSiO3
硅酸钠:Na2O · SiO2
硅酸钙: CaO· SiO2
高岭石:Al2O3 · 2SiO2 ·2H2O
石棉:CaO · 3MgO· 4SiO2
沸石:Na2 O · Al2O3 · 3SiO2· 2H2O
云母: K2O· 3Al2O3 · 6SiO2· 2H2O
长石:K2O · Al2O3 · 6SiO2
水泥:3CaO · SiO2 · 2CaO· SiO2
玻璃:Na2 O · CaO· 6SiO2
粘土:Al2O3 · 2SiO2· 2H2O
最简单的硅酸盐是硅酸钠(Na2SiO3),其水溶液俗称为水玻璃,硅酸钠不能燃烧且不易受腐蚀,可用作肥皂填料、木材防火剂等 。
3.硅酸钠(Na2SiO3)
关于硅酸盐说明:
1.除硅酸钾、硅酸钠、硅酸铵以外均难溶于水
2.硅酸钠是常见的可溶性硅酸盐之一,俗称泡花碱;它的水溶液俗称水玻璃,是一种粘合剂;
硅酸和二氧化硅的制备:
[水玻璃可保存在玻璃瓶中,但不能使用玻璃塞,要用橡胶塞]
较强酸和可溶性硅酸盐反应制硅酸
2HCl + Na2SiO3 + H2O ==== H4SiO4↓+ 2NaCl
H4SiO4 H2SiO3 SiO2
常温分解
受热分解
无机非金属材料
硅酸盐产品
陶瓷
水泥
玻璃
三、硅酸盐工业
t
水泥是一种非常重要的建筑材料。万丈高楼平地起,穿针引线是水泥。
(2)生产过程:
黏土和石灰石
两磨、一烧。
研磨→煅烧→再磨成细粉;
硅酸三钙(3CaO·SiO2)
硅酸二钙(2CaO·SiO2) 混合物
铝酸三钙(3CaO·Al2O3)
(1)水泥的生产原料:
(3)普通硅酸盐水泥的成分:
1、水泥
(4)水泥的性能:
水泥具有水硬性。
水泥、沙子和水的混合物——建筑黏合剂。
水泥、沙子和碎石的混合物。
混凝土:
水泥砂浆:
2、玻璃:
(2)生产过程:
纯碱、石灰石和石英。
Na2CO3+SiO2====Na2SiO3+CO2↑
CaCO3 +SiO2====CaSiO3 + CO2↑
高温
高温
⑴玻璃的生产原料:
(3)普通玻璃的成分:
Na2SiO3、CaSiO3和SiO2组成的混合物。
或Na2O·CaO·6SiO2;
玻璃无固定的熔沸点,在一定温度范围内软化。
(4)玻璃的性能:
普通玻璃的生产过程
3、陶瓷:
陶瓷具有抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等许多优点,因此,陶瓷制品一直为人们所喜爱。
家用陶瓷
江苏宜兴,
有陶都之称。
隋代烧制的三彩陶骆驼
瓷器是中华文明的象征。
在许多拉丁语系国家中,“瓷器”和“中国”都以“CHINA”用同一字母拼音表示。
江西景德镇所烧制的薄胎瓷器被誉为:“洁如玉、明如镜、薄如纸、声如罄。”
我国江西景德镇素有“瓷都”之称
江西景德镇所烧制的瓷器
传统无机非金属材料:
陶瓷、玻璃、水泥
新型无机非金属材料:
新型陶瓷
高温结构陶瓷、压电陶瓷
透明陶瓷、超导陶瓷等
新型无机非金属材料:
1、新型无机非金属材料的特征:
(1)耐高温、强度高;
(2)具有电学性质;
(3)具有光学性质;
(4)具有生物功能;
2、结构材料——高温结构陶瓷:
氧化铝陶瓷
氧化铝透明陶瓷管
氧化铝陶瓷制品
1.下列物质中属于纯净物的是( )
A、Na2CO3·10H2O B、水泥
C、纯净的盐酸 D、普通玻璃
A
2、下列叙述正确的是( )
A、酸均不能与酸性氧化物反应
B、玻璃、陶瓷、水泥容器都不能贮存氢氟酸
C、石灰抹墙、水泥砌墙过程的硬化原理相同
D、石灰窑、玻璃熔炉出来的气体主要成分相同
3、下列物质有固定熔点的是( )
A、水泥 B、玻璃
C、Na2O·SiO2 D、水玻璃
BD
C
