11-12版高中化学新课标同步授课课件:第2章第3节第2课时 氧化剂和还原剂(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学新课标同步授课课件:第2章第3节第2课时 氧化剂和还原剂(鲁科版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 900.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-08 00:00:00 | ||
图片预览




文档简介
(共25张PPT)
第2课时 氧化剂和还原剂
1、复习巩固氧化还原反应的相关概念,认识常见的氧化剂和还原剂。
2、熟练应用氧化还原反应的相关概念,体会氧化还原反应几条规律的内容和应用。
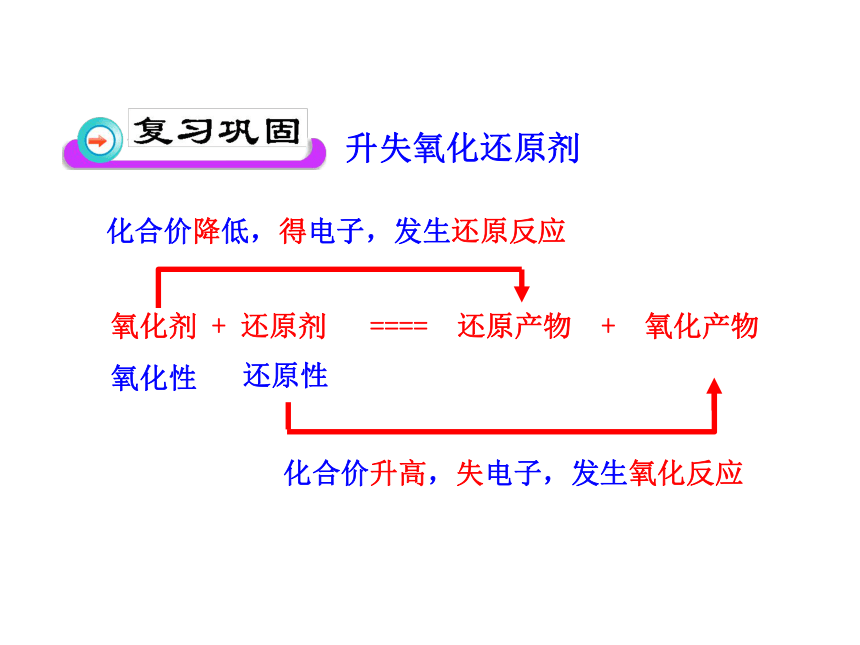
氧化剂 + 还原剂 ==== 还原产物 + 氧化产物
氧化性
还原性
化合价降低,得电子,发生还原反应
化合价升高,失电子,发生氧化反应
升失氧化还原剂
一、认识氧化性和还原性
氧化剂具有氧化性
还原剂具有还原性
得到电子
失去电子
化合价降低
化合价升高
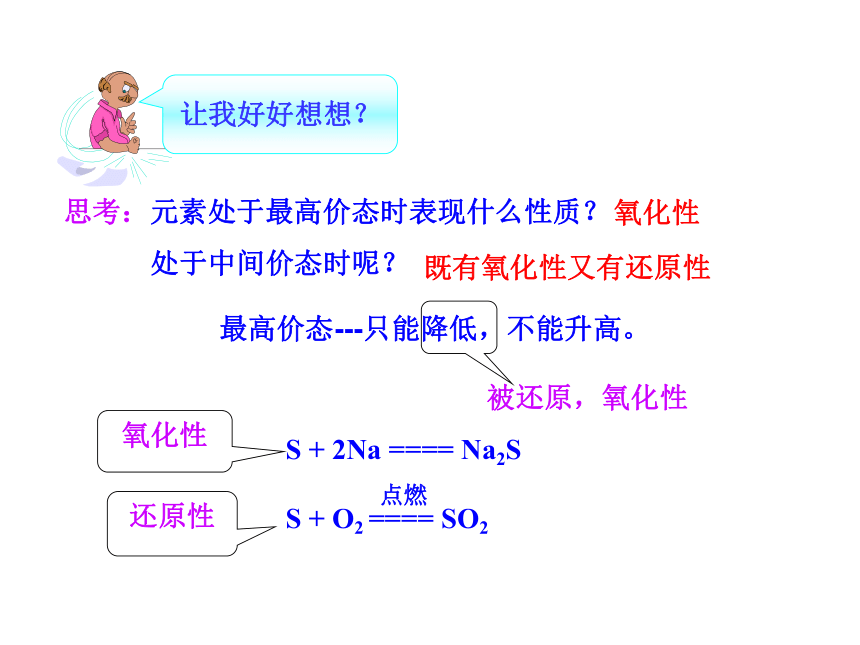
思考:元素处于最高价态时表现什么性质?
处于中间价态时呢?
让我好好想想?
最高价态---只能降低,不能升高。
被还原,氧化性
氧化性
还原性
S + 2Na ==== Na2S
S + O2 ==== SO2
点燃
既有氧化性又有还原性
氧化性
高价氧化(性)、低价还原(性);中间价态两性全。
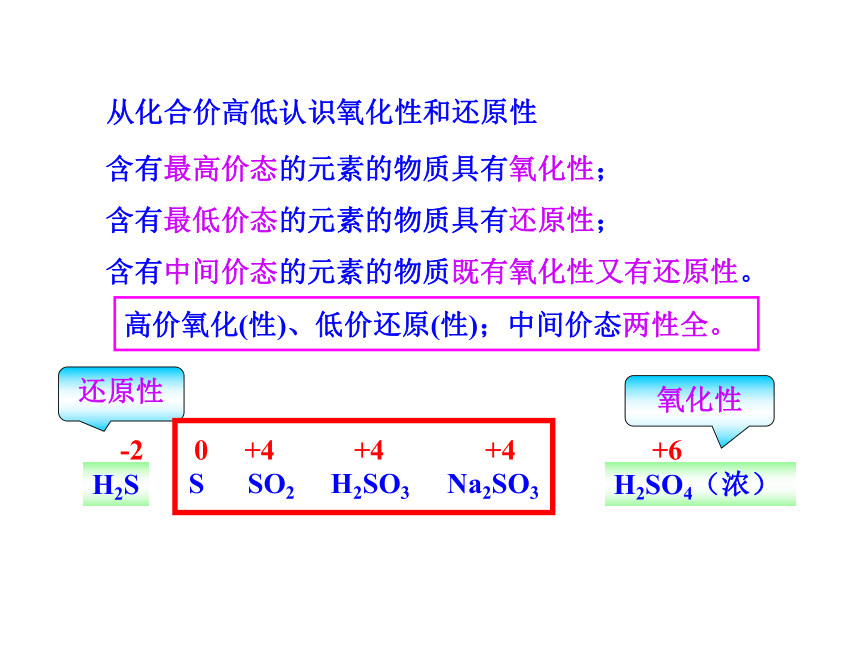
从化合价高低认识氧化性和还原性
H2S S SO2 H2SO3 Na2SO3 H2SO4(浓)
-2 0 +4 +4 +4 +6
氧化性
还原性
H2S
H2SO4(浓)
含有最高价态的元素的物质具有氧化性;
含有最低价态的元素的物质具有还原性;
含有中间价态的元素的物质既有氧化性又有还原性。
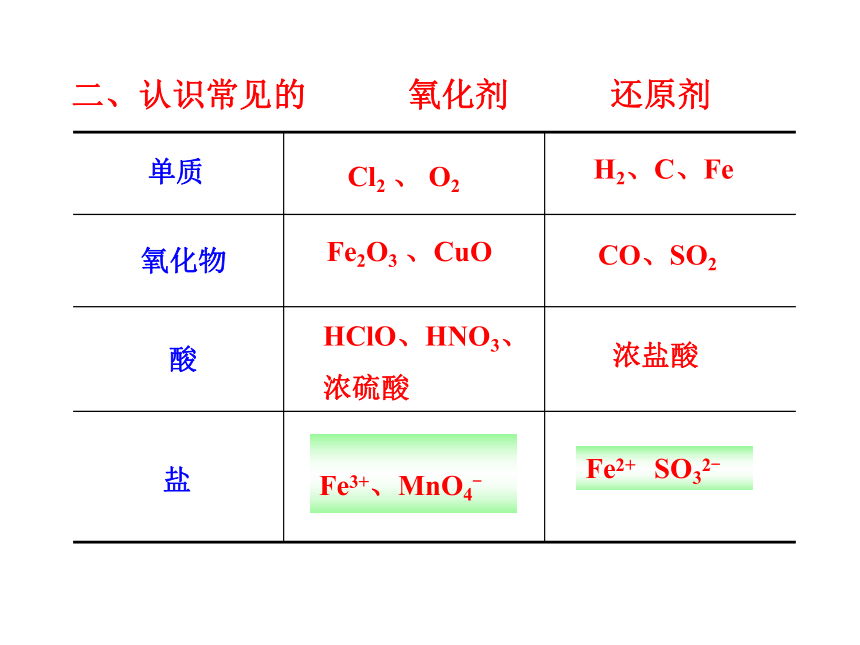
二、认识常见的 氧化剂 还原剂
Cl2 、 O2
H2、C、Fe
Fe2O3 、CuO
CO、SO2
HClO、HNO3、
浓硫酸
KClO3、FeCl3
KMnO4
浓盐酸
FeCl2 Na2SO3
单质
氧化物
酸
盐
Fe3+、MnO4-
Fe2+ SO32-
O2、Cl2、Fe3+
Na、C、 H2
S 、SO2、H2O
下列物质在化学反应中一般是氧化剂还是还原剂?
氧化剂
还原剂
既是氧化剂,又是还原剂
金属单质一定只做还原剂
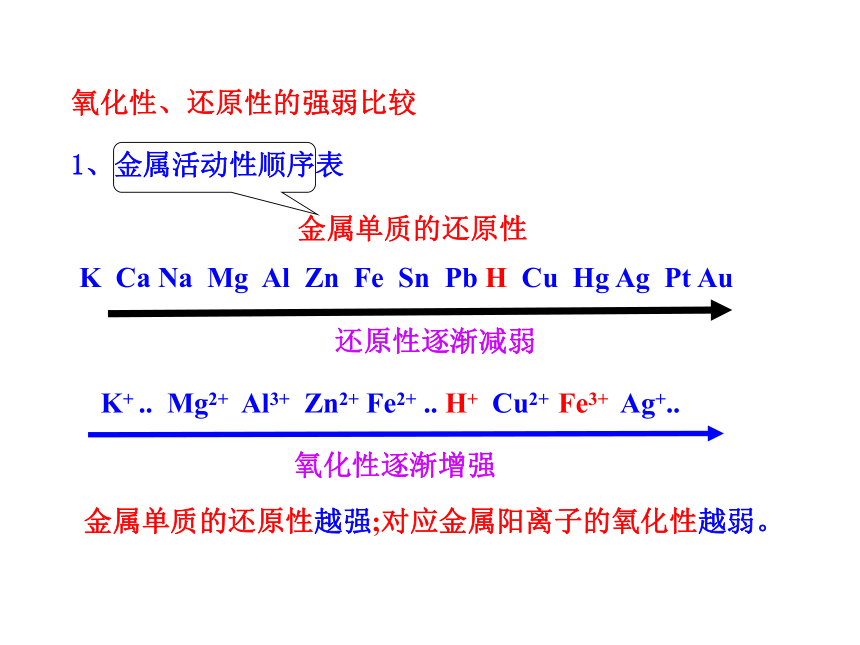
金属单质的还原性
还原性逐渐减弱
1、金属活动性顺序表
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
K+ .. Mg2+ Al3+ Zn2+ Fe2+ .. H+ Cu2+ Fe3+ Ag+..
氧化性逐渐增强
金属单质的还原性越强;对应金属阳离子的氧化性越弱。
氧化性、还原性的强弱比较
2、根据化学方程式判断还原性强弱
Fe + CuSO4 ==== FeSO4 + Cu
前强后弱
还原剂 氧化剂 氧化产物 还原产物
还原性 氧化性 氧化性 还原性
较弱
较强
氧化性:
氧化剂 >氧化产物
还原性:
还原剂 >还原产物
三、判断同种元素多种价态之间的化合价变化
Cl2+2NaOH ==== NaCl + NaClO +H2O
6HCl+KClO3====3Cl2↑+KCl+3H2O
-1 +5 0 -1
0 -1 +1
不交叉规则
① 高价+低价→中间价
② 中间价→高价+低价
③ 高价→较高价,低价→较低价。
四、氧化还原反应中的优先规律:
思考:把铁、锌混合物投入硫酸铜溶液,先发生的反应是?
还原性:锌>铁
锌优先和硫酸铜反应。
一种氧化剂与多种还原剂反应,
还原性最强的先被氧化;
一种还原剂与多种氧化剂反应,
氧化性最强的先被还原。
五、氧化还原反应中的电子守恒规律
已知反应2Fe + 3Cl2 ==== 2FeCl3 ,
可知 2mol Fe 和 3mol Cl2 恰好完全反应。
Fe 作 剂,2molFe 失电子总数为 ;
Cl2作 剂,3molCl2得电子总数为 。
点燃
氧化
还原
6×6.02×1023
6×6.02×1023
氧化还原反应中氧化剂得电子总数
= 还原剂失电子总数
高价氧化(性)、低价还原(性);中间价态两性全。
氧化还原反应
化合价升降
电子转移
氧化剂
还原剂
氧化产物
还原产物
特征
实质
电子转移数目相等
生成
生成
氧化性
还原性
具有
具有
1、有关氧化还原反应的下列叙述,正确的是( )
A、失电子的物质做氧化剂
B、有元素化合价升高的的反应是还原反应
C、还原剂失电子越多,其还原性越强
D、氧化还原反应的本质是电子的转移
D
BD
此题是双选题
2、下列微粒既有氧化性,又有还原性的是( )
A、Mg B、SO2 C、Zn2+ D、HCl
3、下列说法正确的是( )
A、含最高价元素的化合物,一定具有强氧化性
B、阳离子只有氧化性,阴离子只有还原性
C、失电子越多,还原性越强
D、强氧化剂与强还原剂不一定能发生氧化还原反应
D
如:MnO4-
如Fe2+
越易失电子
不一定,如:水
如:H2 与 浓硫酸不反应
4、下列说法正确的是( )
A、在反应中,金属单质只表现还原性,非金属单质只表现氧化性
B、失去电子的物质做氧化剂
C、元素的单质可由氧化或还原含该元素的化合物来制得
D、金属阳离子被还原一定得到金属单质
C
如:H2、C
不一定,如:Fe3+→Fe2+
5、下列变化中,必须 加入还原剂才能实现的是( )
A、NaCl→AgCl B、H2O→O2
C、KClO3→KCl D、MnO2→MnCl2
A、NaCl+AgNO3==== AgCl↓+NaNO3
-2 0
+4 +2
+5 -1
D
C、2KClO3 ==== 2KCl+3O2↑
Δ
D、MnO2+4HCl(浓) ==== MnCl2+Cl2↑+2H2O
Δ
-1 -1
B、2H2O==== 2H2↑+O2↑
电解
6、对于反应NaH+H2O====NaOH+H2↑,下列叙述正确的是( )
①H2是还原剂; ②H2O是氧化剂;
③NaH既是氧化剂,又是还原剂;
④NaH中氢元素被还原;
⑤被氧化的氢原子与被还原氢原子个数比为1:1。
A、①③⑤ B、②④
C、②⑤ D、②④⑤
C
-1 +1 +1 0
7、根据反应方程式
①2Fe3++2I- ==== 2Fe2++I2
② Br2+2Fe2+====2Br-+2Fe3+
可判断离子的还原性由强到弱的顺序为( )
A、Br-、Fe2+、I- B、I-、Fe2+、Br-
C、Br-、I-、Fe2+ D、Fe2+、I-、Br-
B
8、已知X2,Y2,Z2,W2四种物质的氧化性强弱为:
W2 > Z2 > X2 > Y2 ,下列氧化还原反应能发生的是
( )
A、2W- + Z2 ==== 2Z- + W2
B、 2X- + Z2 ==== 2Z- + X2
C、2Y- + W2 ==== 2W- + Y2
D、2Z- + X2 ==== 2X- + Z2
BC
9、在一定条件下用氯酸钾、过氧化氢制取氧气,化学方程式分别为:
2KClO3====2KCl+3O2↑ 2H2O2 ==== 2H2O+O2↑,
当制得同温、同压下相同体积的氧气时,两个反应中
转移的电子数之比为( )
A、1︰1 B、2︰1 C、3︰1 D、3︰2
MnO2
△
B
10、在Fe 2+、Fe 3+、Mg 2+、S、 I-、H+中只有氧化性的是 ,只有还原性的是 ,既有氧化性又有还原性的是 。
Fe3+ Mg2+ H+
Fe2+、S
I-
S+ 2H2SO4(浓) ==== 3SO2↑+2H2O
0 +6 +4
-1 +5 0 -1
Cl2+2NaOH ==== NaCl + NaClO +H2O
0 -1 +1
6HCl+KClO3==== 3Cl2↑+KCl+3H2O
11、被氧化与被还原的原子个数比为:_______
1:1
1:2
5:1
第2课时 氧化剂和还原剂
1、复习巩固氧化还原反应的相关概念,认识常见的氧化剂和还原剂。
2、熟练应用氧化还原反应的相关概念,体会氧化还原反应几条规律的内容和应用。
氧化剂 + 还原剂 ==== 还原产物 + 氧化产物
氧化性
还原性
化合价降低,得电子,发生还原反应
化合价升高,失电子,发生氧化反应
升失氧化还原剂
一、认识氧化性和还原性
氧化剂具有氧化性
还原剂具有还原性
得到电子
失去电子
化合价降低
化合价升高
思考:元素处于最高价态时表现什么性质?
处于中间价态时呢?
让我好好想想?
最高价态---只能降低,不能升高。
被还原,氧化性
氧化性
还原性
S + 2Na ==== Na2S
S + O2 ==== SO2
点燃
既有氧化性又有还原性
氧化性
高价氧化(性)、低价还原(性);中间价态两性全。
从化合价高低认识氧化性和还原性
H2S S SO2 H2SO3 Na2SO3 H2SO4(浓)
-2 0 +4 +4 +4 +6
氧化性
还原性
H2S
H2SO4(浓)
含有最高价态的元素的物质具有氧化性;
含有最低价态的元素的物质具有还原性;
含有中间价态的元素的物质既有氧化性又有还原性。
二、认识常见的 氧化剂 还原剂
Cl2 、 O2
H2、C、Fe
Fe2O3 、CuO
CO、SO2
HClO、HNO3、
浓硫酸
KClO3、FeCl3
KMnO4
浓盐酸
FeCl2 Na2SO3
单质
氧化物
酸
盐
Fe3+、MnO4-
Fe2+ SO32-
O2、Cl2、Fe3+
Na、C、 H2
S 、SO2、H2O
下列物质在化学反应中一般是氧化剂还是还原剂?
氧化剂
还原剂
既是氧化剂,又是还原剂
金属单质一定只做还原剂
金属单质的还原性
还原性逐渐减弱
1、金属活动性顺序表
K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au
K+ .. Mg2+ Al3+ Zn2+ Fe2+ .. H+ Cu2+ Fe3+ Ag+..
氧化性逐渐增强
金属单质的还原性越强;对应金属阳离子的氧化性越弱。
氧化性、还原性的强弱比较
2、根据化学方程式判断还原性强弱
Fe + CuSO4 ==== FeSO4 + Cu
前强后弱
还原剂 氧化剂 氧化产物 还原产物
还原性 氧化性 氧化性 还原性
较弱
较强
氧化性:
氧化剂 >氧化产物
还原性:
还原剂 >还原产物
三、判断同种元素多种价态之间的化合价变化
Cl2+2NaOH ==== NaCl + NaClO +H2O
6HCl+KClO3====3Cl2↑+KCl+3H2O
-1 +5 0 -1
0 -1 +1
不交叉规则
① 高价+低价→中间价
② 中间价→高价+低价
③ 高价→较高价,低价→较低价。
四、氧化还原反应中的优先规律:
思考:把铁、锌混合物投入硫酸铜溶液,先发生的反应是?
还原性:锌>铁
锌优先和硫酸铜反应。
一种氧化剂与多种还原剂反应,
还原性最强的先被氧化;
一种还原剂与多种氧化剂反应,
氧化性最强的先被还原。
五、氧化还原反应中的电子守恒规律
已知反应2Fe + 3Cl2 ==== 2FeCl3 ,
可知 2mol Fe 和 3mol Cl2 恰好完全反应。
Fe 作 剂,2molFe 失电子总数为 ;
Cl2作 剂,3molCl2得电子总数为 。
点燃
氧化
还原
6×6.02×1023
6×6.02×1023
氧化还原反应中氧化剂得电子总数
= 还原剂失电子总数
高价氧化(性)、低价还原(性);中间价态两性全。
氧化还原反应
化合价升降
电子转移
氧化剂
还原剂
氧化产物
还原产物
特征
实质
电子转移数目相等
生成
生成
氧化性
还原性
具有
具有
1、有关氧化还原反应的下列叙述,正确的是( )
A、失电子的物质做氧化剂
B、有元素化合价升高的的反应是还原反应
C、还原剂失电子越多,其还原性越强
D、氧化还原反应的本质是电子的转移
D
BD
此题是双选题
2、下列微粒既有氧化性,又有还原性的是( )
A、Mg B、SO2 C、Zn2+ D、HCl
3、下列说法正确的是( )
A、含最高价元素的化合物,一定具有强氧化性
B、阳离子只有氧化性,阴离子只有还原性
C、失电子越多,还原性越强
D、强氧化剂与强还原剂不一定能发生氧化还原反应
D
如:MnO4-
如Fe2+
越易失电子
不一定,如:水
如:H2 与 浓硫酸不反应
4、下列说法正确的是( )
A、在反应中,金属单质只表现还原性,非金属单质只表现氧化性
B、失去电子的物质做氧化剂
C、元素的单质可由氧化或还原含该元素的化合物来制得
D、金属阳离子被还原一定得到金属单质
C
如:H2、C
不一定,如:Fe3+→Fe2+
5、下列变化中,必须 加入还原剂才能实现的是( )
A、NaCl→AgCl B、H2O→O2
C、KClO3→KCl D、MnO2→MnCl2
A、NaCl+AgNO3==== AgCl↓+NaNO3
-2 0
+4 +2
+5 -1
D
C、2KClO3 ==== 2KCl+3O2↑
Δ
D、MnO2+4HCl(浓) ==== MnCl2+Cl2↑+2H2O
Δ
-1 -1
B、2H2O==== 2H2↑+O2↑
电解
6、对于反应NaH+H2O====NaOH+H2↑,下列叙述正确的是( )
①H2是还原剂; ②H2O是氧化剂;
③NaH既是氧化剂,又是还原剂;
④NaH中氢元素被还原;
⑤被氧化的氢原子与被还原氢原子个数比为1:1。
A、①③⑤ B、②④
C、②⑤ D、②④⑤
C
-1 +1 +1 0
7、根据反应方程式
①2Fe3++2I- ==== 2Fe2++I2
② Br2+2Fe2+====2Br-+2Fe3+
可判断离子的还原性由强到弱的顺序为( )
A、Br-、Fe2+、I- B、I-、Fe2+、Br-
C、Br-、I-、Fe2+ D、Fe2+、I-、Br-
B
8、已知X2,Y2,Z2,W2四种物质的氧化性强弱为:
W2 > Z2 > X2 > Y2 ,下列氧化还原反应能发生的是
( )
A、2W- + Z2 ==== 2Z- + W2
B、 2X- + Z2 ==== 2Z- + X2
C、2Y- + W2 ==== 2W- + Y2
D、2Z- + X2 ==== 2X- + Z2
BC
9、在一定条件下用氯酸钾、过氧化氢制取氧气,化学方程式分别为:
2KClO3====2KCl+3O2↑ 2H2O2 ==== 2H2O+O2↑,
当制得同温、同压下相同体积的氧气时,两个反应中
转移的电子数之比为( )
A、1︰1 B、2︰1 C、3︰1 D、3︰2
MnO2
△
B
10、在Fe 2+、Fe 3+、Mg 2+、S、 I-、H+中只有氧化性的是 ,只有还原性的是 ,既有氧化性又有还原性的是 。
Fe3+ Mg2+ H+
Fe2+、S
I-
S+ 2H2SO4(浓) ==== 3SO2↑+2H2O
0 +6 +4
-1 +5 0 -1
Cl2+2NaOH ==== NaCl + NaClO +H2O
0 -1 +1
6HCl+KClO3==== 3Cl2↑+KCl+3H2O
11、被氧化与被还原的原子个数比为:_______
1:1
1:2
5:1
