11-12版高中化学新课标同步授课课件:第2章第3节第1课时 氧化还原反应(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学新课标同步授课课件:第2章第3节第1课时 氧化还原反应(鲁科版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-08 00:00:00 | ||
图片预览





文档简介
(共28张PPT)
第3节 氧化剂和还原剂
第1课时 氧化还原反应
1、认识有的化学反应中存在着元素化合价的变化,
建立氧化还原反应的概念;
2、知道氧化还原反应的实质是电子的转移;
3、体会氧化还原反应的普遍存在,并能举例说明生
产、生活中常见的氧化还原反应。
+2 +4 +4
NH3 NH4Cl NO2 HNO3
-3 -3 +4 +5
H2S SO2 H2SO4
-2 +4 +6
CO CO2 Na2CO3
H、Cl、 Na、 K、 Ag
Cu、Mg、Ba、Ca、Zn
+1价
+2价
基础链接1 熟记常见元素的化合价
化合物中金属只有正价.
有负价的一定是非金属元素.
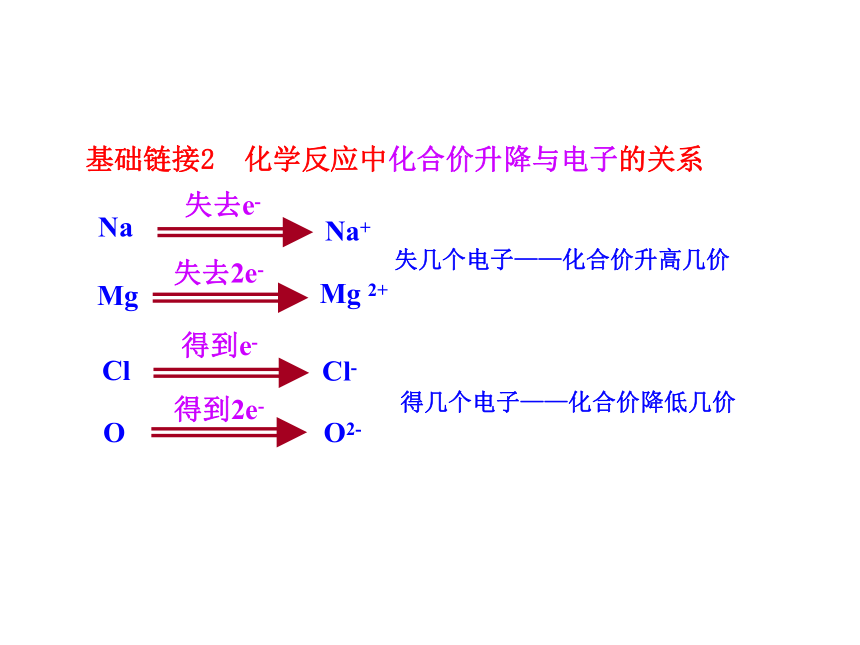
基础链接2 化学反应中化合价升降与电子的关系
失去e-
Na+
Na
失去2e-
Mg 2+
Mg
失几个电子——化合价升高几价
得到e-
Cl-
Cl
得到2e-
O2-
O
得几个电子——化合价降低几价
标出化学反应中各元素的化合价
NaCl + AgNO3 ==== AgCl + NaNO3
H2 +CuO==== Cu + H2 O
△
Zn + CuSO4 ==== Cu + ZnSO4
+1 -1 +1 +5 –2 +1 –1 +1 +5 -2
0 +2 -2 0 +1 -2
0 +2 +6 -2 0 +2 +6 -2
没有化合价变化的反应称为:非氧化还原反应
有化合价变化的反应称为:氧化还原反应
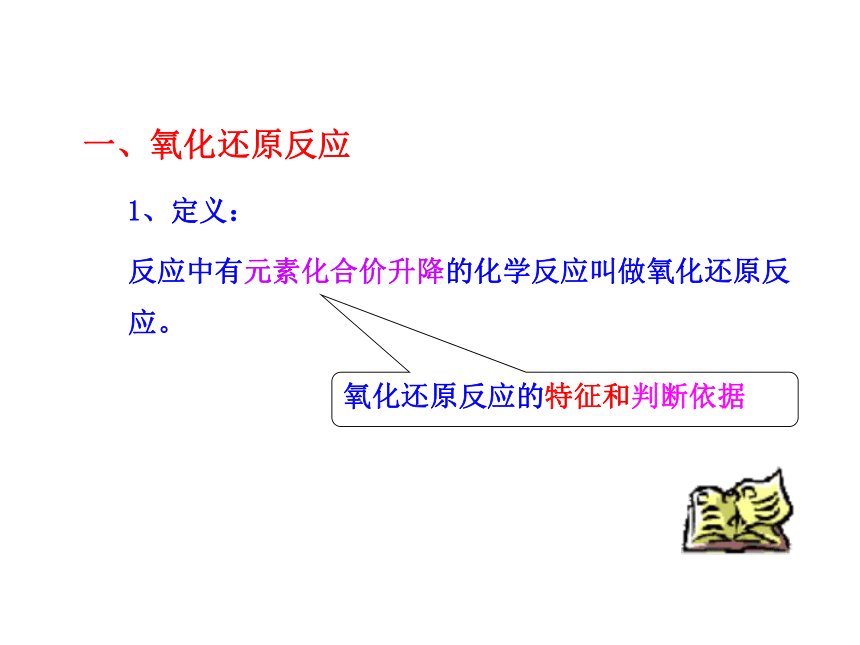
一、氧化还原反应
反应中有元素化合价升降的化学反应叫做氧化还原反应。
1、定义:
氧化还原反应的特征和判断依据
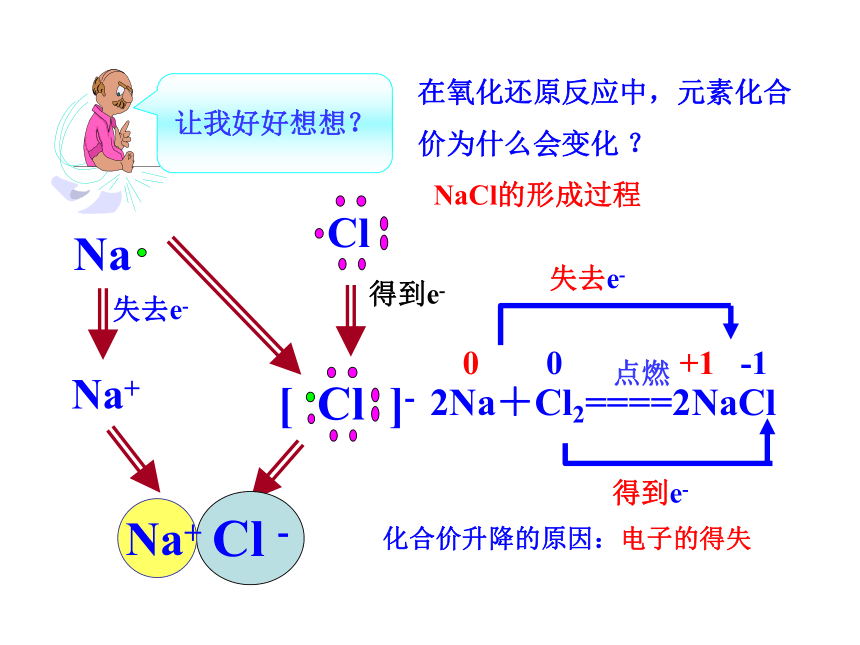
在氧化还原反应中,元素化合价为什么会变化 ?
让我好好想想?
NaCl的形成过程
Cl
Na
失去e-
得到e-
Na+
Cl -
Na+
[ Cl ]-
失去e-
得到e-
0 0 +1 -1
2Na+Cl2====2NaCl
点燃
化合价升降的原因:电子的得失
1对共用电子对偏向Cl
HCl的形成过程:
化合价升降的原因:
共用电子对的偏移
H Cl
H Cl
0 0 +1 -1
1对共用电子对偏离H
H Cl
H2+Cl2==== 2 H Cl
点燃
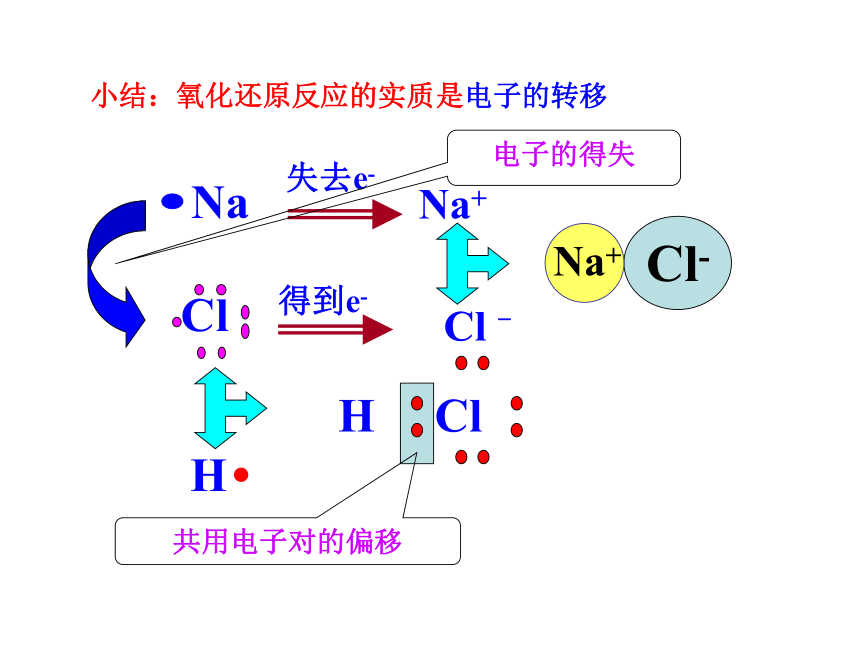
小结:氧化还原反应的实质是电子的转移
Na
失去e-
Na+
Cl
得到e-
Cl -
Cl-
Na+
H Cl
H
共用电子对的偏移
电子的得失
+2 0 0 +1
CuO + H2 ==== Cu + H2O
Δ
氧化剂
还原剂
化合价降低,
化合价升高,
氧化
产物
还原
产物
被还原,
被氧化,
得电子,
失电子,
发生还原反应
发生氧化反应
3、从化合价升降和电子得失的角度认识4组概念
氧化剂
还原剂
升、失、氧 化、还原剂。
氧化反应、被氧化、得氧化产物
被氧化,发生氧化反应
被还原,发生还原反应
还原产物
化合价降低,
得电子,
氧化产物
化合价升高,
失电子,
降、得、还原、氧化剂
反应物
生成物
4、氧化剂和还原剂
所含元素的化合价降低的反应物
所含元素的化合价升高的反应物
一般地,可以用下面的反应式表示一个氧化还原反应。
氧化剂 + 还原剂 ==== 还原产物 + 氧化产物
具有氧化性
具有还原性
____是氧化产物。
+4 -1 +2 0
________是氧化剂,被还原。
________是还原剂,被氧化。
_______是还原产物,
MnO2+4HCl(浓)==== MnCl2+Cl2↑+2H2O,反应中
Δ
MnO2
浓盐酸
MnCl2
Cl2
分析下列反应,找出氧化剂、还原剂、 氧化产物和还原产物。
是氧化剂, 是还原剂。
为还原产物, 为氧化产物。
+5 -2 -1 0
2 K Cl O3 ==== 2 K Cl + 3 O2↑
Δ
KClO3
KClO3
KCl
O2
氧化剂和还原剂可以是同种物质
分析下列反应,找出氧化剂、还原剂、 氧化产物和还原产物。
Cl2 + H2O ==== HCl + HClO
0 -1 +1
______是氧化剂,______是还原剂。
_____为还原产物,_____为氧化产物。
Cl2
Cl2
HCl
HClO
被氧化被还原的元素可以是同种元素
分析下列反应,找出氧化剂、还原剂、 氧化产物和还原产物。
_____是还原剂,______是氧化剂。
______是氧化产物,_______是还原产物。
0 0 +3 -1
2Fe + 3Cl2 ==== 2FeCl3
Δ
Fe
Cl2
FeCl3
FeCl3
氧化产物和还原产物可以是同种物质
分析下列反应,找出氧化剂、还原剂、 氧化产物和还原产物。
2Na+2H2O ==== 2NaOH+H2 ↑
Δ
2Fe+3Cl2 ==== 2FeCl3
Na2O+H2O====2NaOH
CaCO3 ==== CaO+CO2 ↑
高温
CaCl2+Na2CO3 ==== CaCO3↓+2NaCl
化合反应
分解反应
置换反应
判断下列反应是否为氧化还原反应?
√
√
√
×
×
×
2KClO3 ==== 2KCl+3O2↑
Δ
复分解反应
氧化还原反应
复分解反应
分解反应
化合反应
置换反应
4、学会判断化学反应是否为氧化还原反应?
技巧:有单质参加或生成的反应一般有化合价变化。
判断依据:有化合价变化。
5、了解氧化还原反应的表示方法:双线桥法
2Na + Cl2 ==== 2NaCl
点燃
0
0
+1
-1
失e-×2,化合价升高,被氧化
得e-×2,化合价降低,被还原
Fe + CuSO4==== FeSO4 + Cu
CuO + H2 ==== Cu + H2O
△
用双线桥表示下列反应的电子转移
+2
0
0
+1
得2e- ×1 ,化合价降低,被还原
失e-×2,化合价升高,被氧化
Fe + CuSO4==== FeSO4 + Cu
0
0
+2
+2
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
CuO + H2 ==== Cu + H2O
△
1、氧化还原反应的定义:有元素 化合价变化 的化学反应
氧化还原的特征、判断依据
电子的转移
原因
氧化还原的实质
得失或偏移
氧化剂+还原剂 ==== 还原产物+氧化反应
2、四对概念
化合价降低,得电子,发生还原反应
化合价升高,失电子,发生氧化反应
口诀:升、失、氧化----还原剂。
氧化反应
被氧化
得氧化产物
3、氧化还原反应与四种基本反应类型的关系
氧化还原反应
复分解反应
分解反应
化合反应
置换反应
有单质参与的化合反应、分解反应一定是氧化还原反应
1、有关氧化还原反应的下列叙述,正确的是( )
A、失电子的物质做氧化剂
B、有元素化合价升高的的反应是还原反应
C、还原剂失电子越多,其还原性越强
D、氧化还原反应的本质是电子的转移
D
2、下列反应属于氧化还原反应的是( )
A、 CuO + 2HCl ==== CuCl2+H2O
B、Na2CO3+ 2HCl====2NaCl + CO2 ↑+H2O
C、2KMnO4 ==== K2MnO4 + MnO2 + O2 ↑
D、Ca(OH)2 + CO2==== CaCO3 ↑ + H2O
3、下列变化属于氧化反应的是( )
A、Fe2O3 Fe B、 C CO2
C、Na2CO3 CO2 D、Al Al2O3
C
BD
4、下列说法正确的是( )
A、有单质参加的化学反应一定是氧化还原反应
B、单质可由氧化或还原含该元素的化合物来制得
C、在反应中,金属单质一定做氧化剂,非金属单质一定做还原剂
D、金属阳离子被还原一定得到金属单质
×
不一定,如:Fe3+→Fe2+
×
×
√
如:3O2====2O3
B
自己打败自己是最可悲的失败,自己战胜自己是最可贵的胜利。
第3节 氧化剂和还原剂
第1课时 氧化还原反应
1、认识有的化学反应中存在着元素化合价的变化,
建立氧化还原反应的概念;
2、知道氧化还原反应的实质是电子的转移;
3、体会氧化还原反应的普遍存在,并能举例说明生
产、生活中常见的氧化还原反应。
+2 +4 +4
NH3 NH4Cl NO2 HNO3
-3 -3 +4 +5
H2S SO2 H2SO4
-2 +4 +6
CO CO2 Na2CO3
H、Cl、 Na、 K、 Ag
Cu、Mg、Ba、Ca、Zn
+1价
+2价
基础链接1 熟记常见元素的化合价
化合物中金属只有正价.
有负价的一定是非金属元素.
基础链接2 化学反应中化合价升降与电子的关系
失去e-
Na+
Na
失去2e-
Mg 2+
Mg
失几个电子——化合价升高几价
得到e-
Cl-
Cl
得到2e-
O2-
O
得几个电子——化合价降低几价
标出化学反应中各元素的化合价
NaCl + AgNO3 ==== AgCl + NaNO3
H2 +CuO==== Cu + H2 O
△
Zn + CuSO4 ==== Cu + ZnSO4
+1 -1 +1 +5 –2 +1 –1 +1 +5 -2
0 +2 -2 0 +1 -2
0 +2 +6 -2 0 +2 +6 -2
没有化合价变化的反应称为:非氧化还原反应
有化合价变化的反应称为:氧化还原反应
一、氧化还原反应
反应中有元素化合价升降的化学反应叫做氧化还原反应。
1、定义:
氧化还原反应的特征和判断依据
在氧化还原反应中,元素化合价为什么会变化 ?
让我好好想想?
NaCl的形成过程
Cl
Na
失去e-
得到e-
Na+
Cl -
Na+
[ Cl ]-
失去e-
得到e-
0 0 +1 -1
2Na+Cl2====2NaCl
点燃
化合价升降的原因:电子的得失
1对共用电子对偏向Cl
HCl的形成过程:
化合价升降的原因:
共用电子对的偏移
H Cl
H Cl
0 0 +1 -1
1对共用电子对偏离H
H Cl
H2+Cl2==== 2 H Cl
点燃
小结:氧化还原反应的实质是电子的转移
Na
失去e-
Na+
Cl
得到e-
Cl -
Cl-
Na+
H Cl
H
共用电子对的偏移
电子的得失
+2 0 0 +1
CuO + H2 ==== Cu + H2O
Δ
氧化剂
还原剂
化合价降低,
化合价升高,
氧化
产物
还原
产物
被还原,
被氧化,
得电子,
失电子,
发生还原反应
发生氧化反应
3、从化合价升降和电子得失的角度认识4组概念
氧化剂
还原剂
升、失、氧 化、还原剂。
氧化反应、被氧化、得氧化产物
被氧化,发生氧化反应
被还原,发生还原反应
还原产物
化合价降低,
得电子,
氧化产物
化合价升高,
失电子,
降、得、还原、氧化剂
反应物
生成物
4、氧化剂和还原剂
所含元素的化合价降低的反应物
所含元素的化合价升高的反应物
一般地,可以用下面的反应式表示一个氧化还原反应。
氧化剂 + 还原剂 ==== 还原产物 + 氧化产物
具有氧化性
具有还原性
____是氧化产物。
+4 -1 +2 0
________是氧化剂,被还原。
________是还原剂,被氧化。
_______是还原产物,
MnO2+4HCl(浓)==== MnCl2+Cl2↑+2H2O,反应中
Δ
MnO2
浓盐酸
MnCl2
Cl2
分析下列反应,找出氧化剂、还原剂、 氧化产物和还原产物。
是氧化剂, 是还原剂。
为还原产物, 为氧化产物。
+5 -2 -1 0
2 K Cl O3 ==== 2 K Cl + 3 O2↑
Δ
KClO3
KClO3
KCl
O2
氧化剂和还原剂可以是同种物质
分析下列反应,找出氧化剂、还原剂、 氧化产物和还原产物。
Cl2 + H2O ==== HCl + HClO
0 -1 +1
______是氧化剂,______是还原剂。
_____为还原产物,_____为氧化产物。
Cl2
Cl2
HCl
HClO
被氧化被还原的元素可以是同种元素
分析下列反应,找出氧化剂、还原剂、 氧化产物和还原产物。
_____是还原剂,______是氧化剂。
______是氧化产物,_______是还原产物。
0 0 +3 -1
2Fe + 3Cl2 ==== 2FeCl3
Δ
Fe
Cl2
FeCl3
FeCl3
氧化产物和还原产物可以是同种物质
分析下列反应,找出氧化剂、还原剂、 氧化产物和还原产物。
2Na+2H2O ==== 2NaOH+H2 ↑
Δ
2Fe+3Cl2 ==== 2FeCl3
Na2O+H2O====2NaOH
CaCO3 ==== CaO+CO2 ↑
高温
CaCl2+Na2CO3 ==== CaCO3↓+2NaCl
化合反应
分解反应
置换反应
判断下列反应是否为氧化还原反应?
√
√
√
×
×
×
2KClO3 ==== 2KCl+3O2↑
Δ
复分解反应
氧化还原反应
复分解反应
分解反应
化合反应
置换反应
4、学会判断化学反应是否为氧化还原反应?
技巧:有单质参加或生成的反应一般有化合价变化。
判断依据:有化合价变化。
5、了解氧化还原反应的表示方法:双线桥法
2Na + Cl2 ==== 2NaCl
点燃
0
0
+1
-1
失e-×2,化合价升高,被氧化
得e-×2,化合价降低,被还原
Fe + CuSO4==== FeSO4 + Cu
CuO + H2 ==== Cu + H2O
△
用双线桥表示下列反应的电子转移
+2
0
0
+1
得2e- ×1 ,化合价降低,被还原
失e-×2,化合价升高,被氧化
Fe + CuSO4==== FeSO4 + Cu
0
0
+2
+2
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
CuO + H2 ==== Cu + H2O
△
1、氧化还原反应的定义:有元素 化合价变化 的化学反应
氧化还原的特征、判断依据
电子的转移
原因
氧化还原的实质
得失或偏移
氧化剂+还原剂 ==== 还原产物+氧化反应
2、四对概念
化合价降低,得电子,发生还原反应
化合价升高,失电子,发生氧化反应
口诀:升、失、氧化----还原剂。
氧化反应
被氧化
得氧化产物
3、氧化还原反应与四种基本反应类型的关系
氧化还原反应
复分解反应
分解反应
化合反应
置换反应
有单质参与的化合反应、分解反应一定是氧化还原反应
1、有关氧化还原反应的下列叙述,正确的是( )
A、失电子的物质做氧化剂
B、有元素化合价升高的的反应是还原反应
C、还原剂失电子越多,其还原性越强
D、氧化还原反应的本质是电子的转移
D
2、下列反应属于氧化还原反应的是( )
A、 CuO + 2HCl ==== CuCl2+H2O
B、Na2CO3+ 2HCl====2NaCl + CO2 ↑+H2O
C、2KMnO4 ==== K2MnO4 + MnO2 + O2 ↑
D、Ca(OH)2 + CO2==== CaCO3 ↑ + H2O
3、下列变化属于氧化反应的是( )
A、Fe2O3 Fe B、 C CO2
C、Na2CO3 CO2 D、Al Al2O3
C
BD
4、下列说法正确的是( )
A、有单质参加的化学反应一定是氧化还原反应
B、单质可由氧化或还原含该元素的化合物来制得
C、在反应中,金属单质一定做氧化剂,非金属单质一定做还原剂
D、金属阳离子被还原一定得到金属单质
×
不一定,如:Fe3+→Fe2+
×
×
√
如:3O2====2O3
B
自己打败自己是最可悲的失败,自己战胜自己是最可贵的胜利。
