11-12版高中化学新课标同步授课课件:第2章第2节第2课时 电解质在水溶液中的反应(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学新课标同步授课课件:第2章第2节第2课时 电解质在水溶液中的反应(鲁科版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-08 00:00:00 | ||
图片预览





文档简介
(共37张PPT)
第2课时 电解质在水溶液
中的反应
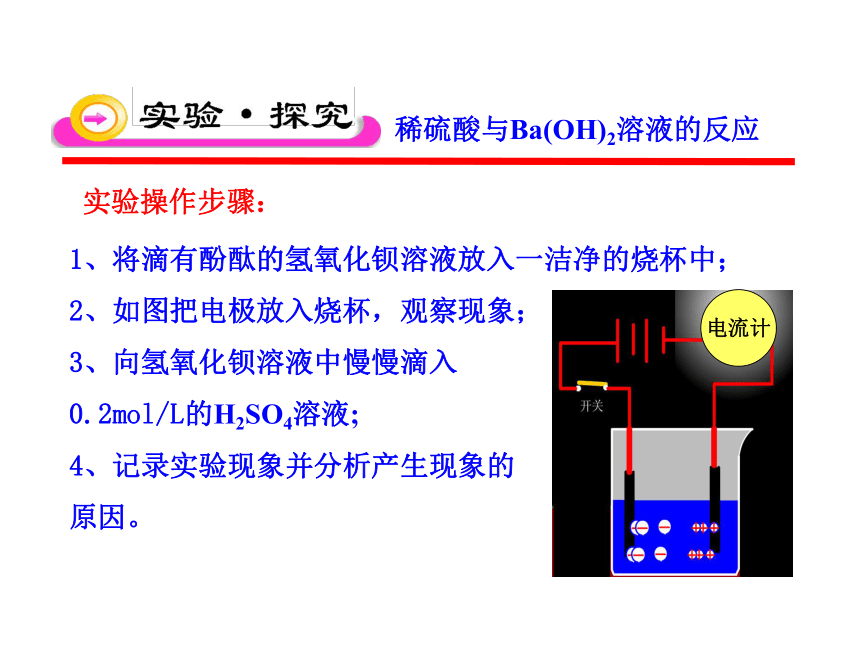
电流计
1、理解离子反应和离子方程式的含义;
2、认识离子交换引起的离子反应的发生条件;
3、初步学会一些简单离子反应的离子方程式的书写。
实验操作步骤:
1、将滴有酚酞的氢氧化钡溶液放入一洁净的烧杯中;
2、如图把电极放入烧杯,观察现象;
3、向氢氧化钡溶液中慢慢滴入
0.2mol/L的H2SO4溶液;
4、记录实验现象并分析产生现象的
原因。
稀硫酸与Ba(OH)2溶液的反应
电流计
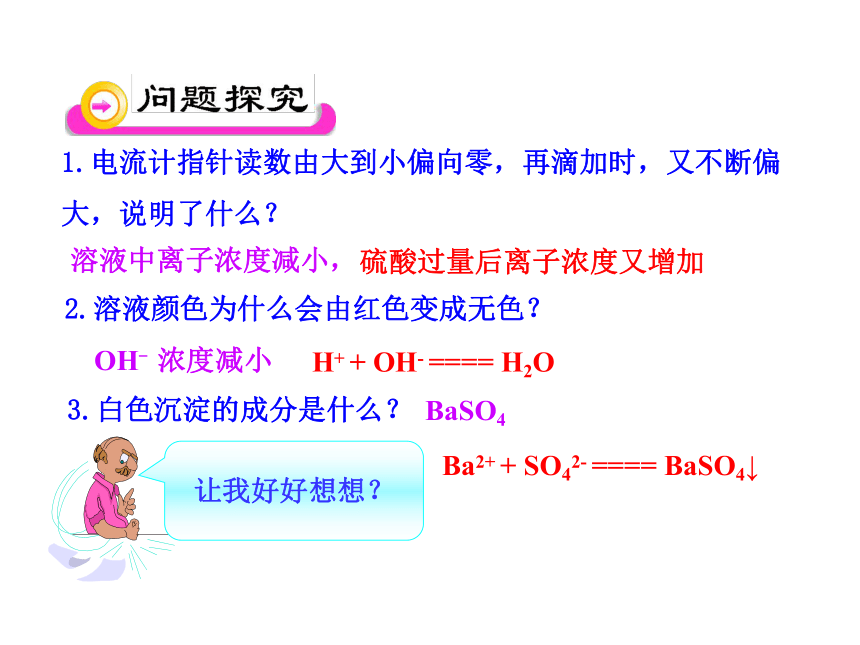
1.电流计指针读数由大到小偏向零,再滴加时,又不断偏大,说明了什么?
2.溶液颜色为什么会由红色变成无色?
3.白色沉淀的成分是什么?
溶液中离子浓度减小,
OH- 浓度减小
H+ + OH- ==== H2O
BaSO4
Ba2+ + SO42- ==== BaSO4↓
让我好好想想?
硫酸过量后离子浓度又增加
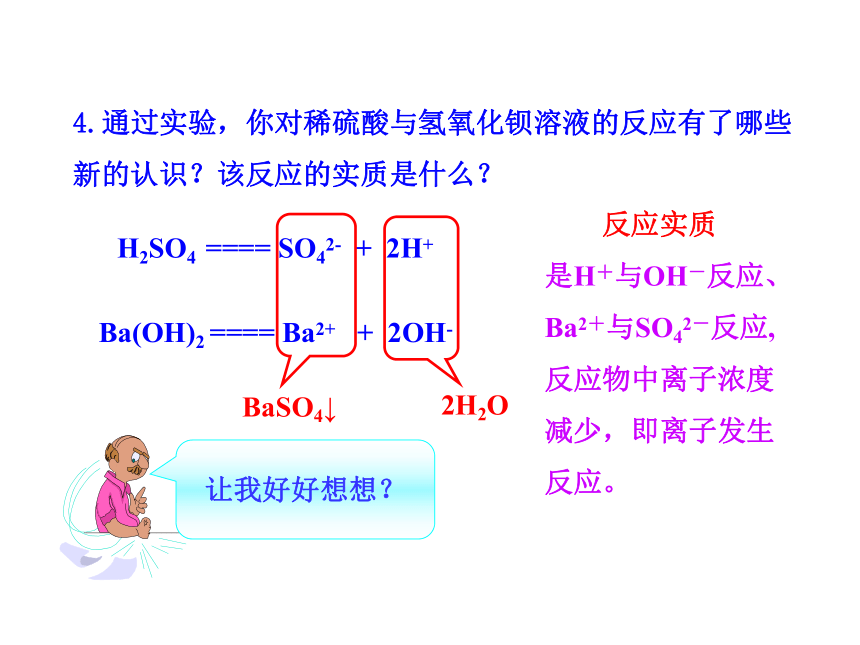
4.通过实验,你对稀硫酸与氢氧化钡溶液的反应有了哪些新的认识?该反应的实质是什么?
让我好好想想?
H2SO4 ==== SO42- + 2H+
Ba(OH)2 ==== Ba2+ + 2OH-
BaSO4↓
2H2O
反应实质
是H+与OH-反应、
Ba2+与SO42-反应,
反应物中离子浓度
减少,即离子发生
反应。
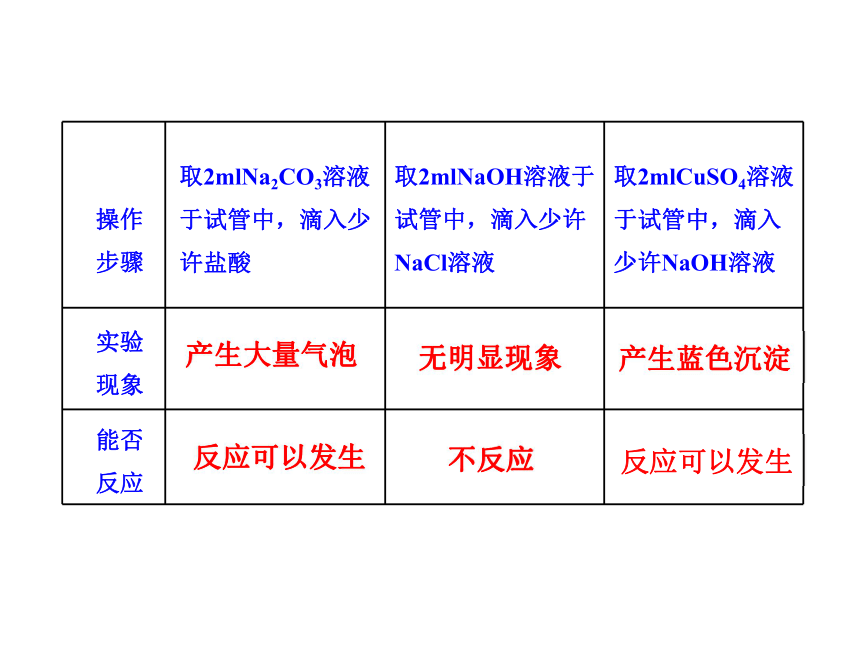
操作
步骤 取2mlNa2CO3溶液于试管中,滴入少
许盐酸 取2mlNaOH溶液于试管中,滴入少许 NaCl溶液 取2mlCuSO4溶液于试管中,滴入少许NaOH溶液
实验
现象
能否
反应
产生大量气泡
不反应
反应可以发生
无明显现象
产生蓝色沉淀
反应可以发生
1、概念:
电解质溶液之间发生的反应都是离子反应,都能使溶液中的离子浓度降低。
在溶液中有离子参加的化学反应叫做离子反应。
一、离子反应
2、发生的条件
常见难溶物:BaSO4、 AgCl、CaCO3、BaCO3、Cu(OH)2
有难溶的物质生成;
有难电离的物质(如:水)生成;
有挥发性的气体生成。
Ag+ + Cl- ====
AgCl↓
×
√
√
√
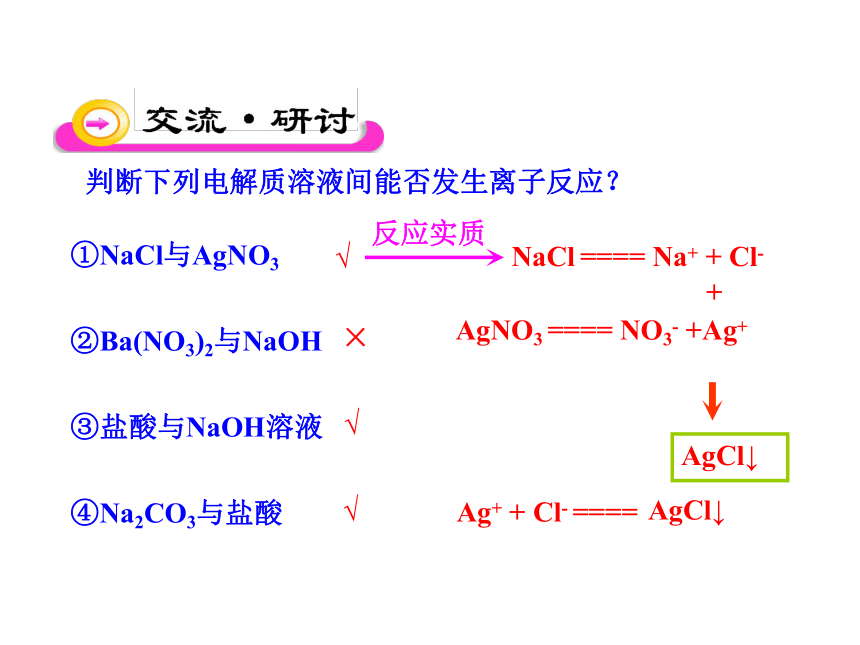
判断下列电解质溶液间能否发生离子反应?
NaCl ==== Na+ + Cl-
AgNO3 ==== NO3- +Ag+
+
AgCl↓
反应实质
①NaCl与AgNO3
②Ba(NO3)2与NaOH
③盐酸与NaOH溶液
④Na2CO3与盐酸
③ NaOH溶液与盐酸反应
生成了难电离的物质H2O
生成了难电离的物质H2O和挥发性物质CO2
④ Na2CO3和盐酸反应
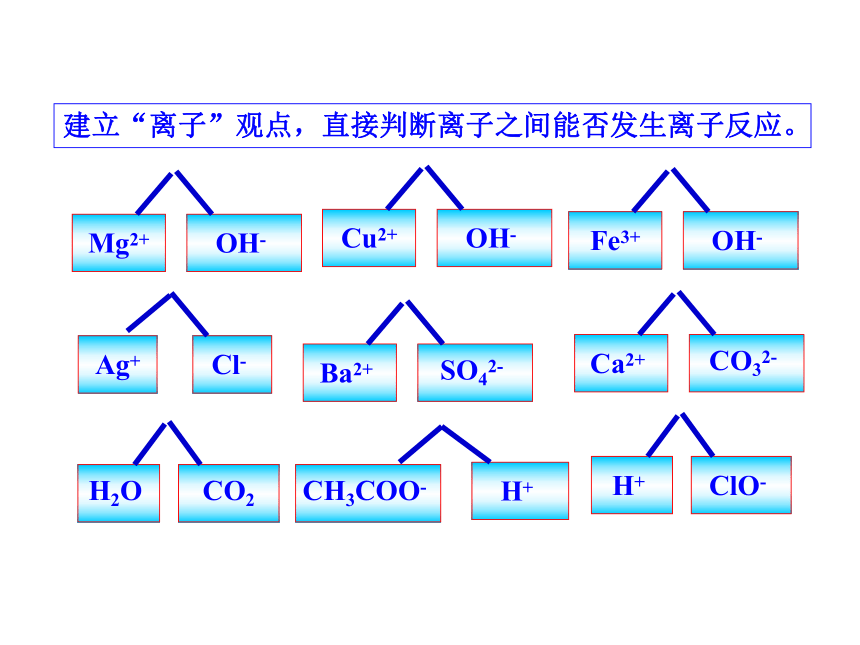
Ag+
Cl-
Ba2+
SO42-
Mg2+
OH-
Cu2+
OH-
Ca2+
CO32-
H+
ClO-
CH3COO-
H+
H2O
CO2
Fe3+
OH-
建立“离子”观点,直接判断离子之间能否发生离子反应。
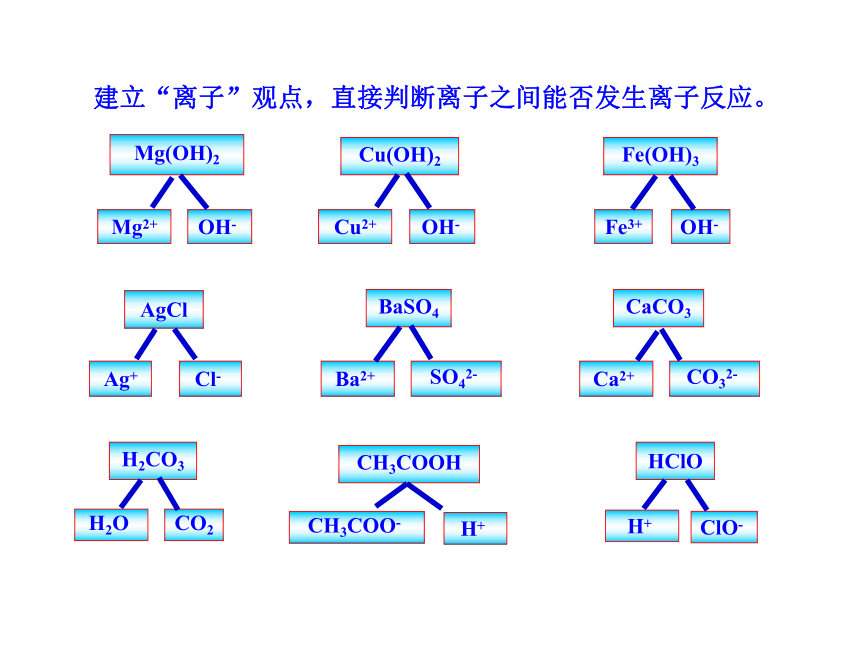
建立“离子”观点,直接判断离子之间能否发生离子反应。
AgCl
Ag+
Cl-
BaSO4
Ba2+
SO42-
Mg(OH)2
Mg2+
OH-
Cu(OH)2
Cu2+
OH-
CaCO3
Ca2+
CO32-
HClO
H+
ClO-
CH3COOH
CH3COO-
H+
H2CO3
H2O
CO2
Fe(OH)3
Fe3+
OH-
1、概念:
用实际参加反应的离子的符号表示离子反应的式子。
二、离子方程式
2.离子方程式的书写步骤:
一写——写出化学方程式;
二拆——将完全以离子形式存在的拆成离子;
四查——电荷守恒,原子守恒。
以Ba(OH)2溶液和盐酸反应为例:
Ba(OH)2+2HCl====BaCl2+ 2H2O
三删——删去不参与反应的离子;
Ba 2+ + 2OH- +2H+ +2Cl- ====Ba 2+ + 2Cl- + 2H2O
Ba2++2OH- +2H+ +2Cl- =====Ba 2+ + 2Cl- + 2H2O
OH- + H+ ==== H2O
3.书写离子方程式方法归纳
写出易溶且易电离的酸、碱、盐的电离方程式
分析哪些离子能发生反应而结合成水、沉淀、气体
将实际参加反应的离子符号写在左边,生成的水或沉淀或气体的化学式写在右边。
检查电荷守恒及微粒种类和数量守恒
按照上述方法书写下列反应的离子方程式:
①NaOH溶液和H2SO4溶液的反应
②KOH溶液和盐酸的反应
③BaCl2溶液和Na2SO4溶液的反应
④Ba(NO3)2溶液和Na2SO4溶液的反应
H+ +OH- ====H2O
H+ +OH- ====H2O
Ba2+ +SO42- ====BaSO4↓
Ba2+ +SO42- ====BaSO4↓
酸、碱、盐在离子方程式中哪些该拆、哪些不该拆?
(1)易溶于水的强电解质都要拆开成离子形式
(六强酸、四强碱、易溶盐)
(2)单质、氧化物、气体、沉淀、弱电解质
都写成化学式,不能拆
(3)不在溶液中进行的反应一般不能写离子方程式
比较上述各反应的离子方程式,你发现了什么?
你能说出离子方程式和化学方程式有哪些区别吗?
离子方程式不仅可以表示一定物质间的某个反应,
还可表示所有同一类型的离子反应。
揭示了溶液中化学反应的实质
【例】判断下列各组离子能否大量共存
① Ca2+ Na+ CO32- NO3-
② Ba2+ Na+ SO42- NO3-
③ H+ K+ Cl- OH-
④ H+ K+ CO32- SO42-
⑤ Na+ H+ ClO-、 NO3-
判断离子能否大量共存
离子间不发生化学反应就可以大量共存
Ca2+
CO32-
SO42-
Ba2+
H+
OH-
CO32-
H+
H+ ClO-
(1)生成难溶物或微溶物:
如:Ba2+与CO32-、Ag+与Cl-、Ca2+与SO42- 、Ba2+与SO42-
(2)生成气体或挥发性物质:
如:NH4+与OH-、H+与CO32-
(3) 生成难电离物质(即弱电解质):
如:H+与CH3COO-、ClO- 生成弱酸;H+与OH-生成水
离子不能大量共存的归纳
(4)题干隐含条件:
四种有色离子:Cu2+ , Fe2+ , Fe3+ , MnO4-
例: 在某酸性无色溶液中可以大量共存的离子组是( )
A、 K+ SO42- OH- Na+
B、Fe3+ Ca2+ Cl- NO3-
C、Cu2+ MnO4- Na+ H+
D、K+ Na+ Cl- NO3-
D
如溶液的酸性、碱性、颜色
离子方程式的正误判断:
(1)符合客观事实:
如:铁与稀盐酸反应
2Fe + 6 H+ ==== 2Fe3+ + 3H2↑
(2)符合质量守恒(原子守恒):
如:铝与稀盐酸反应
Al+ 3H+ ==== Al3++ H2↑
(3)符合电荷守恒:
如:Fe + Ag+ ==== Fe 2+ + Ag
(4)拆分要正确:
如:碳酸钡和稀硝酸反应
CO32-+2H+ ==== H2O+CO2↑
BaCO3+2H+ ==== Ba2++H2O+CO2↑
√
√
Fe + 2Ag+ ==== Fe 2+ + 2 Ag
(5)以物质的组成为依据:
如:氢氧化钡和稀硫酸
Ba2++ OH- + H++SO42-====BaSO4↓+ H2O
(6)注意物质的状态及是否漏写:
如:碳酸钾和稀盐酸
CO32-+2H+ ==== H2O+CO2
↑
Ba2++2OH-+2H++SO42-====BaSO4↓+2H2O
√
指出下列离子方程式属于哪种错误,并改正:
1、氢氧化铁与盐酸反应:H++OH-==== H2O
2、石灰石与盐酸反应: CO32-+2H+====CO2↑+H2O
3、碳酸钠与醋酸反应:CO32-+2H+====CO2↑+H2O
Fe(OH)3+3H+====Fe3++3H2O
CaCO3+2H+====Ca2++CO2↑+H2O
CO32-+2CH3COOH====2CH3COO- +CO2↑+H2O
4、铁和稀硫酸反应 : 2Fe+6H+====2Fe3++3H2↑
Fe+2H+====Fe2++H2 ↑
5、硫酸与氢氧化钡溶液的反应 :
H+ +SO42-+OH-+Ba2+====BaSO4↓+H2O
2H++SO42-+2OH-+Ba2+====BaSO4↓+2H2O
7、过量二氧化碳通入澄清石灰水反应 :
CO2 + Ca2+ + 2OH-====CaCO3↓+ H2O
CO2 + OH-==== HCO3-
6、氧化铜和稀硫酸反应:O2-+2H+====H2O↑
CuO +2H+ ====2Cu2++H2O↑
检验离子的存在
【例】待测液中Cl-的检验实验:
1、取少量待测液于一洁净试管中;
2、加入AgNO3溶液;
3、观察到产生白色沉淀;
4、得出结论:待测液中有Cl-。
再加稀硝酸,
白色沉淀不溶。
1、下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②易溶于水的电解质都是强电解质
③熔融状态能导电的纯净物都是电解质
④强酸溶液中的氢离子浓度一定大于弱酸溶液中的氢离子浓度
⑤电解质溶液导电是因为溶液中有自由移动的阴、阳离子
⑥0.5mol·L-1的所有一元酸的氢离子浓度都是0.5mol·L-1
A、①③⑤⑥ B、②③④⑤ C、只有⑤ D、只有③
D
2、下列离子方程式的书写正确的是( )
A、实验室用大理石和稀盐酸制取CO2
2H++CO32-====CO2↑+H2O
B、铜片插入硝酸银溶液中
Cu+2Ag+ ====Cu2++2Ag
C、钠放入冷水:Na+H2O====Na++OH-+H2↑
D、NaHCO3溶液与盐酸反应:
2H++CO32-====CO2↑+H2O
B
3、在某无色透明的酸性溶液中,能大量共存的离子组
是 ( )
A、K+、SO4 2- 、CO32-、Na+
B、Na+、ClO-、K+、NO3-
C、MnO4-、K+、SO42-、Na+
D、NH4+、Al3+、NO3-、Cl-
D
4、下列各组离子反应可以用H+ + OH- ==== H2O表示的有 ( )
A、Cu(OH)2和HNO3
B、Ba(OH)2与H2SO4
C、CO2和NaOH溶液
D、H2SO4和NaOH
D
5、下列各组中的反应(反应在溶液中进行),不可用同一离子方程式表示的是( )
A、NaOH+HCl====KOH+H2SO4
B、NaOH+H2SO4====Ba(OH)2+H2SO4
C、BaCl2+H2SO4====Ba(OH)2+Na2SO4
D、NaCl+AgNO3====HCl + AgNO3
B
6、某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子大量共存的是( )
A、CO32-、Cl- B、NO3-、Cl-
C、NO3-、SO42- D、OH -、NO3-
B
7、下列离子方程式正确的是( )
A、氢氧化钡溶液与稀硫酸的反应 OH +H+ ====H2O
B、澄清的石灰水与稀盐酸反应
Ca(OH)2 + 2H+ ==== Ca2+ + 2H2O
C、氯气溶于水:Cl2 + H2O ==== H+ + Cl- + HClO
D、鸡蛋壳与食醋发生反应:
CaCO3 + 2H+ ==== Ca2+ + H2O + CO2↑
C
8、写出下列反应的离子方程式。
①铁和硫酸铜溶液
②氢氧化铜和稀硫酸
③钠和冷水
④氧化钠和水
⑤过氧化钠和水
⑥氯气通入NaOH溶液
Fe+Cu2+====Fe2++Cu
2H++Cu(OH)2==== Cu2++2H2O
2Na+2H2O====2Na++2OH-+H2↑
Na2O+H2O====2Na++2OH-
2Na2O2+2H2O====4Na++4OH-+O2 ↑
Cl2+2OH-====Cl-+ClO-+H2O
要铭记在心:每天都是一生中最美好的日子。
第2课时 电解质在水溶液
中的反应
电流计
1、理解离子反应和离子方程式的含义;
2、认识离子交换引起的离子反应的发生条件;
3、初步学会一些简单离子反应的离子方程式的书写。
实验操作步骤:
1、将滴有酚酞的氢氧化钡溶液放入一洁净的烧杯中;
2、如图把电极放入烧杯,观察现象;
3、向氢氧化钡溶液中慢慢滴入
0.2mol/L的H2SO4溶液;
4、记录实验现象并分析产生现象的
原因。
稀硫酸与Ba(OH)2溶液的反应
电流计
1.电流计指针读数由大到小偏向零,再滴加时,又不断偏大,说明了什么?
2.溶液颜色为什么会由红色变成无色?
3.白色沉淀的成分是什么?
溶液中离子浓度减小,
OH- 浓度减小
H+ + OH- ==== H2O
BaSO4
Ba2+ + SO42- ==== BaSO4↓
让我好好想想?
硫酸过量后离子浓度又增加
4.通过实验,你对稀硫酸与氢氧化钡溶液的反应有了哪些新的认识?该反应的实质是什么?
让我好好想想?
H2SO4 ==== SO42- + 2H+
Ba(OH)2 ==== Ba2+ + 2OH-
BaSO4↓
2H2O
反应实质
是H+与OH-反应、
Ba2+与SO42-反应,
反应物中离子浓度
减少,即离子发生
反应。
操作
步骤 取2mlNa2CO3溶液于试管中,滴入少
许盐酸 取2mlNaOH溶液于试管中,滴入少许 NaCl溶液 取2mlCuSO4溶液于试管中,滴入少许NaOH溶液
实验
现象
能否
反应
产生大量气泡
不反应
反应可以发生
无明显现象
产生蓝色沉淀
反应可以发生
1、概念:
电解质溶液之间发生的反应都是离子反应,都能使溶液中的离子浓度降低。
在溶液中有离子参加的化学反应叫做离子反应。
一、离子反应
2、发生的条件
常见难溶物:BaSO4、 AgCl、CaCO3、BaCO3、Cu(OH)2
有难溶的物质生成;
有难电离的物质(如:水)生成;
有挥发性的气体生成。
Ag+ + Cl- ====
AgCl↓
×
√
√
√
判断下列电解质溶液间能否发生离子反应?
NaCl ==== Na+ + Cl-
AgNO3 ==== NO3- +Ag+
+
AgCl↓
反应实质
①NaCl与AgNO3
②Ba(NO3)2与NaOH
③盐酸与NaOH溶液
④Na2CO3与盐酸
③ NaOH溶液与盐酸反应
生成了难电离的物质H2O
生成了难电离的物质H2O和挥发性物质CO2
④ Na2CO3和盐酸反应
Ag+
Cl-
Ba2+
SO42-
Mg2+
OH-
Cu2+
OH-
Ca2+
CO32-
H+
ClO-
CH3COO-
H+
H2O
CO2
Fe3+
OH-
建立“离子”观点,直接判断离子之间能否发生离子反应。
建立“离子”观点,直接判断离子之间能否发生离子反应。
AgCl
Ag+
Cl-
BaSO4
Ba2+
SO42-
Mg(OH)2
Mg2+
OH-
Cu(OH)2
Cu2+
OH-
CaCO3
Ca2+
CO32-
HClO
H+
ClO-
CH3COOH
CH3COO-
H+
H2CO3
H2O
CO2
Fe(OH)3
Fe3+
OH-
1、概念:
用实际参加反应的离子的符号表示离子反应的式子。
二、离子方程式
2.离子方程式的书写步骤:
一写——写出化学方程式;
二拆——将完全以离子形式存在的拆成离子;
四查——电荷守恒,原子守恒。
以Ba(OH)2溶液和盐酸反应为例:
Ba(OH)2+2HCl====BaCl2+ 2H2O
三删——删去不参与反应的离子;
Ba 2+ + 2OH- +2H+ +2Cl- ====Ba 2+ + 2Cl- + 2H2O
Ba2++2OH- +2H+ +2Cl- =====Ba 2+ + 2Cl- + 2H2O
OH- + H+ ==== H2O
3.书写离子方程式方法归纳
写出易溶且易电离的酸、碱、盐的电离方程式
分析哪些离子能发生反应而结合成水、沉淀、气体
将实际参加反应的离子符号写在左边,生成的水或沉淀或气体的化学式写在右边。
检查电荷守恒及微粒种类和数量守恒
按照上述方法书写下列反应的离子方程式:
①NaOH溶液和H2SO4溶液的反应
②KOH溶液和盐酸的反应
③BaCl2溶液和Na2SO4溶液的反应
④Ba(NO3)2溶液和Na2SO4溶液的反应
H+ +OH- ====H2O
H+ +OH- ====H2O
Ba2+ +SO42- ====BaSO4↓
Ba2+ +SO42- ====BaSO4↓
酸、碱、盐在离子方程式中哪些该拆、哪些不该拆?
(1)易溶于水的强电解质都要拆开成离子形式
(六强酸、四强碱、易溶盐)
(2)单质、氧化物、气体、沉淀、弱电解质
都写成化学式,不能拆
(3)不在溶液中进行的反应一般不能写离子方程式
比较上述各反应的离子方程式,你发现了什么?
你能说出离子方程式和化学方程式有哪些区别吗?
离子方程式不仅可以表示一定物质间的某个反应,
还可表示所有同一类型的离子反应。
揭示了溶液中化学反应的实质
【例】判断下列各组离子能否大量共存
① Ca2+ Na+ CO32- NO3-
② Ba2+ Na+ SO42- NO3-
③ H+ K+ Cl- OH-
④ H+ K+ CO32- SO42-
⑤ Na+ H+ ClO-、 NO3-
判断离子能否大量共存
离子间不发生化学反应就可以大量共存
Ca2+
CO32-
SO42-
Ba2+
H+
OH-
CO32-
H+
H+ ClO-
(1)生成难溶物或微溶物:
如:Ba2+与CO32-、Ag+与Cl-、Ca2+与SO42- 、Ba2+与SO42-
(2)生成气体或挥发性物质:
如:NH4+与OH-、H+与CO32-
(3) 生成难电离物质(即弱电解质):
如:H+与CH3COO-、ClO- 生成弱酸;H+与OH-生成水
离子不能大量共存的归纳
(4)题干隐含条件:
四种有色离子:Cu2+ , Fe2+ , Fe3+ , MnO4-
例: 在某酸性无色溶液中可以大量共存的离子组是( )
A、 K+ SO42- OH- Na+
B、Fe3+ Ca2+ Cl- NO3-
C、Cu2+ MnO4- Na+ H+
D、K+ Na+ Cl- NO3-
D
如溶液的酸性、碱性、颜色
离子方程式的正误判断:
(1)符合客观事实:
如:铁与稀盐酸反应
2Fe + 6 H+ ==== 2Fe3+ + 3H2↑
(2)符合质量守恒(原子守恒):
如:铝与稀盐酸反应
Al+ 3H+ ==== Al3++ H2↑
(3)符合电荷守恒:
如:Fe + Ag+ ==== Fe 2+ + Ag
(4)拆分要正确:
如:碳酸钡和稀硝酸反应
CO32-+2H+ ==== H2O+CO2↑
BaCO3+2H+ ==== Ba2++H2O+CO2↑
√
√
Fe + 2Ag+ ==== Fe 2+ + 2 Ag
(5)以物质的组成为依据:
如:氢氧化钡和稀硫酸
Ba2++ OH- + H++SO42-====BaSO4↓+ H2O
(6)注意物质的状态及是否漏写:
如:碳酸钾和稀盐酸
CO32-+2H+ ==== H2O+CO2
↑
Ba2++2OH-+2H++SO42-====BaSO4↓+2H2O
√
指出下列离子方程式属于哪种错误,并改正:
1、氢氧化铁与盐酸反应:H++OH-==== H2O
2、石灰石与盐酸反应: CO32-+2H+====CO2↑+H2O
3、碳酸钠与醋酸反应:CO32-+2H+====CO2↑+H2O
Fe(OH)3+3H+====Fe3++3H2O
CaCO3+2H+====Ca2++CO2↑+H2O
CO32-+2CH3COOH====2CH3COO- +CO2↑+H2O
4、铁和稀硫酸反应 : 2Fe+6H+====2Fe3++3H2↑
Fe+2H+====Fe2++H2 ↑
5、硫酸与氢氧化钡溶液的反应 :
H+ +SO42-+OH-+Ba2+====BaSO4↓+H2O
2H++SO42-+2OH-+Ba2+====BaSO4↓+2H2O
7、过量二氧化碳通入澄清石灰水反应 :
CO2 + Ca2+ + 2OH-====CaCO3↓+ H2O
CO2 + OH-==== HCO3-
6、氧化铜和稀硫酸反应:O2-+2H+====H2O↑
CuO +2H+ ====2Cu2++H2O↑
检验离子的存在
【例】待测液中Cl-的检验实验:
1、取少量待测液于一洁净试管中;
2、加入AgNO3溶液;
3、观察到产生白色沉淀;
4、得出结论:待测液中有Cl-。
再加稀硝酸,
白色沉淀不溶。
1、下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②易溶于水的电解质都是强电解质
③熔融状态能导电的纯净物都是电解质
④强酸溶液中的氢离子浓度一定大于弱酸溶液中的氢离子浓度
⑤电解质溶液导电是因为溶液中有自由移动的阴、阳离子
⑥0.5mol·L-1的所有一元酸的氢离子浓度都是0.5mol·L-1
A、①③⑤⑥ B、②③④⑤ C、只有⑤ D、只有③
D
2、下列离子方程式的书写正确的是( )
A、实验室用大理石和稀盐酸制取CO2
2H++CO32-====CO2↑+H2O
B、铜片插入硝酸银溶液中
Cu+2Ag+ ====Cu2++2Ag
C、钠放入冷水:Na+H2O====Na++OH-+H2↑
D、NaHCO3溶液与盐酸反应:
2H++CO32-====CO2↑+H2O
B
3、在某无色透明的酸性溶液中,能大量共存的离子组
是 ( )
A、K+、SO4 2- 、CO32-、Na+
B、Na+、ClO-、K+、NO3-
C、MnO4-、K+、SO42-、Na+
D、NH4+、Al3+、NO3-、Cl-
D
4、下列各组离子反应可以用H+ + OH- ==== H2O表示的有 ( )
A、Cu(OH)2和HNO3
B、Ba(OH)2与H2SO4
C、CO2和NaOH溶液
D、H2SO4和NaOH
D
5、下列各组中的反应(反应在溶液中进行),不可用同一离子方程式表示的是( )
A、NaOH+HCl====KOH+H2SO4
B、NaOH+H2SO4====Ba(OH)2+H2SO4
C、BaCl2+H2SO4====Ba(OH)2+Na2SO4
D、NaCl+AgNO3====HCl + AgNO3
B
6、某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子大量共存的是( )
A、CO32-、Cl- B、NO3-、Cl-
C、NO3-、SO42- D、OH -、NO3-
B
7、下列离子方程式正确的是( )
A、氢氧化钡溶液与稀硫酸的反应 OH +H+ ====H2O
B、澄清的石灰水与稀盐酸反应
Ca(OH)2 + 2H+ ==== Ca2+ + 2H2O
C、氯气溶于水:Cl2 + H2O ==== H+ + Cl- + HClO
D、鸡蛋壳与食醋发生反应:
CaCO3 + 2H+ ==== Ca2+ + H2O + CO2↑
C
8、写出下列反应的离子方程式。
①铁和硫酸铜溶液
②氢氧化铜和稀硫酸
③钠和冷水
④氧化钠和水
⑤过氧化钠和水
⑥氯气通入NaOH溶液
Fe+Cu2+====Fe2++Cu
2H++Cu(OH)2==== Cu2++2H2O
2Na+2H2O====2Na++2OH-+H2↑
Na2O+H2O====2Na++2OH-
2Na2O2+2H2O====4Na++4OH-+O2 ↑
Cl2+2OH-====Cl-+ClO-+H2O
要铭记在心:每天都是一生中最美好的日子。
