11-12版高中化学新课标同步授课课件:第1章第3节第4课时 物质的量在化学反应中的应用(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学新课标同步授课课件:第1章第3节第4课时 物质的量在化学反应中的应用(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-08 15:51:25 | ||
图片预览






文档简介
(共22张PPT)
第4课时 物质的量在化
学反应中的应用
1、理解化学方程式包含的物质各种量的定量关系。
2、了解物质的量在化学方程式中的计算格式。
微观(粒子个数)
宏观(质量)
物质的量(n)
23g Na与足量水反应能生成多少个H2分子?
2Na+2H2O====2NaOH+H2↑
化学计量数之比
物质的量之比
2Na + 2H2O ==== 2NaOH + H2↑
2
2
2
:
:
:
1
2mol
2mol
2mol
:
:
1mol
:
一、理解化学方程式包含的信息有哪些
微粒数之比
2个 : 2个 : 2个 : 1个
化学计量数之比=物质的量之比
扩大NA倍
扩大NA倍
46 g 2g
1mol
物质的量角度:
质量角度:
2mol
计算的关键: 上下相同, 左右对应。
23g Na能生成几molH2?
46 g ~1mol
23 g ~ mol
2Na +2H2O ====2NaOH+ H2↑
0.5mol
3.01×1023个
23g Na能生成多少个H2分子?
2H2 + O2 ==== 2H2O
点燃
4g 36g
2mol 2mol
8g
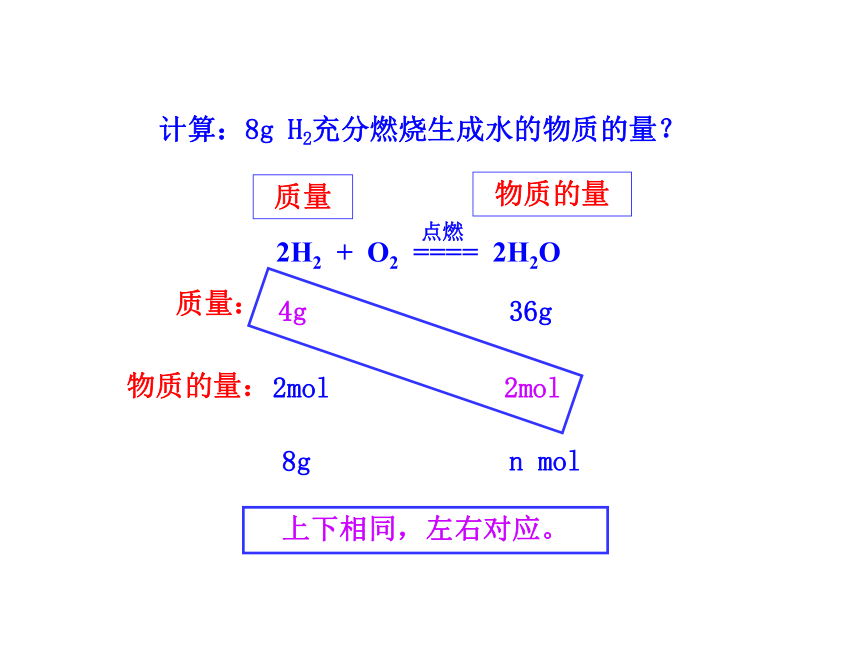
计算:8g H2充分燃烧生成水的物质的量?
质量
物质的量
n mol
上下相同,左右对应。
质量:
物质的量:
2H2 + O2 ==== 2H2O
点燃
4g 36g
2mol 1mol
8g
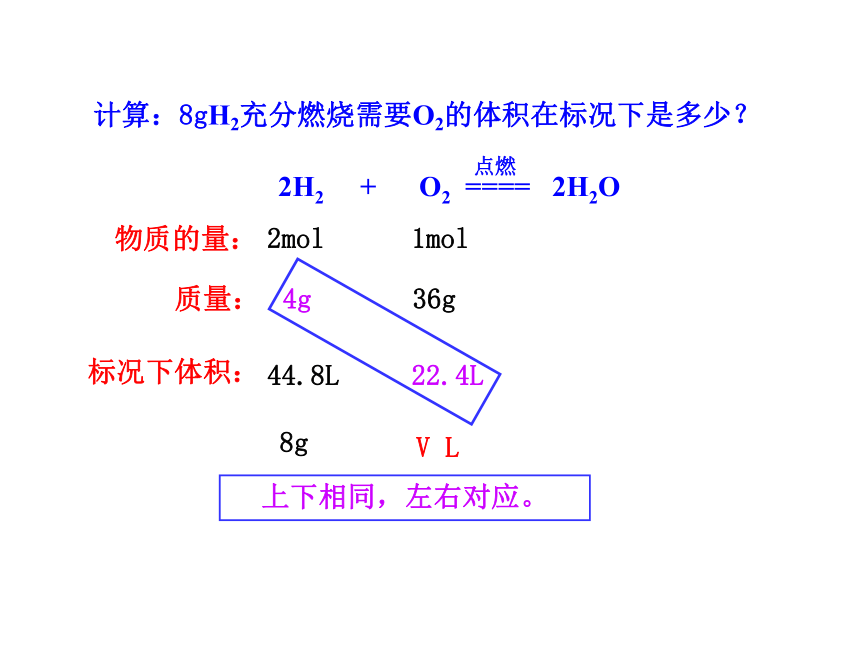
计算:8gH2充分燃烧需要O2的体积在标况下是多少?
V L
44.8L 22.4L
上下相同,左右对应。
质量:
物质的量:
标况下体积:
(1)根据题意写出相关反应的化学方程式;
(2)找出相关物质的计量数之比;
(3)对应计量系数,找出相关物质的物质的量;
(要求的量用n(B)或设未知数x、y等代表)
(4)根据计量关系列比例式进行计算。
二、根据化学方程式进行计算的基本步骤 :
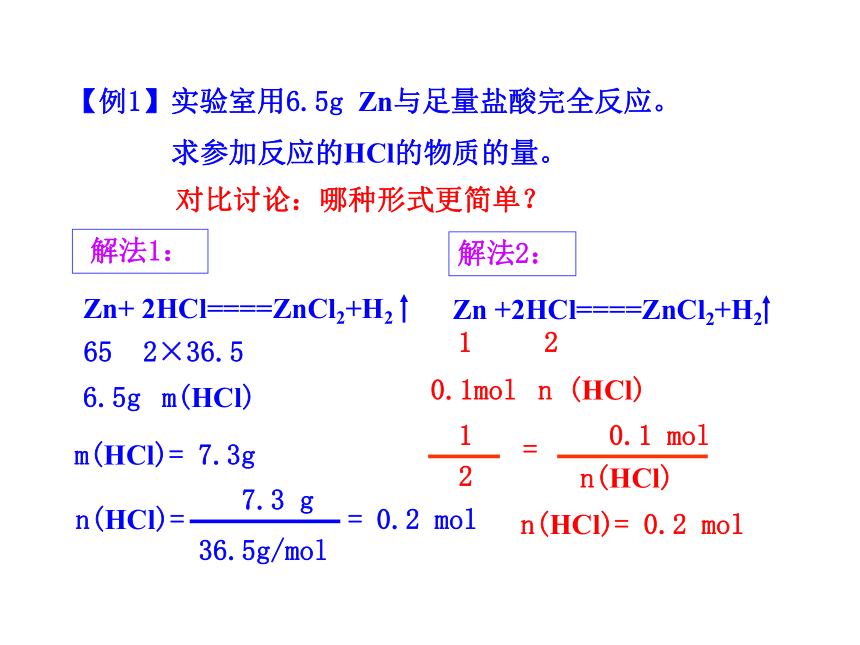
Zn+ 2HCl====ZnCl2+H2
1
2
n (HCl)
0.1mol
n(HCl)= 0.2 mol
1
2
0.1 mol
n(HCl)
=
Zn +2HCl====ZnCl2+H2
m(HCl)
6.5g
65
2×36.5
m(HCl)= 7.3g
7.3 g
36.5g/mol
n(HCl)=
= 0.2 mol
解法1:
解法2:
对比讨论:哪种形式更简单?
【例1】实验室用6.5g Zn与足量盐酸完全反应。
求参加反应的HCl的物质的量。
【例2】实验室用6.5g Zn与足量盐酸完全反应。
求生成H2的体积(标况下)。
Zn + 2HCl ==== ZnCl2 + H2
1mol
22.4L
V(H2)
0.1mol
V(H2)=
2.24 L
=
0.1 mol×22.4 L
1mol
1mol
0.1mol
=
22.4L
V(H2)
用解法2:
【例3】在200 mL 0.5mol/L NaCl溶液中滴入足量AgNO3溶液,生成多少克沉淀?
n(NaCl)=0.5mol/L×0.2L =0.1 mol
m(AgCl)
1mol
143.5g
0.1mol
答:能生成14.35 g AgCl沉淀。
解:
NaCl + AgNO3 ====AgCl + NaNO3
m(AgCl)= =14.35 g
0.1 mol×143.5g
1mol
【例4】实验室用60g含CaCO380%的大理石与足量12mol/L的浓盐酸完全反应(杂质不参加反应)
求:①参加反应的浓盐酸的体积。
②生成CO2的体积(标况下)。
解:
CaCO3摩尔质量为100 g/mol
M (CaCO3)
n( CaCO3) =
m(CaCO3)
( CaCO3)
=
60 g×80%
100 g/mol
= 0.48 mol
1mol
V [HCL(aq)] =
2mol×0.48 mol
2 mol
0.48 mol
答:参加反应的浓盐酸体积为0.08L;
生成CO2的体积在标况下10.75 L。
CaCO3(s) + 2HCl(aq) ==== CaCl2(aq) + CO2 + H2O
12mol/L×V [HCl(aq)]
1mol×12mol/L
=0.08 L
22.4 L
V (CO2)
V(CO2)
=
0.48mol×22.4 L
1mol
=10.752 L
2、化学方程式所表示的是实际参加反应的物质之间的量的关系。
1、化学方程式中各物质的化学计量数之比等于各物质的物质的量之比。
通过做以上各题,大家有什么体会?
3、单位应上下相同,左右对应。
D
1、物质在相互反应时( )
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量比等于方程式中化学计量数之比
D.它们物质的量比等于方程式中化学计量数之比
B
2、0.16 g氢氧化钠恰好与20 mL的盐酸完全反应,则盐酸的物质的量浓度为( )
A、0.1 mol/L B、0.2 mol/L
C、0.5 mol/L D、1 mol/L
3、NA代表阿伏加德罗常数的值,下述正确的是( )
A、同温同压时,相同体积的任何气体单质所含原子数目相同
B、2g氢气所含原子数目为NA
C、常温常压下,11.2L氮气所含原子数目为NA
D、0.5mol单质铝与足量盐酸反应生成的氢气在标准状况下体积为16.8L
D
4、100mL0.3mol·L-1Na2SO4溶液和50mL0.2mol·L-1
Al2(SO4)3溶液混合后,溶液中的SO42-的浓度为(设混合溶液的体积等于混合前两种溶液的体积和)( )
A、0.20 mol·L-1 B、0.25 mol·L-1
C、0.40 mol·L-1 D、0.50 mol·L-1
C
5、物质的量浓度相同的NaCl、MgCl2、AlCl3三种物质
的溶液,当溶液的体积比为3:2:1时,它们与同一浓度
的AgNO3溶液恰好完全反应。则消耗AgNO3溶液的体积比为( )
A、3:4:3 B、1:1:1
C、1:2:3 D、3:2:1
A
m(HNO3)= 31.5 g
NaOH + HNO3 ==== NaNO3 + H2O
6、完全中和0.5 mol NaOH需多少克HNO3?
解:
答:完全中和0.5molNaOH需31.5g HNO3。
1mol
0.5mol
63g
m(HNO3)
=
1mol
63g
m (HNO3 )
0.5 mol
7、在标准状况下,CH4气体2.24升充分燃烧时消耗O2多少摩尔?生成水多少克?
22.4L 2mol 36g
2. 24L n(O2) m(H2O)
n(O2)= 0.2mol
22.4L
2.24L
=
CH4 + 2O2 ==== CO2 + 2H2O
点燃
解:
2mol
n(O2)
36g
m(H2O)
=
m(H2O) = 3.6g
幸福的大秘诀是:与其让外界的事物适应自己,不如让自己去适应外界的事物。
第4课时 物质的量在化
学反应中的应用
1、理解化学方程式包含的物质各种量的定量关系。
2、了解物质的量在化学方程式中的计算格式。
微观(粒子个数)
宏观(质量)
物质的量(n)
23g Na与足量水反应能生成多少个H2分子?
2Na+2H2O====2NaOH+H2↑
化学计量数之比
物质的量之比
2Na + 2H2O ==== 2NaOH + H2↑
2
2
2
:
:
:
1
2mol
2mol
2mol
:
:
1mol
:
一、理解化学方程式包含的信息有哪些
微粒数之比
2个 : 2个 : 2个 : 1个
化学计量数之比=物质的量之比
扩大NA倍
扩大NA倍
46 g 2g
1mol
物质的量角度:
质量角度:
2mol
计算的关键: 上下相同, 左右对应。
23g Na能生成几molH2?
46 g ~1mol
23 g ~ mol
2Na +2H2O ====2NaOH+ H2↑
0.5mol
3.01×1023个
23g Na能生成多少个H2分子?
2H2 + O2 ==== 2H2O
点燃
4g 36g
2mol 2mol
8g
计算:8g H2充分燃烧生成水的物质的量?
质量
物质的量
n mol
上下相同,左右对应。
质量:
物质的量:
2H2 + O2 ==== 2H2O
点燃
4g 36g
2mol 1mol
8g
计算:8gH2充分燃烧需要O2的体积在标况下是多少?
V L
44.8L 22.4L
上下相同,左右对应。
质量:
物质的量:
标况下体积:
(1)根据题意写出相关反应的化学方程式;
(2)找出相关物质的计量数之比;
(3)对应计量系数,找出相关物质的物质的量;
(要求的量用n(B)或设未知数x、y等代表)
(4)根据计量关系列比例式进行计算。
二、根据化学方程式进行计算的基本步骤 :
Zn+ 2HCl====ZnCl2+H2
1
2
n (HCl)
0.1mol
n(HCl)= 0.2 mol
1
2
0.1 mol
n(HCl)
=
Zn +2HCl====ZnCl2+H2
m(HCl)
6.5g
65
2×36.5
m(HCl)= 7.3g
7.3 g
36.5g/mol
n(HCl)=
= 0.2 mol
解法1:
解法2:
对比讨论:哪种形式更简单?
【例1】实验室用6.5g Zn与足量盐酸完全反应。
求参加反应的HCl的物质的量。
【例2】实验室用6.5g Zn与足量盐酸完全反应。
求生成H2的体积(标况下)。
Zn + 2HCl ==== ZnCl2 + H2
1mol
22.4L
V(H2)
0.1mol
V(H2)=
2.24 L
=
0.1 mol×22.4 L
1mol
1mol
0.1mol
=
22.4L
V(H2)
用解法2:
【例3】在200 mL 0.5mol/L NaCl溶液中滴入足量AgNO3溶液,生成多少克沉淀?
n(NaCl)=0.5mol/L×0.2L =0.1 mol
m(AgCl)
1mol
143.5g
0.1mol
答:能生成14.35 g AgCl沉淀。
解:
NaCl + AgNO3 ====AgCl + NaNO3
m(AgCl)= =14.35 g
0.1 mol×143.5g
1mol
【例4】实验室用60g含CaCO380%的大理石与足量12mol/L的浓盐酸完全反应(杂质不参加反应)
求:①参加反应的浓盐酸的体积。
②生成CO2的体积(标况下)。
解:
CaCO3摩尔质量为100 g/mol
M (CaCO3)
n( CaCO3) =
m(CaCO3)
( CaCO3)
=
60 g×80%
100 g/mol
= 0.48 mol
1mol
V [HCL(aq)] =
2mol×0.48 mol
2 mol
0.48 mol
答:参加反应的浓盐酸体积为0.08L;
生成CO2的体积在标况下10.75 L。
CaCO3(s) + 2HCl(aq) ==== CaCl2(aq) + CO2 + H2O
12mol/L×V [HCl(aq)]
1mol×12mol/L
=0.08 L
22.4 L
V (CO2)
V(CO2)
=
0.48mol×22.4 L
1mol
=10.752 L
2、化学方程式所表示的是实际参加反应的物质之间的量的关系。
1、化学方程式中各物质的化学计量数之比等于各物质的物质的量之比。
通过做以上各题,大家有什么体会?
3、单位应上下相同,左右对应。
D
1、物质在相互反应时( )
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量比等于方程式中化学计量数之比
D.它们物质的量比等于方程式中化学计量数之比
B
2、0.16 g氢氧化钠恰好与20 mL的盐酸完全反应,则盐酸的物质的量浓度为( )
A、0.1 mol/L B、0.2 mol/L
C、0.5 mol/L D、1 mol/L
3、NA代表阿伏加德罗常数的值,下述正确的是( )
A、同温同压时,相同体积的任何气体单质所含原子数目相同
B、2g氢气所含原子数目为NA
C、常温常压下,11.2L氮气所含原子数目为NA
D、0.5mol单质铝与足量盐酸反应生成的氢气在标准状况下体积为16.8L
D
4、100mL0.3mol·L-1Na2SO4溶液和50mL0.2mol·L-1
Al2(SO4)3溶液混合后,溶液中的SO42-的浓度为(设混合溶液的体积等于混合前两种溶液的体积和)( )
A、0.20 mol·L-1 B、0.25 mol·L-1
C、0.40 mol·L-1 D、0.50 mol·L-1
C
5、物质的量浓度相同的NaCl、MgCl2、AlCl3三种物质
的溶液,当溶液的体积比为3:2:1时,它们与同一浓度
的AgNO3溶液恰好完全反应。则消耗AgNO3溶液的体积比为( )
A、3:4:3 B、1:1:1
C、1:2:3 D、3:2:1
A
m(HNO3)= 31.5 g
NaOH + HNO3 ==== NaNO3 + H2O
6、完全中和0.5 mol NaOH需多少克HNO3?
解:
答:完全中和0.5molNaOH需31.5g HNO3。
1mol
0.5mol
63g
m(HNO3)
=
1mol
63g
m (HNO3 )
0.5 mol
7、在标准状况下,CH4气体2.24升充分燃烧时消耗O2多少摩尔?生成水多少克?
22.4L 2mol 36g
2. 24L n(O2) m(H2O)
n(O2)= 0.2mol
22.4L
2.24L
=
CH4 + 2O2 ==== CO2 + 2H2O
点燃
解:
2mol
n(O2)
36g
m(H2O)
=
m(H2O) = 3.6g
幸福的大秘诀是:与其让外界的事物适应自己,不如让自己去适应外界的事物。
