11-12版高中化学新课标同步授课课件:第4章 第1节 无机非金属材料的主角——硅(人教版必修1)
文档属性
| 名称 | 11-12版高中化学新课标同步授课课件:第4章 第1节 无机非金属材料的主角——硅(人教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 08:20:53 | ||
图片预览









文档简介
(共38张PPT)
第一节 无机非金属材料的主角—硅
第四章 非金属及其化合物
美国硅谷
1、了解Si、SiO2、H2SiO3的主要性质。
2、认识Si、SiO2、H2SiO3的广泛用途,体会化学的创造性和实用性。
3、了解硅酸盐的主要性质。
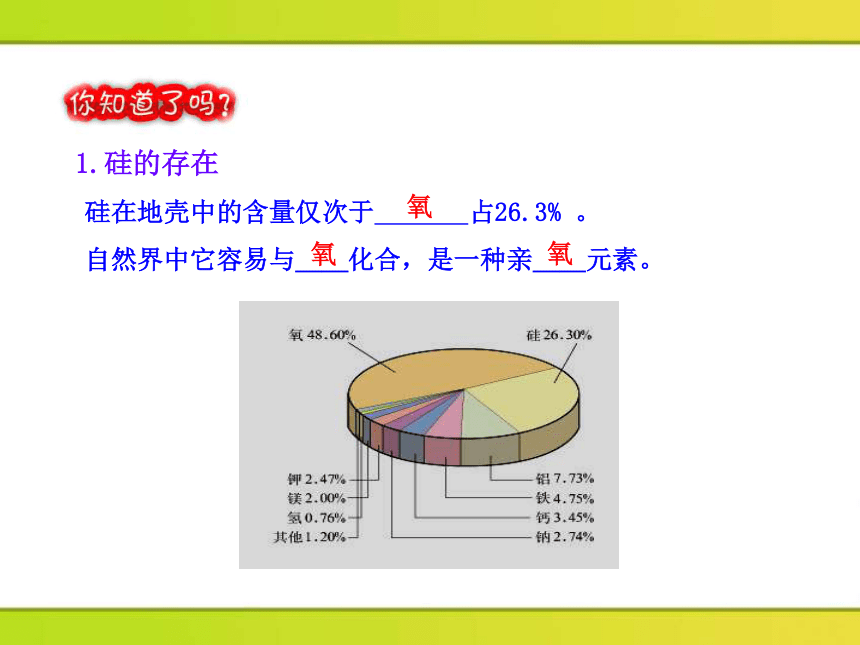
硅在地壳中的含量仅次于 占26.3% 。
自然界中它容易与__化合,是一种亲__元素。
氧
氧
氧
1.硅的存在
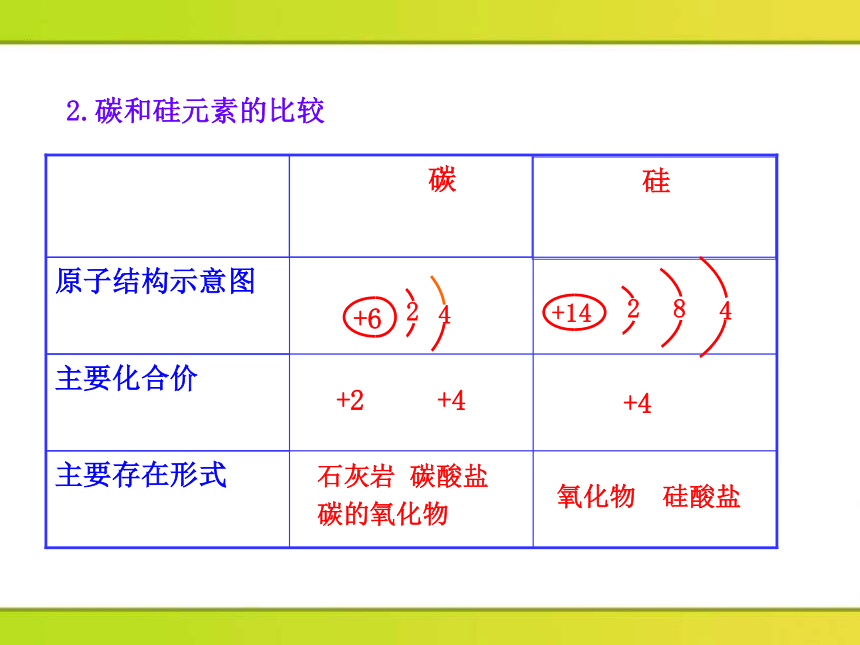
主要存在形式
主要化合价
原子结构示意图
硅
碳
氧化物 硅酸盐
石灰岩 碳酸盐
碳的氧化物
+4
+2 +4
+14
2
8
4
+6
2
4
2.碳和硅元素的比较
有结晶形(石英晶体)
无定形——硅藻土
玛瑙
天
然
的
SiO2
硅
石
一、二氧化硅和硅酸
1、二氧化硅( SiO2 )
(1)二氧化硅的存在
水晶
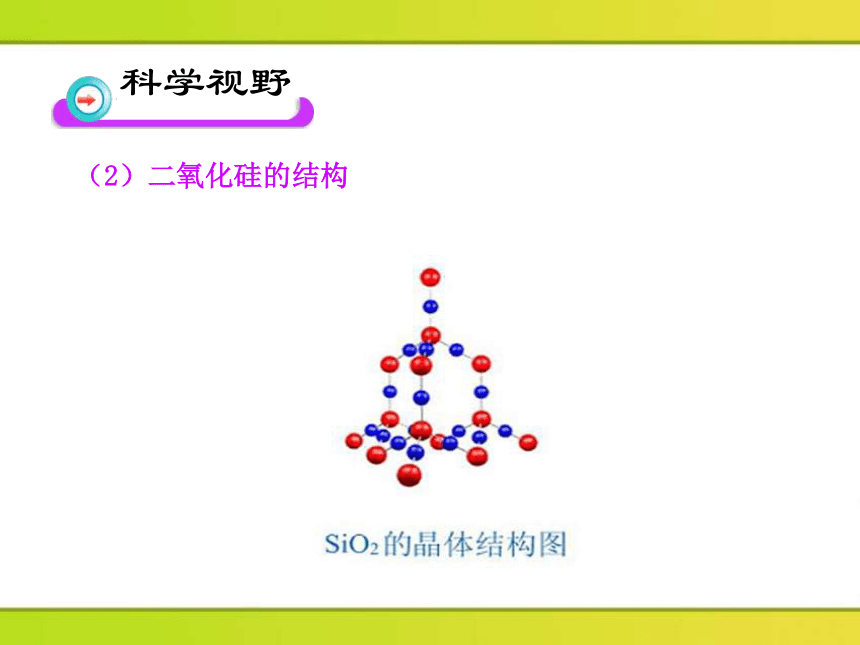
(2)二氧化硅的结构
科学视野
石英研钵
光导纤维
(3)二氧化硅的用途
坩埚
根据SiO2的存在和用途,请你分析以下问题:SiO2具有哪
些物理性质 化学稳定性如何 将你的认识写在下面的横线上,并与同学交流。
物理性质:____________________________
化学稳定性:_________
不溶与水 硬度大 熔点高
很稳定
(4)SiO2的化学性质:
① 酸性氧化物
SiO2 + 2NaOH = Na2SiO3 +H2O
实验室盛装NaOH溶液的试剂瓶为什么用橡胶塞而不用玻璃塞?(提示:玻璃中含有SiO2)
② 特性
SiO2 + 4HF =SiF4↑+ 2H2O
(此反应常用于刻蚀玻璃)
实验室为什么不用玻璃瓶盛装氢氟酸?
2、硅酸(H2SiO3)
滴入酚酞后溶液变为红色,再滴入稀盐酸,溶液由红色变浅至无色,同时有白色胶状物质产生。
a、Na2SiO3溶液呈碱性;b、可溶性硅酸盐与盐酸反应生成不溶于水的白色胶状沉淀硅酸。
(1) 制取
(较强酸制较弱酸)
Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓
思考:
分析以上制取原理,若将CO2通入 Na2SiO3溶液中有何现象
(温馨提示: 碳酸的酸性强于硅酸的酸性)
生成的硅酸逐渐聚合而形成硅酸溶胶,经干燥脱水就形成硅酸干胶,称为“硅胶”。常常用做干燥剂。也可用做催化剂的载体。
(2)用途
二、硅酸盐
结构复杂,一般不溶于水,化学性质很稳定
1、最简单的硅酸盐:硅酸钠(Na2SiO3)
其水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原 料。还可以作为矿物胶。
硅酸盐是由硅、氧和金属元素组成的化合物的总称。
实验4-2
放入蒸馏水 放入Na2SiO3饱和溶液
现象
结论
当水分蒸发后燃烧
当水分蒸发后不易燃烧
用水玻璃浸泡过的木材或织物可防火
(制备木材防火剂的原料)
硅酸盐的丰富性和多样性(阅读课本)
科学视野
(1)玻璃:
普通玻璃:以纯碱 、石灰石和石英 为原料,经混合、粉碎,在玻璃窑中熔融制得。
(Na2CO3)
(SiO2)
Na2CO3+SiO2 ==== Na2SiO3+CO2↑ CaCO3+SiO2====CaSiO3+CO2↑
②主要成分:
Na2SiO3、CaSiO3、SiO2 (Na2O CaO 6SiO2)
2、硅酸盐工业
①有关反应化学方程式:
高温
高温
(2)水泥
以黏土和石灰石为主要原料
经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,研成细粉就得到水泥。
石膏的作用是调节水泥硬化速度。
(3)传统硅酸盐陶瓷:
传统硅酸盐陶瓷是以粘土为原料,经高温烧结而成。日常生活中常见的陶瓷有日用器皿、建筑饰材、卫生洁具等。
人面鱼纹彩陶盆
(4)具有特殊功能的含硅物质:
①、碳化硅
(SiC俗称金刚砂),具有金刚石的结构。硬度很大,用作砂纸、砂轮的磨料。
②、硅 钢
(铁合金)导磁性良好,
用作变压器铁芯。
③硅橡胶
(具有均匀微孔结构
的铝硅酸盐。)
④分子筛
(最好的既耐高温又耐 低温的橡胶)
例如:Na2SiO3 :
Al2(Si2O5)(OH)4 :
Ca(Al2Si3O10)·3H2O :
3、硅酸盐组成的表示:
硅酸盐种类繁多,结构复杂,组成各异,通常用二氧化硅和金属氧化物的组合形式表示。
CaO·Al2O3·3SiO2·3H2O
(活泼金属氧化物+较活泼金属氧化物+二氧化硅+水)
Na2O·SiO2
Al2O3·2SiO2·2H2O
三. 硅单质(晶体硅是良好的半导体材料)
1、硅的存在和状态:
(1)在自然界中硅元素只有化合态,无游离态;
(2)与碳相似,单质硅也有晶体硅和无定形硅。
2、物理性质:
单质硅是灰黑色,有金属光泽、硬而脆的固体, 熔沸点较高。
3、化学性质:
在常温下,硅化学性质不活泼,除氟气、氢氟酸和强碱外,硅不跟其他物质,如氧气、氯气、硫酸、硝酸等起反应。
SiO2+2C====Si+2CO↑
高温
粗硅提纯:
Si+2Cl2==== SiCl4
高温
SiCl4+2H2==== Si+4HCl
高温
4、工业制粗硅:
5、硅的用途
SiF4
SiO2
Na2SiO3
H2SiO3
CaSiO3
Si
1.地壳中含量第一和第二的两种元素所形成的化合物不具有的性质( )
A.熔点很高 B.与水反应生成对应的酸
C.可与烧碱反应生成盐 D.坚硬
2.赏心悦目的花瓶图案是用下列物质的一种对玻璃进行刻蚀而形成的,这种物质是( )
A.盐酸 B.氢氟酸 C.烧碱 D.纯碱
B
B
3、下列试剂不能贮存在磨砂玻璃塞的试剂瓶里的
是( )
A.HNO3溶液 B.KOH溶液
C.盐酸 D.NaCl溶液
4.下列物质的变化,不能通过一步化学反应完成的
是( )
A.CO2→H2CO3 B.SiO2→Na2SiO3
C.Na2O→Na2CO3 D.SiO2→H2SiO3
D
B
6.要除去SiO2中混有的少量CaO杂质,最适宜的试剂
是 ( )
A.纯碱溶液 B. 盐酸 C.硫酸 D.苛性钠溶液
B
5. 将过量的CO2分别通入:
① CaCl2溶液; ② Na2SiO3溶液; ③ Ca(OH)2溶液;
④ 饱和Na2CO3溶液。最终溶液中有白色沉淀析出的
是 ( )
A.①②③④ B.②④ C.①②③ D.②③
B
7.下列反应能说明二氧化硅是酸性氧化物的是( )
A.SiO2 +2C===Si+2CO↑
B.SiO2 +2NaOH===Na2SiO3+H2O
C.SiO2 +4HF===SiF4↑+2H2O
D.SiO2 +CaCO3===CaSiO3+CO2↑
8.下列物质中,不能用玻璃瓶来盛装的是( )
A. 烧碱溶液 B. 浓硫酸
C. 氢氟酸 D. 碳酸钠溶液
B
C
9.制造光导纤维的主要原料是( )
A.晶体硅 B.二氧化硅
C.石墨 D.硅酸钠
10.下列叙述正确的是( )
A.自然界存在大量单质硅
B.SiO2 与任何酸都不起反应
C.光导纤维被广泛应用于能量传输和信息传输
D.SiO2 的化学性质活泼,能与很多物质发生化学反应
B
C
11.硅酸的工业制法是:将稀释好的硅酸钠和硫酸反应生成水凝胶,经水洗干燥得成品。有关的化学方程式是 。
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
第一节 无机非金属材料的主角—硅
第四章 非金属及其化合物
美国硅谷
1、了解Si、SiO2、H2SiO3的主要性质。
2、认识Si、SiO2、H2SiO3的广泛用途,体会化学的创造性和实用性。
3、了解硅酸盐的主要性质。
硅在地壳中的含量仅次于 占26.3% 。
自然界中它容易与__化合,是一种亲__元素。
氧
氧
氧
1.硅的存在
主要存在形式
主要化合价
原子结构示意图
硅
碳
氧化物 硅酸盐
石灰岩 碳酸盐
碳的氧化物
+4
+2 +4
+14
2
8
4
+6
2
4
2.碳和硅元素的比较
有结晶形(石英晶体)
无定形——硅藻土
玛瑙
天
然
的
SiO2
硅
石
一、二氧化硅和硅酸
1、二氧化硅( SiO2 )
(1)二氧化硅的存在
水晶
(2)二氧化硅的结构
科学视野
石英研钵
光导纤维
(3)二氧化硅的用途
坩埚
根据SiO2的存在和用途,请你分析以下问题:SiO2具有哪
些物理性质 化学稳定性如何 将你的认识写在下面的横线上,并与同学交流。
物理性质:____________________________
化学稳定性:_________
不溶与水 硬度大 熔点高
很稳定
(4)SiO2的化学性质:
① 酸性氧化物
SiO2 + 2NaOH = Na2SiO3 +H2O
实验室盛装NaOH溶液的试剂瓶为什么用橡胶塞而不用玻璃塞?(提示:玻璃中含有SiO2)
② 特性
SiO2 + 4HF =SiF4↑+ 2H2O
(此反应常用于刻蚀玻璃)
实验室为什么不用玻璃瓶盛装氢氟酸?
2、硅酸(H2SiO3)
滴入酚酞后溶液变为红色,再滴入稀盐酸,溶液由红色变浅至无色,同时有白色胶状物质产生。
a、Na2SiO3溶液呈碱性;b、可溶性硅酸盐与盐酸反应生成不溶于水的白色胶状沉淀硅酸。
(1) 制取
(较强酸制较弱酸)
Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓
思考:
分析以上制取原理,若将CO2通入 Na2SiO3溶液中有何现象
(温馨提示: 碳酸的酸性强于硅酸的酸性)
生成的硅酸逐渐聚合而形成硅酸溶胶,经干燥脱水就形成硅酸干胶,称为“硅胶”。常常用做干燥剂。也可用做催化剂的载体。
(2)用途
二、硅酸盐
结构复杂,一般不溶于水,化学性质很稳定
1、最简单的硅酸盐:硅酸钠(Na2SiO3)
其水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原 料。还可以作为矿物胶。
硅酸盐是由硅、氧和金属元素组成的化合物的总称。
实验4-2
放入蒸馏水 放入Na2SiO3饱和溶液
现象
结论
当水分蒸发后燃烧
当水分蒸发后不易燃烧
用水玻璃浸泡过的木材或织物可防火
(制备木材防火剂的原料)
硅酸盐的丰富性和多样性(阅读课本)
科学视野
(1)玻璃:
普通玻璃:以纯碱 、石灰石和石英 为原料,经混合、粉碎,在玻璃窑中熔融制得。
(Na2CO3)
(SiO2)
Na2CO3+SiO2 ==== Na2SiO3+CO2↑ CaCO3+SiO2====CaSiO3+CO2↑
②主要成分:
Na2SiO3、CaSiO3、SiO2 (Na2O CaO 6SiO2)
2、硅酸盐工业
①有关反应化学方程式:
高温
高温
(2)水泥
以黏土和石灰石为主要原料
经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,研成细粉就得到水泥。
石膏的作用是调节水泥硬化速度。
(3)传统硅酸盐陶瓷:
传统硅酸盐陶瓷是以粘土为原料,经高温烧结而成。日常生活中常见的陶瓷有日用器皿、建筑饰材、卫生洁具等。
人面鱼纹彩陶盆
(4)具有特殊功能的含硅物质:
①、碳化硅
(SiC俗称金刚砂),具有金刚石的结构。硬度很大,用作砂纸、砂轮的磨料。
②、硅 钢
(铁合金)导磁性良好,
用作变压器铁芯。
③硅橡胶
(具有均匀微孔结构
的铝硅酸盐。)
④分子筛
(最好的既耐高温又耐 低温的橡胶)
例如:Na2SiO3 :
Al2(Si2O5)(OH)4 :
Ca(Al2Si3O10)·3H2O :
3、硅酸盐组成的表示:
硅酸盐种类繁多,结构复杂,组成各异,通常用二氧化硅和金属氧化物的组合形式表示。
CaO·Al2O3·3SiO2·3H2O
(活泼金属氧化物+较活泼金属氧化物+二氧化硅+水)
Na2O·SiO2
Al2O3·2SiO2·2H2O
三. 硅单质(晶体硅是良好的半导体材料)
1、硅的存在和状态:
(1)在自然界中硅元素只有化合态,无游离态;
(2)与碳相似,单质硅也有晶体硅和无定形硅。
2、物理性质:
单质硅是灰黑色,有金属光泽、硬而脆的固体, 熔沸点较高。
3、化学性质:
在常温下,硅化学性质不活泼,除氟气、氢氟酸和强碱外,硅不跟其他物质,如氧气、氯气、硫酸、硝酸等起反应。
SiO2+2C====Si+2CO↑
高温
粗硅提纯:
Si+2Cl2==== SiCl4
高温
SiCl4+2H2==== Si+4HCl
高温
4、工业制粗硅:
5、硅的用途
SiF4
SiO2
Na2SiO3
H2SiO3
CaSiO3
Si
1.地壳中含量第一和第二的两种元素所形成的化合物不具有的性质( )
A.熔点很高 B.与水反应生成对应的酸
C.可与烧碱反应生成盐 D.坚硬
2.赏心悦目的花瓶图案是用下列物质的一种对玻璃进行刻蚀而形成的,这种物质是( )
A.盐酸 B.氢氟酸 C.烧碱 D.纯碱
B
B
3、下列试剂不能贮存在磨砂玻璃塞的试剂瓶里的
是( )
A.HNO3溶液 B.KOH溶液
C.盐酸 D.NaCl溶液
4.下列物质的变化,不能通过一步化学反应完成的
是( )
A.CO2→H2CO3 B.SiO2→Na2SiO3
C.Na2O→Na2CO3 D.SiO2→H2SiO3
D
B
6.要除去SiO2中混有的少量CaO杂质,最适宜的试剂
是 ( )
A.纯碱溶液 B. 盐酸 C.硫酸 D.苛性钠溶液
B
5. 将过量的CO2分别通入:
① CaCl2溶液; ② Na2SiO3溶液; ③ Ca(OH)2溶液;
④ 饱和Na2CO3溶液。最终溶液中有白色沉淀析出的
是 ( )
A.①②③④ B.②④ C.①②③ D.②③
B
7.下列反应能说明二氧化硅是酸性氧化物的是( )
A.SiO2 +2C===Si+2CO↑
B.SiO2 +2NaOH===Na2SiO3+H2O
C.SiO2 +4HF===SiF4↑+2H2O
D.SiO2 +CaCO3===CaSiO3+CO2↑
8.下列物质中,不能用玻璃瓶来盛装的是( )
A. 烧碱溶液 B. 浓硫酸
C. 氢氟酸 D. 碳酸钠溶液
B
C
9.制造光导纤维的主要原料是( )
A.晶体硅 B.二氧化硅
C.石墨 D.硅酸钠
10.下列叙述正确的是( )
A.自然界存在大量单质硅
B.SiO2 与任何酸都不起反应
C.光导纤维被广泛应用于能量传输和信息传输
D.SiO2 的化学性质活泼,能与很多物质发生化学反应
B
C
11.硅酸的工业制法是:将稀释好的硅酸钠和硫酸反应生成水凝胶,经水洗干燥得成品。有关的化学方程式是 。
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
