河北省石家庄第十五中学高中化学《33 铁及其化合物》课件(必修1)
文档属性
| 名称 | 河北省石家庄第十五中学高中化学《33 铁及其化合物》课件(必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 245.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 10:51:22 | ||
图片预览








文档简介
(共30张PPT)
铁及其化合物的复习
人教版 高中化学 必修一 第三章
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
一、铁
1、铁在周期表中的位置
2、从氧化还原角度分析铁元素各价态的性质
铁和铁的化合物
1、铁是第26号元素,位于周期表中第四周期Ⅷ族。常见化合价有0、+2、+3 。
2、铁元素各价态的性质(从氧化还原角度分析)
0价铁:_______________
+2价铁:______________
+3价铁:______________
还原性
氧化性、还原性(以还原性为主)
氧化性
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
一、铁
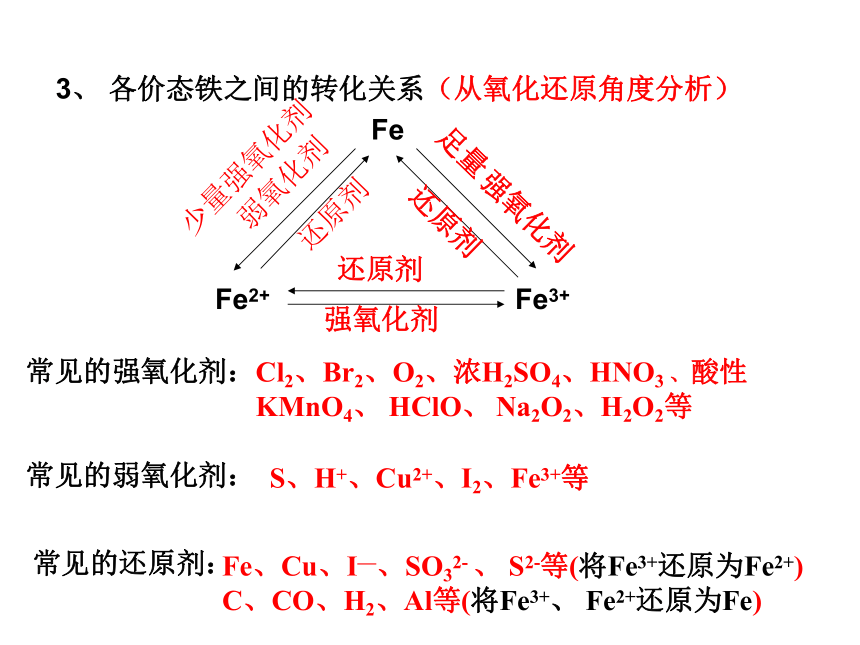
3、从氧化还原角度分析各价态铁之间的转化关系
3、 各价态铁之间的转化关系(从氧化还原角度分析)
Fe
Fe3+
Fe2+
常见的强氧化剂:
常见的弱氧化剂:
常见的还原剂:
S、H+、Cu2+、I2、Fe3+等
Fe、Cu、I—、SO32- 、 S2-等(将Fe3+还原为Fe2+)
C、CO、H2、Al等(将Fe3+、 Fe2+还原为Fe)
弱氧化剂
强氧化剂
Cl2、Br2、O2、浓H2SO4、HNO3 、酸性KMnO4、 HClO、 Na2O2、H2O2等
强氧化剂
还原剂
还原剂
还原剂
足量
少量强氧化剂
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
二、铁及其化合物的性质
思考:1、研究金属元素性质的一般思路是什么?
2、研究金属单质性质的一般思路是什么?
二、铁及其化合物的性质
1、研究金属元素性质的一般思路:
单质→氧化物→氢氧化物→盐
2、研究金属单质一般思路:
物理性质→化学性质→制法→用途
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
二、铁及其化合物的性质
请从物理性质→化学性质→制法→用途这几个方面
总结铁单质的性质
②化学性质:(注意强弱氧化剂的区别)
写出以下反应方程式:
Fe + S = FeS
2Fe + 3Cl2 = 2FeCl3
Fe + 4HNO3(过量) = Fe(NO3)3 + NO↑+ 2H2O
3Fe + 8HNO3(过量) = 3Fe(NO3)2 + 2NO↑+ 4H2O
3Fe + 4H2O = Fe3O4 + 4H2
③制法:Fe2O3 + 3CO = 2Fe + 3CO2
△
点燃
高温
△
①物理性质:银白色,熔沸点高,具有金属的一般物理性质,能被磁铁吸引。
返回
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
二、铁及其化合物的性质
请从物理性质→化学性质→制法→用途这几个方面
总结铁的氧化物的性质
2、铁的氧化物(物理性质→化学性质→制法→用途)
FeO Fe2O3 Fe3O4
物理性质
价态
化学性质
HNO3
(氧化性酸)
HCl
(非氧化性酸)
HI
(还原性酸)
制法
用途
黑色粉末
红棕色粉末
黑色晶体
+2
+3
+2、+3
3FeO+10HNO3=3Fe(NO3)3+NO↑+5H2O
Fe2O3+6H+=2Fe3+ + 3H2O
3Fe3O4+28HNO3=9Fe(NO3)3+NO↑+14H2O
Fe2O3+6H+=2Fe3+ + 3H2O
Fe3O4+8H+=Fe2+ + 2Fe3+ +4H2O
FeO+2H+=Fe2++H2O
FeO+2H+=Fe2++H2O
Fe2O3+6HI=2FeI2+I2+3H2O
Fe3O4+8HI=3FeI2+I2+4H2O
Fe(OH)2 = FeO+H2O
△
2Fe(OH)3 = Fe2O3+3H2O
△
3Fe+2O2 = Fe3O4
点燃
油漆(铁红)
磁铁(磁性氧化铁)
还原性、金属氧化物
氧化性、金属氧化物
氧化性还原性、金属氧化物
返回
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
二、铁及其化合物的性质
请从物理性质→化学性质→制法这几个方面
总结铁的氢氧化物的性质
3、铁的氢氧化物(物理性质→化学性质→制法)
Fe(OH)2 Fe(OH)3
物理性质
化学性质
HNO3
(氧化性酸)
HCl
(非氧化性酸)
HI
(还原性酸)
O2
制法
白色难溶固体
红褐色难溶固体
Fe(OH)2+2H+=Fe2++ 2H2O
4Fe(OH)2+O2+2H2O =4Fe(OH)3
灰白色→灰绿色→红褐色
Fe2+ + 2OH- = Fe(OH)2↓
Fe3+ + 3OH- = Fe(OH)3↓
Fe(OH)3+3H+ = Fe3+ + 3H2O
Fe(OH)3+3H+ = Fe3+ + 3H2O
Fe(OH)2+2H+=Fe2++ 2H2O
3Fe(OH)2+10HNO3=3Fe(OH)3+NO↑+8H2O
2Fe(OH)3+6HI =2FeI2 + I2+6H2O
碱性、还原性
碱性、氧化性
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
二、铁及其化合物的性质
关于Fe(OH)2制备的讨论.
我们可以采取哪些措施?
1、使用新制的FeSO4(或加入少量铁粉)
4、有时可以采用液封(有机溶剂)
我们可以采取哪些措施?
思考:如何改进实验装置?
2、用加热煮沸法除去氢氧化钠溶液中的氧气
3、滴管末端伸入液面以下
关于Fe(OH)2的制备的讨论
A.电解法
(1)请书写电极反应方程式?
(2)液面上加苯的原因是什么?
阳极:Fe -2e- = Fe2+
阴极:2H++ 2e- = H2 ↑
隔绝空气,防止被氧化
B.特殊装置
思考:如何操作止水夹,才能得到Fe(OH)2沉淀,并保存较长时间?
在试管I和Ⅱ中加入试剂,打开止水夹,通一段时间氢气,当氢气纯净时,夹上止水夹,即可得Fe(OH)2沉淀。
铁屑、稀硫酸
NaOH溶液
---------
---------
返回
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
二、铁及其化合物的性质
请从物理性质→化学性质→检验方法这几个方面
总结Fe2+、Fe3+盐的性质
4、Fe2+、Fe3+盐(物理性质→化学性质→检验方法)
Fe2+盐 Fe3+盐
物理性质
化学性质
检验方法
绿色
黄色
还原性
氧化性
1、KSCN
2、碱液
3、苯酚
1、碱液
2、KSCN:
先加KSCN,无色,再加氧化剂,红色
返回
二、运用规律,总结方法。
独立思考以下练习后小组内交流,完成本题并选出一位同学在投影仪上展示答案。如果有其他意见,可以自由发言进行补充或更正。然后思考这类问题用什么方法解决较好。
题型1、铁及其化合物的性质及应用
例:在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中,加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目几乎没有变化的是( )
A.Fe3+ B.Al3+ C.NH4+ D.Fe2+
答案:B
例:下列各组离子一定能大量共存的是( )
A、Fe3+、Na+、HCO3-、Cl-、SCN-
B、PH=1的无色溶液中:Fe2+、Mg2+、NO3-、SO42-、ClO-
C、K+、Fe3+、SO42-、S2-
D、NH4+、Fe2+ 、K+、I-、SO42-
题型1、铁及其化合物的性质及应用
答案:D
解析:关于铁的离子共存问题需注意:氧化还原反应、双水解反应、和SCN-的络合反应、以及溶液颜色问题。
返回
题型2、铁及其化合物的实验题
例:实验室用久置的绿矾(已部分氧化变质)配制纯净的FeSO4溶液。可选用的试剂有:蒸馏水、铁粉、稀硫酸。回答下列问题:
(1)写出绿矾中FeSO4变质的化学反应方程式:
_______________________________________。
(2)铁粉、稀硫酸的作用分别是:
铁粉____________________________________
稀硫酸___________________________________。
(3)配制过程中试剂的加入顺序是_____________。
12FeSO4+3O2 +6H2O==4Fe2(SO4)3 +4Fe(OH)3
将Fe3+转化成Fe2+
溶解变质生成的Fe(OH)3、抑制Fe2+的水解
绿矾、水、稀硫酸、铁粉
返回
题型3、有关铁及其化合物的综合推断题
例:结合图示有关转化关系回答以下问题:
(1)液态F是否导电______(填是或否)
否
独立完成以下练习,然后小组内交流,选出代表在投影仪上展示答案。如果有其他意见,可以自由发言进行补充或更正。
三、走进高考,提高能力。
解析:D是淡黄色的固体化合物是本题的突破口,根据中学化学知识基本锁定Na2O2,能与水和CO2反应,但是题目另一信息C是常见的无色无味液体说明C是水,则G为CO2;再依据K能溶于水,说明K为Na2CO3 ,F为O2; 题给信息黑色单质B与氧气(F)反应得到G(CO2),说明B为C(碳);依据F(O2)与E反应生成C(水)可知E为氢气,再根据金属A与碱性溶液反应产生氢气,可得到A为Al.
返回目录
请对照以下答案,规范自己的解题过程,并用红笔纠正错误
解析:首先用过量铁屑将H+、Fe3+、Cu2+、Au3+等离子还原成H2、Fe2+、Cu、Au,发生4个反应,E中应为Fe2+,因为后面生成铁红,故⑤为碱液氢氧化钠,试剂②是将过量铁屑溶解,试剂③是将Cu、Au分离应为稀硝酸,从C中的Cu2+到氧化铜,也应为碱液氢氧化钠。
请对照以下答案,规范自己的解题过程,并用红笔纠正错误
铁及其化合物的复习
人教版 高中化学 必修一 第三章
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
一、铁
1、铁在周期表中的位置
2、从氧化还原角度分析铁元素各价态的性质
铁和铁的化合物
1、铁是第26号元素,位于周期表中第四周期Ⅷ族。常见化合价有0、+2、+3 。
2、铁元素各价态的性质(从氧化还原角度分析)
0价铁:_______________
+2价铁:______________
+3价铁:______________
还原性
氧化性、还原性(以还原性为主)
氧化性
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
一、铁
3、从氧化还原角度分析各价态铁之间的转化关系
3、 各价态铁之间的转化关系(从氧化还原角度分析)
Fe
Fe3+
Fe2+
常见的强氧化剂:
常见的弱氧化剂:
常见的还原剂:
S、H+、Cu2+、I2、Fe3+等
Fe、Cu、I—、SO32- 、 S2-等(将Fe3+还原为Fe2+)
C、CO、H2、Al等(将Fe3+、 Fe2+还原为Fe)
弱氧化剂
强氧化剂
Cl2、Br2、O2、浓H2SO4、HNO3 、酸性KMnO4、 HClO、 Na2O2、H2O2等
强氧化剂
还原剂
还原剂
还原剂
足量
少量强氧化剂
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
二、铁及其化合物的性质
思考:1、研究金属元素性质的一般思路是什么?
2、研究金属单质性质的一般思路是什么?
二、铁及其化合物的性质
1、研究金属元素性质的一般思路:
单质→氧化物→氢氧化物→盐
2、研究金属单质一般思路:
物理性质→化学性质→制法→用途
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
二、铁及其化合物的性质
请从物理性质→化学性质→制法→用途这几个方面
总结铁单质的性质
②化学性质:(注意强弱氧化剂的区别)
写出以下反应方程式:
Fe + S = FeS
2Fe + 3Cl2 = 2FeCl3
Fe + 4HNO3(过量) = Fe(NO3)3 + NO↑+ 2H2O
3Fe + 8HNO3(过量) = 3Fe(NO3)2 + 2NO↑+ 4H2O
3Fe + 4H2O = Fe3O4 + 4H2
③制法:Fe2O3 + 3CO = 2Fe + 3CO2
△
点燃
高温
△
①物理性质:银白色,熔沸点高,具有金属的一般物理性质,能被磁铁吸引。
返回
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
二、铁及其化合物的性质
请从物理性质→化学性质→制法→用途这几个方面
总结铁的氧化物的性质
2、铁的氧化物(物理性质→化学性质→制法→用途)
FeO Fe2O3 Fe3O4
物理性质
价态
化学性质
HNO3
(氧化性酸)
HCl
(非氧化性酸)
HI
(还原性酸)
制法
用途
黑色粉末
红棕色粉末
黑色晶体
+2
+3
+2、+3
3FeO+10HNO3=3Fe(NO3)3+NO↑+5H2O
Fe2O3+6H+=2Fe3+ + 3H2O
3Fe3O4+28HNO3=9Fe(NO3)3+NO↑+14H2O
Fe2O3+6H+=2Fe3+ + 3H2O
Fe3O4+8H+=Fe2+ + 2Fe3+ +4H2O
FeO+2H+=Fe2++H2O
FeO+2H+=Fe2++H2O
Fe2O3+6HI=2FeI2+I2+3H2O
Fe3O4+8HI=3FeI2+I2+4H2O
Fe(OH)2 = FeO+H2O
△
2Fe(OH)3 = Fe2O3+3H2O
△
3Fe+2O2 = Fe3O4
点燃
油漆(铁红)
磁铁(磁性氧化铁)
还原性、金属氧化物
氧化性、金属氧化物
氧化性还原性、金属氧化物
返回
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
二、铁及其化合物的性质
请从物理性质→化学性质→制法这几个方面
总结铁的氢氧化物的性质
3、铁的氢氧化物(物理性质→化学性质→制法)
Fe(OH)2 Fe(OH)3
物理性质
化学性质
HNO3
(氧化性酸)
HCl
(非氧化性酸)
HI
(还原性酸)
O2
制法
白色难溶固体
红褐色难溶固体
Fe(OH)2+2H+=Fe2++ 2H2O
4Fe(OH)2+O2+2H2O =4Fe(OH)3
灰白色→灰绿色→红褐色
Fe2+ + 2OH- = Fe(OH)2↓
Fe3+ + 3OH- = Fe(OH)3↓
Fe(OH)3+3H+ = Fe3+ + 3H2O
Fe(OH)3+3H+ = Fe3+ + 3H2O
Fe(OH)2+2H+=Fe2++ 2H2O
3Fe(OH)2+10HNO3=3Fe(OH)3+NO↑+8H2O
2Fe(OH)3+6HI =2FeI2 + I2+6H2O
碱性、还原性
碱性、氧化性
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
二、铁及其化合物的性质
关于Fe(OH)2制备的讨论.
我们可以采取哪些措施?
1、使用新制的FeSO4(或加入少量铁粉)
4、有时可以采用液封(有机溶剂)
我们可以采取哪些措施?
思考:如何改进实验装置?
2、用加热煮沸法除去氢氧化钠溶液中的氧气
3、滴管末端伸入液面以下
关于Fe(OH)2的制备的讨论
A.电解法
(1)请书写电极反应方程式?
(2)液面上加苯的原因是什么?
阳极:Fe -2e- = Fe2+
阴极:2H++ 2e- = H2 ↑
隔绝空气,防止被氧化
B.特殊装置
思考:如何操作止水夹,才能得到Fe(OH)2沉淀,并保存较长时间?
在试管I和Ⅱ中加入试剂,打开止水夹,通一段时间氢气,当氢气纯净时,夹上止水夹,即可得Fe(OH)2沉淀。
铁屑、稀硫酸
NaOH溶液
---------
---------
返回
一、回顾旧知,探索思路。
独立思考以下问题,然后自由发言。后发言的同学可进行补充或更正。
二、铁及其化合物的性质
请从物理性质→化学性质→检验方法这几个方面
总结Fe2+、Fe3+盐的性质
4、Fe2+、Fe3+盐(物理性质→化学性质→检验方法)
Fe2+盐 Fe3+盐
物理性质
化学性质
检验方法
绿色
黄色
还原性
氧化性
1、KSCN
2、碱液
3、苯酚
1、碱液
2、KSCN:
先加KSCN,无色,再加氧化剂,红色
返回
二、运用规律,总结方法。
独立思考以下练习后小组内交流,完成本题并选出一位同学在投影仪上展示答案。如果有其他意见,可以自由发言进行补充或更正。然后思考这类问题用什么方法解决较好。
题型1、铁及其化合物的性质及应用
例:在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中,加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数目几乎没有变化的是( )
A.Fe3+ B.Al3+ C.NH4+ D.Fe2+
答案:B
例:下列各组离子一定能大量共存的是( )
A、Fe3+、Na+、HCO3-、Cl-、SCN-
B、PH=1的无色溶液中:Fe2+、Mg2+、NO3-、SO42-、ClO-
C、K+、Fe3+、SO42-、S2-
D、NH4+、Fe2+ 、K+、I-、SO42-
题型1、铁及其化合物的性质及应用
答案:D
解析:关于铁的离子共存问题需注意:氧化还原反应、双水解反应、和SCN-的络合反应、以及溶液颜色问题。
返回
题型2、铁及其化合物的实验题
例:实验室用久置的绿矾(已部分氧化变质)配制纯净的FeSO4溶液。可选用的试剂有:蒸馏水、铁粉、稀硫酸。回答下列问题:
(1)写出绿矾中FeSO4变质的化学反应方程式:
_______________________________________。
(2)铁粉、稀硫酸的作用分别是:
铁粉____________________________________
稀硫酸___________________________________。
(3)配制过程中试剂的加入顺序是_____________。
12FeSO4+3O2 +6H2O==4Fe2(SO4)3 +4Fe(OH)3
将Fe3+转化成Fe2+
溶解变质生成的Fe(OH)3、抑制Fe2+的水解
绿矾、水、稀硫酸、铁粉
返回
题型3、有关铁及其化合物的综合推断题
例:结合图示有关转化关系回答以下问题:
(1)液态F是否导电______(填是或否)
否
独立完成以下练习,然后小组内交流,选出代表在投影仪上展示答案。如果有其他意见,可以自由发言进行补充或更正。
三、走进高考,提高能力。
解析:D是淡黄色的固体化合物是本题的突破口,根据中学化学知识基本锁定Na2O2,能与水和CO2反应,但是题目另一信息C是常见的无色无味液体说明C是水,则G为CO2;再依据K能溶于水,说明K为Na2CO3 ,F为O2; 题给信息黑色单质B与氧气(F)反应得到G(CO2),说明B为C(碳);依据F(O2)与E反应生成C(水)可知E为氢气,再根据金属A与碱性溶液反应产生氢气,可得到A为Al.
返回目录
请对照以下答案,规范自己的解题过程,并用红笔纠正错误
解析:首先用过量铁屑将H+、Fe3+、Cu2+、Au3+等离子还原成H2、Fe2+、Cu、Au,发生4个反应,E中应为Fe2+,因为后面生成铁红,故⑤为碱液氢氧化钠,试剂②是将过量铁屑溶解,试剂③是将Cu、Au分离应为稀硝酸,从C中的Cu2+到氧化铜,也应为碱液氢氧化钠。
请对照以下答案,规范自己的解题过程,并用红笔纠正错误
