11-12版高中化学新课标同步授课课件:3.1.3物质的量在化学方程式计算中的应用(人教版必修1)
文档属性
| 名称 | 11-12版高中化学新课标同步授课课件:3.1.3物质的量在化学方程式计算中的应用(人教版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 00:00:00 | ||
图片预览




文档简介
(共19张PPT)
第3课时 物质的量在化学方程式
计算中的应用
1.掌握物质的量、物质的量浓度、气体摩尔体积应用于化学方程式的计算方法和格式。
2.培养学生综合运用知识和综合计算能力。
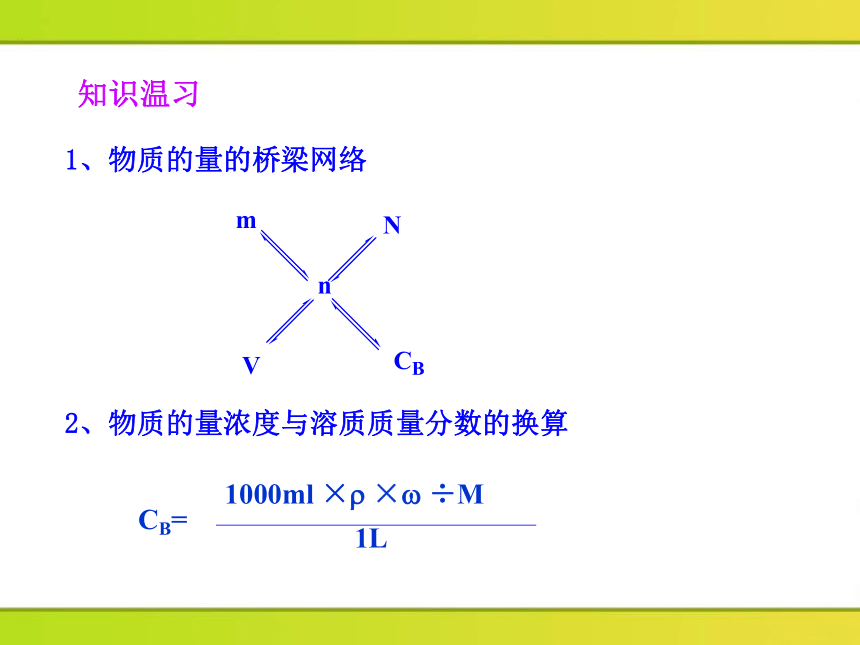
1、物质的量的桥梁网络
2、物质的量浓度与溶质质量分数的换算
1000ml × × ÷M
CB=
1L
知识温习
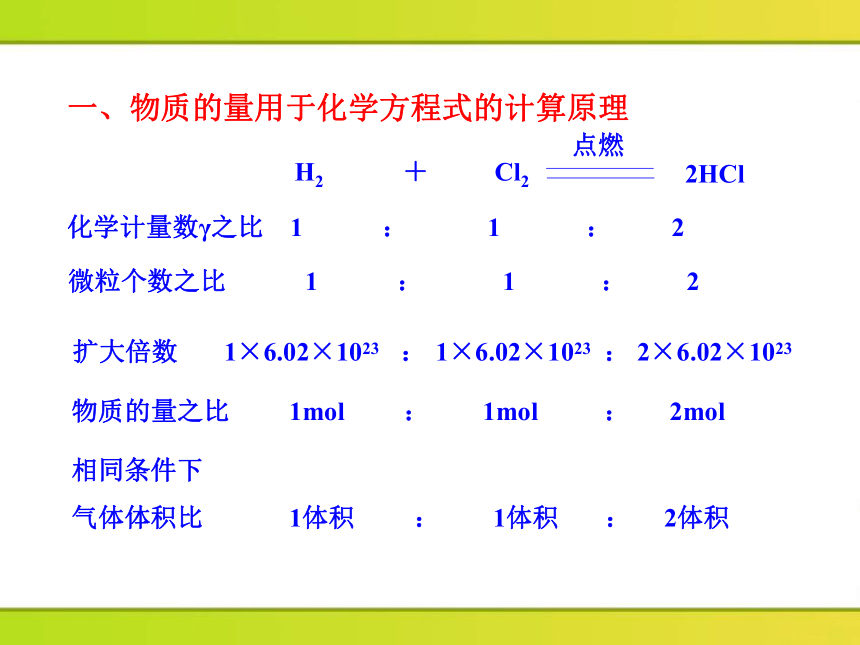
化学计量数γ之比 1 : 1 : 2
微粒个数之比 1 : 1 : 2
扩大倍数 1×6.02×1023 : 1×6.02×1023 : 2×6.02×1023
物质的量之比 1mol : 1mol : 2mol
相同条件下
气体体积比 1体积 : 1体积 : 2体积
一、物质的量用于化学方程式的计算原理
H2 + Cl2
点燃
2HCl
二、物质的量用于化学方程式的计算步骤
(1)根据题意写出相关反应的化学方程式
(2)找出相关物质的化学计量数之比
(3)对应化学计量数,找出相关物质的物质的量
(4)根据计量关系进行计算。
解:(1)
=
n
(
Z
n
)
=
m
(
Z
n
)
M
(
Z
n
)
6
.
5
g
6
5
g
m
o
l
-
1
.
=
0
.
1
m
o
l
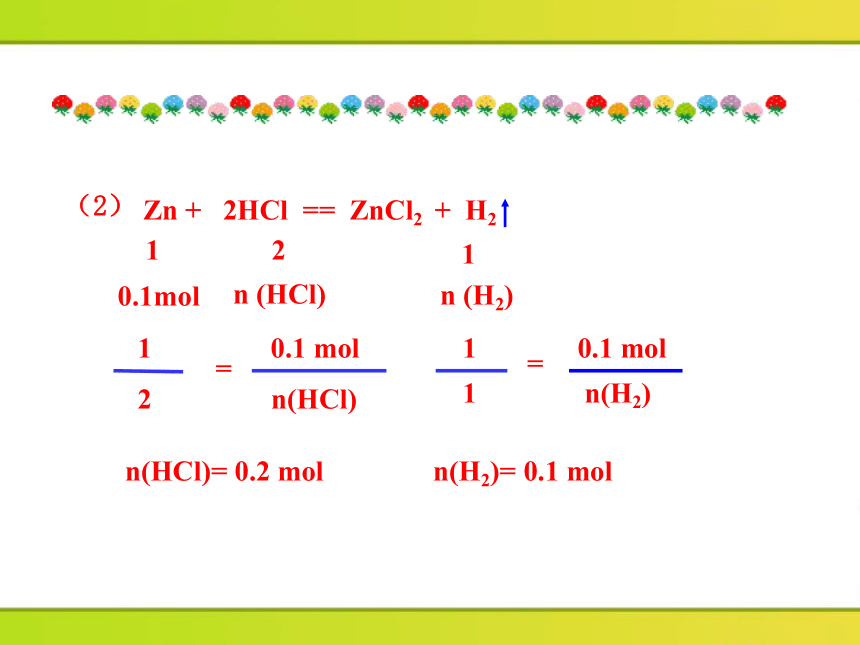
例1 把6.5gZn放入足量盐酸中,锌完全反应。
计算:
(1)6.5gZn的物质的量;
(2)参加反应的HCl的物质的量;
(3)生成H2的体积(标准状况下)。
n(HCl)= 0.2 mol
1
2
1
Zn + 2HCl == ZnCl2 + H2
n (HCl)
0.1mol
n (H2)
n(H2)= 0.1 mol
n(HCl)
=
0.1 mol
1
2
1
1
0.1 mol
n(H2)
=
(2)
答:(1)6.5gZn的物质的量是0.1mol;
(2)有0.2molHCl参加了反应;
(3)生成H2的体积在标准状况下是2.24L。
V(H2)= n(H2) × Vm = 0.1 mol × 22.4 L/mol= 2.24 L
(3)
例2:完全中和0.10molNaOH,需要硫酸的物质的量是多少?所需硫酸的质量是多少?
解:2NaOH +H2SO4 =Na2SO4 + 2H2O
2mol 1mol
0.10mol n(H2SO4)
=
n
(
H
2
S
O
4
)
n
(
N
a
O
H
)
n
(
H
2
S
O
4
)
=
2
0
.
0
5
m
o
l
=
答:完全中和0.10 mol NaOH需H2SO40.05mol,即4.9g
弄清应注意的问题
(1)单位问题:上下一致,左右相当。
(2)化学方程式所表示的是纯净物质之间的量的关系。
(3)如果是离子反应,可以根据离子方程式进行计算。
(4)如果是氧化还原反应,也可以利用电子转移关系进行有关计算。
例3:用一定量的Fe与足量的1mol/L的H2SO4溶液反应来制取H2。若要制得2.24L H2(标准状况),试计算:
(1)参加反应的H2SO4溶液中H2SO4的物质的量。
(2)参加反应的Fe的质量。
(3)将反应后的溶液稀释到500ml,则溶液中FeSO4的物质的量浓度是多少
解:(1) Fe + H2SO4 == FeSO4 + H2↑
56g 1mol 1mol 22.4L
m (Fe) n (H2SO4) n (FeSO4) 2.24L
1mol
n (H2SO4)
22.4L
2.24L
n (H2SO4) = 0.1mol
56g
m(Fe)
22.4L
2.24L
m (Fe) = 5.6g
(2)
1mol
n(FeSO4)
22.4L
2.24L
n (FeSO4) = 0.1mol
答:(1)参加反应的H2SO4溶液中H2SO4的物质的量0.1mol。
(2)参加反应的Fe的质量为5.6g。
(3)将反应后的溶液稀释到500ml,则溶液中FeSO4的物质的量浓度是0.2mol/L 。
(3)
2.规范解题步骤。
3.根据化学方程式进行计算时,同种物质的单位要上
下一致,其他有关物质的单位必须保持左右对应。
1.化学方程式中各物质的化学计量数之比等于各物质
的物质的量的关系。
1.用足量的CO还原Fe2O3,将所生成的气体通入足量澄清石灰水中,得到的沉淀为60g,则Fe2O3的质量是( )
A.16 g B.32 g
C.64 g D.16 g
B
2.物质在相互反应时( )
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量比等于方程式中化学计量数之比
D.它们物质的量比等于方程式中化学计量数之比
D
3.23g金属钠与水反应后得到500mL溶液,求:
(1)该溶液中溶质的物质的量浓度。
(2)反应后生成氢气的体积(标准状况下)?
答案:
(1)该溶液中溶质的物质的量浓度为2mol/L。
(2)生成的氢气在标况下体积为11.2L。
在最悲伤的时候,不能失去信念;在最幸福的时候,不能忘记挫折。
我们在上路的时候,一定要带上三件法宝:健壮的身体、丰富的知识和足够的勇气。
第3课时 物质的量在化学方程式
计算中的应用
1.掌握物质的量、物质的量浓度、气体摩尔体积应用于化学方程式的计算方法和格式。
2.培养学生综合运用知识和综合计算能力。
1、物质的量的桥梁网络
2、物质的量浓度与溶质质量分数的换算
1000ml × × ÷M
CB=
1L
知识温习
化学计量数γ之比 1 : 1 : 2
微粒个数之比 1 : 1 : 2
扩大倍数 1×6.02×1023 : 1×6.02×1023 : 2×6.02×1023
物质的量之比 1mol : 1mol : 2mol
相同条件下
气体体积比 1体积 : 1体积 : 2体积
一、物质的量用于化学方程式的计算原理
H2 + Cl2
点燃
2HCl
二、物质的量用于化学方程式的计算步骤
(1)根据题意写出相关反应的化学方程式
(2)找出相关物质的化学计量数之比
(3)对应化学计量数,找出相关物质的物质的量
(4)根据计量关系进行计算。
解:(1)
=
n
(
Z
n
)
=
m
(
Z
n
)
M
(
Z
n
)
6
.
5
g
6
5
g
m
o
l
-
1
.
=
0
.
1
m
o
l
例1 把6.5gZn放入足量盐酸中,锌完全反应。
计算:
(1)6.5gZn的物质的量;
(2)参加反应的HCl的物质的量;
(3)生成H2的体积(标准状况下)。
n(HCl)= 0.2 mol
1
2
1
Zn + 2HCl == ZnCl2 + H2
n (HCl)
0.1mol
n (H2)
n(H2)= 0.1 mol
n(HCl)
=
0.1 mol
1
2
1
1
0.1 mol
n(H2)
=
(2)
答:(1)6.5gZn的物质的量是0.1mol;
(2)有0.2molHCl参加了反应;
(3)生成H2的体积在标准状况下是2.24L。
V(H2)= n(H2) × Vm = 0.1 mol × 22.4 L/mol= 2.24 L
(3)
例2:完全中和0.10molNaOH,需要硫酸的物质的量是多少?所需硫酸的质量是多少?
解:2NaOH +H2SO4 =Na2SO4 + 2H2O
2mol 1mol
0.10mol n(H2SO4)
=
n
(
H
2
S
O
4
)
n
(
N
a
O
H
)
n
(
H
2
S
O
4
)
=
2
0
.
0
5
m
o
l
=
答:完全中和0.10 mol NaOH需H2SO40.05mol,即4.9g
弄清应注意的问题
(1)单位问题:上下一致,左右相当。
(2)化学方程式所表示的是纯净物质之间的量的关系。
(3)如果是离子反应,可以根据离子方程式进行计算。
(4)如果是氧化还原反应,也可以利用电子转移关系进行有关计算。
例3:用一定量的Fe与足量的1mol/L的H2SO4溶液反应来制取H2。若要制得2.24L H2(标准状况),试计算:
(1)参加反应的H2SO4溶液中H2SO4的物质的量。
(2)参加反应的Fe的质量。
(3)将反应后的溶液稀释到500ml,则溶液中FeSO4的物质的量浓度是多少
解:(1) Fe + H2SO4 == FeSO4 + H2↑
56g 1mol 1mol 22.4L
m (Fe) n (H2SO4) n (FeSO4) 2.24L
1mol
n (H2SO4)
22.4L
2.24L
n (H2SO4) = 0.1mol
56g
m(Fe)
22.4L
2.24L
m (Fe) = 5.6g
(2)
1mol
n(FeSO4)
22.4L
2.24L
n (FeSO4) = 0.1mol
答:(1)参加反应的H2SO4溶液中H2SO4的物质的量0.1mol。
(2)参加反应的Fe的质量为5.6g。
(3)将反应后的溶液稀释到500ml,则溶液中FeSO4的物质的量浓度是0.2mol/L 。
(3)
2.规范解题步骤。
3.根据化学方程式进行计算时,同种物质的单位要上
下一致,其他有关物质的单位必须保持左右对应。
1.化学方程式中各物质的化学计量数之比等于各物质
的物质的量的关系。
1.用足量的CO还原Fe2O3,将所生成的气体通入足量澄清石灰水中,得到的沉淀为60g,则Fe2O3的质量是( )
A.16 g B.32 g
C.64 g D.16 g
B
2.物质在相互反应时( )
A.它们的质量一定相等
B.它们的物质的量一定相等
C.它们的质量比等于方程式中化学计量数之比
D.它们物质的量比等于方程式中化学计量数之比
D
3.23g金属钠与水反应后得到500mL溶液,求:
(1)该溶液中溶质的物质的量浓度。
(2)反应后生成氢气的体积(标准状况下)?
答案:
(1)该溶液中溶质的物质的量浓度为2mol/L。
(2)生成的氢气在标况下体积为11.2L。
在最悲伤的时候,不能失去信念;在最幸福的时候,不能忘记挫折。
我们在上路的时候,一定要带上三件法宝:健壮的身体、丰富的知识和足够的勇气。
