第一章第三节化学键第2课时(人教版必修2)
文档属性
| 名称 | 第一章第三节化学键第2课时(人教版必修2) |  | |
| 格式 | zip | ||
| 文件大小 | 402.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 20:20:56 | ||
图片预览





文档简介
(共12张PPT)
第三节 化学键
第二课时
二、共价键
问题:
1.活泼的金属元素和活泼非金属元素化合时形成离子键,
非金属元素之间化合时,能形成离子键吗?为什么?
不能,因非金属元素的原子均有获得电子的倾向
2.非金属元素之间化合时,核外电子排布是通过什么方式
达到稳定结构的?
H ·
· H
+
→
H H
··
H﹣H(结构式)
以H2、HCl分子的形成为例
探讨:
··
· Cl
··
:
H ·
+
→
Cl
··
··
H
··
··
H﹣Cl(结构式)
结论:
在H2、HCl分子的形成过程中,没有发生电子的得失,而是通过形成共用电子对 达到稳定结构的
用一根短线表示
一个共用电子对
共用电子对
(1)定义:
(2)成键微粒:
(3)相互作用:
(4)成键条件:
1.共价键
原子
共用电子对(静电作用)
原子之间通过共用电子对所形成的相互作用
a.非金属元素原子之间相结合
b.部分金属元素与非金属元素之间的结合
(如AlCl3等)
(6)存在:
a.不仅存在于非金属单质和共价化合物中
b.也存在于某些离子化合物中
Na+
﹕
[ O H ]-
:
﹕
:
Cl
··
··
H
··
··
(5)共价化合物:
以共用电子对形成分子的化合物
H H
··
(如酸、非金属氧化物、有机物等)
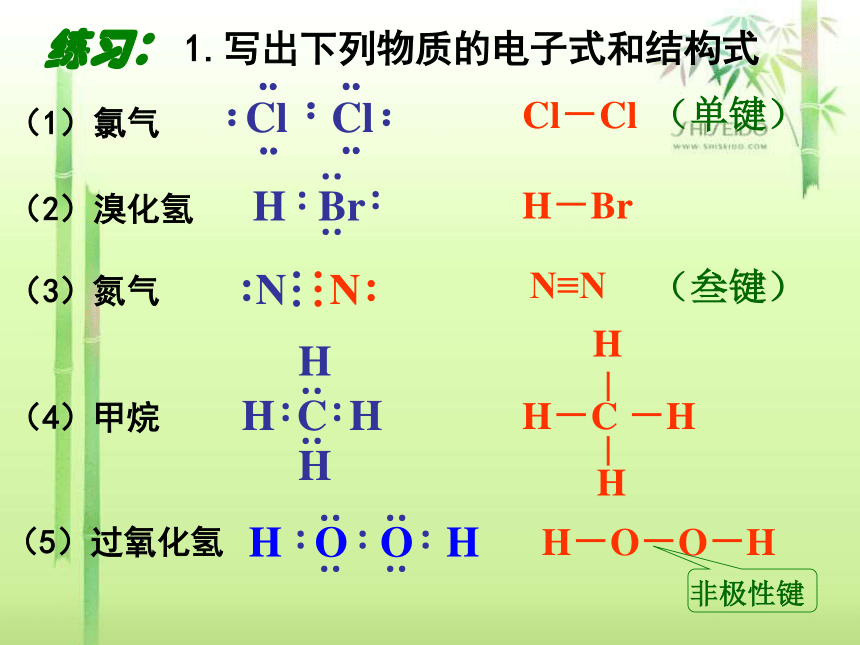
(1)氯气
练习: 1.写出下列物质的电子式和结构式
(2)溴化氢
(5)过氧化氢
(4)甲烷
(3)氮气
Cl Cl
:
:
:
:
:
:
:
…
N N
··
…
··
Cl-Cl
H-Br
N≡N
H-C -H
H
H
-
-
H-O-O-H
(单键)
(叁键)
H Br
﹕
﹕
﹕
﹕
H C H
H
H
﹕
﹕
﹕
﹕
H O O H
﹕
﹕
﹕
﹕
﹕
﹕
﹕
非极性键
2、用电子式表示共价化合物的形成过程
2. HCl
3. H2O
1. H2
5. NH3
4. CO2
H ·
· H
+
→
H H
··
··
· Cl
··
:
H ·
+
→
Cl
··
··
H
··
··
→
··
· O ·
··
H ·
+
H ·
+
O
··
··
H
H
:
:
+
··
· O ·
··
+
:
C
:
··
· O ·
··
→
C
:
:
O
··
··
O
··
··
:
:
3H ·
+
→
:
· N
·
·
··
N
H
:
:
··
H
H
注意:
不标电荷和中括号 “ [ ] ”
H﹣H
H﹣Cl
H
H
O
O=C=O
H
H
H
-N-
结构式
离子键和共价键的比较
键型 离子键 共价键
形成过程 电子得失 形成共用电子对
成键微粒 阴、阳离子 原子
成键本质 阴阳离子间静电作用 共用电子对
成键元素 活泼的金属元素与活泼的非金属元素之间 非金属元素
存在 只存在于离子化合物中 非金属单质(除稀有气体)、共价化合物、 部分离子化合物
电子式
以NaCl为例
以为HCl例
[设计P42表]
[ ]
+
-
·
Na
Cl
·
·
:
:
·
Cl
··
··
H
··
··
3.共价键的分类
问题:
探讨:
结论:
在HCl中,为什么H元素显+1价、Cl元素显-1价
共用电子对偏移的共价键叫做极性共价键
在HCl分子中:
a.17Cl原子核内质子数大于1H原子核内质子数
b.17Cl原子核对共用电子对的吸引力大于1H原子核对
共用电子对的吸引力
c.共用电子对偏向于对其吸引力强的一方
(显负电性,化合价为负)
共用电子对偏离于对其吸引力弱的一方
(显正电性,化合价为正)
+1 -1
··
Cl
··
:
H
.
(1)极性共价键
共用电子对不偏移的共价键叫做非极性共价键
问题:
在H2分子中,H元素的化合价为何为0?
共用电子对有无偏移
探讨:
结论:
(2)非极性共价键
在H2分子中:
a.1H原子核内质子数相同
b.两个1H原子核对共用电子对的吸引力大小相等
c.共用电子对位于两原子核的正中央不偏向于任何一方
(不显电性,化合价为0)
H
.
H
思考:
极性键与非极性键的区别?
极性键与非极性键的区别
[设计P41表]
非极性键 极 性 键
原子种类 同种原子 不同种原子
原子吸引共用电子对能力 相同 不相同
共用电子对有无偏移 不偏向任何一个原子 偏向吸引电子能力强的原子一方
成键原子的
电性 不显电性 吸引电子能力强的显负电性吸引电子能力弱的显正电性
实例 H2、N2、O2、Cl2等 HCl、H2O、NH3、CO2等
巧记为: 同 非
练习: 书写下列微粒的电子式
H、C、N、O、F、Ne、Na、Mg、Al
H2、N2、O2、Cl2、CO2、CS2、CCl4
HF、HCl、H2O、H2S、NH3、PH3、CH4、SiH4
Na2O、Na2O2、NaCl、NaOH、Na2S
MgO、MgCl2、NH4Cl
Cl-、O2-、O22-、OH-、NH4+
HClO、NaClO
··
Na+[ O H ]-
··
··
··
H
[ ]+
··
[ Cl ]-
··
:
:
祝同学们学习进步
再见
第三节 化学键
第二课时
二、共价键
问题:
1.活泼的金属元素和活泼非金属元素化合时形成离子键,
非金属元素之间化合时,能形成离子键吗?为什么?
不能,因非金属元素的原子均有获得电子的倾向
2.非金属元素之间化合时,核外电子排布是通过什么方式
达到稳定结构的?
H ·
· H
+
→
H H
··
H﹣H(结构式)
以H2、HCl分子的形成为例
探讨:
··
· Cl
··
:
H ·
+
→
Cl
··
··
H
··
··
H﹣Cl(结构式)
结论:
在H2、HCl分子的形成过程中,没有发生电子的得失,而是通过形成共用电子对 达到稳定结构的
用一根短线表示
一个共用电子对
共用电子对
(1)定义:
(2)成键微粒:
(3)相互作用:
(4)成键条件:
1.共价键
原子
共用电子对(静电作用)
原子之间通过共用电子对所形成的相互作用
a.非金属元素原子之间相结合
b.部分金属元素与非金属元素之间的结合
(如AlCl3等)
(6)存在:
a.不仅存在于非金属单质和共价化合物中
b.也存在于某些离子化合物中
Na+
﹕
[ O H ]-
:
﹕
:
Cl
··
··
H
··
··
(5)共价化合物:
以共用电子对形成分子的化合物
H H
··
(如酸、非金属氧化物、有机物等)
(1)氯气
练习: 1.写出下列物质的电子式和结构式
(2)溴化氢
(5)过氧化氢
(4)甲烷
(3)氮气
Cl Cl
:
:
:
:
:
:
:
…
N N
··
…
··
Cl-Cl
H-Br
N≡N
H-C -H
H
H
-
-
H-O-O-H
(单键)
(叁键)
H Br
﹕
﹕
﹕
﹕
H C H
H
H
﹕
﹕
﹕
﹕
H O O H
﹕
﹕
﹕
﹕
﹕
﹕
﹕
非极性键
2、用电子式表示共价化合物的形成过程
2. HCl
3. H2O
1. H2
5. NH3
4. CO2
H ·
· H
+
→
H H
··
··
· Cl
··
:
H ·
+
→
Cl
··
··
H
··
··
→
··
· O ·
··
H ·
+
H ·
+
O
··
··
H
H
:
:
+
··
· O ·
··
+
:
C
:
··
· O ·
··
→
C
:
:
O
··
··
O
··
··
:
:
3H ·
+
→
:
· N
·
·
··
N
H
:
:
··
H
H
注意:
不标电荷和中括号 “ [ ] ”
H﹣H
H﹣Cl
H
H
O
O=C=O
H
H
H
-N-
结构式
离子键和共价键的比较
键型 离子键 共价键
形成过程 电子得失 形成共用电子对
成键微粒 阴、阳离子 原子
成键本质 阴阳离子间静电作用 共用电子对
成键元素 活泼的金属元素与活泼的非金属元素之间 非金属元素
存在 只存在于离子化合物中 非金属单质(除稀有气体)、共价化合物、 部分离子化合物
电子式
以NaCl为例
以为HCl例
[设计P42表]
[ ]
+
-
·
Na
Cl
·
·
:
:
·
Cl
··
··
H
··
··
3.共价键的分类
问题:
探讨:
结论:
在HCl中,为什么H元素显+1价、Cl元素显-1价
共用电子对偏移的共价键叫做极性共价键
在HCl分子中:
a.17Cl原子核内质子数大于1H原子核内质子数
b.17Cl原子核对共用电子对的吸引力大于1H原子核对
共用电子对的吸引力
c.共用电子对偏向于对其吸引力强的一方
(显负电性,化合价为负)
共用电子对偏离于对其吸引力弱的一方
(显正电性,化合价为正)
+1 -1
··
Cl
··
:
H
.
(1)极性共价键
共用电子对不偏移的共价键叫做非极性共价键
问题:
在H2分子中,H元素的化合价为何为0?
共用电子对有无偏移
探讨:
结论:
(2)非极性共价键
在H2分子中:
a.1H原子核内质子数相同
b.两个1H原子核对共用电子对的吸引力大小相等
c.共用电子对位于两原子核的正中央不偏向于任何一方
(不显电性,化合价为0)
H
.
H
思考:
极性键与非极性键的区别?
极性键与非极性键的区别
[设计P41表]
非极性键 极 性 键
原子种类 同种原子 不同种原子
原子吸引共用电子对能力 相同 不相同
共用电子对有无偏移 不偏向任何一个原子 偏向吸引电子能力强的原子一方
成键原子的
电性 不显电性 吸引电子能力强的显负电性吸引电子能力弱的显正电性
实例 H2、N2、O2、Cl2等 HCl、H2O、NH3、CO2等
巧记为: 同 非
练习: 书写下列微粒的电子式
H、C、N、O、F、Ne、Na、Mg、Al
H2、N2、O2、Cl2、CO2、CS2、CCl4
HF、HCl、H2O、H2S、NH3、PH3、CH4、SiH4
Na2O、Na2O2、NaCl、NaOH、Na2S
MgO、MgCl2、NH4Cl
Cl-、O2-、O22-、OH-、NH4+
HClO、NaClO
··
Na+[ O H ]-
··
··
··
H
[ ]+
··
[ Cl ]-
··
:
:
祝同学们学习进步
再见
