第一章第三节化学键第3课时(人教版必修2)
文档属性
| 名称 | 第一章第三节化学键第3课时(人教版必修2) |
|
|
| 格式 | zip | ||
| 文件大小 | 262.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 00:00:00 | ||
图片预览






文档简介
(共20张PPT)
第三节 化 学 键(3)
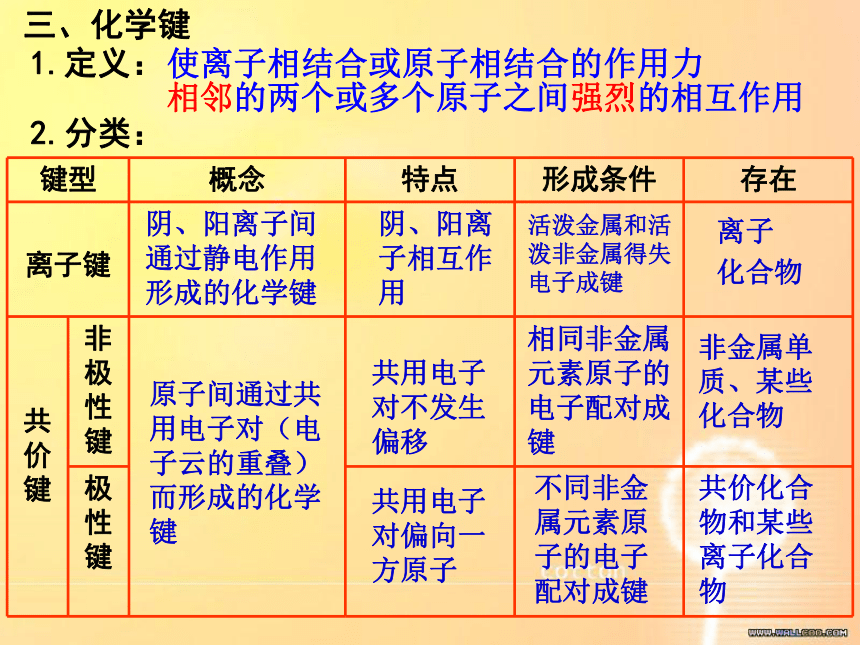
键型 概念 特点 形成条件 存在
离子键
共价键 非极性键
极性键
阴、阳离子间通过静电作用形成的化学键
阴、阳离子相互作用
活泼金属和活泼非金属得失电子成键
离子
化合物
原子间通过共用电子对(电子云的重叠)而形成的化学键
共用电子对不发生偏移
相同非金属元素原子的电子配对成键
非金属单质、某些化合物
共用电子对偏向一方原子
不同非金属元素原子的电子配对成键
共价化合物和某些离子化合物
三、化学键
1.定义:
使离子相结合或原子相结合的作用力
2.分类:
相邻的两个或多个原子之间强烈的相互作用
注意: 化学键的存在
(1)稀有气体单质中不存在化学键
(2)多原子单质分子中存在共价键,
如:H2、O2、O3等
(3)共价化合物分子中只存在共价键,不存在离子键
(4)离子化合物中一定存在离子键,可能存在共价键
如:Na2O2、NaOH、NH4Cl、Na2SO4等含有原子团的
离子化合物
(5)离子化合物可由非金属构成,
如:NH4NO3、NH4Cl 等铵盐
(6)非极性共价键可能存在于离子化合物中,如Na2O2
反应物
化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程,所以化学反应中反应物一定有化学键被破坏
化学反应的过程:
分子原子观点
分解
重新组合
旧键断裂
新键生成
化学键的观点
注意:化学反应中反应物的化学键并非全部被破坏
如:(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
只破坏反应物中的离子键,共价键未被破坏
原子离子
生成物
1.离子化合物的溶解或熔化过程中化学键的变化
因离子化合物溶于水或熔化后均电离成为可自由移动的阴、阳离子,所以离子键被破坏
2.共价化合物的溶解或熔化过程中化学键的变化
a.与水反应——共价键被破坏
如:CO2、SO2等酸性氧化物(酸酐)
b.电解质溶于水——共价键被破坏
如:HCl、H2SO4、HNO3等强酸
c.非电解质溶于水——共价键不被破坏,只破坏分子间作用力
如:乙醇、蔗糖等
①溶解过程
a.由分子构成的共价化合物(分子晶体)——共价键不被破坏,
只破坏分子间作用力,如:冰、干冰、蔗糖等多数共价化合物
b.由原子构成的共价化合物(原子晶体)——共价键被破坏
如:SiO2晶体等少数共价化合物
②熔化过程
3.单质的溶解或熔化过程中化学键的变化
a.与水反应——共价键被破坏,如:Cl2、F2等
b.由分子构成的单质(分子晶体)
——共价键不被破坏,只破坏分子间作用力
如:I2的升华、P4的熔化等
c.由原子构成的单质(原子晶体)——共价键被破坏
如:金刚石、晶体硅的熔化等
①非金属单质
②金属单质
金属单质熔融——金属键被破坏
*金属键:金属晶体中,金属阳离子与自由电子之间的
强烈的静电作用
(2)错,如 NH4Cl 等铵盐
(1)错,如:NaOH 、Na2SO4
(3)错,如:He、Ne等稀有气体
练习
1.判断正误:
(1)含有共价键的化合物一定是共价化合物
(2)全部由非金属元素组成的化合物一定是
共价化合物
(3)在气态单质分子里一定有共价键
2.下列物质中,
(1)含离子键的物质是( )
(2)含非极性共价键的物质是( )
(3)含极性共价键的物质是( )
A、KF B、H2O C、 N2 D、 F2
E、CS2 F、CaCl2、 G、CH4 H、CCl4
I、 Br2 J、 PH3
A、F
B、E、G、H、J
C、D、I
3.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附
C.蔗糖溶于水 D.氯化氢气体溶于水
D
问题??
分子间是否存在相互作用呢?
物质为什么会有三态变化?
不同物质为什么熔、沸点不同?
存在
不同温度下分子具有不同能量
相互作用的大小不同
四、分子间作用力和氢键
1、分子间作用力
定义: 把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。
(1)分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。
(2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
(3)分子间作用力的范围很小(一般是300-500pm),只有分子间的距离很小时才有。
(4)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:
又如气态氢化物:
但是:
为什么HF、H2O和NH3的沸点会反常呢?
讨论:
2、氢键
定义:由于氢原子的存在而使分子间产生的一种比分子间作用力稍强的相互作用——氢键。
(1)氢键不属于化学键,比化学键弱得多,比分子间作用力稍强,也属于分子间作用力的范畴,
(2)形成条件:氢原子与得电子能力很强、原子半径很小的原子形成的分子之间。如HF、H2O、NH3等分子间易形成氢键。
(3)特征:具有方向性。
(4)结果1:氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键
思考:为什么冰会浮在水面上?
雪花为什么是六角形的?
讨论 :如果水分子之间没有氢键存在,
地球上 将会是什么面貌?
(5)结果2:氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。
原子
分子
离子
宏观 物质
或范德华力
得失电子
范德华力
氢键
共价键
金属键或共价键
离子键
离子晶体
分子晶体
原子晶体
金属晶体
作业 :P . 23 1、2
思考:5
小结:
有几种形成方式?
第三节 化 学 键(3)
键型 概念 特点 形成条件 存在
离子键
共价键 非极性键
极性键
阴、阳离子间通过静电作用形成的化学键
阴、阳离子相互作用
活泼金属和活泼非金属得失电子成键
离子
化合物
原子间通过共用电子对(电子云的重叠)而形成的化学键
共用电子对不发生偏移
相同非金属元素原子的电子配对成键
非金属单质、某些化合物
共用电子对偏向一方原子
不同非金属元素原子的电子配对成键
共价化合物和某些离子化合物
三、化学键
1.定义:
使离子相结合或原子相结合的作用力
2.分类:
相邻的两个或多个原子之间强烈的相互作用
注意: 化学键的存在
(1)稀有气体单质中不存在化学键
(2)多原子单质分子中存在共价键,
如:H2、O2、O3等
(3)共价化合物分子中只存在共价键,不存在离子键
(4)离子化合物中一定存在离子键,可能存在共价键
如:Na2O2、NaOH、NH4Cl、Na2SO4等含有原子团的
离子化合物
(5)离子化合物可由非金属构成,
如:NH4NO3、NH4Cl 等铵盐
(6)非极性共价键可能存在于离子化合物中,如Na2O2
反应物
化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程,所以化学反应中反应物一定有化学键被破坏
化学反应的过程:
分子原子观点
分解
重新组合
旧键断裂
新键生成
化学键的观点
注意:化学反应中反应物的化学键并非全部被破坏
如:(NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl
只破坏反应物中的离子键,共价键未被破坏
原子离子
生成物
1.离子化合物的溶解或熔化过程中化学键的变化
因离子化合物溶于水或熔化后均电离成为可自由移动的阴、阳离子,所以离子键被破坏
2.共价化合物的溶解或熔化过程中化学键的变化
a.与水反应——共价键被破坏
如:CO2、SO2等酸性氧化物(酸酐)
b.电解质溶于水——共价键被破坏
如:HCl、H2SO4、HNO3等强酸
c.非电解质溶于水——共价键不被破坏,只破坏分子间作用力
如:乙醇、蔗糖等
①溶解过程
a.由分子构成的共价化合物(分子晶体)——共价键不被破坏,
只破坏分子间作用力,如:冰、干冰、蔗糖等多数共价化合物
b.由原子构成的共价化合物(原子晶体)——共价键被破坏
如:SiO2晶体等少数共价化合物
②熔化过程
3.单质的溶解或熔化过程中化学键的变化
a.与水反应——共价键被破坏,如:Cl2、F2等
b.由分子构成的单质(分子晶体)
——共价键不被破坏,只破坏分子间作用力
如:I2的升华、P4的熔化等
c.由原子构成的单质(原子晶体)——共价键被破坏
如:金刚石、晶体硅的熔化等
①非金属单质
②金属单质
金属单质熔融——金属键被破坏
*金属键:金属晶体中,金属阳离子与自由电子之间的
强烈的静电作用
(2)错,如 NH4Cl 等铵盐
(1)错,如:NaOH 、Na2SO4
(3)错,如:He、Ne等稀有气体
练习
1.判断正误:
(1)含有共价键的化合物一定是共价化合物
(2)全部由非金属元素组成的化合物一定是
共价化合物
(3)在气态单质分子里一定有共价键
2.下列物质中,
(1)含离子键的物质是( )
(2)含非极性共价键的物质是( )
(3)含极性共价键的物质是( )
A、KF B、H2O C、 N2 D、 F2
E、CS2 F、CaCl2、 G、CH4 H、CCl4
I、 Br2 J、 PH3
A、F
B、E、G、H、J
C、D、I
3.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附
C.蔗糖溶于水 D.氯化氢气体溶于水
D
问题??
分子间是否存在相互作用呢?
物质为什么会有三态变化?
不同物质为什么熔、沸点不同?
存在
不同温度下分子具有不同能量
相互作用的大小不同
四、分子间作用力和氢键
1、分子间作用力
定义: 把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。
(1)分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。
(2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
(3)分子间作用力的范围很小(一般是300-500pm),只有分子间的距离很小时才有。
(4)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:
又如气态氢化物:
但是:
为什么HF、H2O和NH3的沸点会反常呢?
讨论:
2、氢键
定义:由于氢原子的存在而使分子间产生的一种比分子间作用力稍强的相互作用——氢键。
(1)氢键不属于化学键,比化学键弱得多,比分子间作用力稍强,也属于分子间作用力的范畴,
(2)形成条件:氢原子与得电子能力很强、原子半径很小的原子形成的分子之间。如HF、H2O、NH3等分子间易形成氢键。
(3)特征:具有方向性。
(4)结果1:氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键
思考:为什么冰会浮在水面上?
雪花为什么是六角形的?
讨论 :如果水分子之间没有氢键存在,
地球上 将会是什么面貌?
(5)结果2:氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。
原子
分子
离子
宏观 物质
或范德华力
得失电子
范德华力
氢键
共价键
金属键或共价键
离子键
离子晶体
分子晶体
原子晶体
金属晶体
作业 :P . 23 1、2
思考:5
小结:
有几种形成方式?
