11-12版高中化学新课标同步授课课件:1.2.1 物质的量的单位——摩尔(人教版必修1)
文档属性
| 名称 | 11-12版高中化学新课标同步授课课件:1.2.1 物质的量的单位——摩尔(人教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 20:25:30 | ||
图片预览











文档简介
(共34张PPT)
第二节 化学计量在实验中的应用
第1课时 物质的量的单位——摩尔
世界是物质的,物质由哪些微粒组成?该如何称量?观看Flash,认真的体会。
一打=12支
订书钉是一排一排的,
然后放入盒中
曲别针是100只装一盒
以下文化用品是如何计量的?
订书钉
根据刚才的图例,针对生活中的计量方法,
你能得到哪些启示?
计量方法有:支,打,排,盒,只
1、不同的物质可能有不同的计量方法。(方便)
2、不同的计量方法之间是能相互转化的。(联系)
3、外观越小的物质,用集团来计量较方便(迁移)
1打等于12支,100只为1盒
能总结,会归纳,也是一种学习哦!
做实验时,取用的药品无论是单质还是化合物,都是可以用器具称量的。(宏观)而物质间发生的化学反应是原子、离子或分子之间按一定的数目关系进行的。 (微观)
原子、离子和分子等不仅我们直接用肉眼看不到,也难以称量。用什么方法来计量原子、离子或分子(外观较小)呢?
微观粒子个体很小,当数量很大时,
我们将以集团(集体)为单位对其进行计量。
(单位)
(物理量)
摩尔
你知道吗
物质的量
一、物质的量(n)
表示含有一定数目粒子的集合体的物理量。符号为n。
单位为“摩尔”符号为mol
注意 物质的量是一个专有名词,由四个字组成,是一个整体,不能分割,也不可加字、减字;粒子指微观可数的分子、原子、离子、电子、质子、中子、原子团等;粒子要指明,一般用化学式表示。
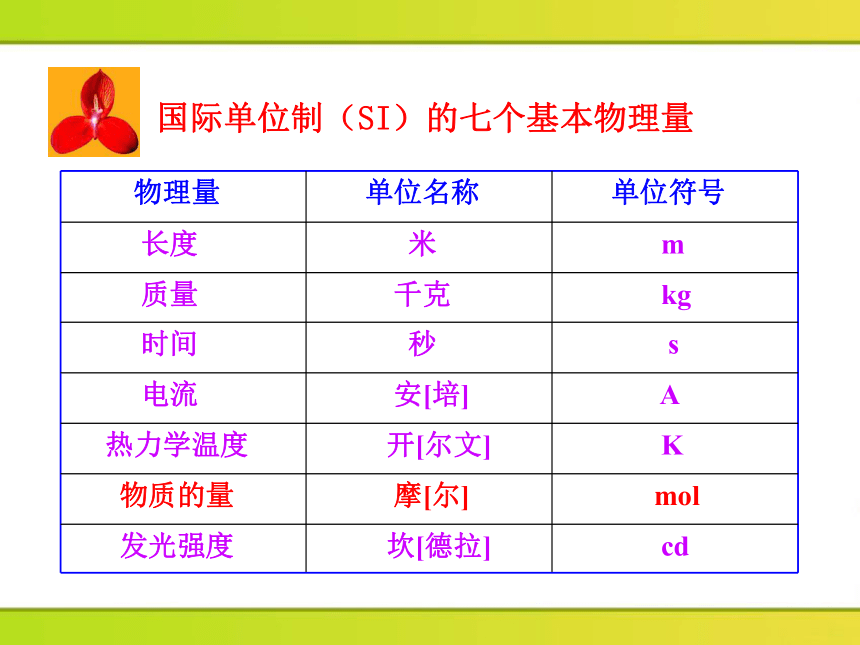
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
国际单位制(SI)的七个基本物理量
国际上规定,1mol粒子集合体所含的粒子数与0.012 kg 12C中所含的碳原子数相同。
质量的单位是千克,1千克=1000克,物质的量的单位是摩尔,1mol含有多少个微粒?
0.012 kg12C中所含的碳原子数到底有多少个?
这是个定值,称为阿伏加德罗常数,符号为NA,通常用 6.02×1023 mol-1表示。
NA,令人惊讶的数值!
1.将6.02×1023个一角硬币排起来,可来回地球和太阳间400亿次之多。
2.如果把 6.02×1023粒米给全球60亿人吃,每人每天吃一斤,要吃14万年。所以物质的量只用来表示原子、分子、离子等微观粒子的数量。
=
N
微粒数
(单位:个)
NA
(单位:个/mol)
阿伏加德罗常数
以上三者有怎样的联系呢?
n
物质的量
(单位:mol)
记住哦,知道了个数(N)就可以求物质的量了。
这样通过物质的量就把可称量的宏观物质与难以称量的微观粒子联系起来了。
1mol不同物质含有的微粒数相等,那么1mol不同物质的质量是否也相同呢?
不一定相同。因为每一个微粒的质量不一定相等,当6.02×1023个微粒放在一起,质量当然可能不一样了。
看一看,1mol微粒的质量有什么规律
O Al H2 H2O
一个分子或原子的质量 2.657×
10-23g 4.485×
10-23g 3.294×
10-24g 2.990×
10-23g
物质的量 1mol 1mol 1mol 1mol
相对分子或原子质量 16 27 2 18
1mol微粒
的质量 16g 27g 2g 18g
1mol任何粒子或物质的质量以克为单位时,其数值都等于该物质的相对分子质量或相对原子质量。
二、摩尔质量
每摩尔物质具有的质量。
克/摩
符号:g/mol 或 g ·mol-1
等于该物质的相对分子质量或相对原子质量。
物质的量 (mol)
物质的质量 (g)
摩尔质量 (g/mol)
=
M = m ÷ n
我知道计
算公式了
定义:
单位:
数值:
公式:
符号:M
1.下面叙述是否正确
(1)摩尔是七个物理量之一
(2)摩尔是物质的数量单位
物质的量是七个基本物理量之一,摩尔是物质的量的单位。
摩尔是物质的量的单位,“物质的量”四字为一整体,不能随便拆写
做一做
错误
错误
(3)1摩尔大米约含有6.02×1023个米粒
物质的量只适用于微观粒子,不能用来描述宏观物质。
错误
2.请说出下列语句的含义
(1)1mol H
(2)3mol H2O
3.判断正误,并说明理由。
A. 1mol 氢
B. 1mol CO2
物质物质的量的表示方法:物质的量的多少(mol)+能表示微观粒子的符号
表示1mol的氢原子
表示3mol的水分子
错误。没有指出是分子、原子或离子
正确。
4. 1 mol 碳原子含有约 个碳原子
1× 6.02×1023
5. 0.3 mol 硫酸分子含有约 个硫酸分子
0.3×6.02×1023
6. 10 mol 钠离子含有约 个钠离子
10×6.02×1023
物质的量 (n)
=
物质所含微粒数目 (N)
阿伏加德罗常数 (NA)
做几个填空题吧
1 mol H2O中氢原子、 氧原子的物质的量各为多少?
H2O
1
1 mol
NA
2H
O
2
1
2NA
NA
1 mol
2 mol
结论:
微粒之间的个数之比也就是物质的量之比
微粒个数
微粒集团
物质的量
例题1
7. 1 mol Na2SO4含有 mol Na+
2
mol SO42-
1
个氧原子
8. 0.5 mol Na2SO4含有 mol Na+
1
mol SO42-
0.5
个氧原子
约2×6.02×1023
约4×6.02×1023
光说不练,等于白干,再做几个吧。
9.1 mol OH-含有 mol 质子
电子
10. 含有 5.418×1023 个质子的 OH-离子的物质的量约
为 摩尔
9
约10×6.02×1023
(5.418×1023) ÷(9×6.02×1023) = 0.1
来几个稍微有点难度的,要看提示哦
质子数=原子序数之和;
原子的电子数=质子数;
阴离子的电子数=质子数+电荷数;
阳离子的电子数=质子数-电荷数
提示:
11. 0.1 mol KClO3 和 0.1 mol KClO 中所含微粒数相等的是 ( )
A. 钾离子 B. 氯离子
C. 氧离子 D. 氧原子
A
KClO3 ==== K+ + ClO3-
KClO ==== K+ + ClO-
这是个选择题,是单项选择哦
例题2 90克水相当于多少摩尔水
解: 水的相对分子质量是18
水的摩尔质量是18g/mol。
n (H2O)=
90g
18g/mol
= 5 mol
答:90克水相当于5mol水。
注意解题
格式
例题3 4. 9 克H2SO4里含有多少个硫酸分子
解: 硫酸的相对分子质量是98,
硫酸的摩尔质量是 98g/mol 。
n (H2SO4) =
4. 9 g
98g/mol
= 0.05 mol
答:4.9克硫酸里含有 3.01×1022个硫酸分子。
N (H2SO4)=
0.05 mol×6.02×1023/mol
= 3.01×1022
先公式、后数字;标明每一个量;带单位计算。
12、下列说法正确的是 ( )
A.硫酸的摩尔质量是98g
B.18g水中含有1mol水
C.O2的摩尔质量(单位是g·mol-1)在数值上等于其相对分子质量
D.1 mol CO的质量为28g·mol-1
C
13、23.75g某二价金属的氯化物(MCl2)中含有3.01×1023个
Cl-,则MCl2的摩尔质量是________。
MCl2的相对分子质量是________,
M的相对原子质量是________。
95g/mol
95
24
第二节 化学计量在实验中的应用
第1课时 物质的量的单位——摩尔
世界是物质的,物质由哪些微粒组成?该如何称量?观看Flash,认真的体会。
一打=12支
订书钉是一排一排的,
然后放入盒中
曲别针是100只装一盒
以下文化用品是如何计量的?
订书钉
根据刚才的图例,针对生活中的计量方法,
你能得到哪些启示?
计量方法有:支,打,排,盒,只
1、不同的物质可能有不同的计量方法。(方便)
2、不同的计量方法之间是能相互转化的。(联系)
3、外观越小的物质,用集团来计量较方便(迁移)
1打等于12支,100只为1盒
能总结,会归纳,也是一种学习哦!
做实验时,取用的药品无论是单质还是化合物,都是可以用器具称量的。(宏观)而物质间发生的化学反应是原子、离子或分子之间按一定的数目关系进行的。 (微观)
原子、离子和分子等不仅我们直接用肉眼看不到,也难以称量。用什么方法来计量原子、离子或分子(外观较小)呢?
微观粒子个体很小,当数量很大时,
我们将以集团(集体)为单位对其进行计量。
(单位)
(物理量)
摩尔
你知道吗
物质的量
一、物质的量(n)
表示含有一定数目粒子的集合体的物理量。符号为n。
单位为“摩尔”符号为mol
注意 物质的量是一个专有名词,由四个字组成,是一个整体,不能分割,也不可加字、减字;粒子指微观可数的分子、原子、离子、电子、质子、中子、原子团等;粒子要指明,一般用化学式表示。
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
国际单位制(SI)的七个基本物理量
国际上规定,1mol粒子集合体所含的粒子数与0.012 kg 12C中所含的碳原子数相同。
质量的单位是千克,1千克=1000克,物质的量的单位是摩尔,1mol含有多少个微粒?
0.012 kg12C中所含的碳原子数到底有多少个?
这是个定值,称为阿伏加德罗常数,符号为NA,通常用 6.02×1023 mol-1表示。
NA,令人惊讶的数值!
1.将6.02×1023个一角硬币排起来,可来回地球和太阳间400亿次之多。
2.如果把 6.02×1023粒米给全球60亿人吃,每人每天吃一斤,要吃14万年。所以物质的量只用来表示原子、分子、离子等微观粒子的数量。
=
N
微粒数
(单位:个)
NA
(单位:个/mol)
阿伏加德罗常数
以上三者有怎样的联系呢?
n
物质的量
(单位:mol)
记住哦,知道了个数(N)就可以求物质的量了。
这样通过物质的量就把可称量的宏观物质与难以称量的微观粒子联系起来了。
1mol不同物质含有的微粒数相等,那么1mol不同物质的质量是否也相同呢?
不一定相同。因为每一个微粒的质量不一定相等,当6.02×1023个微粒放在一起,质量当然可能不一样了。
看一看,1mol微粒的质量有什么规律
O Al H2 H2O
一个分子或原子的质量 2.657×
10-23g 4.485×
10-23g 3.294×
10-24g 2.990×
10-23g
物质的量 1mol 1mol 1mol 1mol
相对分子或原子质量 16 27 2 18
1mol微粒
的质量 16g 27g 2g 18g
1mol任何粒子或物质的质量以克为单位时,其数值都等于该物质的相对分子质量或相对原子质量。
二、摩尔质量
每摩尔物质具有的质量。
克/摩
符号:g/mol 或 g ·mol-1
等于该物质的相对分子质量或相对原子质量。
物质的量 (mol)
物质的质量 (g)
摩尔质量 (g/mol)
=
M = m ÷ n
我知道计
算公式了
定义:
单位:
数值:
公式:
符号:M
1.下面叙述是否正确
(1)摩尔是七个物理量之一
(2)摩尔是物质的数量单位
物质的量是七个基本物理量之一,摩尔是物质的量的单位。
摩尔是物质的量的单位,“物质的量”四字为一整体,不能随便拆写
做一做
错误
错误
(3)1摩尔大米约含有6.02×1023个米粒
物质的量只适用于微观粒子,不能用来描述宏观物质。
错误
2.请说出下列语句的含义
(1)1mol H
(2)3mol H2O
3.判断正误,并说明理由。
A. 1mol 氢
B. 1mol CO2
物质物质的量的表示方法:物质的量的多少(mol)+能表示微观粒子的符号
表示1mol的氢原子
表示3mol的水分子
错误。没有指出是分子、原子或离子
正确。
4. 1 mol 碳原子含有约 个碳原子
1× 6.02×1023
5. 0.3 mol 硫酸分子含有约 个硫酸分子
0.3×6.02×1023
6. 10 mol 钠离子含有约 个钠离子
10×6.02×1023
物质的量 (n)
=
物质所含微粒数目 (N)
阿伏加德罗常数 (NA)
做几个填空题吧
1 mol H2O中氢原子、 氧原子的物质的量各为多少?
H2O
1
1 mol
NA
2H
O
2
1
2NA
NA
1 mol
2 mol
结论:
微粒之间的个数之比也就是物质的量之比
微粒个数
微粒集团
物质的量
例题1
7. 1 mol Na2SO4含有 mol Na+
2
mol SO42-
1
个氧原子
8. 0.5 mol Na2SO4含有 mol Na+
1
mol SO42-
0.5
个氧原子
约2×6.02×1023
约4×6.02×1023
光说不练,等于白干,再做几个吧。
9.1 mol OH-含有 mol 质子
电子
10. 含有 5.418×1023 个质子的 OH-离子的物质的量约
为 摩尔
9
约10×6.02×1023
(5.418×1023) ÷(9×6.02×1023) = 0.1
来几个稍微有点难度的,要看提示哦
质子数=原子序数之和;
原子的电子数=质子数;
阴离子的电子数=质子数+电荷数;
阳离子的电子数=质子数-电荷数
提示:
11. 0.1 mol KClO3 和 0.1 mol KClO 中所含微粒数相等的是 ( )
A. 钾离子 B. 氯离子
C. 氧离子 D. 氧原子
A
KClO3 ==== K+ + ClO3-
KClO ==== K+ + ClO-
这是个选择题,是单项选择哦
例题2 90克水相当于多少摩尔水
解: 水的相对分子质量是18
水的摩尔质量是18g/mol。
n (H2O)=
90g
18g/mol
= 5 mol
答:90克水相当于5mol水。
注意解题
格式
例题3 4. 9 克H2SO4里含有多少个硫酸分子
解: 硫酸的相对分子质量是98,
硫酸的摩尔质量是 98g/mol 。
n (H2SO4) =
4. 9 g
98g/mol
= 0.05 mol
答:4.9克硫酸里含有 3.01×1022个硫酸分子。
N (H2SO4)=
0.05 mol×6.02×1023/mol
= 3.01×1022
先公式、后数字;标明每一个量;带单位计算。
12、下列说法正确的是 ( )
A.硫酸的摩尔质量是98g
B.18g水中含有1mol水
C.O2的摩尔质量(单位是g·mol-1)在数值上等于其相对分子质量
D.1 mol CO的质量为28g·mol-1
C
13、23.75g某二价金属的氯化物(MCl2)中含有3.01×1023个
Cl-,则MCl2的摩尔质量是________。
MCl2的相对分子质量是________,
M的相对原子质量是________。
95g/mol
95
24
