11-12版高中化学新课标同步授课课件:2.3.1氧化还原反应(人教版必修1)
文档属性
| 名称 | 11-12版高中化学新课标同步授课课件:2.3.1氧化还原反应(人教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 20:25:30 | ||
图片预览










文档简介
(共39张PPT)
第三节 氧化还原反应
第1课时 氧化还原反应
1.能根据反应前后元素化合价有无变化,判断反应是否为氧化还原反应 。
2.根据实验事实了解氧化还原反应的本质是电子的转移。
问题二
Fe2O3+3CO====2Fe+3CO2属于四大基本反应类型中的哪一种
问题一
我们在初中学过哪些基本反应类型,能否举例说明?
思考下面的问题
△
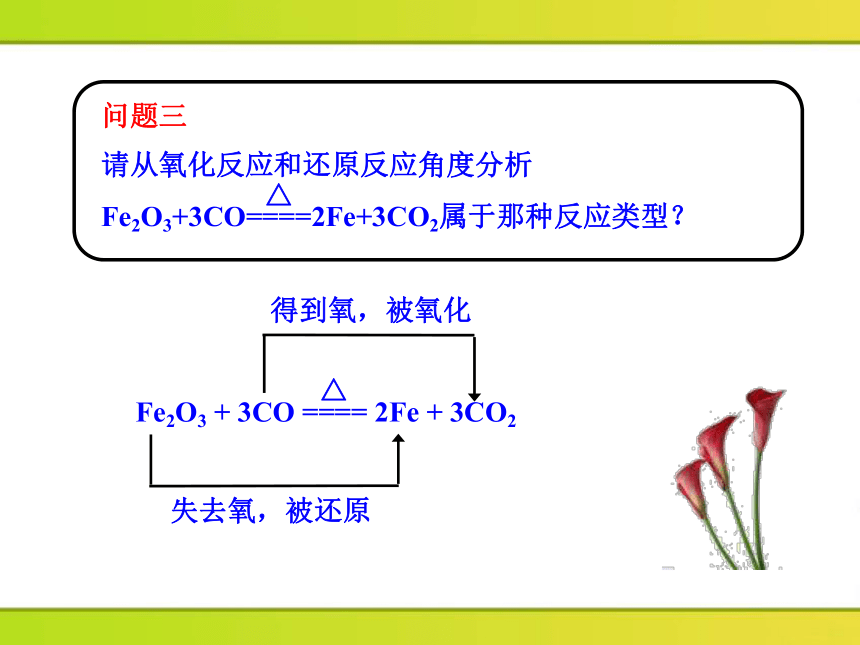
问题三
请从氧化反应和还原反应角度分析Fe2O3+3CO====2Fe+3CO2属于那种反应类型?
得到氧,被氧化
失去氧,被还原
△
Fe2O3 + 3CO ==== 2Fe + 3CO2
△
氧化反应:物质得到氧原子的反应
还原反应:物质失去氧原子的反应
从得失氧的角度可得出氧化还原反应的定义:
一种物质失去氧,同时另一种物质得到氧的反应,叫做氧化还原反应。
特别提醒:氧化反应和还原反应同时发生
问题四
标出下列氧化还原反应中的各个元素的化合价,观察化合价有无变化,变化有无规律?
2Mg+O2====2MgO
H2+CuO====Cu+H2O
CO+CuO====Cu+CO2
△
△
点燃
CO+CuO====Cu+CO2
0 0 +2 -2
+2 +2 0 +4
氧化反应,化合价升高
氧化反应,化合价升高
还原反应,化合价降低
还原反应,化合价降低
2Mg+O2====2MgO
氧化反应,化合价升高
H2 + CuO ==== H2O + Cu
还原反应,化合价降低
+2
0
0
+1
点燃
从化合价升降的角度来分析
氧化反应即为化合价升高的反应;
还原反应即为化合价降低的反应。
氧化还原反应是否一定存在得失氧?请分析下面的反应
Zn+2HCl==== ZnCl2+H2
化合价降低
化合价升高
化合价升高
被还原
被还原
被氧化
被氧化
2Na+Cl2====2NaCl
化合价降低
点燃
从化合价升降的角度定义
有元素化合价升降的反应,叫氧化还原反应。
氧化还原反应的判断依据是:
有无化合价的升降
氧化还原反应的特征:有元素化合价的升降
根据元素化合价是否有变化把化学反应分为:
氧化还原反应
非氧化还原反应
我们初中学过的四大基本反应类型有哪些?
它们与氧化还原反应的关系是怎样的?
复分解反应、置换反应、化合反应、分解反应
分解反应
化合反应
复分解反应
置换反应
氧化还原反应
氧化还原反应和四大基本反应类型的关系:
判断以下反应是否是氧化还原反应
Fe + CuSO4 ==== FeSO4 + Cu
Zn + 2HCl ====ZnCl2 + H2↑
+2
0
+2
0
+6
-2
+6
-2
0
0
+2
+1
-1
-1
是
是
化合价升高,氧化反应
化合价升高,氧化反应
化合价降低,还原反应
化合价降低,还原反应
2H2O2 ==== 2H2O + O2↑
-1
-2
0
NaOH + HCl ==== NaCl + H2O
-1
-1
+1
+1
+1
+1
+1
-2
-2
化合价升高,氧化反应
化合价降低,还原反应
不是
是
化合价升高,失去电子
2Na + Cl2 ==== 2NaCl
化合价降低,得到电子
先分析钠与
氯气的反应吧
想一想:
化合价的升降与电子转移的关系,氧化还原反应的实质是什么?
钠与氯气反应的动画演示
电子得失的动画演示
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
化合价的升降——电子的得失
化合价变化本质原因的分析
2Na + Cl2 ==== 2NaCl
点燃
氧化反应(化合价升高)的实质是原子失去电子的过程。
还原反应(化合价降低)的实质是原子得到电子的过程。
2Na+Cl2 ==== 2Na Cl
0
0
+1 -1
H2 + Cl2 ==== 2HCl的动画演示
点燃
H Cl
+17
+1
+1
+17
H Cl
δ+ δ-
H2 + Cl2 ==== 2HCl
H
Cl
HCl
化合价的升降——共用电子对的偏移
点燃
氧化还原反应的实质
有电子转移(得失或偏移)的反应都是氧化还原反应。
原来是因为我!!!
(本质) (特征)
归纳总结
某元素得到电子
(或电子对偏向)
化合价降低
还原反应
某元素失去电子
(或电子对偏离)
化合价升高
氧化反应
思 考
我们能否方便直观的显示出氧化还原反应中的电子转移情况呢?
我……
MnO2 + 4HCl==== MnCl2 + Cl2 ↑+ 2H2O
化合价降低、被还原、得到1×2e-
化合价升高、被氧化、失去2×e-
双线桥表示法
氧化还原反应中的电子转移情况表示方法
方法总结
1. 标出变化了的元素的化合价;
2. 两根线桥;
3. 箭头总是从反应物指向生成物;
4. 箭头起止于同种元素;
5. 必须标明电子转移的数目并指明“得”、“失”。
现学现用
用双线桥法标出下列反应电子转移的方向和数目:
①MnO2+4HCl====MnCl2+Cl2↑+2H2O
②Cl2+2NaOH====NaCl+NaClO+H2O
△
①MnO2+4HCl====MnCl2+Cl2↑+2H2O
②Cl2+2NaOH====NaCl+NaClO+H2O
失1×e-
得1×e-
表示氧化还原反应中的电子转移情况还有一种更简单的方法!
失2×e-
得1×2e-
△
书写方法
1.标出变化了的元素化合价;
2.箭头总是从失电子的元素指向得电子的元素;
3.在箭桥上标出转移电子数目,不写“得” “ 失”。
+2
0
+4
0
4e-
2CuO + C ==== 2Cu + CO2
高温
单线桥
表示法
1.用双线桥法标出电子转移情况
(1)Fe + CuSO4 ==== FeSO4 + Cu
0
+2
+2
0
化合价升高,失1×2e-
化合价降低,得1×2e-
(2) 2H2 + O2 ==== 2H2O
点燃
0 0 +1 -2
化合价升高,失4×e-
化合价降低,得2×2e-
2.下列反应属于氧化还原反应的是( )
A.CaCO3+2HCl====CaCl2+H2O+CO2↑
B.CaCO3====CaO+CO2↑
C.Na2O+H2O====2NaOH
D.Mg+2HCl====MgCl2+H2↑
高温
D
3.当化合物中的元素被转化成单质中的元素时,该元
素( )
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.化合价降低为零
C
这道题似乎有点难哦
4.氧化还原反应的实质是( )
A.化合价的升降
B.分子中各原子重新组合
C.电子的得失或共用电子对的偏移
D.氧原子的得失
5.下列四种基本类型的反应中,一定是氧化还原反应的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
C
C
6. 根据下列物质变化中化合价的情况,判断属于还原反应的是 ( )
A. CuO → Cu B. NaCl → HCl
C. C → CO2 D. FeCl2 → FeCl3
A
失电子
(或电子对偏离)
→
化合价
升高
→
氧化反应
得电子
(或电子对偏向)
→
化合价
降低
→
还原反应
↓
本质
↓
特征
氧化还原反应的整合
第三节 氧化还原反应
第1课时 氧化还原反应
1.能根据反应前后元素化合价有无变化,判断反应是否为氧化还原反应 。
2.根据实验事实了解氧化还原反应的本质是电子的转移。
问题二
Fe2O3+3CO====2Fe+3CO2属于四大基本反应类型中的哪一种
问题一
我们在初中学过哪些基本反应类型,能否举例说明?
思考下面的问题
△
问题三
请从氧化反应和还原反应角度分析Fe2O3+3CO====2Fe+3CO2属于那种反应类型?
得到氧,被氧化
失去氧,被还原
△
Fe2O3 + 3CO ==== 2Fe + 3CO2
△
氧化反应:物质得到氧原子的反应
还原反应:物质失去氧原子的反应
从得失氧的角度可得出氧化还原反应的定义:
一种物质失去氧,同时另一种物质得到氧的反应,叫做氧化还原反应。
特别提醒:氧化反应和还原反应同时发生
问题四
标出下列氧化还原反应中的各个元素的化合价,观察化合价有无变化,变化有无规律?
2Mg+O2====2MgO
H2+CuO====Cu+H2O
CO+CuO====Cu+CO2
△
△
点燃
CO+CuO====Cu+CO2
0 0 +2 -2
+2 +2 0 +4
氧化反应,化合价升高
氧化反应,化合价升高
还原反应,化合价降低
还原反应,化合价降低
2Mg+O2====2MgO
氧化反应,化合价升高
H2 + CuO ==== H2O + Cu
还原反应,化合价降低
+2
0
0
+1
点燃
从化合价升降的角度来分析
氧化反应即为化合价升高的反应;
还原反应即为化合价降低的反应。
氧化还原反应是否一定存在得失氧?请分析下面的反应
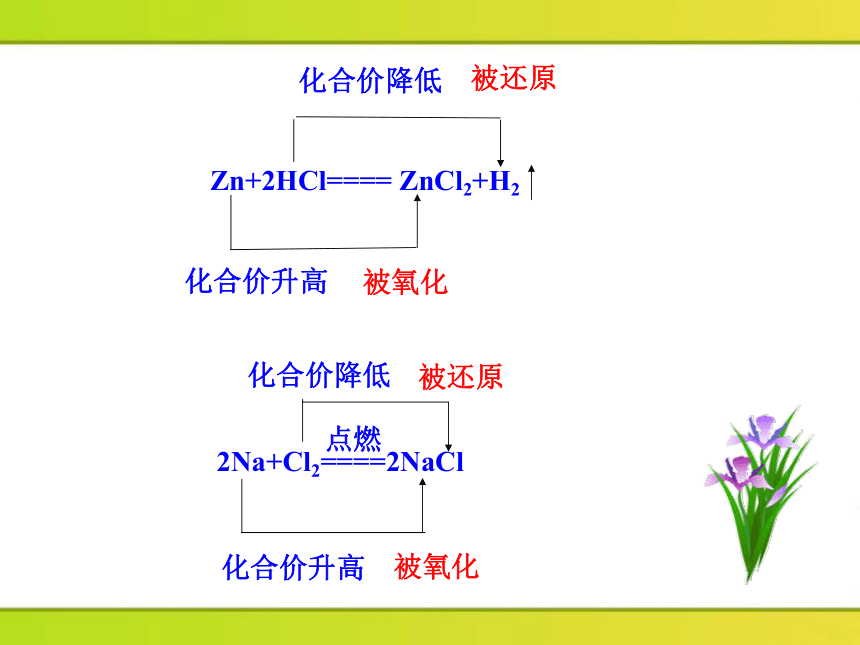
Zn+2HCl==== ZnCl2+H2
化合价降低
化合价升高
化合价升高
被还原
被还原
被氧化
被氧化
2Na+Cl2====2NaCl
化合价降低
点燃
从化合价升降的角度定义
有元素化合价升降的反应,叫氧化还原反应。
氧化还原反应的判断依据是:
有无化合价的升降
氧化还原反应的特征:有元素化合价的升降
根据元素化合价是否有变化把化学反应分为:
氧化还原反应
非氧化还原反应
我们初中学过的四大基本反应类型有哪些?
它们与氧化还原反应的关系是怎样的?
复分解反应、置换反应、化合反应、分解反应
分解反应
化合反应
复分解反应
置换反应
氧化还原反应
氧化还原反应和四大基本反应类型的关系:
判断以下反应是否是氧化还原反应
Fe + CuSO4 ==== FeSO4 + Cu
Zn + 2HCl ====ZnCl2 + H2↑
+2
0
+2
0
+6
-2
+6
-2
0
0
+2
+1
-1
-1
是
是
化合价升高,氧化反应
化合价升高,氧化反应
化合价降低,还原反应
化合价降低,还原反应
2H2O2 ==== 2H2O + O2↑
-1
-2
0
NaOH + HCl ==== NaCl + H2O
-1
-1
+1
+1
+1
+1
+1
-2
-2
化合价升高,氧化反应
化合价降低,还原反应
不是
是
化合价升高,失去电子
2Na + Cl2 ==== 2NaCl
化合价降低,得到电子
先分析钠与
氯气的反应吧
想一想:
化合价的升降与电子转移的关系,氧化还原反应的实质是什么?
钠与氯气反应的动画演示
电子得失的动画演示
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
化合价的升降——电子的得失
化合价变化本质原因的分析
2Na + Cl2 ==== 2NaCl
点燃
氧化反应(化合价升高)的实质是原子失去电子的过程。
还原反应(化合价降低)的实质是原子得到电子的过程。
2Na+Cl2 ==== 2Na Cl
0
0
+1 -1
H2 + Cl2 ==== 2HCl的动画演示
点燃
H Cl
+17
+1
+1
+17
H Cl
δ+ δ-
H2 + Cl2 ==== 2HCl
H
Cl
HCl
化合价的升降——共用电子对的偏移
点燃
氧化还原反应的实质
有电子转移(得失或偏移)的反应都是氧化还原反应。
原来是因为我!!!
(本质) (特征)
归纳总结
某元素得到电子
(或电子对偏向)
化合价降低
还原反应
某元素失去电子
(或电子对偏离)
化合价升高
氧化反应
思 考
我们能否方便直观的显示出氧化还原反应中的电子转移情况呢?
我……
MnO2 + 4HCl==== MnCl2 + Cl2 ↑+ 2H2O
化合价降低、被还原、得到1×2e-
化合价升高、被氧化、失去2×e-
双线桥表示法
氧化还原反应中的电子转移情况表示方法
方法总结
1. 标出变化了的元素的化合价;
2. 两根线桥;
3. 箭头总是从反应物指向生成物;
4. 箭头起止于同种元素;
5. 必须标明电子转移的数目并指明“得”、“失”。
现学现用
用双线桥法标出下列反应电子转移的方向和数目:
①MnO2+4HCl====MnCl2+Cl2↑+2H2O
②Cl2+2NaOH====NaCl+NaClO+H2O
△
①MnO2+4HCl====MnCl2+Cl2↑+2H2O
②Cl2+2NaOH====NaCl+NaClO+H2O
失1×e-
得1×e-
表示氧化还原反应中的电子转移情况还有一种更简单的方法!
失2×e-
得1×2e-
△
书写方法
1.标出变化了的元素化合价;
2.箭头总是从失电子的元素指向得电子的元素;
3.在箭桥上标出转移电子数目,不写“得” “ 失”。
+2
0
+4
0
4e-
2CuO + C ==== 2Cu + CO2
高温
单线桥
表示法
1.用双线桥法标出电子转移情况
(1)Fe + CuSO4 ==== FeSO4 + Cu
0
+2
+2
0
化合价升高,失1×2e-
化合价降低,得1×2e-
(2) 2H2 + O2 ==== 2H2O
点燃
0 0 +1 -2
化合价升高,失4×e-
化合价降低,得2×2e-
2.下列反应属于氧化还原反应的是( )
A.CaCO3+2HCl====CaCl2+H2O+CO2↑
B.CaCO3====CaO+CO2↑
C.Na2O+H2O====2NaOH
D.Mg+2HCl====MgCl2+H2↑
高温
D
3.当化合物中的元素被转化成单质中的元素时,该元
素( )
A.一定被氧化
B.一定被还原
C.可能被氧化,也可能被还原
D.化合价降低为零
C
这道题似乎有点难哦
4.氧化还原反应的实质是( )
A.化合价的升降
B.分子中各原子重新组合
C.电子的得失或共用电子对的偏移
D.氧原子的得失
5.下列四种基本类型的反应中,一定是氧化还原反应的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
C
C
6. 根据下列物质变化中化合价的情况,判断属于还原反应的是 ( )
A. CuO → Cu B. NaCl → HCl
C. C → CO2 D. FeCl2 → FeCl3
A
失电子
(或电子对偏离)
→
化合价
升高
→
氧化反应
得电子
(或电子对偏向)
→
化合价
降低
→
还原反应
↓
本质
↓
特征
氧化还原反应的整合
