11-12版高中化学新课标同步授课课件:2.3.2氧化剂和还原剂(人教版必修1)
文档属性
| 名称 | 11-12版高中化学新课标同步授课课件:2.3.2氧化剂和还原剂(人教版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 00:00:00 | ||
图片预览






文档简介
(共26张PPT)
第2课时 氧化剂和还原剂
1.掌握氧化剂和还原剂的概念
2.理解氧化剂和还原剂的判断
3.了解氧化性和还原性大小的比较
复习回顾
Cu + Cl2 ==== CuCl2
Zn + H2SO4 ==== ZnSO4 + H2↑
CaCO3+ 2HCl ====CaCl2+H2O+CO2↑
Cl2 + H2O==== HCl + HClO
1.下列化学反应中,哪些属于氧化还原反应?
√
√
×
√
点燃
物质所含元素化合价升高的反应是氧化反应
化合价降低,得电子,被还原
化合价升高,失电子,被氧化
CuO + H2 ==== Cu + H2O
+2
-2
0
0
+1
-2
物质所含元素化合价降低的反应是还原反应
失去电子的反应就是氧化反应
得到电子的反应就是还原反应
再复习回顾一下吧
△
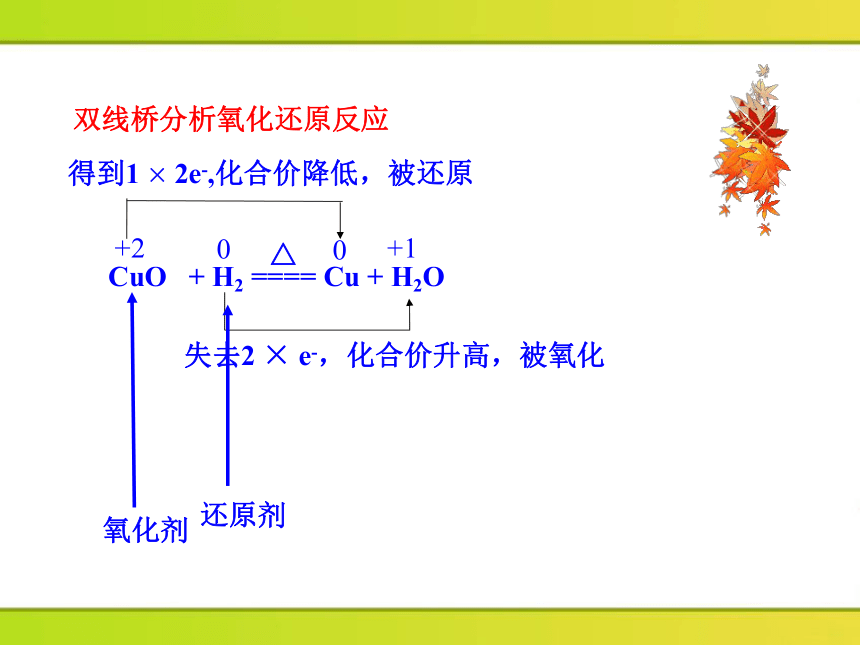
双线桥分析氧化还原反应
CuO + H2 ==== Cu + H2O
+2
0
0
+1
得到1 × 2e-,化合价降低,被还原
失去2 × e-,化合价升高,被氧化
氧化剂
还原剂
△
氧化剂和还原剂的动画演示
还是咱哥俩好啊!
氧化剂和还原剂
氧化剂:是得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低的反应物。
还原剂:是失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高的反应物。
氧化还原反应基本概念
1.反应物中:
氧化剂:得到电子化合价降低的物质。
还原剂:失去电子化合价升高的物质。
2.氧化性和还原性:
氧化性:物质得电子性质,氧化剂具有氧化性。 且物质得电子越容易氧化性越强
还原性:物质失电子性质,还原剂具有还原性。 且物质失电子越容易还原性越强
下列反应中,哪些是氧化剂?哪些是还原剂?
氧化剂
还原剂
氧化剂
还原剂
既是氧化剂又是还原剂
非氧化还原反应
Cu + Cl2 ==== CuCl2
Zn + H2SO4 ==== ZnSO4 + H2↑
CaCO3 + 2HCl ==== CaCl2 + H2O + CO2↑
Cl2 + H2O==== HCl + HClO
点燃
从电子转移的观点说明氧化剂、还原剂的实质是什么?
失e-的反应物 → 所含元素化合价升高→
发生氧化反应
→是还原剂→具有还原性
得e-的反应物 → 所含元素化合价降低→
发生还原反应
→是氧化剂→具有氧化性
使氧化剂发生还原反应的性质
使还原剂发生氧化反应的性质
CuO + H2 ==== Cu + H2O
△
得电子,
化合价降低,
被还原,
发生还原反应
纵观全局
化合价升高,
失电子,
被氧化,
发生氧化反应
氧化剂
还原剂
还原
产物
氧化
产物
常见氧化剂和还原剂
氧化剂 还原剂
单质
化合物 氧化物
盐
含氧酸
无氧酸
O2、Cl2、Br2
Na、Fe、H2、C
MnO2、CO2
CO、SO2
FeCl3、KMnO4
FeSO4、Na2SO3
HClO、HNO3、浓硫酸
H2SO3
HCl
H2S、HCl
氧化还原反应的存在
钢铁的冶炼
氧化性、还原性强弱的判断
特别提示:
氧化性、还原性的强弱取决于物质得失电子的难易程度而与得失电子数目的多少无关。
拓展应用
氧化性:物质得电子的能力(物质越容易得电子,即得电子能力越强,氧化性就越强)
还原性:物质失电子的能力(物质越容易失电子,即失电子能力越强,还原性就越强)
氧化性、还原性强弱的判断(1)
1.根据元素的化合价
物质中元素处于最高价态,该元素只有氧化性;物质中元素处于最低价态,该元素只有还原性;物质中元素处于中间价态,该元素既有氧化性又有还原性。
需要注意的是:元素的化合价处于最高价态时,具有氧化性,但不一定具有强氧化性,如Na+。同理元素的化合价处于最低价态时,具有还原性,但不一定具有强还原性,如F-。
氧化性、还原性强弱的判断(2)
2. 根据氧化还原反应方程式
在同一氧化还原反应中,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。即:
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。
也就是说,一个氧化还原反应一定是较强氧化剂制较弱氧化剂,较强还原剂制较弱还原剂。
氧化剂 + 还原剂 ==== 还原产物 + 氧化产物
(强氧化性) (强还原性) (弱还原性) (弱氧化性)
得ne-
失ne-
氧化性、还原性强弱的判断(3)
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ H+ Cu2+ Ag+
还原性逐渐增强
氧化性逐渐增强
3.根据金属活动性顺序表
在金属活动性顺序表中,金属的位置越靠前,其还原性就越强;金属的位置越靠后,其阳离子的氧化性就越强。
1.判断下列反应中的氧化剂、还原剂
② CuSO4 + Fe ==== FeSO4 + Cu
④MnO2 +4HCl(浓)====MnCl2 +2H2O +Cl2↑
△
③ 2H2O ==== 2H2 + O2↑
电解
① 2Na + Cl2 === 2NaCl
氧化剂
氧化剂
既是氧化剂又是还原剂
氧化剂
还原剂
还原剂
还原剂
2.在Fe2+、Fe3+、S、I-、H+中只有氧化性的是
,只有还原性的是_______,既有氧化性又有还原性的是 。
3.实现下列变化,一定要加入其它物质作氧化剂的是
( )
A.CaCO3 → CO2
B.NaCl → NaNO3
C.Zn → ZnCl2
D.CuO → CuSO4
Fe 2+
S
H +
I -
Fe 3+
C
4.苹果汁是人们喜欢的饮料,由于此饮料中含有Fe2+,现
榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时
加入维生素C,可有效防止这种现象发生,说明维生素C
具有( )
A. 氧化性 B. 还原性
C. 碱性 D. 酸性
B
5.已知常温下在溶液中可发生如下两个离子反应: Ce4++Fe2+====Fe3++Ce3+ Sn2++2Fe3+====2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A. Sn2+、Fe2+、Ce3+
B. Sn2+、Ce3+ 、 Fe2+
C. Ce3+、Fe2+、Sn2+
D. Fe2+、 Sn2+、Ce3+
A
第2课时 氧化剂和还原剂
1.掌握氧化剂和还原剂的概念
2.理解氧化剂和还原剂的判断
3.了解氧化性和还原性大小的比较
复习回顾
Cu + Cl2 ==== CuCl2
Zn + H2SO4 ==== ZnSO4 + H2↑
CaCO3+ 2HCl ====CaCl2+H2O+CO2↑
Cl2 + H2O==== HCl + HClO
1.下列化学反应中,哪些属于氧化还原反应?
√
√
×
√
点燃
物质所含元素化合价升高的反应是氧化反应
化合价降低,得电子,被还原
化合价升高,失电子,被氧化
CuO + H2 ==== Cu + H2O
+2
-2
0
0
+1
-2
物质所含元素化合价降低的反应是还原反应
失去电子的反应就是氧化反应
得到电子的反应就是还原反应
再复习回顾一下吧
△
双线桥分析氧化还原反应
CuO + H2 ==== Cu + H2O
+2
0
0
+1
得到1 × 2e-,化合价降低,被还原
失去2 × e-,化合价升高,被氧化
氧化剂
还原剂
△
氧化剂和还原剂的动画演示
还是咱哥俩好啊!
氧化剂和还原剂
氧化剂:是得到电子(或电子对偏向)的物质,在反应时所含元素的化合价降低的反应物。
还原剂:是失去电子(或电子对偏离)的物质,在反应时所含元素的化合价升高的反应物。
氧化还原反应基本概念
1.反应物中:
氧化剂:得到电子化合价降低的物质。
还原剂:失去电子化合价升高的物质。
2.氧化性和还原性:
氧化性:物质得电子性质,氧化剂具有氧化性。 且物质得电子越容易氧化性越强
还原性:物质失电子性质,还原剂具有还原性。 且物质失电子越容易还原性越强
下列反应中,哪些是氧化剂?哪些是还原剂?
氧化剂
还原剂
氧化剂
还原剂
既是氧化剂又是还原剂
非氧化还原反应
Cu + Cl2 ==== CuCl2
Zn + H2SO4 ==== ZnSO4 + H2↑
CaCO3 + 2HCl ==== CaCl2 + H2O + CO2↑
Cl2 + H2O==== HCl + HClO
点燃
从电子转移的观点说明氧化剂、还原剂的实质是什么?
失e-的反应物 → 所含元素化合价升高→
发生氧化反应
→是还原剂→具有还原性
得e-的反应物 → 所含元素化合价降低→
发生还原反应
→是氧化剂→具有氧化性
使氧化剂发生还原反应的性质
使还原剂发生氧化反应的性质
CuO + H2 ==== Cu + H2O
△
得电子,
化合价降低,
被还原,
发生还原反应
纵观全局
化合价升高,
失电子,
被氧化,
发生氧化反应
氧化剂
还原剂
还原
产物
氧化
产物
常见氧化剂和还原剂
氧化剂 还原剂
单质
化合物 氧化物
盐
含氧酸
无氧酸
O2、Cl2、Br2
Na、Fe、H2、C
MnO2、CO2
CO、SO2
FeCl3、KMnO4
FeSO4、Na2SO3
HClO、HNO3、浓硫酸
H2SO3
HCl
H2S、HCl
氧化还原反应的存在
钢铁的冶炼
氧化性、还原性强弱的判断
特别提示:
氧化性、还原性的强弱取决于物质得失电子的难易程度而与得失电子数目的多少无关。
拓展应用
氧化性:物质得电子的能力(物质越容易得电子,即得电子能力越强,氧化性就越强)
还原性:物质失电子的能力(物质越容易失电子,即失电子能力越强,还原性就越强)
氧化性、还原性强弱的判断(1)
1.根据元素的化合价
物质中元素处于最高价态,该元素只有氧化性;物质中元素处于最低价态,该元素只有还原性;物质中元素处于中间价态,该元素既有氧化性又有还原性。
需要注意的是:元素的化合价处于最高价态时,具有氧化性,但不一定具有强氧化性,如Na+。同理元素的化合价处于最低价态时,具有还原性,但不一定具有强还原性,如F-。
氧化性、还原性强弱的判断(2)
2. 根据氧化还原反应方程式
在同一氧化还原反应中,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。即:
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。
也就是说,一个氧化还原反应一定是较强氧化剂制较弱氧化剂,较强还原剂制较弱还原剂。
氧化剂 + 还原剂 ==== 还原产物 + 氧化产物
(强氧化性) (强还原性) (弱还原性) (弱氧化性)
得ne-
失ne-
氧化性、还原性强弱的判断(3)
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ H+ Cu2+ Ag+
还原性逐渐增强
氧化性逐渐增强
3.根据金属活动性顺序表
在金属活动性顺序表中,金属的位置越靠前,其还原性就越强;金属的位置越靠后,其阳离子的氧化性就越强。
1.判断下列反应中的氧化剂、还原剂
② CuSO4 + Fe ==== FeSO4 + Cu
④MnO2 +4HCl(浓)====MnCl2 +2H2O +Cl2↑
△
③ 2H2O ==== 2H2 + O2↑
电解
① 2Na + Cl2 === 2NaCl
氧化剂
氧化剂
既是氧化剂又是还原剂
氧化剂
还原剂
还原剂
还原剂
2.在Fe2+、Fe3+、S、I-、H+中只有氧化性的是
,只有还原性的是_______,既有氧化性又有还原性的是 。
3.实现下列变化,一定要加入其它物质作氧化剂的是
( )
A.CaCO3 → CO2
B.NaCl → NaNO3
C.Zn → ZnCl2
D.CuO → CuSO4
Fe 2+
S
H +
I -
Fe 3+
C
4.苹果汁是人们喜欢的饮料,由于此饮料中含有Fe2+,现
榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时
加入维生素C,可有效防止这种现象发生,说明维生素C
具有( )
A. 氧化性 B. 还原性
C. 碱性 D. 酸性
B
5.已知常温下在溶液中可发生如下两个离子反应: Ce4++Fe2+====Fe3++Ce3+ Sn2++2Fe3+====2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A. Sn2+、Fe2+、Ce3+
B. Sn2+、Ce3+ 、 Fe2+
C. Ce3+、Fe2+、Sn2+
D. Fe2+、 Sn2+、Ce3+
A
