11-12版高中化学课时讲练通配套课件:1.2.1 研究物质性质的基本方法(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:1.2.1 研究物质性质的基本方法(鲁科版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 00:00:00 | ||
图片预览











文档简介
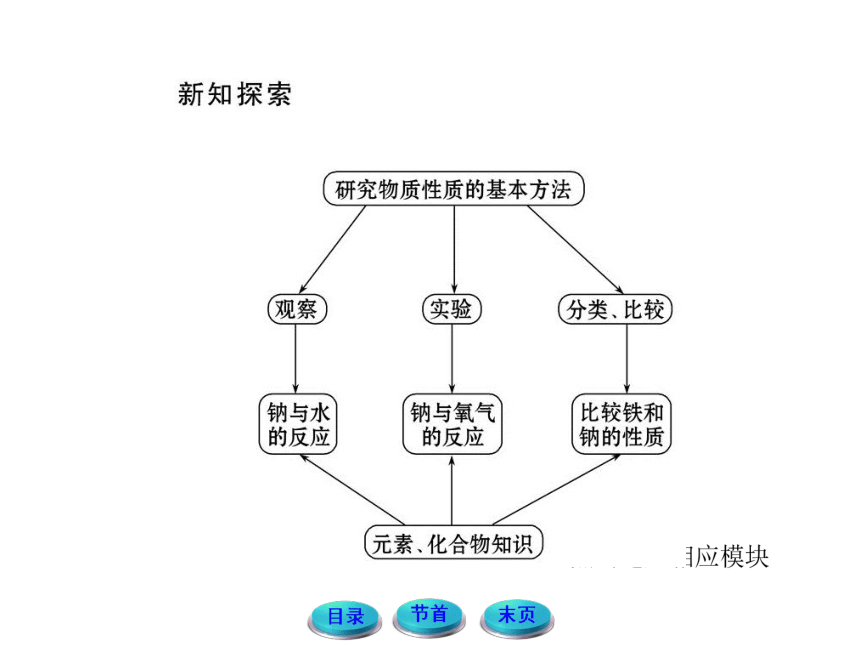
(共68张PPT)
1.结合课本P9“观察·思考”栏目完成下列问题
(1)怎样取用一小块钠?简述操作过程。从中你可以看出钠有什么性质?剩余钠应如何处理?
提示:用镊子将金属钠从试剂瓶中取出,用滤纸吸干表面的煤油,在玻璃片上用小刀切下黄豆粒大小的一小块钠。钠可以用小刀切割,可见钠质地比较软,即硬度较小;剩余的钠块放回原瓶。
(2)向培养皿中加适量水,滴入1~2 滴酚酞,将切好的钠投入水中,有什么现象?你能解释出现这些现象的原因吗?
提示:现象及解释
2.请分析比较钠与水的反应和钠与盐酸的反应哪个反应更剧烈。
提示:钠与盐酸的反应更剧烈。钠与H2O反应的实质是Na与H+作用,因为酸可以产生大量的H+,Na就可以直接与酸作用,当与酸反应完后才与H2O反应。如钠和足量盐酸反应的化学方程式为2Na+2HCl ==== 2NaCl+H2↑。
3.钠与硫酸铜溶液反应可以置换出单质铜吗?
提示:不可以。钠不能从盐溶液中置换出金属,钠与盐溶液反应的实质仍是Na与H2O反应。Na与H2O反应生成的NaOH若能与盐反应生成难溶碱,则盐也会参与反应。
如将Na加入CuSO4溶液中,反应的第一步为:
2Na+2H2O ==== 2NaOH+H2↑,
第二步为:2NaOH+CuSO4 ==== Cu(OH)2↓+Na2SO4。
例1 有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证:①钠的物理性质;②钠与水反应的产物。
(1)为了完成此实验,还需要的仪器有__________。
(2)假如已按如图所示装配好了仪器,接下来的操作是
_________________。
(3)实验现象是______________________。
【规范解答】(1)由于实验目的是做钠与水的反应,验证钠的物理性质并验证钠与水反应的产物,所以要收集产生的气体,并验证气体的可燃性,故还需用小试管和酒精灯。
(2)要由钠和水反应来验证钠的物理性质,使钠块与水接触,就要想办法将钠块放入水中:将大头针向上提,使钠块落入水中,将小试管扣在导管上收集反应产生的气体,用拇指堵住试管口移近酒精灯,松开拇指,点燃小试管中的气体。
(3)观察到的现象是:钠浮在水面上很快熔化成闪亮的小球,并逐渐消失,水溶液由无色变成红色,点燃小试管中的气体时,有尖锐的爆鸣声。
答案:(1)小试管和酒精灯
(2)将大头针向上提,使钠块落入水中,将小试管扣在导管上收集反应产生的气体,用拇指堵住试管口移近酒精灯,松开拇指点燃小试管中的气体
(3)钠浮在水面上很快熔化成闪亮的小球,并逐渐消失,水溶液由无色变成红色,点燃小试管中的气体时,有尖锐的爆鸣声
【互动探究】若“滴有酚酞的水溶液”改为“饱和石灰水”,会出现什么现象?
提示:将钠投入饱和石灰水中,首先观察到的是钠与水的反应现象,即钠浮在水面上,熔化成银白色小球,四处游动。由于钠与水反应消耗水,且反应放热使石灰水温度升高,使Ca(OH)2的溶解度减小,澄清石灰水会变浑浊。
1.取用金属钠要注意安全,剩余的钠要放回原瓶。
2.钠与水的反应体现了钠较软、熔点低、密度比水小等物理性质。
3.钠与盐溶液反应时不能置换出金属单质。
1.钠切开后为什么会立即变暗?
提示:因为钠的化学性质很活泼,很容易被空气中的氧气氧化。
2.钠为什么要保存在煤油中?
提示:钠的化学性质很活泼,易与空气中的O2、H2O等反应。而钠不能与煤油反应,且密度比煤油大,因此将钠放在煤油中可以隔绝空气。
3.通过钠与氧气在不同条件下得到的产物不同,我们在今后实验中应注意什么?
提示:反应条件的不同可能会影响反应结果,因此,在实验过程中要注意控制反应条件。
4.在你做过的实验或学过的知识中,还有因条件改变而影响产物的吗?
提示:例如碳在氧气充足的条件下生成CO2,不充足的条件下生成CO;又如把少量CO2通入澄清石灰水中生成沉淀(CaCO3),CO2过量时又变澄清(生成碳酸氢钙)。
例2 已知用金属钠生成氧化钠,可有多种方法:
①4Na+O2 ==== 2Na2O
②4Na+CO2 ==== 2Na2O+C
③2NaNO2+6Na ==== 4Na2O+N2↑
上述三种方法中最好的是_______,原因是_________。
【规范解答】方法①用钠与O2直接反应,生成的Na2O将有少量发生如下反应:2Na2O+O2 ==== 2Na2O2,即产物是Na2O和Na2O2的混合物。方法②中固体产物中既有C,又有由反应Na2O+CO2 ==== Na2CO3生成的Na2CO3。方法③产物较纯,且不易变质(有氮气作保护气)。
答案:③ 产物中只有Na2O固体生成,且生成的氮气可以将环境中的氧气排除,确保Na2O不再被氧化
【变式训练】有一块表面被氧化成氧化钠的金属钠,质量为0.584 g,放入9.436 g水中,当反应结束时,生成氢气0.02 g。
(1)此金属钠中含有多少克钠
(2)所得氢氧化钠溶液的质量分数是多少?
【解析】(1)由2Na+2H2O ==== 2NaOH + H2↑
46 2
m(Na) 0.02 g
得m(Na)=0.46 g
(2)混合物中 Na2O的质量为m(Na2O)=0.584 g- 0.46 g=
0.124 g
Na2O+H2O ==== 2NaOH
62 80
0.124 g m(NaOH)1
m(NaOH)1=0.16 g
2Na+2H2O ==== 2NaOH+H2↑
46 80
0.46 g m(NaOH)2
m(NaOH)2=0.8 g
所得氢氧化钠溶液中m(NaOH)=0.8 g+0.16 g=0.96 g
溶液的总质量0.584 g+9.436 g-0.02 g=10 g
氢氧化钠溶液的质量分数=0.96 g/10 g×100%=9.6%
答案:(1)0.46 g (2)9.6%
1.在实验设计中,利用相同反应物,有时可以通过控制反应条件而制得不同产物。
2.金属钠要保存在煤油中,物质的保存方式是由其性质决定的。
1.如何判断Na2O2与H2O反应所得的气体是氢气还是氧气?
提示:可以利用如图装置制取气体,并用排水
法收集,然后利用检验两种气体的方法检验。
若是H2,点燃时会燃烧,并听到爆鸣声;若是O2,
则可以使带火星的木条复燃。
2.如何验证过氧化钠与二氧化碳的反应?
提示:在一个盛有少量碳酸钠固体的小烧杯中加入稀盐酸,用坩埚钳夹取包有过氧化钠粉末的脱脂棉伸入烧杯上部 ,观察现象,若脱脂棉燃烧,证明过氧化钠与二氧化碳发生了反应。
3.在实验室中,该如何保存过氧化钠呢?
提示:过氧化钠能与空气中的水和二氧化碳反应,所以要密封保存。
例3 关于氧化钠和过氧化钠的有关叙述中正确的是
A.Na2O和Na2O2都能与CO2发生化合反应
B.Na2O和Na2O2长期置于空气中最终产物相同
C.将Na2O和Na2O2投入水中都可以得到NaOH溶液,同时有氧气生成
D.Na2O和Na2O2都是碱性氧化物
【规范解答】选B。Na2O2与CO2的反应不是化合反应,A错;Na2O和Na2O2在空气中长期放置最终都生成Na2CO3,B正确;Na2O与水反应只生成NaOH,没有O2生成,C错;Na2O2与酸反应除生成盐和H2O之外,还生成O2,不是碱性氧化物,D错。
【互动探究】若将等质量的Na2O和Na2O2分别投入过量且等质量的水中,能否形成溶质质量分数相等的溶液?
提示:Na2O和Na2O2与水反应均生成NaOH,但是等质量的Na2O和Na2O2与水反应消耗水的质量不同,生成的NaOH质量也不相等,最终得到的溶液中溶质的质量分数不相等。
过氧化钠和氧化钠的比较
Na2O2与CO2和H2O反应中的质量变化
【示例】将质量为m g的CO2与过量Na2O2固体充分反应,试
分析固体质量的变化。
【解析】
2CO2 + 2Na2O2 ==== 2Na2CO3 + O2
2×44 2×78 2×106
m g
由此可知反应后固体的质量增加
答案:固体增加 。
探究:
1.若将m g CO在足量氧气中充分燃烧,立即将生成物通入
足量Na2O2固体中,则固体的质量有何变化?
提示:2CO+O2 2CO2
2×28 2×44
m g m(CO2)= g
2CO2 + 2Na2O2 ==== 2Na2CO3 + O2
2×44 2×78 2×106
由此可知固体质量增加
点燃
====
2.若将CO换成等质量的H2重复上述过程,则固体质量有何变
化
提示:由2H2+O2 2H2O,2H2O+2Na2O2 ==== 4NaOH+
O2↑可以看出上述过程中Na2O2转化成NaOH相当于吸收了H2
的质量,因此固体质量增加 m g。
点燃
====
3.若取m g CO和H2的混合气重复上述过程,固体的质量又会有何变化?
提示:固体增加的质量恰好为CO和H2混合气的质量m g,与二者的比例无关。
1.下列有关钠的物理性质叙述正确的是( )
①银白色金属 ②质软,可以用小刀切割 ③熔点低于100 ℃ ④密度比水小 ⑤热和电的良导体
A.①②④ B.①②③④ C.①③④ D.①②③④⑤
【解析】选D。所有这些都是钠的物理性质。
2.下列说法正确的是( )
A.钠与水反应的产物是氢氧化钠和氧气
B.钠与水的反应放热
C.实验室可用钠与水反应制备H2
D.钠着火,可用水灭火
【解析】选B。钠与水反应的产物是氢氧化钠和氢气,A不正确;钠与水反应时,钠熔化成闪亮的小球,使钠熔化的能量正是钠与水反应放出的热量,B正确;钠与水反应过于激烈,且不能将大块钠放入水中,故实验室中不用钠和水反应制取H2,C不正确;钠与水也反应,故不可用水灭火,相反,如果用水,必然导致爆炸发生。
3.下列关于钠的说法正确的是( )
A.金属钠与氧气反应,条件不同,产物不同
B.少量钠可保存于CCl4中
C.少量钠可保存在汽油中
D.钠的化学性质活泼,可从CuSO4溶液中置换出Cu
【解析】选A。钠与氧气反应,在常温下生成Na2O,在加热时生成Na2O2,故A项对;钠的密度比CCl4小,浮在液面上不能隔绝空气,故B项错;汽油易挥发且易燃烧,钠不能保存于汽油中,故C项错;由于钠与盐溶液反应时,首先是钠与水发生反应,生成的NaOH再与盐溶液反应,故D项错。
4.下列钠的化合物在自然界中不存在的是( )
A.氧化物 B.硫酸盐 C.氯化物 D.碳酸盐
【解析】选A。硫酸钠、氯化钠、碳酸钠和碳酸氢钠在自然界都存在,只有氧化钠与过氧化钠在自然界不存在,因为它们极易与空气中的水或二氧化碳发生反应。
5.(2011·济宁高一检测)A、B、C是三种常见的化合物,
A为淡黄色固体,它们之间的转化关系如图所示:
完成下列空白:
(1)A的化学式为_____,B的化学式为______;
(2)写出甲+B C+丙的化学反应方程式:_________;
(3)写出A的一种重要用途__________。
【解析】A为淡黄色固体,且是一种化合物,则A可能是Na2O2,则甲是Na,A与甲均可以与B反应,且生成的乙和丙可点燃再生成B,则B是H2O,乙为O2,丙为H2,C为NaOH,从而推出A为Na2O2,符合题意。
答案:(1)Na2O2 H2O
(2)2Na+2H2O ==== 2NaOH+H2↑
(3)供氧剂、漂白剂、消毒剂(任答一种即可)
一、选择题(本题包括6小题,每小题4分,共24分)
1.(2011·泰安高一检测)按照如图所示的方
法研究某气体的性质,这种方法属于( )
A.实验法 B.观察法
C.分类法 D.比较法
【解析】选B。图中所示的是一名同学闻有毒气体气味的正确方法。许多同学容易误认为是实验法。观察是一种有计划、有目的地用感官考察研究对象的方法。人们既可以直接用肉眼观察物质的颜色、状态,用鼻子闻物质的气味,也可以借助一些仪器来进行观察。
2.2.3 g钠在干燥的空气中与氧气反应,可得3.5 g固体,
据此可判断其产物为( )
A.只有Na2O2 B.只有Na2O
C.Na2O和 Na2O2 D. 无法确定
【解析】选C。金属钠和氧气反应可生成Na2O或Na2O2 ,此
题用“极限法”:若2.3 g钠全部反应生成Na2O ,由反应
4Na + O2 ==== 2Na2O 可得生成Na2O的质量为3.1 g;若
2.3 g钠全部反应生成Na2O2,由反应2Na + O2 Na2O2
可得生成Na2O2的质量为3.9 g;现产物为3.5 g,介于
3.1 g和3.9 g之间,故为Na2O和Na2O2的混合物。
△
====
【规律方法】极限法的应用范围
极限法是一种重要的思维方法,也是我们在解答该类题目时常用的一种方法。极限法解题要特别注意使用的范围。一般是存在两种反应的“可能性”,通过计算或推断,确定一个范围,然后结合题意得到最终答案。
3.将一小块钠投入FeCl3溶液中,下列对有关实验结果的预测正确的是( )
A.钠溶解,有铁析出,并有气体产生
B.只有气体产生
C.只有沉淀产生
D.既有沉淀产生,又有气体产生
【解析】选D。Na首先与H2O反应,生成的NaOH再与FeCl3反应,有关反应方程式为:2Na+2H2O ==== 2NaOH+H2↑,FeCl3+3NaOH ==== Fe(OH)3↓+3NaCl,根据发生的上述两个反应即可确定只有D选项中的预测正确。
4.有一位学生将一小块钠投入到盛有煤油和水的试管中(煤油和水均足够多),想一想可能观察到的现象是( )
A.钠浮在试管中的液面上并四处游动
B.钠沉入试管底部
C.钠与水剧烈反应
D.钠处于煤油和水的交界处并可能作上、下跳动
【解析】选D。钠的密度比水的小,比煤油的大,所以钠会在煤油和水的交界处,当产生氢气时,氢气会托起钠,使钠离开水,钠表面的氢气逸出后,钠又会重新回到水中,作上、下跳动。
5. 将2.3 g钠放入97.7 g水中,形成的溶液中溶质的质量分数为( )
A.等于2.3% B.等于4%
C.大于2.3% D.大于4%
【解析】选D 。由方程式2Na+2H2O ==== 2NaOH+H2↑可得2.3 g 钠可生成NaOH的质量为4.0 g,生成氢气的质量为0.1 g。而溶液总质量= 钠的质量+ 水的质量-氢气的质量<100 g,所以质量分数大于4%。
【举一反三】将3.1 g Na2O投入到96.9 g水中或将3.9 g Na2O2投入到96.9 g水中形成的溶液中溶质的质量分数是多少?
提示:由Na2O+H2O ==== 2NaOH可知3.1 g Na2O可得氢氧化钠4.0 g,溶液总质量为100 g,所以质量分数等于4%;若为Na2O2,生成4.0 g氢氧化钠的同时,还生成了氧气0.8 g,故溶液的总质量为(3.9+96.9- 0.8) g,也为100 g,所以质量分数也等于4%。
6.下列各组中的两物质反应时,反应条件或反应物用量的改变对生成物没有影响的是( )
A.C与O2 B.Ca(OH)2与CO2
C.Na与O2 D.Na与H2O
【解析】选D。A项中氧气少量会生成CO,过量会生成CO2;B项中二氧化碳少量会生成碳酸钙,过量会生成碳酸氢钙;Na与O2反应在加热时生成过氧化钠,不加热则生成氧化钠;Na与H2O无论条件与试剂用量如何都是生成氢氧化钠与氢气。
二、非选择题(本题包括2小题,共26分)
7.(14分)(2011·宁波高一检测)过氧化钠保存不当容易变质。某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。
上图中的E和F构成量气装置,用来测定O2的体积。
(1)写出装置A和B中发生反应的化学方程式:
装置A:_______________________________________,
装置B:______________________________________。
(2)写出装置C中发生反应的化学方程式:__________。
(3)NaOH溶液的作用是_________________。
(4)他们在读出量筒内水的体积数后,折算成氧气的质量为m g,则样品中过氧化钠的质量分数为______________。
【解析】装置A用来制取二氧化碳气体,装置B用来吸收二氧化碳中混有的氯化氢气体。NaOH溶液的作用是吸收未反应的CO2,以便E、F装置测得的气体只有氧气。由反应2Na2O2+2CO2 ==== 2Na2CO3+O2,可求得过氧化钠的质量为39m/8 g,进而求得过氧化钠的质量分数为39m/8a。
答案:(1)CaCO3+2HCl ==== CaCl2+H2O+CO2↑
NaHCO3+HCl ==== NaCl+H2O+CO2↑
(2)2Na2O2+2CO2 ==== 2Na2CO3+O2
(3)吸收未反应的CO2
(4)39m/8a
8.(12分)(2011·北京海淀高一检测)钠在空气中燃烧
(如图)生成的固体产物物质中除有黄色粉末外,还有黑色
固体物质——炭。
(1)请假设黑色固体物质产生的原因可能是:
假设①煤油不完全燃烧得到;
假设②______________;
假设③酒精灯中的酒精不完全燃烧得到。
(2)为确认以上其中一种假设的正误,某同学进行如下推断:由于金属钠与氧的结合能力比碳强,因此黑色的炭可能是二氧化碳与金属钠发生置换反应而生成。该同学设计实验如下:
用打孔器钻取一段金属钠,取中间一小块
钠放在充满二氧化碳气体的玻璃管中加热
(如图),观察到钠燃烧发出黄色火焰,并
有黄色固体和黑色固体生成,生成的黄色
固体立即变成白色。请回答下列问题:
①用打孔器取金属钠的原因是____________;
②产生以上现象的化学反应方程式________________。
【解析】(1)黑色固体物质炭的来源可考虑与含碳元素有关
的物质:①煤油不完全燃烧得到;②酒精灯中的酒精不完
全燃烧得到;③产生的CO2与金属Na反应得到。(2)金属钠
易被氧化,故为证明上述③的原因,应取纯净的不被氧化
的钠,反应方程式可能为:2Na+CO2 C+Na2O2,
2Na2O2+2CO2 2Na2CO3+O2。
答案:(1)酒精燃烧产生的二氧化碳(或空气中的二氧化碳)
与金属钠反应生成的炭
(2)①取得较纯净的Na ②2Na+CO2 C+Na2O2,
2Na2O2+2CO2 2Na2CO3+O2
点燃
====
△
====
点燃
====
△
====
1.结合课本P9“观察·思考”栏目完成下列问题
(1)怎样取用一小块钠?简述操作过程。从中你可以看出钠有什么性质?剩余钠应如何处理?
提示:用镊子将金属钠从试剂瓶中取出,用滤纸吸干表面的煤油,在玻璃片上用小刀切下黄豆粒大小的一小块钠。钠可以用小刀切割,可见钠质地比较软,即硬度较小;剩余的钠块放回原瓶。
(2)向培养皿中加适量水,滴入1~2 滴酚酞,将切好的钠投入水中,有什么现象?你能解释出现这些现象的原因吗?
提示:现象及解释
2.请分析比较钠与水的反应和钠与盐酸的反应哪个反应更剧烈。
提示:钠与盐酸的反应更剧烈。钠与H2O反应的实质是Na与H+作用,因为酸可以产生大量的H+,Na就可以直接与酸作用,当与酸反应完后才与H2O反应。如钠和足量盐酸反应的化学方程式为2Na+2HCl ==== 2NaCl+H2↑。
3.钠与硫酸铜溶液反应可以置换出单质铜吗?
提示:不可以。钠不能从盐溶液中置换出金属,钠与盐溶液反应的实质仍是Na与H2O反应。Na与H2O反应生成的NaOH若能与盐反应生成难溶碱,则盐也会参与反应。
如将Na加入CuSO4溶液中,反应的第一步为:
2Na+2H2O ==== 2NaOH+H2↑,
第二步为:2NaOH+CuSO4 ==== Cu(OH)2↓+Na2SO4。
例1 有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证:①钠的物理性质;②钠与水反应的产物。
(1)为了完成此实验,还需要的仪器有__________。
(2)假如已按如图所示装配好了仪器,接下来的操作是
_________________。
(3)实验现象是______________________。
【规范解答】(1)由于实验目的是做钠与水的反应,验证钠的物理性质并验证钠与水反应的产物,所以要收集产生的气体,并验证气体的可燃性,故还需用小试管和酒精灯。
(2)要由钠和水反应来验证钠的物理性质,使钠块与水接触,就要想办法将钠块放入水中:将大头针向上提,使钠块落入水中,将小试管扣在导管上收集反应产生的气体,用拇指堵住试管口移近酒精灯,松开拇指,点燃小试管中的气体。
(3)观察到的现象是:钠浮在水面上很快熔化成闪亮的小球,并逐渐消失,水溶液由无色变成红色,点燃小试管中的气体时,有尖锐的爆鸣声。
答案:(1)小试管和酒精灯
(2)将大头针向上提,使钠块落入水中,将小试管扣在导管上收集反应产生的气体,用拇指堵住试管口移近酒精灯,松开拇指点燃小试管中的气体
(3)钠浮在水面上很快熔化成闪亮的小球,并逐渐消失,水溶液由无色变成红色,点燃小试管中的气体时,有尖锐的爆鸣声
【互动探究】若“滴有酚酞的水溶液”改为“饱和石灰水”,会出现什么现象?
提示:将钠投入饱和石灰水中,首先观察到的是钠与水的反应现象,即钠浮在水面上,熔化成银白色小球,四处游动。由于钠与水反应消耗水,且反应放热使石灰水温度升高,使Ca(OH)2的溶解度减小,澄清石灰水会变浑浊。
1.取用金属钠要注意安全,剩余的钠要放回原瓶。
2.钠与水的反应体现了钠较软、熔点低、密度比水小等物理性质。
3.钠与盐溶液反应时不能置换出金属单质。
1.钠切开后为什么会立即变暗?
提示:因为钠的化学性质很活泼,很容易被空气中的氧气氧化。
2.钠为什么要保存在煤油中?
提示:钠的化学性质很活泼,易与空气中的O2、H2O等反应。而钠不能与煤油反应,且密度比煤油大,因此将钠放在煤油中可以隔绝空气。
3.通过钠与氧气在不同条件下得到的产物不同,我们在今后实验中应注意什么?
提示:反应条件的不同可能会影响反应结果,因此,在实验过程中要注意控制反应条件。
4.在你做过的实验或学过的知识中,还有因条件改变而影响产物的吗?
提示:例如碳在氧气充足的条件下生成CO2,不充足的条件下生成CO;又如把少量CO2通入澄清石灰水中生成沉淀(CaCO3),CO2过量时又变澄清(生成碳酸氢钙)。
例2 已知用金属钠生成氧化钠,可有多种方法:
①4Na+O2 ==== 2Na2O
②4Na+CO2 ==== 2Na2O+C
③2NaNO2+6Na ==== 4Na2O+N2↑
上述三种方法中最好的是_______,原因是_________。
【规范解答】方法①用钠与O2直接反应,生成的Na2O将有少量发生如下反应:2Na2O+O2 ==== 2Na2O2,即产物是Na2O和Na2O2的混合物。方法②中固体产物中既有C,又有由反应Na2O+CO2 ==== Na2CO3生成的Na2CO3。方法③产物较纯,且不易变质(有氮气作保护气)。
答案:③ 产物中只有Na2O固体生成,且生成的氮气可以将环境中的氧气排除,确保Na2O不再被氧化
【变式训练】有一块表面被氧化成氧化钠的金属钠,质量为0.584 g,放入9.436 g水中,当反应结束时,生成氢气0.02 g。
(1)此金属钠中含有多少克钠
(2)所得氢氧化钠溶液的质量分数是多少?
【解析】(1)由2Na+2H2O ==== 2NaOH + H2↑
46 2
m(Na) 0.02 g
得m(Na)=0.46 g
(2)混合物中 Na2O的质量为m(Na2O)=0.584 g- 0.46 g=
0.124 g
Na2O+H2O ==== 2NaOH
62 80
0.124 g m(NaOH)1
m(NaOH)1=0.16 g
2Na+2H2O ==== 2NaOH+H2↑
46 80
0.46 g m(NaOH)2
m(NaOH)2=0.8 g
所得氢氧化钠溶液中m(NaOH)=0.8 g+0.16 g=0.96 g
溶液的总质量0.584 g+9.436 g-0.02 g=10 g
氢氧化钠溶液的质量分数=0.96 g/10 g×100%=9.6%
答案:(1)0.46 g (2)9.6%
1.在实验设计中,利用相同反应物,有时可以通过控制反应条件而制得不同产物。
2.金属钠要保存在煤油中,物质的保存方式是由其性质决定的。
1.如何判断Na2O2与H2O反应所得的气体是氢气还是氧气?
提示:可以利用如图装置制取气体,并用排水
法收集,然后利用检验两种气体的方法检验。
若是H2,点燃时会燃烧,并听到爆鸣声;若是O2,
则可以使带火星的木条复燃。
2.如何验证过氧化钠与二氧化碳的反应?
提示:在一个盛有少量碳酸钠固体的小烧杯中加入稀盐酸,用坩埚钳夹取包有过氧化钠粉末的脱脂棉伸入烧杯上部 ,观察现象,若脱脂棉燃烧,证明过氧化钠与二氧化碳发生了反应。
3.在实验室中,该如何保存过氧化钠呢?
提示:过氧化钠能与空气中的水和二氧化碳反应,所以要密封保存。
例3 关于氧化钠和过氧化钠的有关叙述中正确的是
A.Na2O和Na2O2都能与CO2发生化合反应
B.Na2O和Na2O2长期置于空气中最终产物相同
C.将Na2O和Na2O2投入水中都可以得到NaOH溶液,同时有氧气生成
D.Na2O和Na2O2都是碱性氧化物
【规范解答】选B。Na2O2与CO2的反应不是化合反应,A错;Na2O和Na2O2在空气中长期放置最终都生成Na2CO3,B正确;Na2O与水反应只生成NaOH,没有O2生成,C错;Na2O2与酸反应除生成盐和H2O之外,还生成O2,不是碱性氧化物,D错。
【互动探究】若将等质量的Na2O和Na2O2分别投入过量且等质量的水中,能否形成溶质质量分数相等的溶液?
提示:Na2O和Na2O2与水反应均生成NaOH,但是等质量的Na2O和Na2O2与水反应消耗水的质量不同,生成的NaOH质量也不相等,最终得到的溶液中溶质的质量分数不相等。
过氧化钠和氧化钠的比较
Na2O2与CO2和H2O反应中的质量变化
【示例】将质量为m g的CO2与过量Na2O2固体充分反应,试
分析固体质量的变化。
【解析】
2CO2 + 2Na2O2 ==== 2Na2CO3 + O2
2×44 2×78 2×106
m g
由此可知反应后固体的质量增加
答案:固体增加 。
探究:
1.若将m g CO在足量氧气中充分燃烧,立即将生成物通入
足量Na2O2固体中,则固体的质量有何变化?
提示:2CO+O2 2CO2
2×28 2×44
m g m(CO2)= g
2CO2 + 2Na2O2 ==== 2Na2CO3 + O2
2×44 2×78 2×106
由此可知固体质量增加
点燃
====
2.若将CO换成等质量的H2重复上述过程,则固体质量有何变
化
提示:由2H2+O2 2H2O,2H2O+2Na2O2 ==== 4NaOH+
O2↑可以看出上述过程中Na2O2转化成NaOH相当于吸收了H2
的质量,因此固体质量增加 m g。
点燃
====
3.若取m g CO和H2的混合气重复上述过程,固体的质量又会有何变化?
提示:固体增加的质量恰好为CO和H2混合气的质量m g,与二者的比例无关。
1.下列有关钠的物理性质叙述正确的是( )
①银白色金属 ②质软,可以用小刀切割 ③熔点低于100 ℃ ④密度比水小 ⑤热和电的良导体
A.①②④ B.①②③④ C.①③④ D.①②③④⑤
【解析】选D。所有这些都是钠的物理性质。
2.下列说法正确的是( )
A.钠与水反应的产物是氢氧化钠和氧气
B.钠与水的反应放热
C.实验室可用钠与水反应制备H2
D.钠着火,可用水灭火
【解析】选B。钠与水反应的产物是氢氧化钠和氢气,A不正确;钠与水反应时,钠熔化成闪亮的小球,使钠熔化的能量正是钠与水反应放出的热量,B正确;钠与水反应过于激烈,且不能将大块钠放入水中,故实验室中不用钠和水反应制取H2,C不正确;钠与水也反应,故不可用水灭火,相反,如果用水,必然导致爆炸发生。
3.下列关于钠的说法正确的是( )
A.金属钠与氧气反应,条件不同,产物不同
B.少量钠可保存于CCl4中
C.少量钠可保存在汽油中
D.钠的化学性质活泼,可从CuSO4溶液中置换出Cu
【解析】选A。钠与氧气反应,在常温下生成Na2O,在加热时生成Na2O2,故A项对;钠的密度比CCl4小,浮在液面上不能隔绝空气,故B项错;汽油易挥发且易燃烧,钠不能保存于汽油中,故C项错;由于钠与盐溶液反应时,首先是钠与水发生反应,生成的NaOH再与盐溶液反应,故D项错。
4.下列钠的化合物在自然界中不存在的是( )
A.氧化物 B.硫酸盐 C.氯化物 D.碳酸盐
【解析】选A。硫酸钠、氯化钠、碳酸钠和碳酸氢钠在自然界都存在,只有氧化钠与过氧化钠在自然界不存在,因为它们极易与空气中的水或二氧化碳发生反应。
5.(2011·济宁高一检测)A、B、C是三种常见的化合物,
A为淡黄色固体,它们之间的转化关系如图所示:
完成下列空白:
(1)A的化学式为_____,B的化学式为______;
(2)写出甲+B C+丙的化学反应方程式:_________;
(3)写出A的一种重要用途__________。
【解析】A为淡黄色固体,且是一种化合物,则A可能是Na2O2,则甲是Na,A与甲均可以与B反应,且生成的乙和丙可点燃再生成B,则B是H2O,乙为O2,丙为H2,C为NaOH,从而推出A为Na2O2,符合题意。
答案:(1)Na2O2 H2O
(2)2Na+2H2O ==== 2NaOH+H2↑
(3)供氧剂、漂白剂、消毒剂(任答一种即可)
一、选择题(本题包括6小题,每小题4分,共24分)
1.(2011·泰安高一检测)按照如图所示的方
法研究某气体的性质,这种方法属于( )
A.实验法 B.观察法
C.分类法 D.比较法
【解析】选B。图中所示的是一名同学闻有毒气体气味的正确方法。许多同学容易误认为是实验法。观察是一种有计划、有目的地用感官考察研究对象的方法。人们既可以直接用肉眼观察物质的颜色、状态,用鼻子闻物质的气味,也可以借助一些仪器来进行观察。
2.2.3 g钠在干燥的空气中与氧气反应,可得3.5 g固体,
据此可判断其产物为( )
A.只有Na2O2 B.只有Na2O
C.Na2O和 Na2O2 D. 无法确定
【解析】选C。金属钠和氧气反应可生成Na2O或Na2O2 ,此
题用“极限法”:若2.3 g钠全部反应生成Na2O ,由反应
4Na + O2 ==== 2Na2O 可得生成Na2O的质量为3.1 g;若
2.3 g钠全部反应生成Na2O2,由反应2Na + O2 Na2O2
可得生成Na2O2的质量为3.9 g;现产物为3.5 g,介于
3.1 g和3.9 g之间,故为Na2O和Na2O2的混合物。
△
====
【规律方法】极限法的应用范围
极限法是一种重要的思维方法,也是我们在解答该类题目时常用的一种方法。极限法解题要特别注意使用的范围。一般是存在两种反应的“可能性”,通过计算或推断,确定一个范围,然后结合题意得到最终答案。
3.将一小块钠投入FeCl3溶液中,下列对有关实验结果的预测正确的是( )
A.钠溶解,有铁析出,并有气体产生
B.只有气体产生
C.只有沉淀产生
D.既有沉淀产生,又有气体产生
【解析】选D。Na首先与H2O反应,生成的NaOH再与FeCl3反应,有关反应方程式为:2Na+2H2O ==== 2NaOH+H2↑,FeCl3+3NaOH ==== Fe(OH)3↓+3NaCl,根据发生的上述两个反应即可确定只有D选项中的预测正确。
4.有一位学生将一小块钠投入到盛有煤油和水的试管中(煤油和水均足够多),想一想可能观察到的现象是( )
A.钠浮在试管中的液面上并四处游动
B.钠沉入试管底部
C.钠与水剧烈反应
D.钠处于煤油和水的交界处并可能作上、下跳动
【解析】选D。钠的密度比水的小,比煤油的大,所以钠会在煤油和水的交界处,当产生氢气时,氢气会托起钠,使钠离开水,钠表面的氢气逸出后,钠又会重新回到水中,作上、下跳动。
5. 将2.3 g钠放入97.7 g水中,形成的溶液中溶质的质量分数为( )
A.等于2.3% B.等于4%
C.大于2.3% D.大于4%
【解析】选D 。由方程式2Na+2H2O ==== 2NaOH+H2↑可得2.3 g 钠可生成NaOH的质量为4.0 g,生成氢气的质量为0.1 g。而溶液总质量= 钠的质量+ 水的质量-氢气的质量<100 g,所以质量分数大于4%。
【举一反三】将3.1 g Na2O投入到96.9 g水中或将3.9 g Na2O2投入到96.9 g水中形成的溶液中溶质的质量分数是多少?
提示:由Na2O+H2O ==== 2NaOH可知3.1 g Na2O可得氢氧化钠4.0 g,溶液总质量为100 g,所以质量分数等于4%;若为Na2O2,生成4.0 g氢氧化钠的同时,还生成了氧气0.8 g,故溶液的总质量为(3.9+96.9- 0.8) g,也为100 g,所以质量分数也等于4%。
6.下列各组中的两物质反应时,反应条件或反应物用量的改变对生成物没有影响的是( )
A.C与O2 B.Ca(OH)2与CO2
C.Na与O2 D.Na与H2O
【解析】选D。A项中氧气少量会生成CO,过量会生成CO2;B项中二氧化碳少量会生成碳酸钙,过量会生成碳酸氢钙;Na与O2反应在加热时生成过氧化钠,不加热则生成氧化钠;Na与H2O无论条件与试剂用量如何都是生成氢氧化钠与氢气。
二、非选择题(本题包括2小题,共26分)
7.(14分)(2011·宁波高一检测)过氧化钠保存不当容易变质。某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。
上图中的E和F构成量气装置,用来测定O2的体积。
(1)写出装置A和B中发生反应的化学方程式:
装置A:_______________________________________,
装置B:______________________________________。
(2)写出装置C中发生反应的化学方程式:__________。
(3)NaOH溶液的作用是_________________。
(4)他们在读出量筒内水的体积数后,折算成氧气的质量为m g,则样品中过氧化钠的质量分数为______________。
【解析】装置A用来制取二氧化碳气体,装置B用来吸收二氧化碳中混有的氯化氢气体。NaOH溶液的作用是吸收未反应的CO2,以便E、F装置测得的气体只有氧气。由反应2Na2O2+2CO2 ==== 2Na2CO3+O2,可求得过氧化钠的质量为39m/8 g,进而求得过氧化钠的质量分数为39m/8a。
答案:(1)CaCO3+2HCl ==== CaCl2+H2O+CO2↑
NaHCO3+HCl ==== NaCl+H2O+CO2↑
(2)2Na2O2+2CO2 ==== 2Na2CO3+O2
(3)吸收未反应的CO2
(4)39m/8a
8.(12分)(2011·北京海淀高一检测)钠在空气中燃烧
(如图)生成的固体产物物质中除有黄色粉末外,还有黑色
固体物质——炭。
(1)请假设黑色固体物质产生的原因可能是:
假设①煤油不完全燃烧得到;
假设②______________;
假设③酒精灯中的酒精不完全燃烧得到。
(2)为确认以上其中一种假设的正误,某同学进行如下推断:由于金属钠与氧的结合能力比碳强,因此黑色的炭可能是二氧化碳与金属钠发生置换反应而生成。该同学设计实验如下:
用打孔器钻取一段金属钠,取中间一小块
钠放在充满二氧化碳气体的玻璃管中加热
(如图),观察到钠燃烧发出黄色火焰,并
有黄色固体和黑色固体生成,生成的黄色
固体立即变成白色。请回答下列问题:
①用打孔器取金属钠的原因是____________;
②产生以上现象的化学反应方程式________________。
【解析】(1)黑色固体物质炭的来源可考虑与含碳元素有关
的物质:①煤油不完全燃烧得到;②酒精灯中的酒精不完
全燃烧得到;③产生的CO2与金属Na反应得到。(2)金属钠
易被氧化,故为证明上述③的原因,应取纯净的不被氧化
的钠,反应方程式可能为:2Na+CO2 C+Na2O2,
2Na2O2+2CO2 2Na2CO3+O2。
答案:(1)酒精燃烧产生的二氧化碳(或空气中的二氧化碳)
与金属钠反应生成的炭
(2)①取得较纯净的Na ②2Na+CO2 C+Na2O2,
2Na2O2+2CO2 2Na2CO3+O2
点燃
====
△
====
点燃
====
△
====
