11-12版高中化学课时讲练通配套课件:1.3.1物质的量及其单位——摩尔 摩尔质量(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:1.3.1物质的量及其单位——摩尔 摩尔质量(鲁科版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 00:00:00 | ||
图片预览










文档简介
(共47张PPT)
1.摩尔是一个物理量吗?
提示:“摩尔”是“物质的量”的单位,就像“米”是“长度”的单位一样,它不是物理量。
2.“物质的量”是表示“物质的质量”吗?
提示:“物质的量”与“物质的质量”是两个不同的概念,物质的量是物质所含微观粒子多少的一个物理量,研究对象为微观粒子;而物质的质量是描述物体所含物质多少的物理量,研究对象可以是宏观物质也可以是微观粒子。两者单位不同,物质的量的单位是摩尔,物质的质量的单位是千克或克。
3.请思考“1 mol大米”和“1 mol氧”这两种说法正确吗?为什么?
提示:摩尔是物质的量的单位,以摩尔为单位量度的对象可以是微观粒子,如原子、分子、离子、中子、质子、电子等,也可以是这些粒子的特定组合,但不能指宏观物质,因此“1 mol 大米”说法错误。在用“mol”时,物质要指明粒子的种类,如“1 mol O”表示1 mol氧原子,
“1 mol O2”表示1 mol 氧气分子,“1 mol O2-”表示
1 mol氧离子,而“1 mol氧”的说法是错误的,因为这里的氧指代不明确。
例1 下列关于物质的量的叙述正确的是
A.1 mol任何物质都含有6.02×1023个分子
B.0.012 kg 12C中含有6.02×1023个12C
C.1 mol CO2中含有2 mol氧和1 mol碳
D.1 mol H2O含有6.02×1023个氢原子
【规范解答】选B。因为有些物质是由分子组成(例如水、氯气等),有些物质是由离子组成[例如NaCl、Ca(OH)2等],还有些物质是由原子直接构成的(例如铁等),所以A的叙述是错误的;碳是由原子构成的,根据规定,
0.012 kg 12C中所含的碳原子数即为阿伏加德罗常数,其值为6.02×1023,所以B的叙述是对的;根据规定,“使用摩尔表示物质的量时,应该用化学式指明粒子的种类,而不是使用该粒子的中文名称”,C中表示CO2的组成时,氧、碳的含义不具体,所以也是不正确的;1 mol H2O含有
2 mol H,个数为2×6.02×1023,故D选项不对。
【互动探究】1 mol CO2含有多少摩尔O,含有多少个碳原子?
提示:1 mol CO2中有2 mol O、1 mol C,碳原子的个数N=n·NA=6.02×1023个。
1.“物质的量”是专有名词,是一个整体,不能拆开,不能理解成物质的多少,不能添字也不能减字。
2.使用物质的量时的注意事项
(1)适用范围:表示微观粒子或它们的特定组合。
(2)使用准则:必须指明微粒的种类。
(3)所含数目大:1 mol微粒所含微粒数巨大。
(4)应用范围极广:它是联系微粒个体与微粒集体、不可称量的反应微粒与可称量的宏观物质的桥梁。
1.物质的质量、摩尔质量、物质的相对分子(原子)质量有何区别与联系?
提示:物质的质量(m)是指物体所含物质多少的物理量,其单位为克或千克;摩尔质量(M)是指单位物质的量的物质所具有的质量,其单位为g/mol或kg/mol。它们之间可以通过公式m=n·M来换算;而物质的相对分子(原子)质量的单位为“1”;当摩尔质量以g/mol为单位时,其数值与物质的相对分子(原子)质量的数值相等。
2.1 mol Na的质量为23克,那么1 mol Na+的质量为多少?
提示:对于离子来说,由于电子的质量很小,当原子失去或得到电子变成离子时,电子的质量可以略去不计,故
1 mol Na 的质量为23克,1 mol Na+的质量还是23克。再如1 mol Cl-的质量是35.5克。
例2 下列说法正确的是
A.1 mol氯含有6.02×1023个微粒
B.6.02×1023 mol-1称为阿伏加德罗常数
C.钠的摩尔质量等于它的相对原子质量
D.H2O的摩尔质量是18 g
【规范解答】 选B。A项,使用摩尔表示物质的量时没有用化学式指明微粒的种类; B正确; C错在把摩尔质量与相对原子质量混同,应为钠的摩尔质量以g/mol为单位时,在数值上等于它的相对原子质量; D错在摩尔质量的单位,应为H2O的摩尔质量是18 g/mol。
【互动探究】6.02×1023个Cl2的质量是多少?
提示:由 则n(Cl2)=
=1 mol,再由n= ,m(Cl2)=n(Cl2)·M(Cl2)=
1 mol×71 g·mol-1=71 g。
1.离子的摩尔质量与原子、分子的一样,当以g/mol为单位时,在数值上等于它的相对原子(分子)质量。
2.对于纯净物来说,摩尔质量是一个确定值,而质量是随物质的多少而发生变化的,当物质是1 mol时,其质量与摩尔质量在数值上相等。
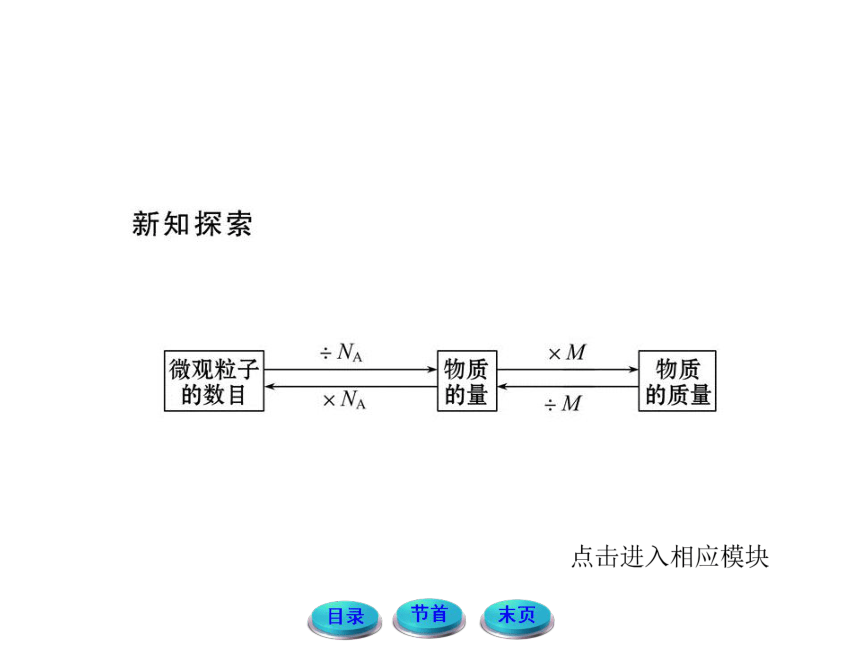
物质的质量、物质的量、微粒数之间的关系
物质的质量、物质的量、粒子数之间的关系表示如下:
在以上转化关系中,很容易看出,物质的量处于核心地位。可以说,物质的量是联系宏观物质的质量与微观粒子数的桥梁。
【示例】若50滴水正好是m g,请计算1滴水中所含分子的个数。
【解析】由题意知,1滴水的质量为 ,由H2O的摩尔质
量为18 g·mol-1得,1滴水的物质的量:n(H2O)=
所含的水分子数目为:N(H2O)=
6.02×1023=6.69m×1020。
答案:6.69m×1020
探究:
1.结合上例分析,如何由宏观物质的质量确定微粒个数
提示:先利用公式 确定物质的量的数值,再根据
N=nNA,求出微粒的个数。
2.如何确定1滴水中所含的氢原子或氧原子个数?
提示:计算分子中的原子、质子、电子等个数时,先分析一个分子中含几个原子、质子、电子。1个H2O中含2个氢原子、1个氧原子,则可知1滴水中所含的氢原子个数是水分子个数的2倍,氧原子个数与水分子个数相同。
3.怎样确定1个水分子的质量是多少?
提示:由于1个水分子的质量太小,无法直接称量,因此需
采用间接的方式。由示例可知m g水中含水分子数为6.02×1023,则每个水分子的质量为
= 。
1.下列对物质的量的理解正确的是( )
A.物质的量是一种基本物理量
B.物质的量就是物质的质量
C.物质的量就是1 mol物质的质量
D.可以用物质的量来描述苹果
【解析】选A。物质的量只适用于微观粒子,如原子、分子、离子、质子、电子及某些特定组合,不适用于宏观物质。
2.下列叙述中正确的是( )
A.相同物质的量的CO2和O3含有相同的原子个数
B.0.5 mol氢的质量是0.5 g
C.摩尔是用来衡量微观粒子多少的一种物理量
D.1 mol H2SO4中含有的氢原子数为6.02×1023
【解析】选A。1个CO2分子和1个O3分子中都含有3个原子,物质的量相同时,分子数相同,原子数相同,故A项正确;由于氢为元素名称,未指明是氢原子、氢分子还是氢离子,所以质量无法求算,故B项错误;摩尔是物质的量的单位,不是一种物理量,故C项错误;由于1 mol H2SO4中含有氢原子的物质的量为2 mol,阿伏加德罗常数为6.02× 1023 mol-1,则1 mol H2SO4中含有氢原子数为2 mol×6.02×
1023 mol-1=1.204×1024,故D项错误。
3.(双选)1 g O2和1 g O3中( )
A.所含分子数相同
B.所含分子数不同
C.所含原子数相同
D.1 g O3中所含分子数较多
【解析】选B、C。相同质量的物质,摩尔质量越小,物质的量越大,所含分子个数就越多。注意1 g O2和1 g O3中原子个数相等。
4.(2011·长沙高一检测)下列关于摩尔质量的叙述中正确的是( )
A.1 mol H2SO4的质量是98 g/mol
B.CO2的摩尔质量等于CO2的相对分子质量
C.0.012 kg 12C 里所含碳原子数为6.02×1023
D.二氧化碳的摩尔质量是44 g
【解析】选C。质量的单位为克或千克等,摩尔质量的单位为g/mol或kg/mol,当物质的摩尔质量以g/mol为单位时,在数值上等于其相对分子(或原子)质量,故A、B、D都错。
5.(NH4)2SO4 的摩尔质量是______,1 mol (NH4)2SO4 中含NH4+的物质的量为_______,所含NH4+的数目为_______。
【解析】(NH4)2SO4 的相对分子质量是132,故(NH4)2SO4 的摩尔质量是132 g/mol,1 mol (NH4)2SO4 中含2 mol NH4+,其数目为1.204×1024。
答案:132 g/mol 2 mol 1.204×1024
一、选择题(本题包括6小题,每小题4分,共24分)
1.地球上一切生命活动起源于水。下列有关水的物理量中,不随水的体积变化而变化的是( )
A.水的物质的量 B.水的摩尔质量
C.水的质量 D.所含水分子的数目
【解析】选B。物质的摩尔质量只与物质的种类有关,与物质的多少无关。
2.下列叙述错误的是( )
A.1 mol任何微粒所含有的微粒数为6.02×1023
B.0.012 kg 12C含有6.02×1023个电子
C.在使用物质的量时,应用化学式指明粒子的种类
D.物质的量是国际单位制中七个基本物理量之一
【解析】选B。0.012 kg 12C含有6.02×1023个12C,一个12C中含有6个电子,故0.012 kg 12C含有6×6.02×1023个电子。
3.下列说法正确的是( )
A.摩尔是物质的质量单位
B.6.02×1023就是阿伏加德罗常数
C.1 mol H3O+ 的质量是19 g
D.摩尔质量与1 mol该物质的质量相等
【解析】选C。摩尔是物质的量的单位,阿伏加德罗常数为6.02×1023 mol-1,当摩尔质量以g/mol为单位时,在数值上等于1 mol该物质的质量。
【规律方法】几个易混淆概念的辨析
(1)物质的量与摩尔:物质的量是用来计量物质所含微粒数的物理量,摩尔是其单位。
(2)摩尔质量与相对原子质量(或相对分子质量):摩尔质量是指单位物质的量的物质所具有的质量,它的单位为g·mol-1;相对原子质量(或相对分子质量)是一个相对质量,其单位为“1”,摩尔质量在以g·mol-1为单位时与相对原子质量(或相对分子质量)在数值上相等。
(3)质量与摩尔质量:质量是SI制中7个基本物理量之一,其单位是g或kg;摩尔质量是单位物质的量的物质所具有的质量,其单位为g·mol-1或kg·mol-1。二者可通过物质的量建立联系。
4.(2011·萍乡高一检测)相同质量的SO2和SO3,它们之间的关系是( )
A.所含硫原子的物质的量之比为1∶1
B.氧原子的物质的量之比为3∶2
C.所含硫原子的个数之比为5∶4
D.氧原子的个数之比为3∶2
【解析】选C。已知M(SO2)=64 g/mol ,M(SO3)=
80 g/mol,利用n=m/M的关系,可得n(SO2)=1/64 mol,
n(SO3)=1/80 mol,相同质量的SO2和SO3所含硫原子的物质的量之比为5∶4,个数之比也是5∶4,氧原子的物质的量之比为5∶6,个数之比也是5∶6。故选C。
5.已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是( )
A.64 g B.32 g
C.64 g/mol D.32 g/mol
【解析】选D。根据n=N/NA,计算出1.505×1023个X气体分子的物质的量为0.25 mol,结合其质量为8 g,利用n=m/M的关系,可得M(X)=32 g/mol。
6.(2011·临汾高一检测)W g H2O中含有n个氢原子,则阿伏加德罗常数的值为( )
A.9W/n B.9n/W
C.W/n D.n/W
【解析】选B。由n=m/M,n(H2O)=W/18 mol,则n(H)=W/9 mol,根据n=N/NA,计算出NA=9n/W mol-1,则阿伏加德罗常数的值为9n/W。
【举一反三】若将n个氢原子改为n个电子,则结果又
如何
提示:W g H2O的物质的量为 由于1个H2O分子中有
10个电子,则W g H2O中含有电子的物质的量为
故 。
二、非选择题(本题包括2小题,共26分)
7.(14分)(1)0.4 mol H3PO4 的质量是_____g, 24.5 g
H3PO4 的物质的量是_____mol;
(2)与29.4 g H2SO4所含氢原子数目相同的NH3的质量是
_______g。
【解析】(1)利用n=m/M,可得m(H3PO4)=0.4 mol×
98 g/mol=39.2 g,24.5 g H3PO4 的物质的量是0.25 mol。
(2)由n=m/M,n(H2SO4)= 0.3 mol,则n(H)=
0.6 mol,则n(NH3)= 0.2 mol,故m(NH3)= 3.4 g。
答案:(1)39.2 0.25 (2) 3.4
8.(12分)16 g R2O3的物质的量为0.1 mol,那么R2O3的摩尔质量为______,其中元素R的相对原子质量为______。
【解析】由n=m/M,得M(R2O3)=160 g/mol,Mr(R2O3)
=160,由相对分子质量的求法得,元素R的相对原子质量为56。
答案:160 g/mol 56
1.摩尔是一个物理量吗?
提示:“摩尔”是“物质的量”的单位,就像“米”是“长度”的单位一样,它不是物理量。
2.“物质的量”是表示“物质的质量”吗?
提示:“物质的量”与“物质的质量”是两个不同的概念,物质的量是物质所含微观粒子多少的一个物理量,研究对象为微观粒子;而物质的质量是描述物体所含物质多少的物理量,研究对象可以是宏观物质也可以是微观粒子。两者单位不同,物质的量的单位是摩尔,物质的质量的单位是千克或克。
3.请思考“1 mol大米”和“1 mol氧”这两种说法正确吗?为什么?
提示:摩尔是物质的量的单位,以摩尔为单位量度的对象可以是微观粒子,如原子、分子、离子、中子、质子、电子等,也可以是这些粒子的特定组合,但不能指宏观物质,因此“1 mol 大米”说法错误。在用“mol”时,物质要指明粒子的种类,如“1 mol O”表示1 mol氧原子,
“1 mol O2”表示1 mol 氧气分子,“1 mol O2-”表示
1 mol氧离子,而“1 mol氧”的说法是错误的,因为这里的氧指代不明确。
例1 下列关于物质的量的叙述正确的是
A.1 mol任何物质都含有6.02×1023个分子
B.0.012 kg 12C中含有6.02×1023个12C
C.1 mol CO2中含有2 mol氧和1 mol碳
D.1 mol H2O含有6.02×1023个氢原子
【规范解答】选B。因为有些物质是由分子组成(例如水、氯气等),有些物质是由离子组成[例如NaCl、Ca(OH)2等],还有些物质是由原子直接构成的(例如铁等),所以A的叙述是错误的;碳是由原子构成的,根据规定,
0.012 kg 12C中所含的碳原子数即为阿伏加德罗常数,其值为6.02×1023,所以B的叙述是对的;根据规定,“使用摩尔表示物质的量时,应该用化学式指明粒子的种类,而不是使用该粒子的中文名称”,C中表示CO2的组成时,氧、碳的含义不具体,所以也是不正确的;1 mol H2O含有
2 mol H,个数为2×6.02×1023,故D选项不对。
【互动探究】1 mol CO2含有多少摩尔O,含有多少个碳原子?
提示:1 mol CO2中有2 mol O、1 mol C,碳原子的个数N=n·NA=6.02×1023个。
1.“物质的量”是专有名词,是一个整体,不能拆开,不能理解成物质的多少,不能添字也不能减字。
2.使用物质的量时的注意事项
(1)适用范围:表示微观粒子或它们的特定组合。
(2)使用准则:必须指明微粒的种类。
(3)所含数目大:1 mol微粒所含微粒数巨大。
(4)应用范围极广:它是联系微粒个体与微粒集体、不可称量的反应微粒与可称量的宏观物质的桥梁。
1.物质的质量、摩尔质量、物质的相对分子(原子)质量有何区别与联系?
提示:物质的质量(m)是指物体所含物质多少的物理量,其单位为克或千克;摩尔质量(M)是指单位物质的量的物质所具有的质量,其单位为g/mol或kg/mol。它们之间可以通过公式m=n·M来换算;而物质的相对分子(原子)质量的单位为“1”;当摩尔质量以g/mol为单位时,其数值与物质的相对分子(原子)质量的数值相等。
2.1 mol Na的质量为23克,那么1 mol Na+的质量为多少?
提示:对于离子来说,由于电子的质量很小,当原子失去或得到电子变成离子时,电子的质量可以略去不计,故
1 mol Na 的质量为23克,1 mol Na+的质量还是23克。再如1 mol Cl-的质量是35.5克。
例2 下列说法正确的是
A.1 mol氯含有6.02×1023个微粒
B.6.02×1023 mol-1称为阿伏加德罗常数
C.钠的摩尔质量等于它的相对原子质量
D.H2O的摩尔质量是18 g
【规范解答】 选B。A项,使用摩尔表示物质的量时没有用化学式指明微粒的种类; B正确; C错在把摩尔质量与相对原子质量混同,应为钠的摩尔质量以g/mol为单位时,在数值上等于它的相对原子质量; D错在摩尔质量的单位,应为H2O的摩尔质量是18 g/mol。
【互动探究】6.02×1023个Cl2的质量是多少?
提示:由 则n(Cl2)=
=1 mol,再由n= ,m(Cl2)=n(Cl2)·M(Cl2)=
1 mol×71 g·mol-1=71 g。
1.离子的摩尔质量与原子、分子的一样,当以g/mol为单位时,在数值上等于它的相对原子(分子)质量。
2.对于纯净物来说,摩尔质量是一个确定值,而质量是随物质的多少而发生变化的,当物质是1 mol时,其质量与摩尔质量在数值上相等。
物质的质量、物质的量、微粒数之间的关系
物质的质量、物质的量、粒子数之间的关系表示如下:
在以上转化关系中,很容易看出,物质的量处于核心地位。可以说,物质的量是联系宏观物质的质量与微观粒子数的桥梁。
【示例】若50滴水正好是m g,请计算1滴水中所含分子的个数。
【解析】由题意知,1滴水的质量为 ,由H2O的摩尔质
量为18 g·mol-1得,1滴水的物质的量:n(H2O)=
所含的水分子数目为:N(H2O)=
6.02×1023=6.69m×1020。
答案:6.69m×1020
探究:
1.结合上例分析,如何由宏观物质的质量确定微粒个数
提示:先利用公式 确定物质的量的数值,再根据
N=nNA,求出微粒的个数。
2.如何确定1滴水中所含的氢原子或氧原子个数?
提示:计算分子中的原子、质子、电子等个数时,先分析一个分子中含几个原子、质子、电子。1个H2O中含2个氢原子、1个氧原子,则可知1滴水中所含的氢原子个数是水分子个数的2倍,氧原子个数与水分子个数相同。
3.怎样确定1个水分子的质量是多少?
提示:由于1个水分子的质量太小,无法直接称量,因此需
采用间接的方式。由示例可知m g水中含水分子数为6.02×1023,则每个水分子的质量为
= 。
1.下列对物质的量的理解正确的是( )
A.物质的量是一种基本物理量
B.物质的量就是物质的质量
C.物质的量就是1 mol物质的质量
D.可以用物质的量来描述苹果
【解析】选A。物质的量只适用于微观粒子,如原子、分子、离子、质子、电子及某些特定组合,不适用于宏观物质。
2.下列叙述中正确的是( )
A.相同物质的量的CO2和O3含有相同的原子个数
B.0.5 mol氢的质量是0.5 g
C.摩尔是用来衡量微观粒子多少的一种物理量
D.1 mol H2SO4中含有的氢原子数为6.02×1023
【解析】选A。1个CO2分子和1个O3分子中都含有3个原子,物质的量相同时,分子数相同,原子数相同,故A项正确;由于氢为元素名称,未指明是氢原子、氢分子还是氢离子,所以质量无法求算,故B项错误;摩尔是物质的量的单位,不是一种物理量,故C项错误;由于1 mol H2SO4中含有氢原子的物质的量为2 mol,阿伏加德罗常数为6.02× 1023 mol-1,则1 mol H2SO4中含有氢原子数为2 mol×6.02×
1023 mol-1=1.204×1024,故D项错误。
3.(双选)1 g O2和1 g O3中( )
A.所含分子数相同
B.所含分子数不同
C.所含原子数相同
D.1 g O3中所含分子数较多
【解析】选B、C。相同质量的物质,摩尔质量越小,物质的量越大,所含分子个数就越多。注意1 g O2和1 g O3中原子个数相等。
4.(2011·长沙高一检测)下列关于摩尔质量的叙述中正确的是( )
A.1 mol H2SO4的质量是98 g/mol
B.CO2的摩尔质量等于CO2的相对分子质量
C.0.012 kg 12C 里所含碳原子数为6.02×1023
D.二氧化碳的摩尔质量是44 g
【解析】选C。质量的单位为克或千克等,摩尔质量的单位为g/mol或kg/mol,当物质的摩尔质量以g/mol为单位时,在数值上等于其相对分子(或原子)质量,故A、B、D都错。
5.(NH4)2SO4 的摩尔质量是______,1 mol (NH4)2SO4 中含NH4+的物质的量为_______,所含NH4+的数目为_______。
【解析】(NH4)2SO4 的相对分子质量是132,故(NH4)2SO4 的摩尔质量是132 g/mol,1 mol (NH4)2SO4 中含2 mol NH4+,其数目为1.204×1024。
答案:132 g/mol 2 mol 1.204×1024
一、选择题(本题包括6小题,每小题4分,共24分)
1.地球上一切生命活动起源于水。下列有关水的物理量中,不随水的体积变化而变化的是( )
A.水的物质的量 B.水的摩尔质量
C.水的质量 D.所含水分子的数目
【解析】选B。物质的摩尔质量只与物质的种类有关,与物质的多少无关。
2.下列叙述错误的是( )
A.1 mol任何微粒所含有的微粒数为6.02×1023
B.0.012 kg 12C含有6.02×1023个电子
C.在使用物质的量时,应用化学式指明粒子的种类
D.物质的量是国际单位制中七个基本物理量之一
【解析】选B。0.012 kg 12C含有6.02×1023个12C,一个12C中含有6个电子,故0.012 kg 12C含有6×6.02×1023个电子。
3.下列说法正确的是( )
A.摩尔是物质的质量单位
B.6.02×1023就是阿伏加德罗常数
C.1 mol H3O+ 的质量是19 g
D.摩尔质量与1 mol该物质的质量相等
【解析】选C。摩尔是物质的量的单位,阿伏加德罗常数为6.02×1023 mol-1,当摩尔质量以g/mol为单位时,在数值上等于1 mol该物质的质量。
【规律方法】几个易混淆概念的辨析
(1)物质的量与摩尔:物质的量是用来计量物质所含微粒数的物理量,摩尔是其单位。
(2)摩尔质量与相对原子质量(或相对分子质量):摩尔质量是指单位物质的量的物质所具有的质量,它的单位为g·mol-1;相对原子质量(或相对分子质量)是一个相对质量,其单位为“1”,摩尔质量在以g·mol-1为单位时与相对原子质量(或相对分子质量)在数值上相等。
(3)质量与摩尔质量:质量是SI制中7个基本物理量之一,其单位是g或kg;摩尔质量是单位物质的量的物质所具有的质量,其单位为g·mol-1或kg·mol-1。二者可通过物质的量建立联系。
4.(2011·萍乡高一检测)相同质量的SO2和SO3,它们之间的关系是( )
A.所含硫原子的物质的量之比为1∶1
B.氧原子的物质的量之比为3∶2
C.所含硫原子的个数之比为5∶4
D.氧原子的个数之比为3∶2
【解析】选C。已知M(SO2)=64 g/mol ,M(SO3)=
80 g/mol,利用n=m/M的关系,可得n(SO2)=1/64 mol,
n(SO3)=1/80 mol,相同质量的SO2和SO3所含硫原子的物质的量之比为5∶4,个数之比也是5∶4,氧原子的物质的量之比为5∶6,个数之比也是5∶6。故选C。
5.已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是( )
A.64 g B.32 g
C.64 g/mol D.32 g/mol
【解析】选D。根据n=N/NA,计算出1.505×1023个X气体分子的物质的量为0.25 mol,结合其质量为8 g,利用n=m/M的关系,可得M(X)=32 g/mol。
6.(2011·临汾高一检测)W g H2O中含有n个氢原子,则阿伏加德罗常数的值为( )
A.9W/n B.9n/W
C.W/n D.n/W
【解析】选B。由n=m/M,n(H2O)=W/18 mol,则n(H)=W/9 mol,根据n=N/NA,计算出NA=9n/W mol-1,则阿伏加德罗常数的值为9n/W。
【举一反三】若将n个氢原子改为n个电子,则结果又
如何
提示:W g H2O的物质的量为 由于1个H2O分子中有
10个电子,则W g H2O中含有电子的物质的量为
故 。
二、非选择题(本题包括2小题,共26分)
7.(14分)(1)0.4 mol H3PO4 的质量是_____g, 24.5 g
H3PO4 的物质的量是_____mol;
(2)与29.4 g H2SO4所含氢原子数目相同的NH3的质量是
_______g。
【解析】(1)利用n=m/M,可得m(H3PO4)=0.4 mol×
98 g/mol=39.2 g,24.5 g H3PO4 的物质的量是0.25 mol。
(2)由n=m/M,n(H2SO4)= 0.3 mol,则n(H)=
0.6 mol,则n(NH3)= 0.2 mol,故m(NH3)= 3.4 g。
答案:(1)39.2 0.25 (2) 3.4
8.(12分)16 g R2O3的物质的量为0.1 mol,那么R2O3的摩尔质量为______,其中元素R的相对原子质量为______。
【解析】由n=m/M,得M(R2O3)=160 g/mol,Mr(R2O3)
=160,由相对分子质量的求法得,元素R的相对原子质量为56。
答案:160 g/mol 56
