11-12版高中化学课时讲练通配套课件:1.3.2气体摩尔体积(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:1.3.2气体摩尔体积(鲁科版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 00:00:00 | ||
图片预览











文档简介
(共52张PPT)
1.气体摩尔体积约为22.4 L/mol吗?
提示:气体摩尔体积是指在一定的温度和压强下,单位物质的量的气体所占的体积。不同条件下,气体摩尔体积的数值可能不同,在标准状况下,它约等于22.4 L/mol。注意:气体摩尔体积约等于22.4 L/mol时,不一定是标准状况。
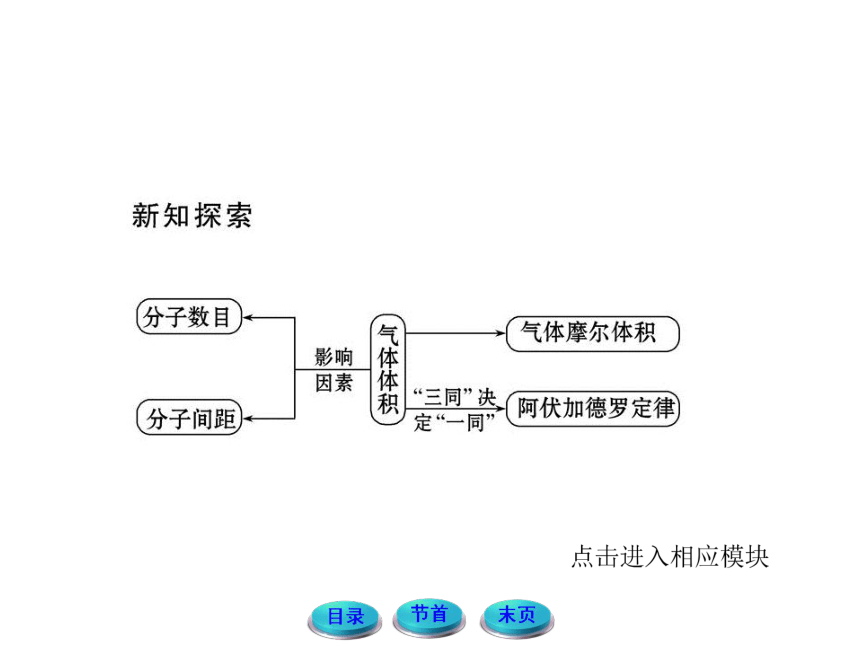
2.在一定的温度和压强下,1 mol任何气体的体积都基本相等吗?
提示:物质的体积主要决定于微粒的多少、微粒的大小、微粒之间的距离。对于固体和液体,由于微粒间的距离很小,1 mol物质的体积主要决定于微粒的大小。对于气体来说,常温、常压下,分子的平均距离比分子直径大得多,分子的体积可以忽略不计,即与气体的分子种类无关,故
1 mol气体的体积决定于气体分子间的距离,而分子间的距离主要由温度和压强决定,所以在一定的温度和压强下,
1 mol任何气体的体积都基本相等。
3.比较气体的体积大小时,为什么要在相同的温度、压强下进行?
提示:因为气体的体积受温度、压强的影响很大,升高温度和减小压强,气体体积增大,反之,气体体积减小。故比较气体体积时必须在相同的温度和压强下进行。
例1 设NA为阿伏加德罗常数的数值,下列说法中正确的是
A.常温常压下,11.2 L Cl2中含有NA个氯原子
B.标准状况下,22.4 L H2O中含有NA个水分子
C.标准状况下,46 g金属钠与水反应生成H2约22.4 L
D.20℃,101 kPa时,NA个甲烷分子的体积仍然约为
22.4 L
【规范解答】选C。A选项,常温常压下,11.2 L Cl2不是0.5 mol,故不含有NA个氯原子;B选项,标准状况下,H2O不是气体;D选项,20℃,101 kPa时,NA个甲烷分子的体积比22.4 L大。
【互动探究】常温常压下,0.5 mol Cl2、35.5 g
Cl2、3.01×1023个Cl2分子中都含有NA个氯原子吗?
提示:当气体多少用体积表示时,要注意其条件,而当用物质的量、质量、个数表示时,因为这些量不受温度、压强等外界因素的影响,所以与所处的条件无关。故常温常压下,0.5 mol Cl2、35.5 g Cl2、3.01×1023个Cl2分子中都含有NA个氯原子。
1.气体摩尔体积是不确定值,只有当温度、压强确定时,气体摩尔体积才是定值,0℃,101 kPa时,Vm =
22.4 L/mol。
2.当气体用体积表示时,要注意温度、压强等条件,而当用物质的量、质量、个数表示时,不用考虑温度、压强等条件。
3.当用公式n=V/Vm来计算时,要注意所给物质在标准状况下是否为气体,若不是气体,不能使用此公式。
1.在常温常压下,气体分子之间的距离大小与分子本身的大小有何关系?
提示:气体分子很小,分子本身的大小远小于气体分子间的距离。
2.相同温度和压强下,不同气体分子间的距离有何关系?
提示:同温同压下,不同气体分子间的平均距离几乎相同。
3.结合气体体积的影响因素,思考分析“若两种气体体积相同,所含分子数也一定相同”的说法是否正确?
提示:不一定,因为气体体积受温度和压强的影响较大,若温度和压强不同时,体积相同的两种气体的物质的量不一定相同,故所含的分子数也不一定相同。
例2 同温同压下,A容器中H2和B容器中NH3所含氢原子数相等,则两个容器的体积比是
A.3∶2 B.1∶3 C.2∶3 D.1∶2
【规范解答】选A。1 mol H2含氢原子2 mol,1 mol NH3含氢原子3 mol,若H2和NH3所含氢原子数相等,则H2和NH3的物质的量之比为3∶2,同温同压下气体的体积比等于其物质的量之比,两容器的体积比是3∶2。
【互动探究】若改为A容器中H2与B容器中NH3所含原子总数相同,则两个容器的体积比是多少?
提示:当原子总数相等时,n(H2)∶n(NH3)=2∶1,根据T、p相同时,V与n成正比,则V(A)∶V(B)=2∶1。
对于阿伏加德罗定律的理解要明确两点
(1)阿伏加德罗定律仅适用于气体,可以是单一气体,也可以是混合气体。
(2)阿伏加德罗定律可以概括为“三同”定“一同”,即同温、同压、同体积决定相同的分子个数。另外这四个量中只要有三个量相同,另一个量也相同。
阿伏加德罗定律的应用及其重要推论
阿伏加德罗定律及其推论是进行气体计算的依据,要灵活运用,注意结合质量守恒定律和相关概念及公式进行换算。
探究:
1.请结合阿伏加德罗定律讨论同温同压同体积的O2和O3的分子数相同吗?能说原子数目也相同吗?
提示:由阿伏加德罗定律可知,同温同压下,体积相同的O2和O3分子数相同,又因为每个O2分子中有两个氧原子,每个O3分子中有三个氧原子,所以同温同压下,体积相同的O2和O3,原子数目不同。
2.推论一:同温同压下,气体的体积与物质的量成正比,
表达式: (T、p相同),请结合该推论求算:同温同
压下,质量相等的N2和CO2的体积之比。
提示:由推论一可知:同温同压下要求气体体积比,可以
先求出气体的物质的量之比,假设N2和CO2的质量均为1 g。
T、p相同,
3.推论二:同温同压下,气体的密度与其摩尔质量成正比,即: (T、p相同),已知在两个密闭容器中,分
别充有质量相同的甲、乙两种气体,若两容器T、p均相
同,且ρ甲>ρ乙,试判断下列说法的正误:
(1)甲的分子数比乙的分子数多
(2)甲的气体摩尔体积比乙的气体摩尔体积小
(3)甲的摩尔质量比乙的摩尔质量小
提示:(1)、(2)、(3)说法都错。分析题意:同T同p,ρ甲>ρ乙可推知M甲>M乙;又因m甲=m乙,可知n甲<
n乙,即甲的分子数比乙的分子数少;同T同p,气体摩尔体积相同,所以甲的气体摩尔体积等于乙的气体摩尔体积。
1.下列有关物理量相应的单位,表达错误的是( )
A.摩尔质量 g/mol B.气体摩尔体积 L/mol
C.阿伏加德罗常数 个 D.密度 g/cm3
【解析】选C。阿伏加德罗常数为6.02×1023 mol-1,单位是mol-1。
2.NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.80 g硝酸铵中含有氮原子数为NA
B.在常温常压下,11.2 L CO2含有的分子数为0.5NA
C.2 mol金属铝与足量的盐酸反应,得到气体的分子数为2NA
D.16 g氧气和16 g臭氧所含的原子数均为NA
【解析】选D。A项中,80 g硝酸铵中含有2 mol氮原子, 氮原子数为2NA ;B项中,在常温常压下,11.2 L CO2不是
0.5 mol;C项中,2 mol Al与足量的盐酸反应,生成3 mol
H2,分子数为3NA,C项错误;D项中,16 g氧气和16 g臭
氧所含的氧原子都是1 mol。
3.下列说法中,正确的是( )
A.1 mol某气体的体积是22.4 L,该气体所处的状况不一定是标准状况
B.非标准状况下,1 mol O2的体积必定不是22.4 L
C.某物质含有阿伏加德罗常数个微粒,该物质在标准状况下的体积为22.4 L
D.标准状况下,1 mol H2和O2的混合气体的体积不一定为22.4 L
【解析】选A。标准状况下,气体摩尔体积约等于
22.4 L/mol,但1 mol气体体积等于22.4 L时,不一定是标准状况,故A正确;非标准状况下,1 mol O2的体积也可能是22.4 L,故B不正确;若物质为固体或液体,则C说法不正确,即使是气体,C说法也可能不正确,如含有1 mol Cl的氯气,在标准状况下的体积为11.2 L;标准状况下,
1 mol任何气体的体积都约等于22.4 L,不管是单一气体还是混合气体。
4.(2011·福州高一检测)下列物质中,与0.1 mol H2O含相同氢原子数的物质是( )
A.0.3 mol HNO3 B.0.1NA个H3PO4分子
C.2.4 g CH4 D.标准状况下4.48 L HCl
【解析】选D。0.1 mol H2O含氢原子的物质的量为
0.2 mol。A中0.3 mol HNO3含有0.3 mol氢原子;B中0.1NA个H3PO4分子含有0.3 mol氢原子;C中2.4 g CH4含有0.6 mol氢原子;D中标准状况下4.48 L HCl含有0.2 mol氢原子。
5.已知在标准状况下的四种气体①6.72 L CH4 ②3.01×
1023个HCl分子 ③13.6 g H2S ④0.2 mol NH3
用相应的序号填写下列空白:
(1)体积最大的是_____;(2)密度最大的是_____;
(3)质量最小的是_____;(4)含氢原子数最少的是
_____。
【解析】 计算密度时,根据 可知,ρ与M成正比,
故HCl的密度最大。
答案:(1)② (2)② (3)④ (4)②
一、选择题(本题包括6小题,每小题4分,共24分)
1.若NA表示阿伏加德罗常数,下列说法正确的是( )
A.5.6 L Cl2含有的原子数为0.5NA
B.在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C.14 g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol CH4的质量比为7∶4
【解析】选C。 A中Cl2未指明气体所处的条件;B中在
0 ℃,101 kPa时,22.4 L氢气中含有2NA个氢原子;D中NA个一氧化碳分子和0.5 mol CH4的质量比为28∶8=7∶2。
2.某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的是( )
A.有1个氧原子 B.有2个氧原子
C.有1个A原子 D.有2个A原子
【解析】选A。据题意,B的体积为反应掉O2体积的2倍(同温同压),据阿伏加德罗定律,B分子数为O2分子数的 2倍,由氧原子守恒可知,B分子中一定有1个氧原子。
3.(2011·牡丹江高一检测)设NA为阿伏加德罗常数,下列说法不正确的是( )
A.1.7 g H2O2中含有的电子数为0.9NA
B.1 mol O3和1.5 mol O2含有相同的氧原子数
C.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.等物质的量的N2和CO所含分子数均为NA
【解析】选D。此题考查了阿伏加德罗常数的知识。H2O2的
相对分子质量为34,故1.7 g的H2O2的物质的量为
0.05 mol,每个分子中含有的电子为18个,则1.7 g中含有
的电子的物质的量为0.9 mol,数目为0.9NA,A对;1 mol
O3和1.5 mol O2含有相同的氧原子数,都是3NA,B对;标准
状况下,22.4 L任何气体的物质的量为1 mol,分子数为
NA,C对;阿伏加德罗常数是指1 mol任何微粒中含有的微粒
数,等物质的量不一定是1 mol,D错。
4.下列各物质中所含原子个数由多到少的顺序正确的是
( )
①0.5 mol NH3;②标准状况下22.4 L氦气;
③4℃时9 mL水;④0.2 mol H3PO4
A.①④③② B.④③②①
C.②③④① D.①④②③
【解析】选 A。四种物质中含分子的物质的量分别是
0.5 mol、1 mol、0.5 mol、0.2 mol,要注意He为单原子分子,所以四种物质中含原子的物质的量分别是2 mol、
1 mol、1.5 mol、1.6 mol。所以答案为①④③②。
【举一反三】若将题干改为:下列物质的质量由大到
小的顺序,怎样排列?
提示:先将各物质都换算成物质的量,再根据各物质的摩尔质量进行计算。
①为8.5 g ②为4 g ③为9 g ④为19.6 g
答案为④③①②。
5.(2011·泰安高一检测)设阿伏加德罗常数的值为NA,
标准状况下某种O2和N2的混合气体m g含有b个分子,则n g
该混合气体在相同状况下所占的体积(L)应是( )
【解析】选A。m g O2和N2的混合气体含有b个分子,则n g
该混合气体的分子数为 该混合气体的物质的量为
该混合气体的体积为 。
6.有CO与CO2的混合气体共33.6 L,其密度为1.726 g/L,已知混合气体共有9.03×1023个分子,则该混合气体的平均摩尔质量是( )
A.58.00 g/mol B.36.09 g/mol
C.36.00 g/mol D.38.67 g/mol
【解析】选D。 m(总)=1.726 g/L×33.6 L≈58 g
n(总)=N÷NA=9.03×1023÷6.02×1023mol-1=1.5 mol
平均摩尔质量=m(总)÷n(总)=58 g÷1.5 mol≈
38.67 g/mol。
【规律方法】平均摩尔质量的求法
(1)已知混合物的总质量[m(混)]和总物质的量
[n(混)],则
(2)已知标准状况下混合气体的密度[ρ(混)],则
=22.4 L·mol-1·ρ(混)
(3)已知同温、同压下混合气体的密度是一种简单气体A的
密度的D倍(混合气体对气体A的相对密度为D),则
=D×M(A)。
(4)已知混合物中各组分的摩尔质量和其物质的量分数
(n1%、n2%……)则:
二、非选择题(本题包括2小题,共26分)
7.(10分)(2011·沈阳高一检测)(1)同温、同压下,实验测得CO、N2和O2三种气体的混合气体密度是H2的14.5倍,其中O2的质量分数为_____。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为_____。
(2)相同条件下,某Cl2与O2的混合气体100 mL恰好与
150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积
比为______,混合气体的平均相对分子质量为______。
【解析】(1)三种气体的平均相对分子质量为14.5×2 =29,因CO与N2的相对分子质量相同,求算平均相对分子质量时可一并考虑,设O2的物质的量分数为x,则CO和N2
的物质的量分数为(1-x),因此有:32x+28(1-x)
=29,解得x=0.25。O2的质量分数为 ≈27.6%。
若CO和N2的物质的量之比为1∶1,设混合气体为1 mol,则
混合气体中氧元素的物质的量为:0.25 mol×2+(0.75 mol
÷2)×1=0.875 mol,氧元素的质量分数为
≈48.3%。
(2)设Cl2的体积为x mL,则O2的体积为(100-x)mL。
根据反应H2+Cl2 2HCl、2H2+O2 2H2O知,反应
中消耗的H2为:x mL+2×(100-x)mL=150 mL,解得x=
50 mL。因此n(Cl2)∶n(O2)=1∶1。体积百分含量各占
50%。混合气体的平均相对分子质量为:71×50%+32×
50%=51.5。
答案:(1)27.6% 48.3% (2)1∶1 51.5
点燃
====
点燃
====
8.(16分)探究气体摩尔体积问题:
A.实验探究:
(1)电解水实验:不同时间阶段生成的O2和H2的体积比各约为______。
(2)假设电解了1.8 g H2O,根据方程式计算生成的O2 、H2的质量及物质的量。
B.计算验证:
下表列出了0℃、101 kPa(标准状况下)O2 和H2 的密度,计算1 mol O2和1 mol H2的体积。
结论:在相同温度和压强下,1 mol O2和1 mol H2的体积基本______。(填“相同”或“不同”)
C.观察分析:
结论1:同温同压下,1 mol不同的固态或液态物质,体积
_______。(填“相同”或“不同”)
结论2:同温同压下,1 mol任何气体的体积均约______。(填“相同”或“不同”)
D.理论解释:
物质的体积大小取决于构成这种物质的______、______和
______三个因素。
(1)1 mol 不同的固态物质和液态物质所含的______相
同,而粒子间距_____,使得固体和液体物质的体积主要取决于_____。但因粒子的大小是______的,所以1 mol不同的固态物质和液态物质的体积______。
(2)对于气体,粒子间的距离______粒子本身的直径,所以,当气体所含粒子数相同时,气体体积主要取决于_____。同温同压下任何气体粒子间距可以看成是______的,因此1 mol任何气体的体积_____。
【解析】本题通过实验探究、计算验证、观察分析、理论解释等过程,一步步总结出同温同压下,1 mol任何气体的体积都相同的结论。
答案:A:(1)1︰2 (2)1.6 0.05 0.2 0.1
n(O2)︰n(H2)= 1︰2
B:22.25 22.39 相同
C:不同 相同
D:粒子数目 粒子大小 粒子间的距离
(1)粒子数 非常小 粒子大小 不同 不同
(2)远远大于 气体粒子间距离 相等 相同
1.气体摩尔体积约为22.4 L/mol吗?
提示:气体摩尔体积是指在一定的温度和压强下,单位物质的量的气体所占的体积。不同条件下,气体摩尔体积的数值可能不同,在标准状况下,它约等于22.4 L/mol。注意:气体摩尔体积约等于22.4 L/mol时,不一定是标准状况。
2.在一定的温度和压强下,1 mol任何气体的体积都基本相等吗?
提示:物质的体积主要决定于微粒的多少、微粒的大小、微粒之间的距离。对于固体和液体,由于微粒间的距离很小,1 mol物质的体积主要决定于微粒的大小。对于气体来说,常温、常压下,分子的平均距离比分子直径大得多,分子的体积可以忽略不计,即与气体的分子种类无关,故
1 mol气体的体积决定于气体分子间的距离,而分子间的距离主要由温度和压强决定,所以在一定的温度和压强下,
1 mol任何气体的体积都基本相等。
3.比较气体的体积大小时,为什么要在相同的温度、压强下进行?
提示:因为气体的体积受温度、压强的影响很大,升高温度和减小压强,气体体积增大,反之,气体体积减小。故比较气体体积时必须在相同的温度和压强下进行。
例1 设NA为阿伏加德罗常数的数值,下列说法中正确的是
A.常温常压下,11.2 L Cl2中含有NA个氯原子
B.标准状况下,22.4 L H2O中含有NA个水分子
C.标准状况下,46 g金属钠与水反应生成H2约22.4 L
D.20℃,101 kPa时,NA个甲烷分子的体积仍然约为
22.4 L
【规范解答】选C。A选项,常温常压下,11.2 L Cl2不是0.5 mol,故不含有NA个氯原子;B选项,标准状况下,H2O不是气体;D选项,20℃,101 kPa时,NA个甲烷分子的体积比22.4 L大。
【互动探究】常温常压下,0.5 mol Cl2、35.5 g
Cl2、3.01×1023个Cl2分子中都含有NA个氯原子吗?
提示:当气体多少用体积表示时,要注意其条件,而当用物质的量、质量、个数表示时,因为这些量不受温度、压强等外界因素的影响,所以与所处的条件无关。故常温常压下,0.5 mol Cl2、35.5 g Cl2、3.01×1023个Cl2分子中都含有NA个氯原子。
1.气体摩尔体积是不确定值,只有当温度、压强确定时,气体摩尔体积才是定值,0℃,101 kPa时,Vm =
22.4 L/mol。
2.当气体用体积表示时,要注意温度、压强等条件,而当用物质的量、质量、个数表示时,不用考虑温度、压强等条件。
3.当用公式n=V/Vm来计算时,要注意所给物质在标准状况下是否为气体,若不是气体,不能使用此公式。
1.在常温常压下,气体分子之间的距离大小与分子本身的大小有何关系?
提示:气体分子很小,分子本身的大小远小于气体分子间的距离。
2.相同温度和压强下,不同气体分子间的距离有何关系?
提示:同温同压下,不同气体分子间的平均距离几乎相同。
3.结合气体体积的影响因素,思考分析“若两种气体体积相同,所含分子数也一定相同”的说法是否正确?
提示:不一定,因为气体体积受温度和压强的影响较大,若温度和压强不同时,体积相同的两种气体的物质的量不一定相同,故所含的分子数也不一定相同。
例2 同温同压下,A容器中H2和B容器中NH3所含氢原子数相等,则两个容器的体积比是
A.3∶2 B.1∶3 C.2∶3 D.1∶2
【规范解答】选A。1 mol H2含氢原子2 mol,1 mol NH3含氢原子3 mol,若H2和NH3所含氢原子数相等,则H2和NH3的物质的量之比为3∶2,同温同压下气体的体积比等于其物质的量之比,两容器的体积比是3∶2。
【互动探究】若改为A容器中H2与B容器中NH3所含原子总数相同,则两个容器的体积比是多少?
提示:当原子总数相等时,n(H2)∶n(NH3)=2∶1,根据T、p相同时,V与n成正比,则V(A)∶V(B)=2∶1。
对于阿伏加德罗定律的理解要明确两点
(1)阿伏加德罗定律仅适用于气体,可以是单一气体,也可以是混合气体。
(2)阿伏加德罗定律可以概括为“三同”定“一同”,即同温、同压、同体积决定相同的分子个数。另外这四个量中只要有三个量相同,另一个量也相同。
阿伏加德罗定律的应用及其重要推论
阿伏加德罗定律及其推论是进行气体计算的依据,要灵活运用,注意结合质量守恒定律和相关概念及公式进行换算。
探究:
1.请结合阿伏加德罗定律讨论同温同压同体积的O2和O3的分子数相同吗?能说原子数目也相同吗?
提示:由阿伏加德罗定律可知,同温同压下,体积相同的O2和O3分子数相同,又因为每个O2分子中有两个氧原子,每个O3分子中有三个氧原子,所以同温同压下,体积相同的O2和O3,原子数目不同。
2.推论一:同温同压下,气体的体积与物质的量成正比,
表达式: (T、p相同),请结合该推论求算:同温同
压下,质量相等的N2和CO2的体积之比。
提示:由推论一可知:同温同压下要求气体体积比,可以
先求出气体的物质的量之比,假设N2和CO2的质量均为1 g。
T、p相同,
3.推论二:同温同压下,气体的密度与其摩尔质量成正比,即: (T、p相同),已知在两个密闭容器中,分
别充有质量相同的甲、乙两种气体,若两容器T、p均相
同,且ρ甲>ρ乙,试判断下列说法的正误:
(1)甲的分子数比乙的分子数多
(2)甲的气体摩尔体积比乙的气体摩尔体积小
(3)甲的摩尔质量比乙的摩尔质量小
提示:(1)、(2)、(3)说法都错。分析题意:同T同p,ρ甲>ρ乙可推知M甲>M乙;又因m甲=m乙,可知n甲<
n乙,即甲的分子数比乙的分子数少;同T同p,气体摩尔体积相同,所以甲的气体摩尔体积等于乙的气体摩尔体积。
1.下列有关物理量相应的单位,表达错误的是( )
A.摩尔质量 g/mol B.气体摩尔体积 L/mol
C.阿伏加德罗常数 个 D.密度 g/cm3
【解析】选C。阿伏加德罗常数为6.02×1023 mol-1,单位是mol-1。
2.NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.80 g硝酸铵中含有氮原子数为NA
B.在常温常压下,11.2 L CO2含有的分子数为0.5NA
C.2 mol金属铝与足量的盐酸反应,得到气体的分子数为2NA
D.16 g氧气和16 g臭氧所含的原子数均为NA
【解析】选D。A项中,80 g硝酸铵中含有2 mol氮原子, 氮原子数为2NA ;B项中,在常温常压下,11.2 L CO2不是
0.5 mol;C项中,2 mol Al与足量的盐酸反应,生成3 mol
H2,分子数为3NA,C项错误;D项中,16 g氧气和16 g臭
氧所含的氧原子都是1 mol。
3.下列说法中,正确的是( )
A.1 mol某气体的体积是22.4 L,该气体所处的状况不一定是标准状况
B.非标准状况下,1 mol O2的体积必定不是22.4 L
C.某物质含有阿伏加德罗常数个微粒,该物质在标准状况下的体积为22.4 L
D.标准状况下,1 mol H2和O2的混合气体的体积不一定为22.4 L
【解析】选A。标准状况下,气体摩尔体积约等于
22.4 L/mol,但1 mol气体体积等于22.4 L时,不一定是标准状况,故A正确;非标准状况下,1 mol O2的体积也可能是22.4 L,故B不正确;若物质为固体或液体,则C说法不正确,即使是气体,C说法也可能不正确,如含有1 mol Cl的氯气,在标准状况下的体积为11.2 L;标准状况下,
1 mol任何气体的体积都约等于22.4 L,不管是单一气体还是混合气体。
4.(2011·福州高一检测)下列物质中,与0.1 mol H2O含相同氢原子数的物质是( )
A.0.3 mol HNO3 B.0.1NA个H3PO4分子
C.2.4 g CH4 D.标准状况下4.48 L HCl
【解析】选D。0.1 mol H2O含氢原子的物质的量为
0.2 mol。A中0.3 mol HNO3含有0.3 mol氢原子;B中0.1NA个H3PO4分子含有0.3 mol氢原子;C中2.4 g CH4含有0.6 mol氢原子;D中标准状况下4.48 L HCl含有0.2 mol氢原子。
5.已知在标准状况下的四种气体①6.72 L CH4 ②3.01×
1023个HCl分子 ③13.6 g H2S ④0.2 mol NH3
用相应的序号填写下列空白:
(1)体积最大的是_____;(2)密度最大的是_____;
(3)质量最小的是_____;(4)含氢原子数最少的是
_____。
【解析】 计算密度时,根据 可知,ρ与M成正比,
故HCl的密度最大。
答案:(1)② (2)② (3)④ (4)②
一、选择题(本题包括6小题,每小题4分,共24分)
1.若NA表示阿伏加德罗常数,下列说法正确的是( )
A.5.6 L Cl2含有的原子数为0.5NA
B.在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C.14 g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol CH4的质量比为7∶4
【解析】选C。 A中Cl2未指明气体所处的条件;B中在
0 ℃,101 kPa时,22.4 L氢气中含有2NA个氢原子;D中NA个一氧化碳分子和0.5 mol CH4的质量比为28∶8=7∶2。
2.某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的是( )
A.有1个氧原子 B.有2个氧原子
C.有1个A原子 D.有2个A原子
【解析】选A。据题意,B的体积为反应掉O2体积的2倍(同温同压),据阿伏加德罗定律,B分子数为O2分子数的 2倍,由氧原子守恒可知,B分子中一定有1个氧原子。
3.(2011·牡丹江高一检测)设NA为阿伏加德罗常数,下列说法不正确的是( )
A.1.7 g H2O2中含有的电子数为0.9NA
B.1 mol O3和1.5 mol O2含有相同的氧原子数
C.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.等物质的量的N2和CO所含分子数均为NA
【解析】选D。此题考查了阿伏加德罗常数的知识。H2O2的
相对分子质量为34,故1.7 g的H2O2的物质的量为
0.05 mol,每个分子中含有的电子为18个,则1.7 g中含有
的电子的物质的量为0.9 mol,数目为0.9NA,A对;1 mol
O3和1.5 mol O2含有相同的氧原子数,都是3NA,B对;标准
状况下,22.4 L任何气体的物质的量为1 mol,分子数为
NA,C对;阿伏加德罗常数是指1 mol任何微粒中含有的微粒
数,等物质的量不一定是1 mol,D错。
4.下列各物质中所含原子个数由多到少的顺序正确的是
( )
①0.5 mol NH3;②标准状况下22.4 L氦气;
③4℃时9 mL水;④0.2 mol H3PO4
A.①④③② B.④③②①
C.②③④① D.①④②③
【解析】选 A。四种物质中含分子的物质的量分别是
0.5 mol、1 mol、0.5 mol、0.2 mol,要注意He为单原子分子,所以四种物质中含原子的物质的量分别是2 mol、
1 mol、1.5 mol、1.6 mol。所以答案为①④③②。
【举一反三】若将题干改为:下列物质的质量由大到
小的顺序,怎样排列?
提示:先将各物质都换算成物质的量,再根据各物质的摩尔质量进行计算。
①为8.5 g ②为4 g ③为9 g ④为19.6 g
答案为④③①②。
5.(2011·泰安高一检测)设阿伏加德罗常数的值为NA,
标准状况下某种O2和N2的混合气体m g含有b个分子,则n g
该混合气体在相同状况下所占的体积(L)应是( )
【解析】选A。m g O2和N2的混合气体含有b个分子,则n g
该混合气体的分子数为 该混合气体的物质的量为
该混合气体的体积为 。
6.有CO与CO2的混合气体共33.6 L,其密度为1.726 g/L,已知混合气体共有9.03×1023个分子,则该混合气体的平均摩尔质量是( )
A.58.00 g/mol B.36.09 g/mol
C.36.00 g/mol D.38.67 g/mol
【解析】选D。 m(总)=1.726 g/L×33.6 L≈58 g
n(总)=N÷NA=9.03×1023÷6.02×1023mol-1=1.5 mol
平均摩尔质量=m(总)÷n(总)=58 g÷1.5 mol≈
38.67 g/mol。
【规律方法】平均摩尔质量的求法
(1)已知混合物的总质量[m(混)]和总物质的量
[n(混)],则
(2)已知标准状况下混合气体的密度[ρ(混)],则
=22.4 L·mol-1·ρ(混)
(3)已知同温、同压下混合气体的密度是一种简单气体A的
密度的D倍(混合气体对气体A的相对密度为D),则
=D×M(A)。
(4)已知混合物中各组分的摩尔质量和其物质的量分数
(n1%、n2%……)则:
二、非选择题(本题包括2小题,共26分)
7.(10分)(2011·沈阳高一检测)(1)同温、同压下,实验测得CO、N2和O2三种气体的混合气体密度是H2的14.5倍,其中O2的质量分数为_____。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为_____。
(2)相同条件下,某Cl2与O2的混合气体100 mL恰好与
150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积
比为______,混合气体的平均相对分子质量为______。
【解析】(1)三种气体的平均相对分子质量为14.5×2 =29,因CO与N2的相对分子质量相同,求算平均相对分子质量时可一并考虑,设O2的物质的量分数为x,则CO和N2
的物质的量分数为(1-x),因此有:32x+28(1-x)
=29,解得x=0.25。O2的质量分数为 ≈27.6%。
若CO和N2的物质的量之比为1∶1,设混合气体为1 mol,则
混合气体中氧元素的物质的量为:0.25 mol×2+(0.75 mol
÷2)×1=0.875 mol,氧元素的质量分数为
≈48.3%。
(2)设Cl2的体积为x mL,则O2的体积为(100-x)mL。
根据反应H2+Cl2 2HCl、2H2+O2 2H2O知,反应
中消耗的H2为:x mL+2×(100-x)mL=150 mL,解得x=
50 mL。因此n(Cl2)∶n(O2)=1∶1。体积百分含量各占
50%。混合气体的平均相对分子质量为:71×50%+32×
50%=51.5。
答案:(1)27.6% 48.3% (2)1∶1 51.5
点燃
====
点燃
====
8.(16分)探究气体摩尔体积问题:
A.实验探究:
(1)电解水实验:不同时间阶段生成的O2和H2的体积比各约为______。
(2)假设电解了1.8 g H2O,根据方程式计算生成的O2 、H2的质量及物质的量。
B.计算验证:
下表列出了0℃、101 kPa(标准状况下)O2 和H2 的密度,计算1 mol O2和1 mol H2的体积。
结论:在相同温度和压强下,1 mol O2和1 mol H2的体积基本______。(填“相同”或“不同”)
C.观察分析:
结论1:同温同压下,1 mol不同的固态或液态物质,体积
_______。(填“相同”或“不同”)
结论2:同温同压下,1 mol任何气体的体积均约______。(填“相同”或“不同”)
D.理论解释:
物质的体积大小取决于构成这种物质的______、______和
______三个因素。
(1)1 mol 不同的固态物质和液态物质所含的______相
同,而粒子间距_____,使得固体和液体物质的体积主要取决于_____。但因粒子的大小是______的,所以1 mol不同的固态物质和液态物质的体积______。
(2)对于气体,粒子间的距离______粒子本身的直径,所以,当气体所含粒子数相同时,气体体积主要取决于_____。同温同压下任何气体粒子间距可以看成是______的,因此1 mol任何气体的体积_____。
【解析】本题通过实验探究、计算验证、观察分析、理论解释等过程,一步步总结出同温同压下,1 mol任何气体的体积都相同的结论。
答案:A:(1)1︰2 (2)1.6 0.05 0.2 0.1
n(O2)︰n(H2)= 1︰2
B:22.25 22.39 相同
C:不同 相同
D:粒子数目 粒子大小 粒子间的距离
(1)粒子数 非常小 粒子大小 不同 不同
(2)远远大于 气体粒子间距离 相等 相同
