11-12版高中化学课时讲练通配套课件:2.1.1 元素与物质的分类 物质的分类(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:2.1.1 元素与物质的分类 物质的分类(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 20:27:46 | ||
图片预览











文档简介
(共65张PPT)
1.请写出几种含钠元素的物质,探究该元素在物质中的化合价。
提示:钠元素的物质家族:0价:金属钠;+1价:氯化钠、硫酸钠、次氯酸钠等。
2.纯净物与混合物的本质区别是什么?
提示:纯净物是由同种物质组成的,具有一定的组成,可以用一种化学式来表示,有固定的熔沸点;混合物由不同物质组成,没有一定的组成,不能用一种化学式来表示,无固定的熔沸点。
例1 下列说法中,正确的是
A.一种元素只能显示一种化合价
B.非金属元素只能显示负化合价
C.金属元素在化合物中一般只显示正化合价
D.一种元素在同一种化合物中,只能显示一种化合价
【规范解答】选C。有些元素有多种化合价,如Cl元素的化合价为-1、+1、+3、+5、+7;非金属元素大多有多种化合价,既有正化合价,也有负化合价;金属元素在化合物中一般只显示正化合价;一种元素在同一种化合物中,也可以显示不同的化合价,如:在硝酸铵中氮元素显-3、+5价。
【互动探究】只含有一种元素的物质肯定是纯净物吗?
提示:不一定。可能是纯净物,也可能是混合物,如由氧元素可以组成O2、O3,两者混合就是混合物。
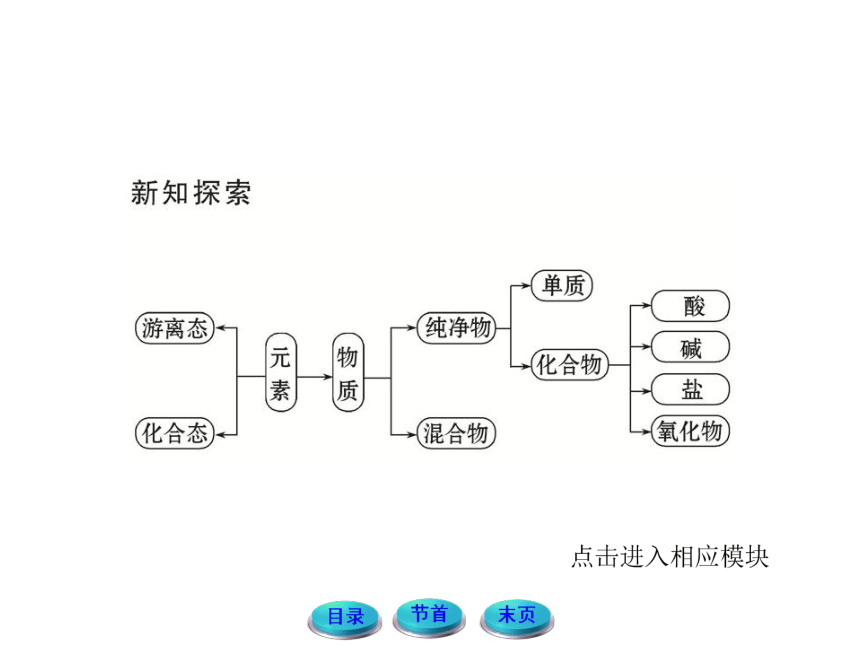
1.元素在自然界中的存在形态
(1)活泼金属和活泼非金属以化合态存在于自然界中。
(2)不活泼金属和不活泼非金属以游离态和化合态存在于自然界中。
(3)常见元素在自然界中既存在游离态,又存在化合态的:氮元素、氧元素、碳元素、铁元素等。
2.元素的化合价
(1)在单质中元素的化合价为零。
(2)金属元素在化合物中只显正价,非金属元素在化合物中既可显正价,也可显负价。
(3)非金属元素F无正价。
1.Na2O2是碱性氧化物吗?
提示:不是。碱性氧化物是指能与酸反应生成盐和水的氧化物。而Na2O2与酸反应时,不仅生成了盐和水,同时还生成了氧气,所以Na2O2不是碱性氧化物。
2.金属氧化物都是碱性氧化物吗?碱性氧化物都是金属氧化物吗?
提示:金属氧化物不一定都是碱性氧化物,如:Al2O3为两性氧化物,Mn2O7为酸性氧化物等;但碱性氧化物都是金属氧化物。
3.非金属氧化物都是酸性氧化物吗?酸性氧化物都是非金属氧化物吗?
提示:非金属氧化物不一定都是酸性氧化物,如CO、H2O;酸性氧化物也不一定都是非金属氧化物,如Mn2O7。
例2 下列物质的分类合理的是
A.氧化物:CO2、NO、SO2、H2O、Na2O
B.碱:NaOH、KOH、Ba(OH)2、Na2CO3
C.铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D.碱性氧化物:Na2O、CaO、Mn2O7、Al2O3
【规范解答】选A。A中注意H2O是氢的氧化物;B中的Na2CO3虽俗名纯碱,其水溶液呈碱性,它属于盐;C中的NH3·H2O为碱;D中的Mn2O7为酸性氧化物,而Al2O3为两性氧化物。
【互动探究】A项物质依据组成还能分成哪两组?
提示:依据组成可以分成金属氧化物和非金属氧化物,即Na2O和CO2、NO、SO2、H2O两组。
1.根据物质的组成和性质对物质进行分类
2.根据分类的依据不同,同一物质可以属于不同的类别,如NaHSO4可属于纯净物、钠盐、酸式盐、含氧酸盐、电解质等。
物质的分类与通性
根据组成和性质可以把纯净物分为单质、氧化物、酸、碱、盐,为探究它们之间的转化关系,老师提供了下列试剂:金属铁、金属钠、金属铜、硫、木炭、氯气、氧气、氢气、氧化钙、氧化铜、氧化铁、二氧化碳、水、大理石、稀盐酸、稀硫酸、稀硝酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液、碳酸钠溶液、硝酸银溶液、硫酸铜溶液、石蕊试剂、酚酞试剂。
请利用上述试剂,探究以下问题:
1.金属有哪些化学性质?
提示:(1)能与非金属反应
3Fe+2O2 Fe3O4 Cu+Cl2 CuCl2
(2)活泼金属能与水或酸反应放出氢气
2Na+2H2O ==== 2NaOH+H2↑ Fe+H2SO4 ==== FeSO4+H2↑
(3)能与某些盐反应Cu+2AgNO3 ==== Cu(NO3)2+2Ag
Fe+CuSO4 ==== FeSO4+ Cu
点燃
====
点燃
====
2.非金属有哪些化学性质?
提示:(1)能与金属或非金属单质反应
2Fe+3Cl2 2FeCl3 S+O2 SO2
(2)能与氧化物反应
C+CO2 2CO 3C+2Fe2O3 4Fe+3CO2↑
H2+CuO Cu+H2O
高温
====
点燃
====
△
====
高温
====
点燃
====
3.酸性氧化物有哪些化学性质?
提示:(1)有些酸性氧化物能与水反应CO2+H2O ==== H2CO3
(2)能与碱性氧化物反应CO2+CaO ==== CaCO3
(3)能与碱反应CO2+2NaOH ==== Na2CO3+H2O
4.碱性氧化物有哪些化学性质?
提示:(1)有些碱性氧化物能与水反应CaO+H2O ==== Ca(OH)2
(2)能与酸性氧化物反应CaO+CO2 ==== CaCO3
(3)能与酸反应Fe2O3+6HCl ==== 2FeCl3+3H2O
5.酸的通性有哪些?
提示:(1)酸溶液与指示剂的反应
酸溶液中滴加石蕊试剂显红色
(2)与活泼金属的反应Fe+H2SO4 ==== FeSO4+H2↑
(3)与碱性氧化物的反应CuO+2HCl ==== CuCl2+H2O
(4)与碱的反应HCl+NaOH ==== NaCl+H2O
(5)与某些盐的反应2HCl+Na2CO3 ==== 2NaCl+H2O+CO2↑
6.碱的通性有哪些?
提示:(1)碱溶液与酸碱指示剂反应
碱能使紫色石蕊试剂变蓝
碱能使无色的酚酞试剂变红
(2)与酸性氧化物反应
Ca(OH)2+CO2 ==== CaCO3↓+H2O
2NaOH+CO2 ==== Na2CO3+H2O
(3)与酸发生中和反应
2NaOH+H2SO4 ==== Na2SO4+2H2O
Ca(OH)2+2HNO3 ==== Ca(NO3)2+2H2O
(4)与某些盐的反应
2NaOH+CuSO4 ==== Cu(OH)2 ↓+ Na2SO4
7.盐有哪些性质?
提示:(1)与某些金属的反应Fe+CuSO4 ==== Cu+ FeSO4
(2)与酸的反应CaCO3+2HCl ==== CaCl2+H2O+CO2↑
(3)与某些碱的反应
CuSO4+2NaOH ==== Na2SO4+ Cu(OH)2↓
Na2CO3+Ca(OH)2 ==== CaCO3↓+2NaOH
(4)与另一种盐的反应NaCl+AgNO3 ==== NaNO3+AgCl↓
1.通过食盐补碘、酱油补铁是国家实施的涉及千万家庭健康的活动。这里的碘、铁指的是( )
A.分子 B.原子 C.元素 D.单质
【解析】选C。食盐补碘加的是碘酸钾,酱油补铁添加的为乙二胺四乙酸铁钠,故这里的碘、铁指的是元素。
2.对下列物质分类正确的是( )
①纯碱 ②氯水 ③石灰水 ④NaOH
⑤液态氧 ⑥KClO3
A.碱——①④ B.纯净物——③④⑤
C.盐——①⑥ D.混合物——②⑤
【解析】选C。纯碱为Na2CO3,属于盐类物质;氯水为Cl2的水溶液,为混合物;石灰水是Ca(OH)2的水溶液,为混合物;液态氧即液态的氧气,为纯净物;KClO3为盐类物质,故答案为C。
3.化学概念在逻辑上存在如图所示关系,对下列概念的说法正确的是( )
A.纯净物与混合物属于包含关系
B.化合物与氧化物属于包含关系
C.单质与化合物属于交叉关系
D.纯净物与单质属于并列关系
【解析】选B。纯净物与混合物属于并列关系,A错;氧化物是一种化合物,但化合物不一定都是氧化物,二者属于包含关系,B对;单质与化合物属于并列关系,C错;纯净物包括单质,两者是包含关系,D错。
4.(2011·达州高一检测)符合下图阴影部分的物质是( )
A.NaCl B.KHCO3 C.K2CO3 D.Na2CO3
【解析】选C。既属于钾盐、碳酸盐又属于正盐的是K2CO3。
5.下列每组物质中均有一种与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来,并指出分类依据。
(1)CO2、SO2、H2O(g)、CaO_____;
(2)HNO3、H2SiO3(硅酸)、HCl、H2SO4_____;
(3)空气、N2、HCl气体、CuSO4·5H2O_____;
(4)HClO3、KClO3、Cl2、NaClO3_____;
(5)CO2、O2、Na2O、Fe2O3______。
【解析】这是一道开放性题目,物质分类有多种方法,解题时先仔细分析每组中各物质在组成元素、化合价以及状态等方面的特点,找出其相似性,即可找出不同的一种物质。(1)只有CaO为金属氧化物,其他均为非金属氧化物;(2)只有HCl是无氧酸(或只有H2SiO3为难溶酸,其余为易溶酸);(3)只有空气属混合物,其他均为纯净物(或只有CuSO4· 5H2O为固态,其余均为气态物质);(4)只有Cl2中Cl元素化合价为零,其他均为+5价(或只有Cl2为单质,其余均为化合物);(5)只有O2不是氧化物。
答案:(1)CaO,分类依据为是否是非金属氧化物
(2)HCl,分类依据为是否是含氧酸(或H2SiO3,分类依据为是否是可溶性酸)
(3)空气,分类依据为是否是纯净物
(4)Cl2,分类依据为是否是化合物
(5)O2,分类依据为是否是氧化物(合理即可)
一、选择题(本题包括6小题,每小题4分,共24分)
1.(2011·大庆高一检测) 关于氧化物的叙述正确的是
( )
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
C.碱性氧化物都能与水化合生成碱
D.酸性氧化物都能与水化合生成酸
【解析】选B。A项,金属氧化物不一定都是碱性氧化物。如Mn2O7是酸性氧化物,Al2O3是两性氧化物,非金属氧化物不一定都是酸性氧化物,如CO、NO等都不能与碱反应,是不成盐氧化物;B项,酸性氧化物不一定都是非金属氧化物。如Mn2O7对应的酸是HMnO4,是金属氧化物,故B对;氧化物不一定与水反应,如CuO、SiO2都不与水反应生成对应的碱和酸,故C、D不对。
2.下列说法中,正确的是( )
A.元素的存在形态只有化合态和游离态两种
B.同一元素呈化合态时其化合价一定比游离态时高
C.有多少种元素就有多少种单质
D.同一元素在不同的物质中呈现的价态一定不同
【解析】选A。同一元素在不同化合物中的价态可能是正价,也可能是负价,B错误;同一元素可能有多种单质,C错误;同一元素在不同物质中的价态可能相同,如SO3与H2SO4中硫元素都是+6价,D错误。
3.下列关于物质分类的正确组合是( )
【解析】选D。A项中C2H5OH不是碱,Al2O3为两性氧化物;B项中CO不能与碱反应,是不成盐氧化物,不是酸性氧化物;C项中纯碱是碳酸钠,是盐不是碱,Na2O2与酸反应生成盐、水、氧气,故不是碱性氧化物。
【规律方法】物质分类时应注意的事项
①纯碱叫碱不是碱。纯碱是Na2CO3的俗名,它是一种盐,不属于碱类。
②能电离出H+的不一定是酸。如NaHSO4能电离出H+,同时电离出的阳离子还有Na+,它是一种酸式盐。
③酸性氧化物不一定是非金属氧化物,如Mn2O7是一种酸性氧化物;非金属氧化物也不一定是酸性氧化物,如CO、NO等不成盐氧化物。
④碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7这种金属氧化物属酸性氧化物,Al2O3属于两性氧化物。
4.(2011·成都高一检测)中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700 ℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是( )
A.金刚石属于金属单质 B.制造过程中元素种类没有改变
C.CCl4是一种化合物 D.这个反应是置换反应
【解析】选A。金刚石属于非金属单质;这个反应是置换反应,CCl4是一种化合物,化学反应过程中元素的种类不变。
5.实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如图所示,做“硫酸的性质”的实验时,某同学取用Ba(OH)2溶液后,应把它放回的位置是( )
【解析】选D。HCl、H2SO4属于酸,酚酞、石蕊属于酸碱指示剂,NaCl属于盐,NaOH、Ba(OH)2属于碱,据药品按规律摆放的原则,Ba(OH)2溶液应放在D处。
6.Fe、CO、CuO、NaOH溶液、Na2CO3溶液、Ba(OH)2溶液、稀硫酸七种物质,在常温下两种物质间能发生的化学反应有
( )
A.4个 B.5个 C.6个 D.7个
【解析】选C。这七种物质之间的反应为:①Fe和H2SO4
②CO和CuO在高温下能反应,但不符合题目条件 ③CuO和H2SO4 ④NaOH和H2SO4 ⑤Na2CO3和H2SO4 ⑥Na2CO3和Ba(OH)2⑦Ba(OH)2和H2SO4。故在常温下反应的共六个。
【举一反三】上述七个反应中哪个反应不属于四种基本反应类型?
提示:②CO和CuO的反应,注意该反应不是置换反应
二、非选择题(本题包括2小题,共26分)
7.(10分)(2011·保定高一检测)有些食品包装袋中有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰所属的物质类型______(用序号填空)。
①金属氧化物 ②碱性氧化物 ③碱 ④碱性干燥剂
(2)生石灰可作干燥剂的理由是(用化学方程式表示):
_______________。
(3)你认为下列内容还必须在这种小纸袋上注明的是____
(用序号填空)。
①禁止食用 ②可以食用
③禁止未成年人用手拿 ④生产日期
(4)硅胶也是一种很好的干燥剂,用硅胶作干燥剂的优点是__________(用序号填空)。
①腐蚀性低 ②使用时间长
【解析】此题联系生活实际,要善于运用化学视角,观察分析生产、生活中遇到的与化学知识有关的问题。小纸袋上除注明禁止食用外,还应注明生产日期,因长时间放置会失去吸水作用。硅胶性质稳定,无腐蚀性,能较长时间使用。
答案:(1)①②④ (2)CaO+H2O ==== Ca(OH)2
(3)①④ (4)①②
8.(16分)“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)____________ 。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有____个,属于氧化还原反应的有_____个,其中能“吃掉”盐酸的盐是____________(填化学式),写出该反应的离子方程式_____________。
(3)在不能与盐酸反应的物质中,属于氧化物的是______
(填写物质序号,下同),属于单质的是______。
(4)如果将盐酸换成氧气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么?_____________。
【解析】(1)图中物质③、⑥、⑩、⑦、 、 均不与盐
酸反应,沿该路线可走出迷宫。(2)盐酸与NaOH、
Ca(OH)2的反应属于酸和碱中和反应,能“吃掉”盐酸
的盐是Na2CO3,该反应的化学方程式为Na2CO3+2HCl ====
CO2↑+H2O+2NaCl。(3)在不能与盐酸反应的物质中,属
于氧化物的是CO2、CO,属于单质的是Cu、Ag。(4)如果
将盐酸换成氧气,它不能沿着盐酸走出的路线“走出”这
个迷宫,因为氧气遇到一氧化碳、铜、银等物质时会发生
反应也会被“吃掉”。
答案:(1)③、⑥、⑩、⑦、 、
(2)2 1 Na2CO3 CO32-+2H+ ==== CO2↑+H2O
(3)③⑩ ⑦ (4)不能,因为氧气遇到一氧化碳、铜、银等物质也会发生反应被“吃掉”
1.请写出几种含钠元素的物质,探究该元素在物质中的化合价。
提示:钠元素的物质家族:0价:金属钠;+1价:氯化钠、硫酸钠、次氯酸钠等。
2.纯净物与混合物的本质区别是什么?
提示:纯净物是由同种物质组成的,具有一定的组成,可以用一种化学式来表示,有固定的熔沸点;混合物由不同物质组成,没有一定的组成,不能用一种化学式来表示,无固定的熔沸点。
例1 下列说法中,正确的是
A.一种元素只能显示一种化合价
B.非金属元素只能显示负化合价
C.金属元素在化合物中一般只显示正化合价
D.一种元素在同一种化合物中,只能显示一种化合价
【规范解答】选C。有些元素有多种化合价,如Cl元素的化合价为-1、+1、+3、+5、+7;非金属元素大多有多种化合价,既有正化合价,也有负化合价;金属元素在化合物中一般只显示正化合价;一种元素在同一种化合物中,也可以显示不同的化合价,如:在硝酸铵中氮元素显-3、+5价。
【互动探究】只含有一种元素的物质肯定是纯净物吗?
提示:不一定。可能是纯净物,也可能是混合物,如由氧元素可以组成O2、O3,两者混合就是混合物。
1.元素在自然界中的存在形态
(1)活泼金属和活泼非金属以化合态存在于自然界中。
(2)不活泼金属和不活泼非金属以游离态和化合态存在于自然界中。
(3)常见元素在自然界中既存在游离态,又存在化合态的:氮元素、氧元素、碳元素、铁元素等。
2.元素的化合价
(1)在单质中元素的化合价为零。
(2)金属元素在化合物中只显正价,非金属元素在化合物中既可显正价,也可显负价。
(3)非金属元素F无正价。
1.Na2O2是碱性氧化物吗?
提示:不是。碱性氧化物是指能与酸反应生成盐和水的氧化物。而Na2O2与酸反应时,不仅生成了盐和水,同时还生成了氧气,所以Na2O2不是碱性氧化物。
2.金属氧化物都是碱性氧化物吗?碱性氧化物都是金属氧化物吗?
提示:金属氧化物不一定都是碱性氧化物,如:Al2O3为两性氧化物,Mn2O7为酸性氧化物等;但碱性氧化物都是金属氧化物。
3.非金属氧化物都是酸性氧化物吗?酸性氧化物都是非金属氧化物吗?
提示:非金属氧化物不一定都是酸性氧化物,如CO、H2O;酸性氧化物也不一定都是非金属氧化物,如Mn2O7。
例2 下列物质的分类合理的是
A.氧化物:CO2、NO、SO2、H2O、Na2O
B.碱:NaOH、KOH、Ba(OH)2、Na2CO3
C.铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D.碱性氧化物:Na2O、CaO、Mn2O7、Al2O3
【规范解答】选A。A中注意H2O是氢的氧化物;B中的Na2CO3虽俗名纯碱,其水溶液呈碱性,它属于盐;C中的NH3·H2O为碱;D中的Mn2O7为酸性氧化物,而Al2O3为两性氧化物。
【互动探究】A项物质依据组成还能分成哪两组?
提示:依据组成可以分成金属氧化物和非金属氧化物,即Na2O和CO2、NO、SO2、H2O两组。
1.根据物质的组成和性质对物质进行分类
2.根据分类的依据不同,同一物质可以属于不同的类别,如NaHSO4可属于纯净物、钠盐、酸式盐、含氧酸盐、电解质等。
物质的分类与通性
根据组成和性质可以把纯净物分为单质、氧化物、酸、碱、盐,为探究它们之间的转化关系,老师提供了下列试剂:金属铁、金属钠、金属铜、硫、木炭、氯气、氧气、氢气、氧化钙、氧化铜、氧化铁、二氧化碳、水、大理石、稀盐酸、稀硫酸、稀硝酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液、碳酸钠溶液、硝酸银溶液、硫酸铜溶液、石蕊试剂、酚酞试剂。
请利用上述试剂,探究以下问题:
1.金属有哪些化学性质?
提示:(1)能与非金属反应
3Fe+2O2 Fe3O4 Cu+Cl2 CuCl2
(2)活泼金属能与水或酸反应放出氢气
2Na+2H2O ==== 2NaOH+H2↑ Fe+H2SO4 ==== FeSO4+H2↑
(3)能与某些盐反应Cu+2AgNO3 ==== Cu(NO3)2+2Ag
Fe+CuSO4 ==== FeSO4+ Cu
点燃
====
点燃
====
2.非金属有哪些化学性质?
提示:(1)能与金属或非金属单质反应
2Fe+3Cl2 2FeCl3 S+O2 SO2
(2)能与氧化物反应
C+CO2 2CO 3C+2Fe2O3 4Fe+3CO2↑
H2+CuO Cu+H2O
高温
====
点燃
====
△
====
高温
====
点燃
====
3.酸性氧化物有哪些化学性质?
提示:(1)有些酸性氧化物能与水反应CO2+H2O ==== H2CO3
(2)能与碱性氧化物反应CO2+CaO ==== CaCO3
(3)能与碱反应CO2+2NaOH ==== Na2CO3+H2O
4.碱性氧化物有哪些化学性质?
提示:(1)有些碱性氧化物能与水反应CaO+H2O ==== Ca(OH)2
(2)能与酸性氧化物反应CaO+CO2 ==== CaCO3
(3)能与酸反应Fe2O3+6HCl ==== 2FeCl3+3H2O
5.酸的通性有哪些?
提示:(1)酸溶液与指示剂的反应
酸溶液中滴加石蕊试剂显红色
(2)与活泼金属的反应Fe+H2SO4 ==== FeSO4+H2↑
(3)与碱性氧化物的反应CuO+2HCl ==== CuCl2+H2O
(4)与碱的反应HCl+NaOH ==== NaCl+H2O
(5)与某些盐的反应2HCl+Na2CO3 ==== 2NaCl+H2O+CO2↑
6.碱的通性有哪些?
提示:(1)碱溶液与酸碱指示剂反应
碱能使紫色石蕊试剂变蓝
碱能使无色的酚酞试剂变红
(2)与酸性氧化物反应
Ca(OH)2+CO2 ==== CaCO3↓+H2O
2NaOH+CO2 ==== Na2CO3+H2O
(3)与酸发生中和反应
2NaOH+H2SO4 ==== Na2SO4+2H2O
Ca(OH)2+2HNO3 ==== Ca(NO3)2+2H2O
(4)与某些盐的反应
2NaOH+CuSO4 ==== Cu(OH)2 ↓+ Na2SO4
7.盐有哪些性质?
提示:(1)与某些金属的反应Fe+CuSO4 ==== Cu+ FeSO4
(2)与酸的反应CaCO3+2HCl ==== CaCl2+H2O+CO2↑
(3)与某些碱的反应
CuSO4+2NaOH ==== Na2SO4+ Cu(OH)2↓
Na2CO3+Ca(OH)2 ==== CaCO3↓+2NaOH
(4)与另一种盐的反应NaCl+AgNO3 ==== NaNO3+AgCl↓
1.通过食盐补碘、酱油补铁是国家实施的涉及千万家庭健康的活动。这里的碘、铁指的是( )
A.分子 B.原子 C.元素 D.单质
【解析】选C。食盐补碘加的是碘酸钾,酱油补铁添加的为乙二胺四乙酸铁钠,故这里的碘、铁指的是元素。
2.对下列物质分类正确的是( )
①纯碱 ②氯水 ③石灰水 ④NaOH
⑤液态氧 ⑥KClO3
A.碱——①④ B.纯净物——③④⑤
C.盐——①⑥ D.混合物——②⑤
【解析】选C。纯碱为Na2CO3,属于盐类物质;氯水为Cl2的水溶液,为混合物;石灰水是Ca(OH)2的水溶液,为混合物;液态氧即液态的氧气,为纯净物;KClO3为盐类物质,故答案为C。
3.化学概念在逻辑上存在如图所示关系,对下列概念的说法正确的是( )
A.纯净物与混合物属于包含关系
B.化合物与氧化物属于包含关系
C.单质与化合物属于交叉关系
D.纯净物与单质属于并列关系
【解析】选B。纯净物与混合物属于并列关系,A错;氧化物是一种化合物,但化合物不一定都是氧化物,二者属于包含关系,B对;单质与化合物属于并列关系,C错;纯净物包括单质,两者是包含关系,D错。
4.(2011·达州高一检测)符合下图阴影部分的物质是( )
A.NaCl B.KHCO3 C.K2CO3 D.Na2CO3
【解析】选C。既属于钾盐、碳酸盐又属于正盐的是K2CO3。
5.下列每组物质中均有一种与其他物质在分类上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来,并指出分类依据。
(1)CO2、SO2、H2O(g)、CaO_____;
(2)HNO3、H2SiO3(硅酸)、HCl、H2SO4_____;
(3)空气、N2、HCl气体、CuSO4·5H2O_____;
(4)HClO3、KClO3、Cl2、NaClO3_____;
(5)CO2、O2、Na2O、Fe2O3______。
【解析】这是一道开放性题目,物质分类有多种方法,解题时先仔细分析每组中各物质在组成元素、化合价以及状态等方面的特点,找出其相似性,即可找出不同的一种物质。(1)只有CaO为金属氧化物,其他均为非金属氧化物;(2)只有HCl是无氧酸(或只有H2SiO3为难溶酸,其余为易溶酸);(3)只有空气属混合物,其他均为纯净物(或只有CuSO4· 5H2O为固态,其余均为气态物质);(4)只有Cl2中Cl元素化合价为零,其他均为+5价(或只有Cl2为单质,其余均为化合物);(5)只有O2不是氧化物。
答案:(1)CaO,分类依据为是否是非金属氧化物
(2)HCl,分类依据为是否是含氧酸(或H2SiO3,分类依据为是否是可溶性酸)
(3)空气,分类依据为是否是纯净物
(4)Cl2,分类依据为是否是化合物
(5)O2,分类依据为是否是氧化物(合理即可)
一、选择题(本题包括6小题,每小题4分,共24分)
1.(2011·大庆高一检测) 关于氧化物的叙述正确的是
( )
A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物
B.碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
C.碱性氧化物都能与水化合生成碱
D.酸性氧化物都能与水化合生成酸
【解析】选B。A项,金属氧化物不一定都是碱性氧化物。如Mn2O7是酸性氧化物,Al2O3是两性氧化物,非金属氧化物不一定都是酸性氧化物,如CO、NO等都不能与碱反应,是不成盐氧化物;B项,酸性氧化物不一定都是非金属氧化物。如Mn2O7对应的酸是HMnO4,是金属氧化物,故B对;氧化物不一定与水反应,如CuO、SiO2都不与水反应生成对应的碱和酸,故C、D不对。
2.下列说法中,正确的是( )
A.元素的存在形态只有化合态和游离态两种
B.同一元素呈化合态时其化合价一定比游离态时高
C.有多少种元素就有多少种单质
D.同一元素在不同的物质中呈现的价态一定不同
【解析】选A。同一元素在不同化合物中的价态可能是正价,也可能是负价,B错误;同一元素可能有多种单质,C错误;同一元素在不同物质中的价态可能相同,如SO3与H2SO4中硫元素都是+6价,D错误。
3.下列关于物质分类的正确组合是( )
【解析】选D。A项中C2H5OH不是碱,Al2O3为两性氧化物;B项中CO不能与碱反应,是不成盐氧化物,不是酸性氧化物;C项中纯碱是碳酸钠,是盐不是碱,Na2O2与酸反应生成盐、水、氧气,故不是碱性氧化物。
【规律方法】物质分类时应注意的事项
①纯碱叫碱不是碱。纯碱是Na2CO3的俗名,它是一种盐,不属于碱类。
②能电离出H+的不一定是酸。如NaHSO4能电离出H+,同时电离出的阳离子还有Na+,它是一种酸式盐。
③酸性氧化物不一定是非金属氧化物,如Mn2O7是一种酸性氧化物;非金属氧化物也不一定是酸性氧化物,如CO、NO等不成盐氧化物。
④碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7这种金属氧化物属酸性氧化物,Al2O3属于两性氧化物。
4.(2011·成都高一检测)中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700 ℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是( )
A.金刚石属于金属单质 B.制造过程中元素种类没有改变
C.CCl4是一种化合物 D.这个反应是置换反应
【解析】选A。金刚石属于非金属单质;这个反应是置换反应,CCl4是一种化合物,化学反应过程中元素的种类不变。
5.实验室中的药品常按物质的性质、类别等有规律地摆放。现有部分药品按某种规律摆放在实验桌上,如图所示,做“硫酸的性质”的实验时,某同学取用Ba(OH)2溶液后,应把它放回的位置是( )
【解析】选D。HCl、H2SO4属于酸,酚酞、石蕊属于酸碱指示剂,NaCl属于盐,NaOH、Ba(OH)2属于碱,据药品按规律摆放的原则,Ba(OH)2溶液应放在D处。
6.Fe、CO、CuO、NaOH溶液、Na2CO3溶液、Ba(OH)2溶液、稀硫酸七种物质,在常温下两种物质间能发生的化学反应有
( )
A.4个 B.5个 C.6个 D.7个
【解析】选C。这七种物质之间的反应为:①Fe和H2SO4
②CO和CuO在高温下能反应,但不符合题目条件 ③CuO和H2SO4 ④NaOH和H2SO4 ⑤Na2CO3和H2SO4 ⑥Na2CO3和Ba(OH)2⑦Ba(OH)2和H2SO4。故在常温下反应的共六个。
【举一反三】上述七个反应中哪个反应不属于四种基本反应类型?
提示:②CO和CuO的反应,注意该反应不是置换反应
二、非选择题(本题包括2小题,共26分)
7.(10分)(2011·保定高一检测)有些食品包装袋中有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。
(1)生石灰所属的物质类型______(用序号填空)。
①金属氧化物 ②碱性氧化物 ③碱 ④碱性干燥剂
(2)生石灰可作干燥剂的理由是(用化学方程式表示):
_______________。
(3)你认为下列内容还必须在这种小纸袋上注明的是____
(用序号填空)。
①禁止食用 ②可以食用
③禁止未成年人用手拿 ④生产日期
(4)硅胶也是一种很好的干燥剂,用硅胶作干燥剂的优点是__________(用序号填空)。
①腐蚀性低 ②使用时间长
【解析】此题联系生活实际,要善于运用化学视角,观察分析生产、生活中遇到的与化学知识有关的问题。小纸袋上除注明禁止食用外,还应注明生产日期,因长时间放置会失去吸水作用。硅胶性质稳定,无腐蚀性,能较长时间使用。
答案:(1)①②④ (2)CaO+H2O ==== Ca(OH)2
(3)①④ (4)①②
8.(16分)“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过。
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)____________ 。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有____个,属于氧化还原反应的有_____个,其中能“吃掉”盐酸的盐是____________(填化学式),写出该反应的离子方程式_____________。
(3)在不能与盐酸反应的物质中,属于氧化物的是______
(填写物质序号,下同),属于单质的是______。
(4)如果将盐酸换成氧气,它能沿着盐酸走出的路线“走出”这个迷宫吗?为什么?_____________。
【解析】(1)图中物质③、⑥、⑩、⑦、 、 均不与盐
酸反应,沿该路线可走出迷宫。(2)盐酸与NaOH、
Ca(OH)2的反应属于酸和碱中和反应,能“吃掉”盐酸
的盐是Na2CO3,该反应的化学方程式为Na2CO3+2HCl ====
CO2↑+H2O+2NaCl。(3)在不能与盐酸反应的物质中,属
于氧化物的是CO2、CO,属于单质的是Cu、Ag。(4)如果
将盐酸换成氧气,它不能沿着盐酸走出的路线“走出”这
个迷宫,因为氧气遇到一氧化碳、铜、银等物质时会发生
反应也会被“吃掉”。
答案:(1)③、⑥、⑩、⑦、 、
(2)2 1 Na2CO3 CO32-+2H+ ==== CO2↑+H2O
(3)③⑩ ⑦ (4)不能,因为氧气遇到一氧化碳、铜、银等物质也会发生反应被“吃掉”
