11-12版高中化学课时讲练通配套课件:2.3.2氧化剂和还原剂(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:2.3.2氧化剂和还原剂(鲁科版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 00:00:00 | ||
图片预览









文档简介
(共64张PPT)
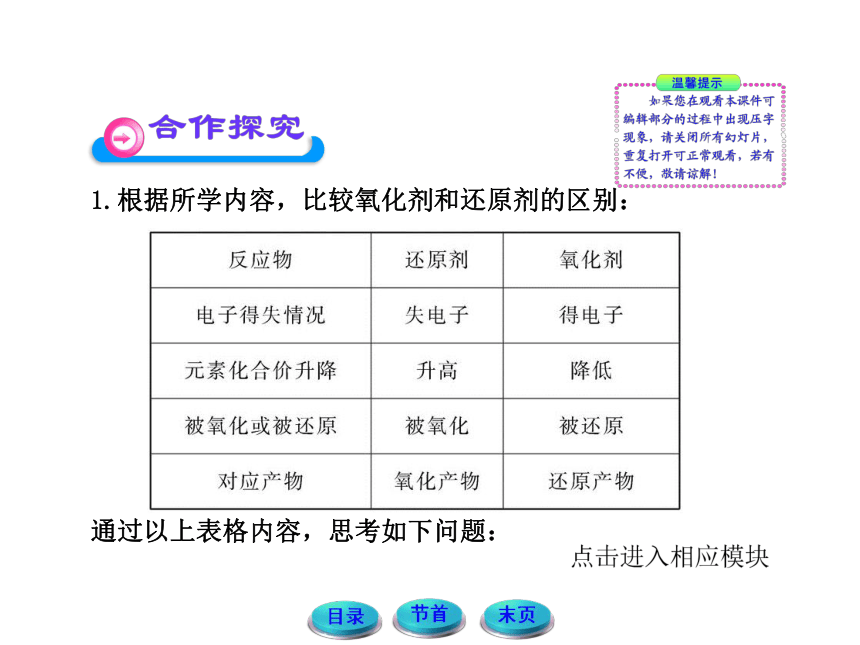
1.根据所学内容,比较氧化剂和还原剂的区别:
通过以上表格内容,思考如下问题:
(1)氧化剂获得的电子总数与还原剂失去的电子总数是否相等?
提示:相等。在氧化还原反应中还原剂失去的电子全部转移给氧化剂,所以氧化剂获得的电子总数与还原剂失去的电子总数相等。这是有关氧化还原反应计算的依据。
(2)氧化剂中元素化合价降低的总数是否等于还原剂中元
素化合价升高的总数?
提示:是。化合价的变化与得失电子数是一致的,所以氧化剂中元素化合价降低的总数等于还原剂中元素化合价升高的总数。
2.分析下列五个反应,探究以下问题:
①Cl2+2NaOH ==== NaCl+NaClO+H2O
②2KClO3 2KCl+3O2↑
③Mg+S MgS
④S+O2 SO2
⑤2H2S+SO2 ==== 3S↓+2H2O
(1)在同一反应中,氧化剂和还原剂可以是同一种物质吗?
提示:可以。在反应①中0价的Cl既有转化生成了-1价的Cl-,又有转化生成了+1价的ClO-,所以Cl2既是氧化剂又是还原剂;同理反应②中的KClO3既是氧化剂又是还原剂。
点燃
====
△
====
△
====
(2)在同一反应中,氧化产物和还原产物可以是同一种物质吗?
提示:可以。在反应⑤中,产物中的一部分硫单质是由H2S中的-2价硫元素被氧化得到的,一部分硫单质是由SO2中的+4价硫元素被还原得到的,即硫单质既是氧化产物又是还原产物。同理,③④中的MgS和SO2既是氧化产物又是还原产物。
例1 服用维生素C可使食物中的三价铁离子转变为二价铁离子,因为Fe2+比Fe3+易被人体吸收。
(1)①Fe2+→Fe3+的转化中,Fe2+作_____剂,发生_____反应,被_______。
②Fe3+→Fe2+的转化中,Fe3+作______剂,发生_____反应,被_______。
(2)某种麦片中含有微量的颗粒细小的还原铁粉,然后在胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为_______________________________,
离子方程式为________________________________。
【规范解答】(1)由Fe2+→Fe3+知Fe的化合价升高,所以Fe2+作还原剂,发生了氧化反应,被氧化;同理Fe3+→Fe2+中Fe的化合价降低,所以Fe3+作氧化剂,发生了还原反应,被还原。
(2)铁单质与胃液中的胃酸(即盐酸)反应。
答案:(1)①还原 氧化 氧化 ②氧化 还原 还原
(2)Fe+2HCl ==== FeCl2+H2↑ Fe+2H+ ==== Fe2++ H2↑
【互动探究】服用维生素C可使食物中的三价铁离子转变为二价铁离子这说明维生素C在该过程中具有什么性质?
提示:在该过程中三价铁离子转变为二价铁离子,三价铁离子得电子,所以维生素C在该过程中失电子,作还原剂,具有还原性。
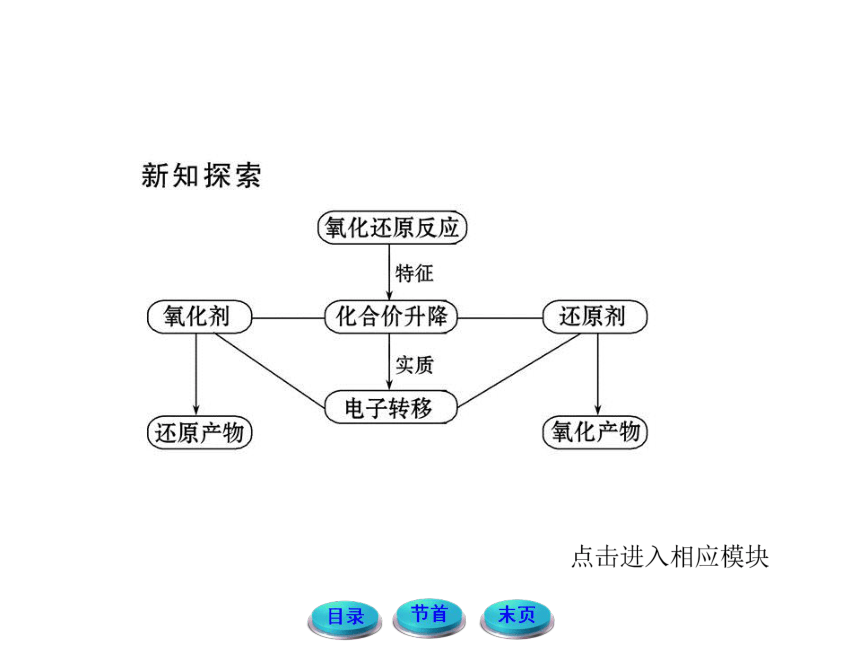
1.关于概念的理解
(1)氧化剂和还原剂是针对反应物而言。氧化剂是在氧化还原反应中得到电子的物质;还原剂是在氧化还原反应中失去电子的物质。
(2)化合价的变化是判断氧化剂和还原剂的宏观标志;电子得失是氧化还原反应的本质。
2.氧化还原反应中电子转移的数目
在分析电子转移数目时,氧化剂得电子数(或还原剂失电子数)即为转移的电子数。
1.分析元素的价态与氧化性、还原性的关系并举例说明。
(1)所含元素处于最高价态的微粒具有什么性质?
提示:元素处于最高价态的微粒在氧化还原反应中只能得电子,从而使化合价降低,所以元素处于最高价态的微粒具有氧化性,如Fe3+。
(2)所含元素处于最低价态的微粒具有什么性质
提示:元素处于最低价态的微粒在氧化还原反应中只能失电子,从而使化合价升高,所以元素处于最低价态的微粒具有还原性,如S2-。
(3)元素处于中间价态的微粒有什么性质?
提示:元素处于中间价态的微粒在氧化还原反应中既能失电子使化合价升高,又能得电子使化合价降低,所以元素处于中间价态的微粒既具有还原性又具有氧化性,如Fe2+。
2.结合以下信息思考物质氧化性、还原性强弱的判断方法。
(1)如何根据氧化还原反应方程式进行判断?
提示:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(2)如何根据金属的活动性进行判断?
提示:在金属活动性顺序表中,活动性越强的金属越易失电子,表现出的还原性越强;活动性越强的金属对应的阳离子得电子的能力越弱,氧化性也越弱。
(3)分析下面的两组化学方程式,思考还可以依据什么判
断氧化性和还原性的强弱?
A组:①16HCl+2KMnO4 ==== 2KCl+2MnCl2+8H2O+5Cl2↑
②4HCl(浓)+ MnO2 MnCl2+2H2O+ Cl2↑
提示:在以上两个反应中还原剂都是浓盐酸,氧化产物都
是氯气,而氧化剂分别为KMnO4 和MnO2。①式中KMnO4常温
时可以把盐酸中的氯离子氧化为氯气,②式中MnO2需要在
加热条件下才能完成,由此可知氧化性:KMnO4>MnO2,即还
可以根据反应条件来判断物质氧化性或还原性的强弱。
△
====
B组:③2Fe+3Cl2 2FeCl3
④Fe+S FeS
提示:在加热条件下氯气能把铁氧化为Fe3+,而硫只能把铁
氧化为Fe2+,这说明氧化性Cl2>S,即可以根据产物的价态
来判断物质的氧化性或还原性的强弱。
△
====
△
====
例2 已知下列化学反应可以发生:
(1)2Fe3++2I- ==== 2Fe2++I2
(2)Br2+2Fe2+ ==== 2Fe3++2Br-
由上述反应推断氧化剂的氧化性强弱顺序为
A.Br2>Fe3+>I2 B.Fe3+>Br2>I2
C.I2>Br2>Fe3+ D.Br2>I2>Fe3+
【规范解答】选A。首先判断各反应中的氧化剂和氧化产物:在反应(1)中Fe3+作氧化剂,I2是氧化产物,所以氧化性Fe3+>I2;在反应(2)中Br2作氧化剂,Fe3+是氧化产物,所以氧化性Br2>Fe3+。故选A。
【互动探究】分析上述两个方程式,判断I-、Fe2+和Br-的还原性强弱。
提示:在反应(1)中I-作还原剂,Fe2+是还原产物,所以还原性I-> Fe2+;在反应(2)中Fe2+作还原剂,Br-是还原产物,所以还原性Fe2+> Br-,故还原性顺序为I->Fe2+>Br-。
1.氧化性和还原性的强弱取决于物质得失电子的难易程度,而与得失电子的数目无关;
2.所含元素的价态越高,物质的氧化性不一定越强;如氧化性:HClO4< HClO。
一、氧化还原反应的有关计算
【示例】24 mL浓度为0.05 mol·L-1的Na2SO3(已知硫元素最高价为+6价)溶液,恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7 (铬元素最高价为+6价)溶液完全反应,则元素Cr在被还原的产物中的化合价是
A.+6 B.+3 C.+2 D.0
【解析】选B。解答本题应依据氧化还原反应中得失电子守恒来计算,24 mL浓度为0.05 mol·L-1的Na2SO3中S原子失去电子的物质的量为n=0.024 L×0.05 mol·L-1×2=
0.002 4 mol,与K2Cr2O7中Cr原子所得电子的总数是相等的,n(Cr)=0.02 L×0.02 mol·L-1×2=0.000 8 mol,所以每个Cr原子得到0.002 4 mol/0.000 8 mol=3个电子,Cr元素的化合价降低3价,在K2Cr2O7中Cr为+6价,最后产物中Cr的化合价为+3价。
探究:根据以上例题讨论:如何依据电子守恒进行氧化还原反应的计算?
提示:氧化还原反应的计算依据是电子守恒,所谓电子守恒是指得电子总数与失电子总数相等或化合价升高总数与化合价降低总数相等。其计算式为:氧化剂物质的量×变价元素的原子个数×化合价的变化值=还原剂物质的量×变价元素的原子个数×化合价的变化值。
二、氧化还原反应的规律
探究:
1.强弱规律是指相对较强氧化性的氧化剂与较强还原性的
还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化
产物,即:
试比较下列反应物中氧化性、还原性的强弱。
①Fe+CuSO4 ==== FeSO4+Cu;
②2Fe+3Cl2 2FeCl3
点燃
====
提示:在反应①中,Fe是还原剂,CuSO4 是氧化剂,FeSO4是氧化产物,Cu是还原产物,故还原性:Fe>Cu;氧化性:CuSO4>FeSO4。
在反应②中,Fe是还原剂,Cl2 是氧化剂,FeCl3既是氧化产物又是还原产物,故还原性:Fe>FeCl3;氧化性:Cl2>FeCl3。
2.价态规律是指物质所含元素的价态高低与物质的氧化性和还原性有关,结合该规律判断Zn、O22-、Cu2+具有氧化性还是还原性?并总结价态与氧化性、还原性的关系。
提示:Zn具有还原性;O22-既有氧化性又有还原性;Cu2+只有氧化性。
价态与氧化性、还原性的关系:元素处于最高价态,只有氧化性;元素处于最低价态,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现其中一种性质。
3.先后规律是指氧化还原反应中氧化性(或还原性)强的优先发生反应;已知I-、Fe2+、Cl-的还原性依次减弱,则在含等物质的量Fe2+和I-的溶液中通入少量氯气,发生反应的离子方程式是什么?
提示:还原性I->Fe2+>Cl-,通入少量Cl2时,Cl2优先氧化还原性最强的I-,离子方程式为Cl2+2I- ==== I2+2Cl-。
1.(2011·衡水高一检测)下列叙述正确的是( )
A.含金属元素的离子一定都是阳离子
B.某元素从化合态变为游离态时一定是被还原
C.在氧化还原反应中,非金属单质不一定是氧化剂
D.金属阳离子被还原一定得到金属单质
【解析】选C。A项,含金属元素的离子不一定都是阳离子,如MnO4-等;B项,某元素从化合态变为游离态时可能被还原也可能被氧化;D项,金属阳离子被还原不一定得到金属单质,如Fe3+可以被还原为Fe2+。
2.(2011·北京四中高一检测)吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体内的活性氧,由此推断Na2SeO3的作用是( )
A.作还原剂
B.作氧化剂
C.既作氧化剂又作还原剂
D.既不作氧化剂又不作还原剂
【解析】选A。由题意知,“活性氧”具有极强的氧化性,而化合物亚硒酸钠(Na2SeO3)能消除人体内的活性氧,由此推断Na2SeO3的作用是作还原剂。
3.关于物质氧化性及还原性的强弱,下列说法中正确的是
( )
A.物质越易失电子,还原性越强
B.原子失电子越多,还原性越强
C.元素化合价降低越多,氧化性越强
D.物质越易被氧化,氧化性越强
【解析】选A。物质的氧化性及还原性强弱与其得失电子能力大小有关,与得失电子数目多少无关,越易失电子,还原性越强,故A正确,B、C错误;物质越易被氧化,还原性越强,D项错误。
4.指出下列氧化还原反应中的氧化剂和还原剂
①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
②Cl2+H2O === HCl+HClO
③3NO2+H2O ==== 2HNO3+NO
④3CuO+2NH3 ==== 3Cu+N2+3H2O
________________________________________________。
△
====
【解析】结合化学方程式分析化合价升降情况,从而判断氧化剂和还原剂。
答案:①氧化剂:MnO2,还原剂:HCl;
②Cl2既是氧化剂又是还原剂;
③NO2既是氧化剂又是还原剂;
④氧化剂:CuO,还原剂:NH3
5.在Cu2+、Fe2+、Fe3+、Fe、Cl-、S2-、S七种粒子中,只具有氧化性的是______,只具有还原性的是______,既具有氧化性又具有还原性的是____________。
【解析】该类题目的判断依据是由化合价判断物质的氧化性和还原性。
答案:Cu2+、Fe3+ Fe、Cl-、S2- Fe2+、S
6.铁钉浸入硫酸铜溶液中,表面会附着红色物质;铜丝浸入硝酸银溶液后,表面会附着银白色物质。写出反应的化学方程式__________________,____________________。
并判断Cu、Fe、Ag中______的还原性最强,Cu2+、Fe2+、Ag+中______的氧化性最强。
【解析】解答本题的依据是根据金属的活动性来判断物质还原性的强弱。
答案:Fe+ CuSO4 ==== FeSO4+ Cu
Cu+ 2AgNO3 ==== Cu(NO3)2+ 2Ag Fe Ag+
一、选择题(本题包括6小题,每小题4分,共24分)
1.下列关于氧化还原反应的说法不正确的是( )
A.在反应中失去电子的物质是还原剂,得到电子的物质是氧化剂
B.在氧化还原反应中氧化剂发生还原反应,还原剂发生氧化反应
C.氧化还原反应是一种物质首先被氧化,另一种物质再被还原的反应
D.只有氧化没有还原的反应是不存在的
【解析】选C。氧化反应和还原反应是同时存在的,它们共同存在于一个氧化还原反应中。
2.在下列反应中, HCl作氧化剂的是( )
A.NaOH+HCl ==== NaCl+H2O
B.Zn+2HCl ==== ZnCl2+H2↑
C.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
D.CuO+2HCl ==== CuCl2+H2O
△
====
【解析】选B。A和D两项不是氧化还原反应,故可排除A和D两项;B项中HCl中的+1价氢元素转化生成H2,H的化合价降低,被还原,所以HCl作氧化剂,故选B;C项中HCl中的-1价氯元素转化生成Cl2,Cl的化合价升高,所以HCl作还原剂,故C项不正确。
【举一反三】在C项的反应中,氧化剂每反应1 mol有多少还原剂被氧化?
提示:2 mol。在该反应中MnO2作氧化剂,1 mol MnO2可以与4 mol HCl反应,但只有2 mol HCl被氧化。
3.(2011·大庆高一检测)菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法正确的是( )
A.在该反应中维生素C作催化剂
B.因为河虾中含有砷元素,所以不能食用
C.砒霜是砷的氧化物,由上述信息可推知砒霜中含有的砷是+3价
D.上述反应中维生素C作氧化剂
【解析】选C。河虾中+5价的砷与西红柿中的维生素C发生氧化还原反应,+5价砷被还原为有毒的+3价砷,维生素C作还原剂。
4.在下列变化中,需要加入合适的氧化剂才能实现的是
( )
A.CaCO3→CO2 B.CO2→CO
C.Fe2O3→Fe D.Br-→Br2
【解析】选D。如果要加入氧化剂才能实现,说明该过程发生了氧化反应,即该过程是化合价升高的过程,所以只有D项正确。
5.根据反应:
O2 + 2H2S ==== 2S↓+ 2H2O,
Na2S +I2 ==== 2NaI + S↓,
4NaI+O2+2H2SO4 ==== 2I2+ 2Na2SO4 + 2H2O,
判断上述物质的氧化性强弱,正确的是( )
A.O2 >I2 >S B.H2S>NaI>H2O
C.S >I2>O2 D.H2O>NaI>H2S
【解析】选A。该题是通过氧化还原反应方程式来判断物质的氧化性的强弱,其判断依据是:氧化剂的氧化性强于氧化产物的氧化性;在第一个反应中O2是氧化剂,S是氧化产物,所以氧化性O2 >S;在第二个反应中I2>S;在第三个反应中O2>I2,所以A项正确。
【规律方法】氧化还原反应中的几个“不一定”
(1)有单质参与或生成的反应不一定是氧化还原反应。如“红磷—白磷”等同素异形体之间的转化。
(2)在氧化还原反应中,非金属单质不一定作氧化剂。大部分非金属单质往往既具有氧化性又具有还原性,只是以氧化性为主。
(3)氧化还原反应中的反应物不一定都是氧化剂或还原剂。在氧化还原反应中一定有氧化剂和还原剂,但氧化剂和还原剂可以是不同的物质,也可以是同一种物质。
(4)在氧化还原反应中,一种元素被氧化,不一定有另一
种元素被还原,如在Cl2+H2O ==== HCl+HClO中,被氧化与
被还原的都是氯元素。
(5)在氧化还原反应中氧化剂的氧化性一般大于氧化产物
的氧化性,还原剂的还原性一般大于还原产物的还原性。
但此规律不适合于条件苛刻的反应,常见的苛刻条件有高
温、催化剂、通电。如2H2O 2H2↑+O2↑,水既是氧化
剂,又是还原剂,H2是还原产物,O2是氧化产物,但氧化性
O2>H2O;还原性H2>H2O。
通电
====
6.(2011·成都高一检测)金属加工后的废切削液中含
2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液
来处理此废切削液,使NaNO2转化为无毒物质。该反应分两
步进行:
第一步:NaNO2+NH4Cl ==== NaCl+NH4NO2
第二步:NH4NO2 N2↑+2H2O
下列对第二步反应的叙述中正确的是( )
①NH4NO2是氧化剂
②NH4NO2是还原剂
③NH4NO2发生了分解反应
△
====
④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A.①③ B.①④
C.②③④ D.③④⑤
【解析】选D。对第二步反应,NH4NO2发生了分解反应,NH4NO2既是氧化剂又是还原剂,并且只有氮元素的化合价发生了变化。
二、非选择题(本题包括2小题,共26分)
7.(10分)氧化还原反应在工农业生产和日常生活中有广泛运用。
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是________(填化学式)。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有_______(填“氧化性”或“还原性”)。
(3)我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4 ==== 3K2SO4+ 3I2+3H2O ;利用上述反应检验食盐中是否加碘,所需试剂是______(填下列选项的序号)。
①碘水 ②KI溶液 ③淀粉溶液 ④稀硫酸
⑤AgNO3溶液
【解析】(1)在反应C6H12O6+6O2→6CO2+6H2O+能量中,C6H12O6中C的化合价是0价,反应后转化生成的CO2中C的化合价为+4价,即C6H12O6中C在反应中失电子,作还原剂;
(2)根据题干信息“防止食物被空气中的氧气氧化而变质”知,加入的防腐剂应具有还原性;
(3)如果检验食盐中是否含有碘酸钾,应根据题干信息加以分析,该题中所给的信息是在酸性条件下碘酸钾可以与碘化钾发生氧化还原反应生成能使淀粉变蓝的单质碘,所以根据这一信息应选用的试剂是②③④。
答案:(1)C6H12O6 (2)还原性 (3)②③④
8.(16分)根据反应8NH3+3Cl2 ==== 6NH4Cl+N2回答下列问题。
(1)氧化剂______,还原剂______。
(2)氧化剂与还原剂的物质的量之比_______。
(3)当生成28 g N2时,被氧化的物质的质量是______g。
【解析】该反应中化合价发生变化的元素是N和Cl,其中
2 mol -3价的N失6 mol e-转化生成1 mol N2,6 mol 0价的Cl得6 mol e-转化生成6 mol -1价的Cl。根据以上分析可知NH3作还原剂,Cl2作氧化剂;氧化剂和还原剂的物质的量之比为3∶2;当生成28 g N2即1 mol N2时,被氧化的NH3是2 mol,即34 g。
答案:(1)Cl2 NH3
(2)3∶2 (3)34
1.根据所学内容,比较氧化剂和还原剂的区别:
通过以上表格内容,思考如下问题:
(1)氧化剂获得的电子总数与还原剂失去的电子总数是否相等?
提示:相等。在氧化还原反应中还原剂失去的电子全部转移给氧化剂,所以氧化剂获得的电子总数与还原剂失去的电子总数相等。这是有关氧化还原反应计算的依据。
(2)氧化剂中元素化合价降低的总数是否等于还原剂中元
素化合价升高的总数?
提示:是。化合价的变化与得失电子数是一致的,所以氧化剂中元素化合价降低的总数等于还原剂中元素化合价升高的总数。
2.分析下列五个反应,探究以下问题:
①Cl2+2NaOH ==== NaCl+NaClO+H2O
②2KClO3 2KCl+3O2↑
③Mg+S MgS
④S+O2 SO2
⑤2H2S+SO2 ==== 3S↓+2H2O
(1)在同一反应中,氧化剂和还原剂可以是同一种物质吗?
提示:可以。在反应①中0价的Cl既有转化生成了-1价的Cl-,又有转化生成了+1价的ClO-,所以Cl2既是氧化剂又是还原剂;同理反应②中的KClO3既是氧化剂又是还原剂。
点燃
====
△
====
△
====
(2)在同一反应中,氧化产物和还原产物可以是同一种物质吗?
提示:可以。在反应⑤中,产物中的一部分硫单质是由H2S中的-2价硫元素被氧化得到的,一部分硫单质是由SO2中的+4价硫元素被还原得到的,即硫单质既是氧化产物又是还原产物。同理,③④中的MgS和SO2既是氧化产物又是还原产物。
例1 服用维生素C可使食物中的三价铁离子转变为二价铁离子,因为Fe2+比Fe3+易被人体吸收。
(1)①Fe2+→Fe3+的转化中,Fe2+作_____剂,发生_____反应,被_______。
②Fe3+→Fe2+的转化中,Fe3+作______剂,发生_____反应,被_______。
(2)某种麦片中含有微量的颗粒细小的还原铁粉,然后在胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为_______________________________,
离子方程式为________________________________。
【规范解答】(1)由Fe2+→Fe3+知Fe的化合价升高,所以Fe2+作还原剂,发生了氧化反应,被氧化;同理Fe3+→Fe2+中Fe的化合价降低,所以Fe3+作氧化剂,发生了还原反应,被还原。
(2)铁单质与胃液中的胃酸(即盐酸)反应。
答案:(1)①还原 氧化 氧化 ②氧化 还原 还原
(2)Fe+2HCl ==== FeCl2+H2↑ Fe+2H+ ==== Fe2++ H2↑
【互动探究】服用维生素C可使食物中的三价铁离子转变为二价铁离子这说明维生素C在该过程中具有什么性质?
提示:在该过程中三价铁离子转变为二价铁离子,三价铁离子得电子,所以维生素C在该过程中失电子,作还原剂,具有还原性。
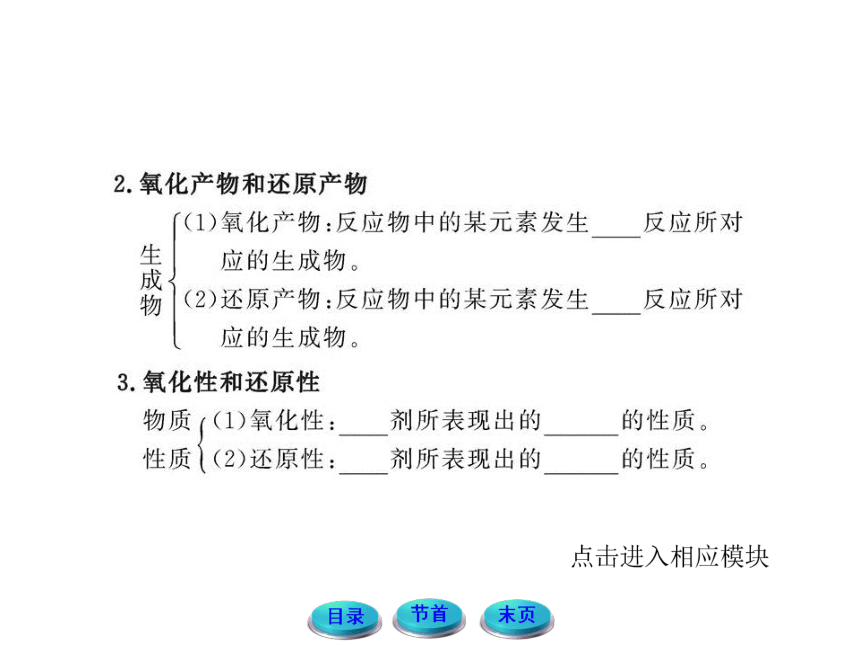
1.关于概念的理解
(1)氧化剂和还原剂是针对反应物而言。氧化剂是在氧化还原反应中得到电子的物质;还原剂是在氧化还原反应中失去电子的物质。
(2)化合价的变化是判断氧化剂和还原剂的宏观标志;电子得失是氧化还原反应的本质。
2.氧化还原反应中电子转移的数目
在分析电子转移数目时,氧化剂得电子数(或还原剂失电子数)即为转移的电子数。
1.分析元素的价态与氧化性、还原性的关系并举例说明。
(1)所含元素处于最高价态的微粒具有什么性质?
提示:元素处于最高价态的微粒在氧化还原反应中只能得电子,从而使化合价降低,所以元素处于最高价态的微粒具有氧化性,如Fe3+。
(2)所含元素处于最低价态的微粒具有什么性质
提示:元素处于最低价态的微粒在氧化还原反应中只能失电子,从而使化合价升高,所以元素处于最低价态的微粒具有还原性,如S2-。
(3)元素处于中间价态的微粒有什么性质?
提示:元素处于中间价态的微粒在氧化还原反应中既能失电子使化合价升高,又能得电子使化合价降低,所以元素处于中间价态的微粒既具有还原性又具有氧化性,如Fe2+。
2.结合以下信息思考物质氧化性、还原性强弱的判断方法。
(1)如何根据氧化还原反应方程式进行判断?
提示:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(2)如何根据金属的活动性进行判断?
提示:在金属活动性顺序表中,活动性越强的金属越易失电子,表现出的还原性越强;活动性越强的金属对应的阳离子得电子的能力越弱,氧化性也越弱。
(3)分析下面的两组化学方程式,思考还可以依据什么判
断氧化性和还原性的强弱?
A组:①16HCl+2KMnO4 ==== 2KCl+2MnCl2+8H2O+5Cl2↑
②4HCl(浓)+ MnO2 MnCl2+2H2O+ Cl2↑
提示:在以上两个反应中还原剂都是浓盐酸,氧化产物都
是氯气,而氧化剂分别为KMnO4 和MnO2。①式中KMnO4常温
时可以把盐酸中的氯离子氧化为氯气,②式中MnO2需要在
加热条件下才能完成,由此可知氧化性:KMnO4>MnO2,即还
可以根据反应条件来判断物质氧化性或还原性的强弱。
△
====
B组:③2Fe+3Cl2 2FeCl3
④Fe+S FeS
提示:在加热条件下氯气能把铁氧化为Fe3+,而硫只能把铁
氧化为Fe2+,这说明氧化性Cl2>S,即可以根据产物的价态
来判断物质的氧化性或还原性的强弱。
△
====
△
====
例2 已知下列化学反应可以发生:
(1)2Fe3++2I- ==== 2Fe2++I2
(2)Br2+2Fe2+ ==== 2Fe3++2Br-
由上述反应推断氧化剂的氧化性强弱顺序为
A.Br2>Fe3+>I2 B.Fe3+>Br2>I2
C.I2>Br2>Fe3+ D.Br2>I2>Fe3+
【规范解答】选A。首先判断各反应中的氧化剂和氧化产物:在反应(1)中Fe3+作氧化剂,I2是氧化产物,所以氧化性Fe3+>I2;在反应(2)中Br2作氧化剂,Fe3+是氧化产物,所以氧化性Br2>Fe3+。故选A。
【互动探究】分析上述两个方程式,判断I-、Fe2+和Br-的还原性强弱。
提示:在反应(1)中I-作还原剂,Fe2+是还原产物,所以还原性I-> Fe2+;在反应(2)中Fe2+作还原剂,Br-是还原产物,所以还原性Fe2+> Br-,故还原性顺序为I->Fe2+>Br-。
1.氧化性和还原性的强弱取决于物质得失电子的难易程度,而与得失电子的数目无关;
2.所含元素的价态越高,物质的氧化性不一定越强;如氧化性:HClO4< HClO。
一、氧化还原反应的有关计算
【示例】24 mL浓度为0.05 mol·L-1的Na2SO3(已知硫元素最高价为+6价)溶液,恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7 (铬元素最高价为+6价)溶液完全反应,则元素Cr在被还原的产物中的化合价是
A.+6 B.+3 C.+2 D.0
【解析】选B。解答本题应依据氧化还原反应中得失电子守恒来计算,24 mL浓度为0.05 mol·L-1的Na2SO3中S原子失去电子的物质的量为n=0.024 L×0.05 mol·L-1×2=
0.002 4 mol,与K2Cr2O7中Cr原子所得电子的总数是相等的,n(Cr)=0.02 L×0.02 mol·L-1×2=0.000 8 mol,所以每个Cr原子得到0.002 4 mol/0.000 8 mol=3个电子,Cr元素的化合价降低3价,在K2Cr2O7中Cr为+6价,最后产物中Cr的化合价为+3价。
探究:根据以上例题讨论:如何依据电子守恒进行氧化还原反应的计算?
提示:氧化还原反应的计算依据是电子守恒,所谓电子守恒是指得电子总数与失电子总数相等或化合价升高总数与化合价降低总数相等。其计算式为:氧化剂物质的量×变价元素的原子个数×化合价的变化值=还原剂物质的量×变价元素的原子个数×化合价的变化值。
二、氧化还原反应的规律
探究:
1.强弱规律是指相对较强氧化性的氧化剂与较强还原性的
还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化
产物,即:
试比较下列反应物中氧化性、还原性的强弱。
①Fe+CuSO4 ==== FeSO4+Cu;
②2Fe+3Cl2 2FeCl3
点燃
====
提示:在反应①中,Fe是还原剂,CuSO4 是氧化剂,FeSO4是氧化产物,Cu是还原产物,故还原性:Fe>Cu;氧化性:CuSO4>FeSO4。
在反应②中,Fe是还原剂,Cl2 是氧化剂,FeCl3既是氧化产物又是还原产物,故还原性:Fe>FeCl3;氧化性:Cl2>FeCl3。
2.价态规律是指物质所含元素的价态高低与物质的氧化性和还原性有关,结合该规律判断Zn、O22-、Cu2+具有氧化性还是还原性?并总结价态与氧化性、还原性的关系。
提示:Zn具有还原性;O22-既有氧化性又有还原性;Cu2+只有氧化性。
价态与氧化性、还原性的关系:元素处于最高价态,只有氧化性;元素处于最低价态,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现其中一种性质。
3.先后规律是指氧化还原反应中氧化性(或还原性)强的优先发生反应;已知I-、Fe2+、Cl-的还原性依次减弱,则在含等物质的量Fe2+和I-的溶液中通入少量氯气,发生反应的离子方程式是什么?
提示:还原性I->Fe2+>Cl-,通入少量Cl2时,Cl2优先氧化还原性最强的I-,离子方程式为Cl2+2I- ==== I2+2Cl-。
1.(2011·衡水高一检测)下列叙述正确的是( )
A.含金属元素的离子一定都是阳离子
B.某元素从化合态变为游离态时一定是被还原
C.在氧化还原反应中,非金属单质不一定是氧化剂
D.金属阳离子被还原一定得到金属单质
【解析】选C。A项,含金属元素的离子不一定都是阳离子,如MnO4-等;B项,某元素从化合态变为游离态时可能被还原也可能被氧化;D项,金属阳离子被还原不一定得到金属单质,如Fe3+可以被还原为Fe2+。
2.(2011·北京四中高一检测)吸入人体内的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体内的活性氧,由此推断Na2SeO3的作用是( )
A.作还原剂
B.作氧化剂
C.既作氧化剂又作还原剂
D.既不作氧化剂又不作还原剂
【解析】选A。由题意知,“活性氧”具有极强的氧化性,而化合物亚硒酸钠(Na2SeO3)能消除人体内的活性氧,由此推断Na2SeO3的作用是作还原剂。
3.关于物质氧化性及还原性的强弱,下列说法中正确的是
( )
A.物质越易失电子,还原性越强
B.原子失电子越多,还原性越强
C.元素化合价降低越多,氧化性越强
D.物质越易被氧化,氧化性越强
【解析】选A。物质的氧化性及还原性强弱与其得失电子能力大小有关,与得失电子数目多少无关,越易失电子,还原性越强,故A正确,B、C错误;物质越易被氧化,还原性越强,D项错误。
4.指出下列氧化还原反应中的氧化剂和还原剂
①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
②Cl2+H2O === HCl+HClO
③3NO2+H2O ==== 2HNO3+NO
④3CuO+2NH3 ==== 3Cu+N2+3H2O
________________________________________________。
△
====
【解析】结合化学方程式分析化合价升降情况,从而判断氧化剂和还原剂。
答案:①氧化剂:MnO2,还原剂:HCl;
②Cl2既是氧化剂又是还原剂;
③NO2既是氧化剂又是还原剂;
④氧化剂:CuO,还原剂:NH3
5.在Cu2+、Fe2+、Fe3+、Fe、Cl-、S2-、S七种粒子中,只具有氧化性的是______,只具有还原性的是______,既具有氧化性又具有还原性的是____________。
【解析】该类题目的判断依据是由化合价判断物质的氧化性和还原性。
答案:Cu2+、Fe3+ Fe、Cl-、S2- Fe2+、S
6.铁钉浸入硫酸铜溶液中,表面会附着红色物质;铜丝浸入硝酸银溶液后,表面会附着银白色物质。写出反应的化学方程式__________________,____________________。
并判断Cu、Fe、Ag中______的还原性最强,Cu2+、Fe2+、Ag+中______的氧化性最强。
【解析】解答本题的依据是根据金属的活动性来判断物质还原性的强弱。
答案:Fe+ CuSO4 ==== FeSO4+ Cu
Cu+ 2AgNO3 ==== Cu(NO3)2+ 2Ag Fe Ag+
一、选择题(本题包括6小题,每小题4分,共24分)
1.下列关于氧化还原反应的说法不正确的是( )
A.在反应中失去电子的物质是还原剂,得到电子的物质是氧化剂
B.在氧化还原反应中氧化剂发生还原反应,还原剂发生氧化反应
C.氧化还原反应是一种物质首先被氧化,另一种物质再被还原的反应
D.只有氧化没有还原的反应是不存在的
【解析】选C。氧化反应和还原反应是同时存在的,它们共同存在于一个氧化还原反应中。
2.在下列反应中, HCl作氧化剂的是( )
A.NaOH+HCl ==== NaCl+H2O
B.Zn+2HCl ==== ZnCl2+H2↑
C.MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
D.CuO+2HCl ==== CuCl2+H2O
△
====
【解析】选B。A和D两项不是氧化还原反应,故可排除A和D两项;B项中HCl中的+1价氢元素转化生成H2,H的化合价降低,被还原,所以HCl作氧化剂,故选B;C项中HCl中的-1价氯元素转化生成Cl2,Cl的化合价升高,所以HCl作还原剂,故C项不正确。
【举一反三】在C项的反应中,氧化剂每反应1 mol有多少还原剂被氧化?
提示:2 mol。在该反应中MnO2作氧化剂,1 mol MnO2可以与4 mol HCl反应,但只有2 mol HCl被氧化。
3.(2011·大庆高一检测)菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食时会生成有毒的+3价砷。下列说法正确的是( )
A.在该反应中维生素C作催化剂
B.因为河虾中含有砷元素,所以不能食用
C.砒霜是砷的氧化物,由上述信息可推知砒霜中含有的砷是+3价
D.上述反应中维生素C作氧化剂
【解析】选C。河虾中+5价的砷与西红柿中的维生素C发生氧化还原反应,+5价砷被还原为有毒的+3价砷,维生素C作还原剂。
4.在下列变化中,需要加入合适的氧化剂才能实现的是
( )
A.CaCO3→CO2 B.CO2→CO
C.Fe2O3→Fe D.Br-→Br2
【解析】选D。如果要加入氧化剂才能实现,说明该过程发生了氧化反应,即该过程是化合价升高的过程,所以只有D项正确。
5.根据反应:
O2 + 2H2S ==== 2S↓+ 2H2O,
Na2S +I2 ==== 2NaI + S↓,
4NaI+O2+2H2SO4 ==== 2I2+ 2Na2SO4 + 2H2O,
判断上述物质的氧化性强弱,正确的是( )
A.O2 >I2 >S B.H2S>NaI>H2O
C.S >I2>O2 D.H2O>NaI>H2S
【解析】选A。该题是通过氧化还原反应方程式来判断物质的氧化性的强弱,其判断依据是:氧化剂的氧化性强于氧化产物的氧化性;在第一个反应中O2是氧化剂,S是氧化产物,所以氧化性O2 >S;在第二个反应中I2>S;在第三个反应中O2>I2,所以A项正确。
【规律方法】氧化还原反应中的几个“不一定”
(1)有单质参与或生成的反应不一定是氧化还原反应。如“红磷—白磷”等同素异形体之间的转化。
(2)在氧化还原反应中,非金属单质不一定作氧化剂。大部分非金属单质往往既具有氧化性又具有还原性,只是以氧化性为主。
(3)氧化还原反应中的反应物不一定都是氧化剂或还原剂。在氧化还原反应中一定有氧化剂和还原剂,但氧化剂和还原剂可以是不同的物质,也可以是同一种物质。
(4)在氧化还原反应中,一种元素被氧化,不一定有另一
种元素被还原,如在Cl2+H2O ==== HCl+HClO中,被氧化与
被还原的都是氯元素。
(5)在氧化还原反应中氧化剂的氧化性一般大于氧化产物
的氧化性,还原剂的还原性一般大于还原产物的还原性。
但此规律不适合于条件苛刻的反应,常见的苛刻条件有高
温、催化剂、通电。如2H2O 2H2↑+O2↑,水既是氧化
剂,又是还原剂,H2是还原产物,O2是氧化产物,但氧化性
O2>H2O;还原性H2>H2O。
通电
====
6.(2011·成都高一检测)金属加工后的废切削液中含
2%~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液
来处理此废切削液,使NaNO2转化为无毒物质。该反应分两
步进行:
第一步:NaNO2+NH4Cl ==== NaCl+NH4NO2
第二步:NH4NO2 N2↑+2H2O
下列对第二步反应的叙述中正确的是( )
①NH4NO2是氧化剂
②NH4NO2是还原剂
③NH4NO2发生了分解反应
△
====
④只有氮元素的化合价发生了变化
⑤NH4NO2既是氧化剂又是还原剂
A.①③ B.①④
C.②③④ D.③④⑤
【解析】选D。对第二步反应,NH4NO2发生了分解反应,NH4NO2既是氧化剂又是还原剂,并且只有氮元素的化合价发生了变化。
二、非选择题(本题包括2小题,共26分)
7.(10分)氧化还原反应在工农业生产和日常生活中有广泛运用。
(1)人通过呼吸作用吸入氧气,氧化体内的葡萄糖(C6H12O6)提供能量以维持生命活动,反应为:C6H12O6+6O2→6CO2+6H2O+能量,该反应中的还原剂是________(填化学式)。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有_______(填“氧化性”或“还原性”)。
(3)我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4 ==== 3K2SO4+ 3I2+3H2O ;利用上述反应检验食盐中是否加碘,所需试剂是______(填下列选项的序号)。
①碘水 ②KI溶液 ③淀粉溶液 ④稀硫酸
⑤AgNO3溶液
【解析】(1)在反应C6H12O6+6O2→6CO2+6H2O+能量中,C6H12O6中C的化合价是0价,反应后转化生成的CO2中C的化合价为+4价,即C6H12O6中C在反应中失电子,作还原剂;
(2)根据题干信息“防止食物被空气中的氧气氧化而变质”知,加入的防腐剂应具有还原性;
(3)如果检验食盐中是否含有碘酸钾,应根据题干信息加以分析,该题中所给的信息是在酸性条件下碘酸钾可以与碘化钾发生氧化还原反应生成能使淀粉变蓝的单质碘,所以根据这一信息应选用的试剂是②③④。
答案:(1)C6H12O6 (2)还原性 (3)②③④
8.(16分)根据反应8NH3+3Cl2 ==== 6NH4Cl+N2回答下列问题。
(1)氧化剂______,还原剂______。
(2)氧化剂与还原剂的物质的量之比_______。
(3)当生成28 g N2时,被氧化的物质的质量是______g。
【解析】该反应中化合价发生变化的元素是N和Cl,其中
2 mol -3价的N失6 mol e-转化生成1 mol N2,6 mol 0价的Cl得6 mol e-转化生成6 mol -1价的Cl。根据以上分析可知NH3作还原剂,Cl2作氧化剂;氧化剂和还原剂的物质的量之比为3∶2;当生成28 g N2即1 mol N2时,被氧化的NH3是2 mol,即34 g。
答案:(1)Cl2 NH3
(2)3∶2 (3)34
