11-12版高中化学课时讲练通配套课件:3.1.1 多种多样的碳单质 广泛存在的含碳化合物(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:3.1.1 多种多样的碳单质 广泛存在的含碳化合物(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 20:27:46 | ||
图片预览








文档简介
(共56张PPT)
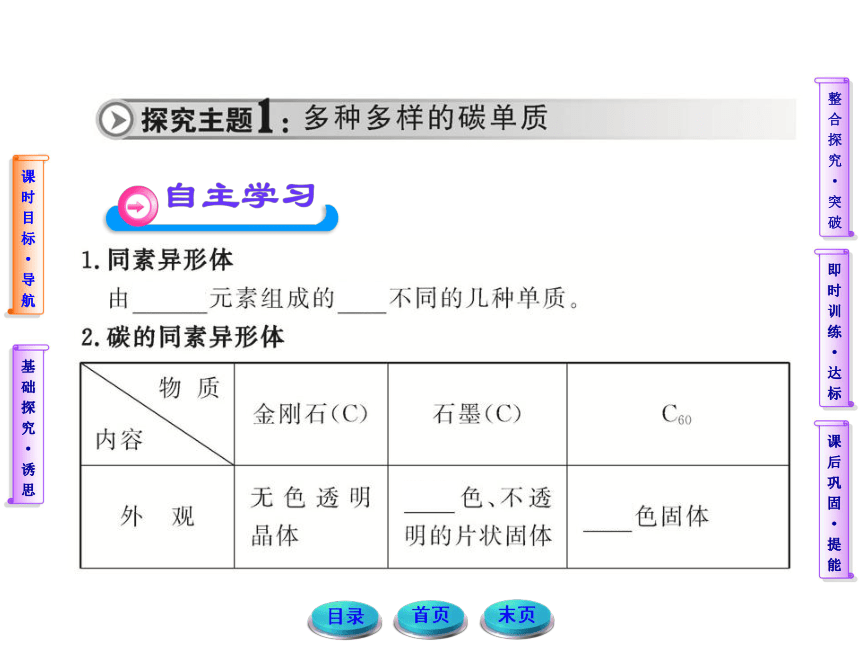
1.结合所学的物质分析并完成下列问题:
(1)同一种元素构成的物质一定是纯净物吗?
提示:同一种元素可能形成多种同素异形体,多种单质形成混合物。
(2)组成元素相同的物质一定是同素异形体吗?
提示:不一定,同素异形体研究的对象是单质,如CO、CO2虽然其组成元素相同,但它们不是单质,故不是同素异形体。金刚石和石墨组成的混合物只由碳元素组成,与C60也不能互称同素异形体。
2.已知石墨在一定条件下可以转化为金刚石,试分析二者转化是物理变化还是化学变化?
提示:判断是物理变化还是化学变化的主要依据是看是否有新物质生成,金刚石和石墨的转化有新物质生成,所以是化学变化。
例1 下列叙述中,正确的是
A.由碳元素的单质组成的物质一定是纯净物
B.金刚石和石墨具有相似的化学性质
C.金刚石转化为石墨,有单质生成,该反应属于氧化还原反应
D.C60是新发现的一种碳的化合物
【规范解答】选B。由碳元素的单质组成的物质不一定为纯净物,也可能为混合物,如石墨、金刚石、C60混合,A排除。金刚石和石墨中的碳原子排列方式不同,因此其物理性质不同,化学性质相似,B选项正确。同素异形体之间的转化,虽然有单质生成,但碳元素的化合价未发生变化,故不属于氧化还原反应,排除C选项。C60属于单质而不是化合物,D排除。
【互动探究】若将B项中“化学性质”改为“物理性质”,该选项对吗?
提示:错误。同素异形体有相似的化学性质,但物理性质差别很大,如金刚石硬度大,不导电,石墨质软,能导电。
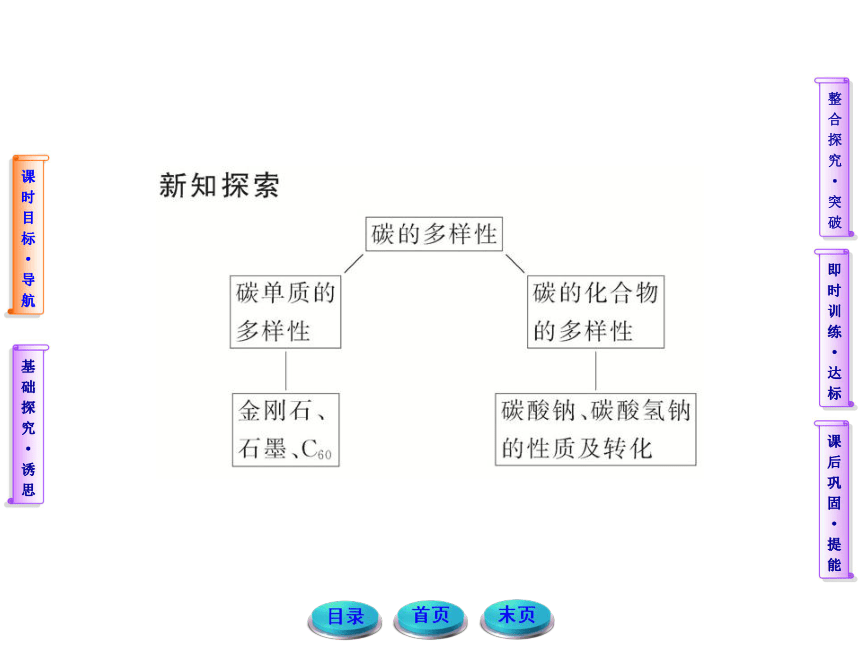
1.构成同素异形体的三个要素
(1)必须由同一种元素构成;
(2)必须是单质;
(3)必须具有不同的结构。
2.构成同素异形体的两种形式
(1)单质中原子的排列方式不同,如金刚石、石墨;
(2)单质中原子数目不同(如O2和O3)。
1.在有HCO3-存在时,如何检验溶液中是否含CO32-?
提示:加入CaCl2或BaCl2溶液,若产生沉淀,过滤,洗涤沉淀后,向沉淀中加稀盐酸,若产生无色无味且能使澄清石灰水变浑浊的气体,则原溶液中含CO32-;若加入CaCl2溶液或BaCl2溶液不产生沉淀,则原溶液中不含CO32-。
2.在有CO32-存在时,如何检验溶液中是否含HCO3-?
提示:应先加入足量的CaCl2溶液或BaCl2溶液,静置后取上层清液,然后再向清液中滴加稀盐酸,看是否产生无色无味且能使澄清石灰水变浑浊的气体,若产生,则原溶液中含HCO3-,若不产生,则原溶液中不含HCO3-。
例2 下列说法中正确的是
A.相同温度下,Na2CO3比NaHCO3难溶于水
B.Na2CO3比NaHCO3的稳定性强
C.CaCl2既能与Na2CO3反应,又能与NaHCO3反应
D.与足量盐酸反应要得到相同质量的CO2,用NaHCO3比Na2CO3的质量多
【规范解答】选B。一般情况下,碳酸盐的溶解性比碳酸氢盐的小,但Na2CO3和NaHCO3是特例,Na2CO3的溶解性比NaHCO3的大,故A错;Na2CO3受热不易分解,NaHCO3受热分解为Na2CO3、H2O和CO2,故B正确;CaCl2只与Na2CO3反应,不能和NaHCO3反应,故C错误;制取相同质量的CO2,假设制取44 g CO2,在盐酸足量的情况下,需NaHCO3 84 g,需Na2CO3 106 g,故D错误。
【互动探究】C选项中如果CaCl2换成澄清石灰水,该选项正确吗?
提示:正确。Ca(OH)2既能与Na2CO3反应,又能和NaHCO3反应。在和NaHCO3反应时,OH-和HCO3-先反应转化为CO32-和H2O,CO32-和Ca2+再反应产生沉淀。
【变式训练】纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这两种物质的方法正确的是( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.放入水中,能溶于水的为小苏打
C.等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,前者产生二氧化碳少
D.先将两样品配成溶液,再分别加入石灰水,无白色沉淀生成的是小苏打
【解析】选C。NaHCO3分解后生成Na2CO3,也有残留物,A错。Na2CO3和NaHCO3均能溶于水且均能与Ca(OH)2反应生成沉淀,B、D均错。
1.溶解性:若碳酸盐溶解度较大,则其对应的碳酸氢盐的溶解度小,如:Na2CO3>NaHCO3,若碳酸盐溶解度较小,则其对应的碳酸氢盐的溶解度较大,如:CaCO32.稳定性:难溶性的碳酸盐,及其对应的碳酸氢盐受热易分解;可溶性的碳酸盐较稳定,受热难分解,其对应的碳酸氢盐受热易分解。
3.NaHCO3和Ca(OH)2反应的产物与反应物的用量有关:
(1)2NaHCO3+Ca(OH)2 ==== Na2CO3+CaCO3↓+2H2O[少量的Ca(OH)2]
(2)NaHCO3+Ca(OH)2 ==== NaOH+CaCO3↓+H2O[过量的
Ca(OH)2]
Na2CO3、NaHCO3的鉴别除杂
【示例】某学校的实验室有一瓶碳酸氢钠,由于放置时间过久,不知是否变质。请你利用所学过的知识,设计一个简单的实验,确定这瓶碳酸氢钠是否变质。你设计的实验方案:______________。
【解析】NaHCO3易分解,如果NaHCO3中含有Na2CO3,说明NaHCO3已变质。鉴别NaHCO3中是否含有Na2CO3可用CaCl2溶液。若NaHCO3完全变质,就会全部生成Na2CO3。
答案:取固体少量,加入试管中,加水配成溶液后滴加CaCl2溶液,有白色沉淀生成,说明NaHCO3已变质,若无白色沉淀生成,说明NaHCO3没有变质
探究:
1.如果该药品已变质,如何鉴别是否完全变质?
提示:称取一定量的药品,加热至质量不变化为止,若加热前后称得的质量相同,则完全变质;若不同,则部分变质。
2.如果该药品只有少部分变质,如何除去杂质?
提示:将药品溶于水,通入足量的CO2,蒸发结晶。
1.金刚石、石墨、C60性质有所不同,是由于( )
A.构成原子不同 B.原子的排列方式不同
C.具有不同的几何外形 D.硬度不同
【解析】选B。金刚石、石墨、C60三者是碳元素的同素异形体,构成原子的种类完全相同,只是其内部碳原子排列方式不同,才导致它们结构不同,进而性质不同。
2.(2011·潍坊高一检测)能用H++OH- ==== H2O来表示的化学反应是( )
A.Cu(OH)2和稀硫酸反应
B.NaOH溶液和HNO3溶液反应
C.KOH溶液和NaHCO3溶液反应
D.Ba(OH)2溶液和稀硫酸反应
【解析】选B。A选项的离子方程式为Cu(OH)2+2H+ ==== Cu2++2H2O,B选项的离子方程式为H++OH- ==== H2O,C选项的离子方程式为OH-+HCO3- ==== CO32-+H2O,D选项的离子方程式为Ba2++2OH-+2H++SO42- ==== BaSO4↓+2H2O。因此选B。
3.20世纪80年代后,人们发现和证实碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是( )
A.X难溶于水
B.X的熔点比金刚石高
C.X是碳的一种同素异形体
D.X的摩尔质量为720n g/mol
【解析】选B。X的熔点比金刚石低。
4.有关Na2CO3和NaHCO3的叙述中正确的是( )
A.相同质量的Na2CO3 和NaHCO3与足量盐酸作用时,产生的气体质量相同
B.NaHCO3比Na2CO3热稳定性强
C.Na2CO3和NaHCO3均可与澄清石灰水反应
D.Na2CO3和NaHCO3均可与NaOH溶液反应
【解析】选C。相同质量的Na2CO3和NaHCO3含有的碳原子的物质的量不同,二者与足量的盐酸反应,碳原子全部转化到二氧化碳中,根据碳原子守恒,产生的二氧化碳的质量不同,因此A选项错误;NaHCO3受热易分解而Na2CO3受热不分解,因此后者热稳定性强,B选项错误;二者都能够与澄清石灰水反应生成白色沉淀碳酸钙,因此C选项正确;碳酸氢钠与氢氧化钠溶液反应,而碳酸钠不与氢氧化钠溶液反应,因此D选项错误。
5.(2011·佛山高一检测)碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸钠俗称_____,其水溶液呈_____(填“酸”、“碱”或“中”)性。等物质的量的碳酸钠和碳酸氢钠与足量等浓度盐酸反应时,反应的剧烈程度,前者_____后者(填“>”、“<”或“=”),生成CO2的量,前者_____后者(填“>”、“<”或“=”)。
(2)碳酸氢钠俗称_____,可治疗胃酸过多,反应的离子方程式为____________。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为
_________________。
【解析】碳酸钠俗称苏打或纯碱,碳酸氢钠俗称小苏打,二者的水溶液均呈碱性;碳酸钠与盐酸反应的实质是先发生①CO32-+H+ ==== HCO3-,再发生②HCO3-+H+ ==== CO2↑+
H2O,因此碳酸氢钠与盐酸反应更剧烈;等物质的量的碳酸钠与碳酸氢钠二者的碳原子的物质的量相等,根据碳原子守恒,二者与足量的盐酸反应产生的二氧化碳的物质的量相同;碳酸钠受热不分解,碳酸氢钠受热分解,因此可用加热的方法除去碳酸钠固体中的碳酸氢钠。
答案:(1)苏打或纯碱 碱 < =
(2)小苏打 HCO3-+H+ ==== H2O+CO2↑
(3)2NaHCO3 Na2CO3+CO2↑+H2O
△
====
一、选择题(本题包括6小题,每小题4分,共24分)
1.石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备损坏。这是由于石墨( )
A.具有放射性 B.易燃、易爆 C.能导电 D.质软
【解析】选C。石墨纤维有导电性,引起电线短路。
2.下列关于金刚石和石墨的说法中,不正确的是( )
A.它们都是由碳元素组成的单质
B.它们都是电的良导体
C.金刚石质硬,石墨质软
D.它们里面的碳原子排列不同
【解析】选B。金刚石和石墨均是由碳元素组成的单质,金刚石中碳原子以强的相互作用形成正四面体结构,质硬不导电,石墨中碳原子呈层状结构,碳原子以强的相互作用形成平面六边形结构,能导电、质软。
3.(2011·东营高一检测)澳大利亚研究人员最近开发出被称为第五形态的单质碳,这种新的碳结构称做“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性。纳米泡沫与金刚石的关系是( )
A.同一种物质 B.原子排列相同
C.同素异形体 D.在O2中充分燃烧都得不到CO2
【解析】选C。纳米泡沫也是一种单质碳,且原子排列与金刚石不同,不是同一种物质,二者是同素异形体,在O2中充分燃烧都得到CO2。
4.为除去括号内的杂质,所选用的试剂或方法不正确的是
( )
A.CO2(CO),将混合气体通过灼热的氧化铜
B.NaHCO3溶液(Na2CO3),向溶液中通入过量的CO2气体
C.CO2(HCl),将气体依次通过Na2CO3溶液和浓硫酸中
D.H2(HCl),将气体通入碱石灰中
【解析】选C。CO2也能和Na2CO3反应,所以应改为饱和NaHCO3溶液。
5.可以肯定溶液中大量存在CO32-的理由是( )
A.加入AgNO3溶液有白色沉淀产生
B.加入稀盐酸有无色无味气体产生
C.加入BaCl2溶液时有白色沉淀产生,再加稀盐酸沉淀溶解,产生可使澄清石灰水变浑浊的无色无味气体
D.加入Ba(OH)2溶液有白色沉淀产生,再加稀盐酸沉淀溶解,产生可使澄清石灰水变浑浊的无色无味气体
【解析】选C。A项溶液中若有Cl-,同样会产生AgCl白色沉淀;B、D项中会有HCO3-的干扰,B中反应为:HCO3-+H+ ==== CO2↑+H2O;D中的反应为Ba2++OH-+HCO3- ==== BaCO3↓+ H2O,BaCO3+2H+ ==== Ba2++CO2↑+H2O,同样会有上述现象产生,故选C。
6.现有25 mL 2 mol/L的Na2CO3溶液和75 mL 1 mol/L的稀盐酸,①将Na2CO3溶液缓缓滴加到稀盐酸中,②将稀盐酸缓缓滴加到Na2CO3溶液中,在标准状况下产生的气体情况是( )
A.均为0.84 L B.均为0.56 L C.①>② D.①<②
【解析】选C。
①将Na2CO3溶液滴入盐酸中:
Na2CO3+2HCl ==== 2NaCl+CO2↑+H2O
应按盐酸的量计算气体体积:
V1=0.075 mol× ×22.4 L/mol=0.84 L
②将盐酸滴入Na2CO3溶液中,反应分两步:
Na2CO3+HCl ==== NaCl+NaHCO3
NaHCO3+HCl ==== NaCl+CO2↑+H2O
生成的CO2用第二步余下的盐酸计算:
V2=(0.075 mol-0.05 mol)×22.4 L/mol=0.56 L
所以V1>V2。
【规律方法】Na2CO3溶液与盐酸反应产生气体情况的分析
Na2CO3溶液与盐酸相互滴加时,滴加顺序不同,产生CO2的量可能相同,也可能不同,可用下述方法快速判断产生气体情况:
当n(HCl)≥2n(Na2CO3)时,无论如何滴加,产生的CO2气体一样多;当n(HCl)<2n(Na2CO3)时,把Na2CO3溶液滴到盐酸中产生的CO2气体多。
二、非选择题(本题包括2小题,共26分)
7.(12分)(2011·吉安高一检测)向碳酸钠的浓溶液中逐滴加入稀盐酸直到不再产生二氧化碳气体为止。
(1)在此过程中,溶液中碳酸氢根离子浓度变化趋势可能是_______。
(2)所发生的化学反应方程式:________________。
【解析】碳酸钠中加入盐酸的过程可分为两步Na2CO3+HCl ==== NaHCO3+NaCl,此时HCO3-浓度逐渐增大,NaHCO3+HCl ==== NaCl+H2O+CO2↑,此过程HCO3-浓度逐渐减小。
答案:(1)先逐渐增大,而后逐渐减小
(2)Na2CO3+HCl ==== NaHCO3+NaCl,
NaHCO3+HCl ==== NaCl+H2O+CO2↑
【举一反三】如改为向NaOH溶液中慢慢通入CO2,则溶液中CO32-的物质的量浓度将如何变化?
提示:先增大后减小。CO2先与NaOH反应生成Na2CO3,当溶液中不再含有NaOH时,CO2与Na2CO3反应生成NaHCO3。
8.(14分)(2011·龙岩高一检测)碳元素在自然界中以多种形态存在。
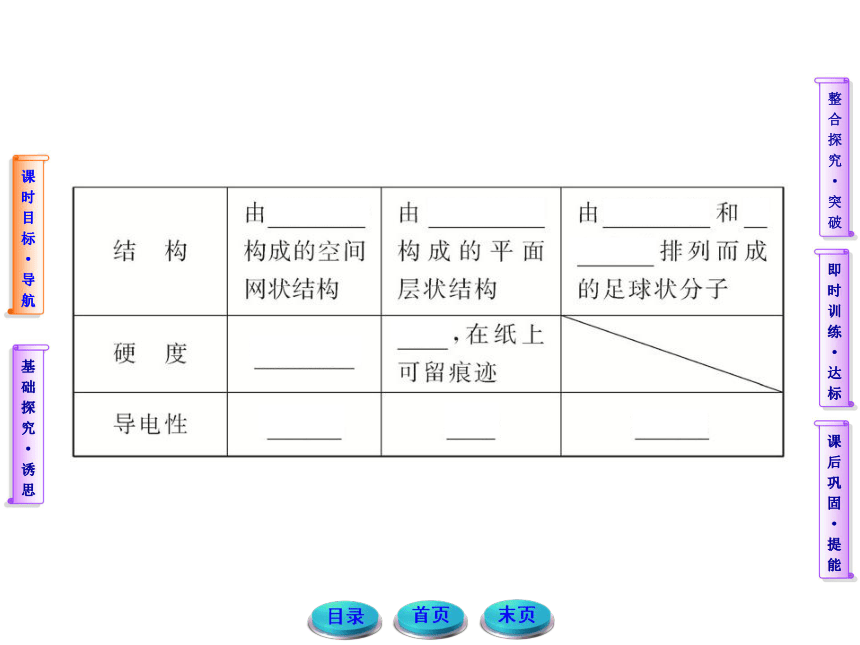
Ⅰ.如图A、B分别表示金刚石和石墨的结构模型。表中为金刚石和石墨的某些性质:
(1)金刚石转化为石墨属于_______变化(填“物理”或“化学”)。
(2)切割玻璃的玻璃刀应选用______(填“金刚石”或“石墨”)做材料。
(3)根据金刚石和石墨的结构和性质推断,下述观点不正确的是______(填字母)。
A.不同物质具有不同的结构
B.不同物质的组成元素一定不同
C.不同物质具有不同的性质
D.物质的结构决定了物质的性质
Ⅱ.碳酸盐是碳的重要化合物。碳酸钠和碳酸氢钠是应用广泛的两种碳酸盐。
(4)碳酸氢钠在日常生活中的一种用途是________。
(5)现有一包白色固体,为检验该粉末是碳酸钠还是碳酸氢钠,某同学设计如下方案开展实验。请根据要求填写空白:
【解析】同素异形体之间的相互转化属于化学变化,通过
表中的信息可知金刚石的硬度大,石墨较软,因此金刚石
可以用做玻璃刀的材料;同素异形体是指同种元素组成的
性质不同的单质,因此不同的物质可以是由同种元素组成
的。碳酸氢钠受热分解,产生二氧化碳。
答案:Ⅰ.(1)化学 (2)金刚石 (3)B
Ⅱ.(4)配制发酵粉
(5)2NaHCO3 Na2CO3+H2O+CO2↑,
CO2+Ca(OH)2 ==== CaCO3↓+H2O
△
====
1.结合所学的物质分析并完成下列问题:
(1)同一种元素构成的物质一定是纯净物吗?
提示:同一种元素可能形成多种同素异形体,多种单质形成混合物。
(2)组成元素相同的物质一定是同素异形体吗?
提示:不一定,同素异形体研究的对象是单质,如CO、CO2虽然其组成元素相同,但它们不是单质,故不是同素异形体。金刚石和石墨组成的混合物只由碳元素组成,与C60也不能互称同素异形体。
2.已知石墨在一定条件下可以转化为金刚石,试分析二者转化是物理变化还是化学变化?
提示:判断是物理变化还是化学变化的主要依据是看是否有新物质生成,金刚石和石墨的转化有新物质生成,所以是化学变化。
例1 下列叙述中,正确的是
A.由碳元素的单质组成的物质一定是纯净物
B.金刚石和石墨具有相似的化学性质
C.金刚石转化为石墨,有单质生成,该反应属于氧化还原反应
D.C60是新发现的一种碳的化合物
【规范解答】选B。由碳元素的单质组成的物质不一定为纯净物,也可能为混合物,如石墨、金刚石、C60混合,A排除。金刚石和石墨中的碳原子排列方式不同,因此其物理性质不同,化学性质相似,B选项正确。同素异形体之间的转化,虽然有单质生成,但碳元素的化合价未发生变化,故不属于氧化还原反应,排除C选项。C60属于单质而不是化合物,D排除。
【互动探究】若将B项中“化学性质”改为“物理性质”,该选项对吗?
提示:错误。同素异形体有相似的化学性质,但物理性质差别很大,如金刚石硬度大,不导电,石墨质软,能导电。
1.构成同素异形体的三个要素
(1)必须由同一种元素构成;
(2)必须是单质;
(3)必须具有不同的结构。
2.构成同素异形体的两种形式
(1)单质中原子的排列方式不同,如金刚石、石墨;
(2)单质中原子数目不同(如O2和O3)。
1.在有HCO3-存在时,如何检验溶液中是否含CO32-?
提示:加入CaCl2或BaCl2溶液,若产生沉淀,过滤,洗涤沉淀后,向沉淀中加稀盐酸,若产生无色无味且能使澄清石灰水变浑浊的气体,则原溶液中含CO32-;若加入CaCl2溶液或BaCl2溶液不产生沉淀,则原溶液中不含CO32-。
2.在有CO32-存在时,如何检验溶液中是否含HCO3-?
提示:应先加入足量的CaCl2溶液或BaCl2溶液,静置后取上层清液,然后再向清液中滴加稀盐酸,看是否产生无色无味且能使澄清石灰水变浑浊的气体,若产生,则原溶液中含HCO3-,若不产生,则原溶液中不含HCO3-。
例2 下列说法中正确的是
A.相同温度下,Na2CO3比NaHCO3难溶于水
B.Na2CO3比NaHCO3的稳定性强
C.CaCl2既能与Na2CO3反应,又能与NaHCO3反应
D.与足量盐酸反应要得到相同质量的CO2,用NaHCO3比Na2CO3的质量多
【规范解答】选B。一般情况下,碳酸盐的溶解性比碳酸氢盐的小,但Na2CO3和NaHCO3是特例,Na2CO3的溶解性比NaHCO3的大,故A错;Na2CO3受热不易分解,NaHCO3受热分解为Na2CO3、H2O和CO2,故B正确;CaCl2只与Na2CO3反应,不能和NaHCO3反应,故C错误;制取相同质量的CO2,假设制取44 g CO2,在盐酸足量的情况下,需NaHCO3 84 g,需Na2CO3 106 g,故D错误。
【互动探究】C选项中如果CaCl2换成澄清石灰水,该选项正确吗?
提示:正确。Ca(OH)2既能与Na2CO3反应,又能和NaHCO3反应。在和NaHCO3反应时,OH-和HCO3-先反应转化为CO32-和H2O,CO32-和Ca2+再反应产生沉淀。
【变式训练】纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这两种物质的方法正确的是( )
A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打
B.放入水中,能溶于水的为小苏打
C.等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,前者产生二氧化碳少
D.先将两样品配成溶液,再分别加入石灰水,无白色沉淀生成的是小苏打
【解析】选C。NaHCO3分解后生成Na2CO3,也有残留物,A错。Na2CO3和NaHCO3均能溶于水且均能与Ca(OH)2反应生成沉淀,B、D均错。
1.溶解性:若碳酸盐溶解度较大,则其对应的碳酸氢盐的溶解度小,如:Na2CO3>NaHCO3,若碳酸盐溶解度较小,则其对应的碳酸氢盐的溶解度较大,如:CaCO3
3.NaHCO3和Ca(OH)2反应的产物与反应物的用量有关:
(1)2NaHCO3+Ca(OH)2 ==== Na2CO3+CaCO3↓+2H2O[少量的Ca(OH)2]
(2)NaHCO3+Ca(OH)2 ==== NaOH+CaCO3↓+H2O[过量的
Ca(OH)2]
Na2CO3、NaHCO3的鉴别除杂
【示例】某学校的实验室有一瓶碳酸氢钠,由于放置时间过久,不知是否变质。请你利用所学过的知识,设计一个简单的实验,确定这瓶碳酸氢钠是否变质。你设计的实验方案:______________。
【解析】NaHCO3易分解,如果NaHCO3中含有Na2CO3,说明NaHCO3已变质。鉴别NaHCO3中是否含有Na2CO3可用CaCl2溶液。若NaHCO3完全变质,就会全部生成Na2CO3。
答案:取固体少量,加入试管中,加水配成溶液后滴加CaCl2溶液,有白色沉淀生成,说明NaHCO3已变质,若无白色沉淀生成,说明NaHCO3没有变质
探究:
1.如果该药品已变质,如何鉴别是否完全变质?
提示:称取一定量的药品,加热至质量不变化为止,若加热前后称得的质量相同,则完全变质;若不同,则部分变质。
2.如果该药品只有少部分变质,如何除去杂质?
提示:将药品溶于水,通入足量的CO2,蒸发结晶。
1.金刚石、石墨、C60性质有所不同,是由于( )
A.构成原子不同 B.原子的排列方式不同
C.具有不同的几何外形 D.硬度不同
【解析】选B。金刚石、石墨、C60三者是碳元素的同素异形体,构成原子的种类完全相同,只是其内部碳原子排列方式不同,才导致它们结构不同,进而性质不同。
2.(2011·潍坊高一检测)能用H++OH- ==== H2O来表示的化学反应是( )
A.Cu(OH)2和稀硫酸反应
B.NaOH溶液和HNO3溶液反应
C.KOH溶液和NaHCO3溶液反应
D.Ba(OH)2溶液和稀硫酸反应
【解析】选B。A选项的离子方程式为Cu(OH)2+2H+ ==== Cu2++2H2O,B选项的离子方程式为H++OH- ==== H2O,C选项的离子方程式为OH-+HCO3- ==== CO32-+H2O,D选项的离子方程式为Ba2++2OH-+2H++SO42- ==== BaSO4↓+2H2O。因此选B。
3.20世纪80年代后,人们发现和证实碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。下图所示为n个C60连接而成的物质X。下列有关说法不正确的是( )
A.X难溶于水
B.X的熔点比金刚石高
C.X是碳的一种同素异形体
D.X的摩尔质量为720n g/mol
【解析】选B。X的熔点比金刚石低。
4.有关Na2CO3和NaHCO3的叙述中正确的是( )
A.相同质量的Na2CO3 和NaHCO3与足量盐酸作用时,产生的气体质量相同
B.NaHCO3比Na2CO3热稳定性强
C.Na2CO3和NaHCO3均可与澄清石灰水反应
D.Na2CO3和NaHCO3均可与NaOH溶液反应
【解析】选C。相同质量的Na2CO3和NaHCO3含有的碳原子的物质的量不同,二者与足量的盐酸反应,碳原子全部转化到二氧化碳中,根据碳原子守恒,产生的二氧化碳的质量不同,因此A选项错误;NaHCO3受热易分解而Na2CO3受热不分解,因此后者热稳定性强,B选项错误;二者都能够与澄清石灰水反应生成白色沉淀碳酸钙,因此C选项正确;碳酸氢钠与氢氧化钠溶液反应,而碳酸钠不与氢氧化钠溶液反应,因此D选项错误。
5.(2011·佛山高一检测)碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸钠俗称_____,其水溶液呈_____(填“酸”、“碱”或“中”)性。等物质的量的碳酸钠和碳酸氢钠与足量等浓度盐酸反应时,反应的剧烈程度,前者_____后者(填“>”、“<”或“=”),生成CO2的量,前者_____后者(填“>”、“<”或“=”)。
(2)碳酸氢钠俗称_____,可治疗胃酸过多,反应的离子方程式为____________。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为
_________________。
【解析】碳酸钠俗称苏打或纯碱,碳酸氢钠俗称小苏打,二者的水溶液均呈碱性;碳酸钠与盐酸反应的实质是先发生①CO32-+H+ ==== HCO3-,再发生②HCO3-+H+ ==== CO2↑+
H2O,因此碳酸氢钠与盐酸反应更剧烈;等物质的量的碳酸钠与碳酸氢钠二者的碳原子的物质的量相等,根据碳原子守恒,二者与足量的盐酸反应产生的二氧化碳的物质的量相同;碳酸钠受热不分解,碳酸氢钠受热分解,因此可用加热的方法除去碳酸钠固体中的碳酸氢钠。
答案:(1)苏打或纯碱 碱 < =
(2)小苏打 HCO3-+H+ ==== H2O+CO2↑
(3)2NaHCO3 Na2CO3+CO2↑+H2O
△
====
一、选择题(本题包括6小题,每小题4分,共24分)
1.石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备损坏。这是由于石墨( )
A.具有放射性 B.易燃、易爆 C.能导电 D.质软
【解析】选C。石墨纤维有导电性,引起电线短路。
2.下列关于金刚石和石墨的说法中,不正确的是( )
A.它们都是由碳元素组成的单质
B.它们都是电的良导体
C.金刚石质硬,石墨质软
D.它们里面的碳原子排列不同
【解析】选B。金刚石和石墨均是由碳元素组成的单质,金刚石中碳原子以强的相互作用形成正四面体结构,质硬不导电,石墨中碳原子呈层状结构,碳原子以强的相互作用形成平面六边形结构,能导电、质软。
3.(2011·东营高一检测)澳大利亚研究人员最近开发出被称为第五形态的单质碳,这种新的碳结构称做“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性。纳米泡沫与金刚石的关系是( )
A.同一种物质 B.原子排列相同
C.同素异形体 D.在O2中充分燃烧都得不到CO2
【解析】选C。纳米泡沫也是一种单质碳,且原子排列与金刚石不同,不是同一种物质,二者是同素异形体,在O2中充分燃烧都得到CO2。
4.为除去括号内的杂质,所选用的试剂或方法不正确的是
( )
A.CO2(CO),将混合气体通过灼热的氧化铜
B.NaHCO3溶液(Na2CO3),向溶液中通入过量的CO2气体
C.CO2(HCl),将气体依次通过Na2CO3溶液和浓硫酸中
D.H2(HCl),将气体通入碱石灰中
【解析】选C。CO2也能和Na2CO3反应,所以应改为饱和NaHCO3溶液。
5.可以肯定溶液中大量存在CO32-的理由是( )
A.加入AgNO3溶液有白色沉淀产生
B.加入稀盐酸有无色无味气体产生
C.加入BaCl2溶液时有白色沉淀产生,再加稀盐酸沉淀溶解,产生可使澄清石灰水变浑浊的无色无味气体
D.加入Ba(OH)2溶液有白色沉淀产生,再加稀盐酸沉淀溶解,产生可使澄清石灰水变浑浊的无色无味气体
【解析】选C。A项溶液中若有Cl-,同样会产生AgCl白色沉淀;B、D项中会有HCO3-的干扰,B中反应为:HCO3-+H+ ==== CO2↑+H2O;D中的反应为Ba2++OH-+HCO3- ==== BaCO3↓+ H2O,BaCO3+2H+ ==== Ba2++CO2↑+H2O,同样会有上述现象产生,故选C。
6.现有25 mL 2 mol/L的Na2CO3溶液和75 mL 1 mol/L的稀盐酸,①将Na2CO3溶液缓缓滴加到稀盐酸中,②将稀盐酸缓缓滴加到Na2CO3溶液中,在标准状况下产生的气体情况是( )
A.均为0.84 L B.均为0.56 L C.①>② D.①<②
【解析】选C。
①将Na2CO3溶液滴入盐酸中:
Na2CO3+2HCl ==== 2NaCl+CO2↑+H2O
应按盐酸的量计算气体体积:
V1=0.075 mol× ×22.4 L/mol=0.84 L
②将盐酸滴入Na2CO3溶液中,反应分两步:
Na2CO3+HCl ==== NaCl+NaHCO3
NaHCO3+HCl ==== NaCl+CO2↑+H2O
生成的CO2用第二步余下的盐酸计算:
V2=(0.075 mol-0.05 mol)×22.4 L/mol=0.56 L
所以V1>V2。
【规律方法】Na2CO3溶液与盐酸反应产生气体情况的分析
Na2CO3溶液与盐酸相互滴加时,滴加顺序不同,产生CO2的量可能相同,也可能不同,可用下述方法快速判断产生气体情况:
当n(HCl)≥2n(Na2CO3)时,无论如何滴加,产生的CO2气体一样多;当n(HCl)<2n(Na2CO3)时,把Na2CO3溶液滴到盐酸中产生的CO2气体多。
二、非选择题(本题包括2小题,共26分)
7.(12分)(2011·吉安高一检测)向碳酸钠的浓溶液中逐滴加入稀盐酸直到不再产生二氧化碳气体为止。
(1)在此过程中,溶液中碳酸氢根离子浓度变化趋势可能是_______。
(2)所发生的化学反应方程式:________________。
【解析】碳酸钠中加入盐酸的过程可分为两步Na2CO3+HCl ==== NaHCO3+NaCl,此时HCO3-浓度逐渐增大,NaHCO3+HCl ==== NaCl+H2O+CO2↑,此过程HCO3-浓度逐渐减小。
答案:(1)先逐渐增大,而后逐渐减小
(2)Na2CO3+HCl ==== NaHCO3+NaCl,
NaHCO3+HCl ==== NaCl+H2O+CO2↑
【举一反三】如改为向NaOH溶液中慢慢通入CO2,则溶液中CO32-的物质的量浓度将如何变化?
提示:先增大后减小。CO2先与NaOH反应生成Na2CO3,当溶液中不再含有NaOH时,CO2与Na2CO3反应生成NaHCO3。
8.(14分)(2011·龙岩高一检测)碳元素在自然界中以多种形态存在。
Ⅰ.如图A、B分别表示金刚石和石墨的结构模型。表中为金刚石和石墨的某些性质:
(1)金刚石转化为石墨属于_______变化(填“物理”或“化学”)。
(2)切割玻璃的玻璃刀应选用______(填“金刚石”或“石墨”)做材料。
(3)根据金刚石和石墨的结构和性质推断,下述观点不正确的是______(填字母)。
A.不同物质具有不同的结构
B.不同物质的组成元素一定不同
C.不同物质具有不同的性质
D.物质的结构决定了物质的性质
Ⅱ.碳酸盐是碳的重要化合物。碳酸钠和碳酸氢钠是应用广泛的两种碳酸盐。
(4)碳酸氢钠在日常生活中的一种用途是________。
(5)现有一包白色固体,为检验该粉末是碳酸钠还是碳酸氢钠,某同学设计如下方案开展实验。请根据要求填写空白:
【解析】同素异形体之间的相互转化属于化学变化,通过
表中的信息可知金刚石的硬度大,石墨较软,因此金刚石
可以用做玻璃刀的材料;同素异形体是指同种元素组成的
性质不同的单质,因此不同的物质可以是由同种元素组成
的。碳酸氢钠受热分解,产生二氧化碳。
答案:Ⅰ.(1)化学 (2)金刚石 (3)B
Ⅱ.(4)配制发酵粉
(5)2NaHCO3 Na2CO3+H2O+CO2↑,
CO2+Ca(OH)2 ==== CaCO3↓+H2O
△
====
