11-12版高中化学课时讲练通配套课件:3.1.2 碳及其化合物间的转化(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:3.1.2 碳及其化合物间的转化(鲁科版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 00:00:00 | ||
图片预览








文档简介
(共61张PPT)
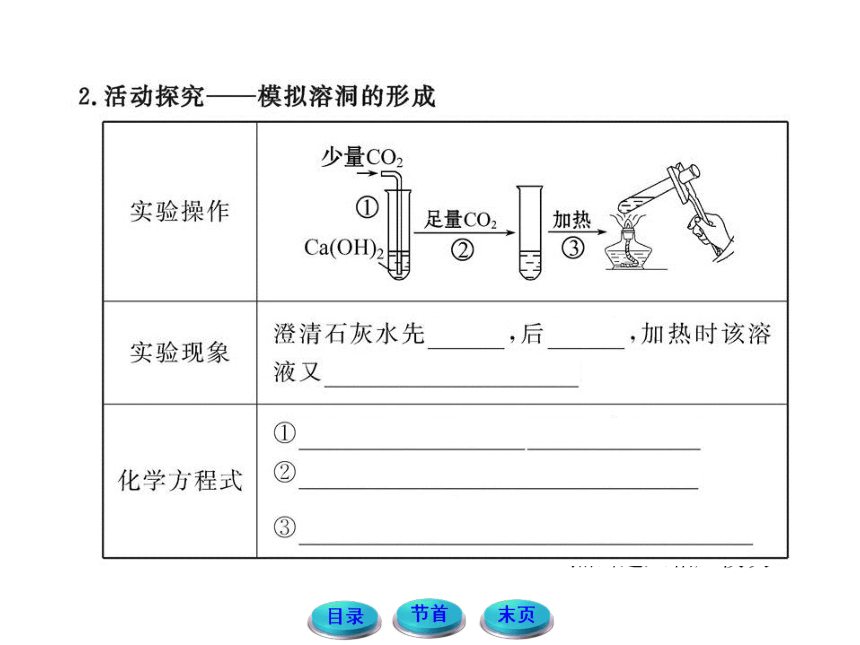
1.长期存放石灰水的瓶子,内壁会出现一层白色固体,请思考如何除去瓶壁上的白色固体?
提示:白色固体为CaCO3,可用盐酸溶解,其反应的化学方程式为:CaCO3+2HCl ==== CaCl2+CO2↑+H2O
2.当CO2气体中混有少量HCl和水蒸气时,请讨论如何才能把HCl和水蒸气除掉?
提示:CO2 气体中含有HCl、H2O等杂质时,先通过饱和NaHCO3溶液除去HCl,然后再通过浓硫酸除去水蒸气,最后得到干燥纯净的CO2 气体。
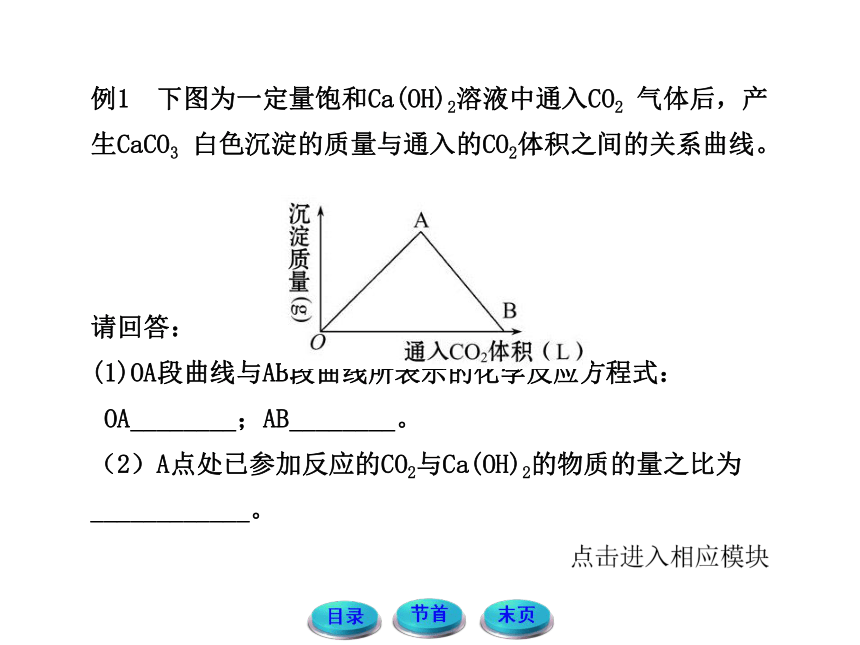
例1 下图为一定量饱和Ca(OH)2溶液中通入CO2 气体后,产生CaCO3 白色沉淀的质量与通入的CO2体积之间的关系曲线。
请回答:
(1)OA段曲线与AB段曲线所表示的化学反应方程式:
OA________;AB________。
(2)A点处已参加反应的CO2与Ca(OH)2的物质的量之比为____________。
【规范解答】(1)向饱和Ca(OH)2溶液中通入CO2气体一开始会产生白色沉淀,直到Ca(OH)2被完全反应后,白色沉淀量达到最大值,因此OA段的化学方程式为Ca(OH)2+CO2 ==== CaCO3↓+H2O;在Ca(OH)2完全转化为CaCO3后,继续通入CO2 气体会使白色沉淀CaCO3转化为易溶于水的Ca(HCO3)2,白色沉淀消失,因此AB段的化学方程式为CaCO3+CO2+H2O ==== Ca(HCO3)2。(2)A点处已参加反应的CO2与Ca(OH)2的物质的量之比可以根据OA段的化学方程式为Ca(OH)2+CO2 ==== CaCO3↓+H2O看出,为1∶1。
答案:(1)Ca(OH)2+CO2 ==== CaCO3↓+H2O
CaCO3+CO2+H2O ==== Ca(HCO3)2 (2)1∶1
【互动探究】(1)在上题中,B点处溶液中存在的浓度最大的两种离子分别是哪两种?
提示:在B点时CaCO3完全转化为Ca(HCO3)2,因此溶液中存在的浓度最大的离子为HCO3-和Ca2+。
(2)将上题中B点处生成的溶液煮沸,会出现什么现象?
提示:Ca(HCO3)2受热分解,因此会出现气体逸出、澄清的溶液变浑浊的现象。
1.CO2和Ca(OH)2反应现象及规律
(1)少量CO2通入澄清石灰水中,溶液变浑浊。
CO2+Ca(OH)2 ==== CaCO3↓+H2O
(2)过量CO2通入澄清石灰水中,溶液先变浑浊,后浑浊消失。
变浑浊:CO2+Ca(OH)2 ==== CaCO3↓+H2O ①
浑浊消失:CaCO3+H2O+CO2 ==== Ca(HCO3)2 ②
①、②两式合并:Ca(OH)2+2CO2 ==== Ca(HCO3)2
2.CaCO3和Ca(HCO3)2的性质比较
(1)CaCO3的溶解性比Ca(HCO3)2小
CaCO3的稳定性比Ca(HCO3)2强
(2)等物质的量的CaCO3和Ca(HCO3)2与足量盐酸反应,CaCO3和Ca(HCO3)2消耗盐酸一样多,但Ca(HCO3)2和盐酸反应放出CO2多。CaCO3+2HCl ==== CaCl2+CO2↑+H2O
Ca(HCO3)2+2HCl ==== CaCl2+2CO2↑+2H2O
1.试探究如何实现CO2、CO32-、HCO3-之间的相互转化。
提示:
②与过量酸反应:CO32-+2H+ ==== H2O+CO2↑
提示:
提示:
2.向饱和Na2CO3溶液中通入CO2会有什么现象?试解释其原因。
提示:有白色物质析出:
Na2CO3溶液中通入CO2后发生反应
Na2CO3+CO2+H2O ==== 2NaHCO3,
由于NaHCO3的溶解度比Na2CO3的小,反应过程中消耗了水,且生成NaHCO3的质量大,所以有NaHCO3析出。
例2 A、B、C、D、E五种物质的转化关系如图所示。已知A为二元碱,微溶于水且溶解度随温度升高而降低。
(1)写出各物质的化学式:
A_____;B_____;C_____;D_____;E_____。
(2)写出下列两个变化的离子方程式:
B→D_________。B→E__________。
【自主解答】A为Ca(OH)2,Ca(OH)2与过量CO2反应生成B,B为Ca(HCO3)2,Ca(HCO3)2受热分解成C,C为CaCO3,CaCO3与盐酸反应生成D,D为CaCl2。
答案:(1)Ca(OH)2 Ca(HCO3)2 CaCO3 CaCl2 Na2CO3
(2)HCO3-+H+ ==== CO2↑+H2O
Ca2++2HCO3-+2OH- ==== CaCO3↓+CO32-+2H2O
【互动探究】E溶液中混有一定量的NaOH,可通过哪种途径得到纯净的固体E?
提示:Na2CO3溶液中混有少量NaOH时,可向该溶液中通入足量CO2,使CO2与NaOH转化为NaHCO3,然后蒸干溶液并灼烧即可得到纯净的Na2CO3固体。
1.碳酸盐与碳酸氢盐之间的转化:
(1)碳酸盐会与二氧化碳、水发生反应生成碳酸氢盐;
(2)碳酸氢盐受热会分解为碳酸盐、二氧化碳与水。
2.混合气体成分检验遵循先检验容易检测的气体,然后再依次通过试剂,逐一检测,检测过程中注意排除干扰气体。
1.(2011·南通高一检测)控制二氧化碳排放,需要从人人做起,“低碳生活”成为新的时尚潮流。下列不属于“低碳生活”方式的是( )
A.多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机
B.尽量使用太阳能等代替化石燃料
C.减少使用一次性餐具
D.提倡塑料袋的无偿使用
【解析】选D。A、B、C三项均为低能耗范围,属于“低碳生活”的范畴,D选项不属于“低碳生活”范畴。
2.(2011·长春高一检测)为了验证小苏打中是否含有纯碱,下列实验操作及判断正确的是( )
A.观察加热时是否放出气体
B.观察滴加盐酸时能否放出气体
C.溶于水中,再滴加石灰水,观察有无沉淀产生
D.溶于水中,滴加少量的氯化钡溶液,观察有无白色沉淀产生
【解析】选D。碳酸氢钠俗称小苏打,碳酸钠俗称苏打、纯碱。碳酸氢钠受热分解,而碳酸钠受热不分解,A选项只能够说明含有碳酸氢钠;二者都能够与盐酸反应放出气体,都能够与澄清石灰水反应,生成白色沉淀,因此B、C选项也无法证明其中含有碳酸钠;碳酸钠能够与氯化钡溶液反应产生白色沉淀,而碳酸氢钠不行,因此D选项正确。
3.下列既能跟NaOH溶液反应,又能跟盐酸反应的是( )
A.Na2CO3溶液 B.CaCO3
C.NaHCO3溶液 D.Na2SO4溶液
【解析】选C。选项A、B只能与盐酸反应;选项D与两者均不能反应;选项C既可以发生HCO3-+H+ ==== H2O+CO2↑也可以发生HCO3-+OH- ==== CO32-+ H2O。
4.某无色混合气体可能含有CO2、CO、H2、H2O(g)中的一种或几种,依次进行如下处理(假定每次处理均反应完全):①通过碱石灰时,气体体积变小;②通过炽热的氧化铜时,固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色;④通过澄清石灰水时,溶液变为浑浊。由此可以确定原混合气体中( )
A.一定含有CO2、H2O(g),H2、CO至少有一种
B.一定含有CO、H2O(g),H2、CO2至少有一种
C.一定含有CO、CO2,H2、H2O(g)至少有一种
D.一定含有CO、H2,CO2、H2O(g)至少有一种
【解析】选D。①通过碱石灰时,气体体积变小,说明混合气体中至少含有CO2、H2O(g)中的一种;②通过炽热的氧化铜时,固体变为红色,说明混合气体中至少含有CO、H2中的一种;③通过白色硫酸铜粉末时,粉末变为蓝色,说明此时有H2O生成,则肯定有H2;④通过澄清石灰水时,溶液变为浑浊,说明此时有CO2生成,则肯定有CO。因此D项正确。
5.(1)实验室中用大理石和稀盐酸反应制取CO2气体,发生反应的离子方程式为_____________。
(2)为制备干燥、纯净的CO2气体,将大理石和稀盐酸反应,生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入______。
A.饱和Na2CO3溶液;无水CaCl2固体
B.饱和NaHCO3溶液;浓硫酸
C.浓硫酸;饱和Na2CO3溶液
D.饱和Na2CO3溶液;稀硫酸
(3)实验室中检验CO2气体最方便的方法是将CO2气体通入足量的饱和澄清石灰水中,产生的实验现象是_______,反应的化学方程式为_____________。
(4)如果大气中二氧化碳的含量明显增加,就会引起“温室效应”,导致全球变暖。从生物地球化学循环的角度,指出降低“温室效应”的措施是_______和______。
(5)请列举CO2在工农业生产和社会生活方面的重要用途。(不少于4种)
答:___________________________________________。
【解析】此题重点考查了CO2实验室制法,在写离子方程式时应该注意易溶于水的强电解质可拆,难溶物、弱电解质、氧化物、单质不可拆。由实验室制法得到的CO2中会含有少量的HCl、H2O(g),想得到干燥、纯净的CO2,必须先除去HCl,再除去H2O(g),在除杂时不能将CO2除掉,B选项可以;A项中通过饱和Na2CO3时,CO2、HCl都除掉了,A选项错误;C选项将气体通过浓硫酸将水蒸气除掉,但是当气体通过饱和Na2CO3溶液时,把CO2、HCl都除掉了,因此C选项错误;同样D选项将气体通过饱和Na2CO3溶液时把CO2、HCl都除掉了,因此D选项错误。
答案:(1)CaCO3+2H+ ==== Ca2++CO2↑+H2O (2)B
(3)产生白色沉淀(或白色浑浊)
Ca(OH)2+CO2 ==== CaCO3↓+H2O
(4)增加绿色植物的数量 减少化石燃料的消耗
(5)用干冰进行人工降雨,用干冰作制冷剂,用CO2做碳酸饮料,用CO2作保护气、灭火
一、选择题(本题包括6小题,每小题4分,共24分)
1.欲除去NaHCO3溶液中少量的Na2CO3可加入( )
A.饱和石灰水 B.NaOH溶液 C.盐酸 D.通入CO2
【解析】选D。选项A、B、C都能够与NaHCO3发生反应,将NaHCO3反应掉;D选项可以将Na2CO3转化为NaHCO3。
【举一反三】欲除去NaCl溶液中的Ca2+、Mg2+、Fe3+、
SO42-,蒸发得到较为纯净的NaCl晶体依次加入哪些试剂(只填化学式)。
提示:依次加入过量的BaCl2、NaOH、Na2CO3、HCl,其中NaOH溶液的加入顺序不影响。
2.下列离子方程式正确的是( )
A.钠与水反应:2Na+2H2O ==== 2Na++2OH-+H2↑
B.氧化钠与盐酸:O2-+2H+ ==== H2O
C.碳酸氢钠与稀硫酸:CO32-+2H+ ==== H2O+CO2↑
D.烧碱溶液与碳酸氢钠溶液:HCO3-+OH- ==== H2O+CO2↑
【解析】选A。离子方程式的正误判断主要从电荷、原子、电子守恒、离子改写及是否尊重事实等角度分析。B中氧化钠不拆写,C中碳酸氢根离子拆写错,D中生成物为H2O和CO32-。
3.下列叙述中正确的是( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2
C.等质量的Na2CO3和NaHCO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入足量CO2,有NaHCO3结晶析出
【解析】选D。本题考查碳酸盐与碳酸氢盐之间的转化问题。在含有碳酸钙沉淀的溶液中通入二氧化碳至恰好生成碳酸氢钙,其与碳酸氢钠混合不发生反应,不会生成碳酸钙沉淀,A项错误;碳酸钠与盐酸的反应分步进行,等物质的量的盐酸与碳酸钠反应只生成碳酸氢钠,即Na2CO3+HCl ==== NaCl+NaHCO3,B项错误;等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应:Na2CO3+2HCl ==== 2NaCl+CO2↑+ H2O,NaHCO3+HCl ==== NaCl+CO2↑+H2O,产生的二氧化
碳在同条件下体积比为84∶106=42∶53,C项错误;向碳酸钠饱和溶液中通入足量二氧化碳,生成碳酸氢钠,由于碳酸氢钠溶解度小于碳酸钠的溶解度,且溶剂减少、生成溶质质量增多,故析出碳酸氢钠晶体(Na2CO3+CO2+H2O ==== 2NaHCO3↓),D项正确。
4.按图所示装置持续通入X气体,
并在管口P处点燃,实验结果使
澄清的石灰水变浑浊,下列情况:
①H2和NaHCO3,②CO和Na2CO3,
③CO和CuO,④H2和Fe2O3中符合
题意的X、Y可以是( )
A.只有①② B.只有①③
C.只有①②③ D.只有③④
【解析】选B。①H2点燃会使NaHCO3分解产生CO2使澄清石灰水变浑浊;②Na2CO3受热不会分解;③CO和CuO反应产生CO2使澄清石灰水变浑浊;④H2和Fe2O3反应不会使澄清石灰水变浑浊。
5.(2011·新乡高一检测)小苏打和苏打分别和同浓度的盐酸反应,下列说法正确的是( )
A.Na2CO3与盐酸反应,要比NaHCO3与盐酸的反应剧烈得多
B.相同物质的量Na2CO3和NaHCO3与盐酸完全反应,产生的CO2一样多
C.实验室制取CO2通常用NaHCO3和盐酸反应
D.相同物质的量的Na2CO3和NaHCO3与盐酸反应完全,耗去盐酸的量一样多
【解析】选B。碳酸钠与盐酸反应的实质是先发生
①CO32-+H+ ==== HCO3-,再发生②HCO3-+H+ ==== CO2↑+ H2O,因此碳酸氢钠与盐酸反应更剧烈,因此A选项错误;等物质的量的碳酸钠与碳酸氢钠二者的碳原子的物质的量相同,根据碳原子守恒,二者与足量的盐酸反应产生的二氧化碳的物质的量相同,因此B选项正确;实验室制取CO2通常用CaCO3和盐酸反应,因此C选项错误;碳酸钠、碳酸氢钠与足量盐酸反应的离子方程式分别为CO32-+2H+ ==== CO2↑+H2O,HCO3-+H+ ==== CO2↑+ H2O,因此等物质的量的碳酸钠、碳酸氢钠与盐酸完全反应,碳酸钠消耗的盐酸的量多,因此D选项错误。
6.将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量关系的是( )
【解析】选C。向溶液中滴加0.1 mol·L-1稀盐酸,稀盐酸会先和NaOH反应,然后再和Na2CO3反应产生CO2,0.4 g NaOH的物质的量为0.01 mol,完全反应消耗HCl 0.01 mol,1.06 g Na2CO3的物质的量为0.01 mol,Na2CO3先和HCl反应转化为0.01 mol NaHCO3,0.01 mol NaHCO3再和HCl反应,产生CO2 0.01 mol;故图像C是正确的。
二、非选择题(本题包括2小题,共26分)
7.(14分)(2011·乌鲁木齐高一检测)工业生产的纯碱常含有少量的NaCl等杂质。如图是测定产品中Na2CO3质量分数的实验装置。操作步骤有:
A.在干燥管内填满碱石灰,质量为m g
B.取n g样品装入广口瓶中
C.检查装置气密性
D.关闭止水夹
E.打开止水夹
F.缓慢鼓入空气数分钟,再称干燥管质量为W g
G.缓慢加入稀硫酸至不再产生气体为止
H.缓缓鼓入空气数分钟
(1)正确的操作顺序是:
C→B→E→H→D→A→G→E→F
(2)步骤F中,要缓缓鼓入空气数分钟,鼓入空气的目的是_____________,装置甲的作用是_______________,
装置乙的作用是______________。
(3)计算溶液中Na2CO3的质量分数的计算式是______。
(4)若去掉装置甲,测定结果会_______,若去掉装置乙,测定结果会_______。(填“偏大”、“偏小”或“无影响”)
【解析】对于实验题首先应该弄清楚本实验的目的是通过
测定碳酸钠与稀硫酸溶液反应产生的二氧化碳的质量,依
此求得碳酸钠的质量。为了减少误差应该让产生的二氧化
碳全部被本实验中的碱石灰吸收,从而减小在测定二氧化
碳质量时的误差。让空气经过氢氧化钠溶液除去混在空气
中的二氧化碳,以减小误差;而后让除去二氧化碳后的空
气把反应产生的二氧化碳赶入乙容器中,除去水蒸气,而
后被碱石灰吸收。碳酸钠的质量分数的计算式:
×106 g·mol-1÷n g×100%。如果去掉装置甲,会使空气
中的二氧化碳被碱石灰吸收,导致测得的二氧化碳的质量
偏大;若去掉装置乙会使水蒸气被碱石灰吸收,导致测得
的二氧化碳的质量偏大。
答案:(2)使广口瓶中产生的CO2气体全部排出 吸收空气中的CO2 吸收CO2中的水蒸气
(3) ×100% (4)偏大 偏大
8.(12分)如图表示往某Na2CO3溶液中滴入稀盐酸产生CO2的过程。
(1)写出a点以前发生反应的离子方程
式___________。
(2)写出a点到b点发生反应的离子方程
式___________。
(3)若某Na2CO3溶液中含m mol Na2CO3,
滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2∶1,则滴入稀盐酸的物质的量等于_____mol(用m表示)。
【解析】向Na2CO3溶液中逐渐滴加HCl时,发生的反应依次
为Na2CO3+HCl ==== NaCl+NaHCO3 ①
NaHCO3+HCl ==== NaCl+CO2↑+H2O ②
(1)a点以前发生反应①,离子方程式为CO32-+H+ ====
HCO3-。
(2)a点到b点,发生反应②,离子方程式为
HCO3-+H+ ==== CO2↑+H2O。
(3)根据反应①、②,当n(Cl-)∶n(HCO3-)=2∶1时,Na2CO3
部分转化为NaHCO3,所以
解得n(HCl)=4m/3 mol。
答案:(1)CO32-+H+ ==== HCO3-
(2)HCO3-+H+ ==== CO2↑+H2O (3)4m/3
【规律方法】解图像题三步曲:“一看”、“二想”、“三判断”
(1)“一看”(看图像)
①看面:弄清纵、横坐标的含义。②看线:弄清线的走向、变化趋势及线的陡与平。③看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等。④看量的变化:弄清是浓度变化、物质的量的变化还是转化率的变化。
(2)“二想”
看完线后联想有关的化学方程式。
(3)“三判断”
通过分析,依据化学方程式,作出正确判断。
1.长期存放石灰水的瓶子,内壁会出现一层白色固体,请思考如何除去瓶壁上的白色固体?
提示:白色固体为CaCO3,可用盐酸溶解,其反应的化学方程式为:CaCO3+2HCl ==== CaCl2+CO2↑+H2O
2.当CO2气体中混有少量HCl和水蒸气时,请讨论如何才能把HCl和水蒸气除掉?
提示:CO2 气体中含有HCl、H2O等杂质时,先通过饱和NaHCO3溶液除去HCl,然后再通过浓硫酸除去水蒸气,最后得到干燥纯净的CO2 气体。
例1 下图为一定量饱和Ca(OH)2溶液中通入CO2 气体后,产生CaCO3 白色沉淀的质量与通入的CO2体积之间的关系曲线。
请回答:
(1)OA段曲线与AB段曲线所表示的化学反应方程式:
OA________;AB________。
(2)A点处已参加反应的CO2与Ca(OH)2的物质的量之比为____________。
【规范解答】(1)向饱和Ca(OH)2溶液中通入CO2气体一开始会产生白色沉淀,直到Ca(OH)2被完全反应后,白色沉淀量达到最大值,因此OA段的化学方程式为Ca(OH)2+CO2 ==== CaCO3↓+H2O;在Ca(OH)2完全转化为CaCO3后,继续通入CO2 气体会使白色沉淀CaCO3转化为易溶于水的Ca(HCO3)2,白色沉淀消失,因此AB段的化学方程式为CaCO3+CO2+H2O ==== Ca(HCO3)2。(2)A点处已参加反应的CO2与Ca(OH)2的物质的量之比可以根据OA段的化学方程式为Ca(OH)2+CO2 ==== CaCO3↓+H2O看出,为1∶1。
答案:(1)Ca(OH)2+CO2 ==== CaCO3↓+H2O
CaCO3+CO2+H2O ==== Ca(HCO3)2 (2)1∶1
【互动探究】(1)在上题中,B点处溶液中存在的浓度最大的两种离子分别是哪两种?
提示:在B点时CaCO3完全转化为Ca(HCO3)2,因此溶液中存在的浓度最大的离子为HCO3-和Ca2+。
(2)将上题中B点处生成的溶液煮沸,会出现什么现象?
提示:Ca(HCO3)2受热分解,因此会出现气体逸出、澄清的溶液变浑浊的现象。
1.CO2和Ca(OH)2反应现象及规律
(1)少量CO2通入澄清石灰水中,溶液变浑浊。
CO2+Ca(OH)2 ==== CaCO3↓+H2O
(2)过量CO2通入澄清石灰水中,溶液先变浑浊,后浑浊消失。
变浑浊:CO2+Ca(OH)2 ==== CaCO3↓+H2O ①
浑浊消失:CaCO3+H2O+CO2 ==== Ca(HCO3)2 ②
①、②两式合并:Ca(OH)2+2CO2 ==== Ca(HCO3)2
2.CaCO3和Ca(HCO3)2的性质比较
(1)CaCO3的溶解性比Ca(HCO3)2小
CaCO3的稳定性比Ca(HCO3)2强
(2)等物质的量的CaCO3和Ca(HCO3)2与足量盐酸反应,CaCO3和Ca(HCO3)2消耗盐酸一样多,但Ca(HCO3)2和盐酸反应放出CO2多。CaCO3+2HCl ==== CaCl2+CO2↑+H2O
Ca(HCO3)2+2HCl ==== CaCl2+2CO2↑+2H2O
1.试探究如何实现CO2、CO32-、HCO3-之间的相互转化。
提示:
②与过量酸反应:CO32-+2H+ ==== H2O+CO2↑
提示:
提示:
2.向饱和Na2CO3溶液中通入CO2会有什么现象?试解释其原因。
提示:有白色物质析出:
Na2CO3溶液中通入CO2后发生反应
Na2CO3+CO2+H2O ==== 2NaHCO3,
由于NaHCO3的溶解度比Na2CO3的小,反应过程中消耗了水,且生成NaHCO3的质量大,所以有NaHCO3析出。
例2 A、B、C、D、E五种物质的转化关系如图所示。已知A为二元碱,微溶于水且溶解度随温度升高而降低。
(1)写出各物质的化学式:
A_____;B_____;C_____;D_____;E_____。
(2)写出下列两个变化的离子方程式:
B→D_________。B→E__________。
【自主解答】A为Ca(OH)2,Ca(OH)2与过量CO2反应生成B,B为Ca(HCO3)2,Ca(HCO3)2受热分解成C,C为CaCO3,CaCO3与盐酸反应生成D,D为CaCl2。
答案:(1)Ca(OH)2 Ca(HCO3)2 CaCO3 CaCl2 Na2CO3
(2)HCO3-+H+ ==== CO2↑+H2O
Ca2++2HCO3-+2OH- ==== CaCO3↓+CO32-+2H2O
【互动探究】E溶液中混有一定量的NaOH,可通过哪种途径得到纯净的固体E?
提示:Na2CO3溶液中混有少量NaOH时,可向该溶液中通入足量CO2,使CO2与NaOH转化为NaHCO3,然后蒸干溶液并灼烧即可得到纯净的Na2CO3固体。
1.碳酸盐与碳酸氢盐之间的转化:
(1)碳酸盐会与二氧化碳、水发生反应生成碳酸氢盐;
(2)碳酸氢盐受热会分解为碳酸盐、二氧化碳与水。
2.混合气体成分检验遵循先检验容易检测的气体,然后再依次通过试剂,逐一检测,检测过程中注意排除干扰气体。
1.(2011·南通高一检测)控制二氧化碳排放,需要从人人做起,“低碳生活”成为新的时尚潮流。下列不属于“低碳生活”方式的是( )
A.多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机
B.尽量使用太阳能等代替化石燃料
C.减少使用一次性餐具
D.提倡塑料袋的无偿使用
【解析】选D。A、B、C三项均为低能耗范围,属于“低碳生活”的范畴,D选项不属于“低碳生活”范畴。
2.(2011·长春高一检测)为了验证小苏打中是否含有纯碱,下列实验操作及判断正确的是( )
A.观察加热时是否放出气体
B.观察滴加盐酸时能否放出气体
C.溶于水中,再滴加石灰水,观察有无沉淀产生
D.溶于水中,滴加少量的氯化钡溶液,观察有无白色沉淀产生
【解析】选D。碳酸氢钠俗称小苏打,碳酸钠俗称苏打、纯碱。碳酸氢钠受热分解,而碳酸钠受热不分解,A选项只能够说明含有碳酸氢钠;二者都能够与盐酸反应放出气体,都能够与澄清石灰水反应,生成白色沉淀,因此B、C选项也无法证明其中含有碳酸钠;碳酸钠能够与氯化钡溶液反应产生白色沉淀,而碳酸氢钠不行,因此D选项正确。
3.下列既能跟NaOH溶液反应,又能跟盐酸反应的是( )
A.Na2CO3溶液 B.CaCO3
C.NaHCO3溶液 D.Na2SO4溶液
【解析】选C。选项A、B只能与盐酸反应;选项D与两者均不能反应;选项C既可以发生HCO3-+H+ ==== H2O+CO2↑也可以发生HCO3-+OH- ==== CO32-+ H2O。
4.某无色混合气体可能含有CO2、CO、H2、H2O(g)中的一种或几种,依次进行如下处理(假定每次处理均反应完全):①通过碱石灰时,气体体积变小;②通过炽热的氧化铜时,固体变为红色;③通过白色硫酸铜粉末时,粉末变为蓝色;④通过澄清石灰水时,溶液变为浑浊。由此可以确定原混合气体中( )
A.一定含有CO2、H2O(g),H2、CO至少有一种
B.一定含有CO、H2O(g),H2、CO2至少有一种
C.一定含有CO、CO2,H2、H2O(g)至少有一种
D.一定含有CO、H2,CO2、H2O(g)至少有一种
【解析】选D。①通过碱石灰时,气体体积变小,说明混合气体中至少含有CO2、H2O(g)中的一种;②通过炽热的氧化铜时,固体变为红色,说明混合气体中至少含有CO、H2中的一种;③通过白色硫酸铜粉末时,粉末变为蓝色,说明此时有H2O生成,则肯定有H2;④通过澄清石灰水时,溶液变为浑浊,说明此时有CO2生成,则肯定有CO。因此D项正确。
5.(1)实验室中用大理石和稀盐酸反应制取CO2气体,发生反应的离子方程式为_____________。
(2)为制备干燥、纯净的CO2气体,将大理石和稀盐酸反应,生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入______。
A.饱和Na2CO3溶液;无水CaCl2固体
B.饱和NaHCO3溶液;浓硫酸
C.浓硫酸;饱和Na2CO3溶液
D.饱和Na2CO3溶液;稀硫酸
(3)实验室中检验CO2气体最方便的方法是将CO2气体通入足量的饱和澄清石灰水中,产生的实验现象是_______,反应的化学方程式为_____________。
(4)如果大气中二氧化碳的含量明显增加,就会引起“温室效应”,导致全球变暖。从生物地球化学循环的角度,指出降低“温室效应”的措施是_______和______。
(5)请列举CO2在工农业生产和社会生活方面的重要用途。(不少于4种)
答:___________________________________________。
【解析】此题重点考查了CO2实验室制法,在写离子方程式时应该注意易溶于水的强电解质可拆,难溶物、弱电解质、氧化物、单质不可拆。由实验室制法得到的CO2中会含有少量的HCl、H2O(g),想得到干燥、纯净的CO2,必须先除去HCl,再除去H2O(g),在除杂时不能将CO2除掉,B选项可以;A项中通过饱和Na2CO3时,CO2、HCl都除掉了,A选项错误;C选项将气体通过浓硫酸将水蒸气除掉,但是当气体通过饱和Na2CO3溶液时,把CO2、HCl都除掉了,因此C选项错误;同样D选项将气体通过饱和Na2CO3溶液时把CO2、HCl都除掉了,因此D选项错误。
答案:(1)CaCO3+2H+ ==== Ca2++CO2↑+H2O (2)B
(3)产生白色沉淀(或白色浑浊)
Ca(OH)2+CO2 ==== CaCO3↓+H2O
(4)增加绿色植物的数量 减少化石燃料的消耗
(5)用干冰进行人工降雨,用干冰作制冷剂,用CO2做碳酸饮料,用CO2作保护气、灭火
一、选择题(本题包括6小题,每小题4分,共24分)
1.欲除去NaHCO3溶液中少量的Na2CO3可加入( )
A.饱和石灰水 B.NaOH溶液 C.盐酸 D.通入CO2
【解析】选D。选项A、B、C都能够与NaHCO3发生反应,将NaHCO3反应掉;D选项可以将Na2CO3转化为NaHCO3。
【举一反三】欲除去NaCl溶液中的Ca2+、Mg2+、Fe3+、
SO42-,蒸发得到较为纯净的NaCl晶体依次加入哪些试剂(只填化学式)。
提示:依次加入过量的BaCl2、NaOH、Na2CO3、HCl,其中NaOH溶液的加入顺序不影响。
2.下列离子方程式正确的是( )
A.钠与水反应:2Na+2H2O ==== 2Na++2OH-+H2↑
B.氧化钠与盐酸:O2-+2H+ ==== H2O
C.碳酸氢钠与稀硫酸:CO32-+2H+ ==== H2O+CO2↑
D.烧碱溶液与碳酸氢钠溶液:HCO3-+OH- ==== H2O+CO2↑
【解析】选A。离子方程式的正误判断主要从电荷、原子、电子守恒、离子改写及是否尊重事实等角度分析。B中氧化钠不拆写,C中碳酸氢根离子拆写错,D中生成物为H2O和CO32-。
3.下列叙述中正确的是( )
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2
C.等质量的Na2CO3和NaHCO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入足量CO2,有NaHCO3结晶析出
【解析】选D。本题考查碳酸盐与碳酸氢盐之间的转化问题。在含有碳酸钙沉淀的溶液中通入二氧化碳至恰好生成碳酸氢钙,其与碳酸氢钠混合不发生反应,不会生成碳酸钙沉淀,A项错误;碳酸钠与盐酸的反应分步进行,等物质的量的盐酸与碳酸钠反应只生成碳酸氢钠,即Na2CO3+HCl ==== NaCl+NaHCO3,B项错误;等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应:Na2CO3+2HCl ==== 2NaCl+CO2↑+ H2O,NaHCO3+HCl ==== NaCl+CO2↑+H2O,产生的二氧化
碳在同条件下体积比为84∶106=42∶53,C项错误;向碳酸钠饱和溶液中通入足量二氧化碳,生成碳酸氢钠,由于碳酸氢钠溶解度小于碳酸钠的溶解度,且溶剂减少、生成溶质质量增多,故析出碳酸氢钠晶体(Na2CO3+CO2+H2O ==== 2NaHCO3↓),D项正确。
4.按图所示装置持续通入X气体,
并在管口P处点燃,实验结果使
澄清的石灰水变浑浊,下列情况:
①H2和NaHCO3,②CO和Na2CO3,
③CO和CuO,④H2和Fe2O3中符合
题意的X、Y可以是( )
A.只有①② B.只有①③
C.只有①②③ D.只有③④
【解析】选B。①H2点燃会使NaHCO3分解产生CO2使澄清石灰水变浑浊;②Na2CO3受热不会分解;③CO和CuO反应产生CO2使澄清石灰水变浑浊;④H2和Fe2O3反应不会使澄清石灰水变浑浊。
5.(2011·新乡高一检测)小苏打和苏打分别和同浓度的盐酸反应,下列说法正确的是( )
A.Na2CO3与盐酸反应,要比NaHCO3与盐酸的反应剧烈得多
B.相同物质的量Na2CO3和NaHCO3与盐酸完全反应,产生的CO2一样多
C.实验室制取CO2通常用NaHCO3和盐酸反应
D.相同物质的量的Na2CO3和NaHCO3与盐酸反应完全,耗去盐酸的量一样多
【解析】选B。碳酸钠与盐酸反应的实质是先发生
①CO32-+H+ ==== HCO3-,再发生②HCO3-+H+ ==== CO2↑+ H2O,因此碳酸氢钠与盐酸反应更剧烈,因此A选项错误;等物质的量的碳酸钠与碳酸氢钠二者的碳原子的物质的量相同,根据碳原子守恒,二者与足量的盐酸反应产生的二氧化碳的物质的量相同,因此B选项正确;实验室制取CO2通常用CaCO3和盐酸反应,因此C选项错误;碳酸钠、碳酸氢钠与足量盐酸反应的离子方程式分别为CO32-+2H+ ==== CO2↑+H2O,HCO3-+H+ ==== CO2↑+ H2O,因此等物质的量的碳酸钠、碳酸氢钠与盐酸完全反应,碳酸钠消耗的盐酸的量多,因此D选项错误。
6.将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量关系的是( )
【解析】选C。向溶液中滴加0.1 mol·L-1稀盐酸,稀盐酸会先和NaOH反应,然后再和Na2CO3反应产生CO2,0.4 g NaOH的物质的量为0.01 mol,完全反应消耗HCl 0.01 mol,1.06 g Na2CO3的物质的量为0.01 mol,Na2CO3先和HCl反应转化为0.01 mol NaHCO3,0.01 mol NaHCO3再和HCl反应,产生CO2 0.01 mol;故图像C是正确的。
二、非选择题(本题包括2小题,共26分)
7.(14分)(2011·乌鲁木齐高一检测)工业生产的纯碱常含有少量的NaCl等杂质。如图是测定产品中Na2CO3质量分数的实验装置。操作步骤有:
A.在干燥管内填满碱石灰,质量为m g
B.取n g样品装入广口瓶中
C.检查装置气密性
D.关闭止水夹
E.打开止水夹
F.缓慢鼓入空气数分钟,再称干燥管质量为W g
G.缓慢加入稀硫酸至不再产生气体为止
H.缓缓鼓入空气数分钟
(1)正确的操作顺序是:
C→B→E→H→D→A→G→E→F
(2)步骤F中,要缓缓鼓入空气数分钟,鼓入空气的目的是_____________,装置甲的作用是_______________,
装置乙的作用是______________。
(3)计算溶液中Na2CO3的质量分数的计算式是______。
(4)若去掉装置甲,测定结果会_______,若去掉装置乙,测定结果会_______。(填“偏大”、“偏小”或“无影响”)
【解析】对于实验题首先应该弄清楚本实验的目的是通过
测定碳酸钠与稀硫酸溶液反应产生的二氧化碳的质量,依
此求得碳酸钠的质量。为了减少误差应该让产生的二氧化
碳全部被本实验中的碱石灰吸收,从而减小在测定二氧化
碳质量时的误差。让空气经过氢氧化钠溶液除去混在空气
中的二氧化碳,以减小误差;而后让除去二氧化碳后的空
气把反应产生的二氧化碳赶入乙容器中,除去水蒸气,而
后被碱石灰吸收。碳酸钠的质量分数的计算式:
×106 g·mol-1÷n g×100%。如果去掉装置甲,会使空气
中的二氧化碳被碱石灰吸收,导致测得的二氧化碳的质量
偏大;若去掉装置乙会使水蒸气被碱石灰吸收,导致测得
的二氧化碳的质量偏大。
答案:(2)使广口瓶中产生的CO2气体全部排出 吸收空气中的CO2 吸收CO2中的水蒸气
(3) ×100% (4)偏大 偏大
8.(12分)如图表示往某Na2CO3溶液中滴入稀盐酸产生CO2的过程。
(1)写出a点以前发生反应的离子方程
式___________。
(2)写出a点到b点发生反应的离子方程
式___________。
(3)若某Na2CO3溶液中含m mol Na2CO3,
滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO3-的物质的量之比为2∶1,则滴入稀盐酸的物质的量等于_____mol(用m表示)。
【解析】向Na2CO3溶液中逐渐滴加HCl时,发生的反应依次
为Na2CO3+HCl ==== NaCl+NaHCO3 ①
NaHCO3+HCl ==== NaCl+CO2↑+H2O ②
(1)a点以前发生反应①,离子方程式为CO32-+H+ ====
HCO3-。
(2)a点到b点,发生反应②,离子方程式为
HCO3-+H+ ==== CO2↑+H2O。
(3)根据反应①、②,当n(Cl-)∶n(HCO3-)=2∶1时,Na2CO3
部分转化为NaHCO3,所以
解得n(HCl)=4m/3 mol。
答案:(1)CO32-+H+ ==== HCO3-
(2)HCO3-+H+ ==== CO2↑+H2O (3)4m/3
【规律方法】解图像题三步曲:“一看”、“二想”、“三判断”
(1)“一看”(看图像)
①看面:弄清纵、横坐标的含义。②看线:弄清线的走向、变化趋势及线的陡与平。③看点:弄清曲线上点的含义,特别是一些特殊点,如与坐标轴的交点、曲线的交点、折点、最高点与最低点等。④看量的变化:弄清是浓度变化、物质的量的变化还是转化率的变化。
(2)“二想”
看完线后联想有关的化学方程式。
(3)“三判断”
通过分析,依据化学方程式,作出正确判断。
