11-12版高中化学课时讲练通配套课件:1认识化学科学(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:1认识化学科学(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 638.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 20:32:45 | ||
图片预览





文档简介
(共18张PPT)
1.研究物质性质的基本方法
(1)观察法 (2)实验法 (3)分类法 (4)比较法
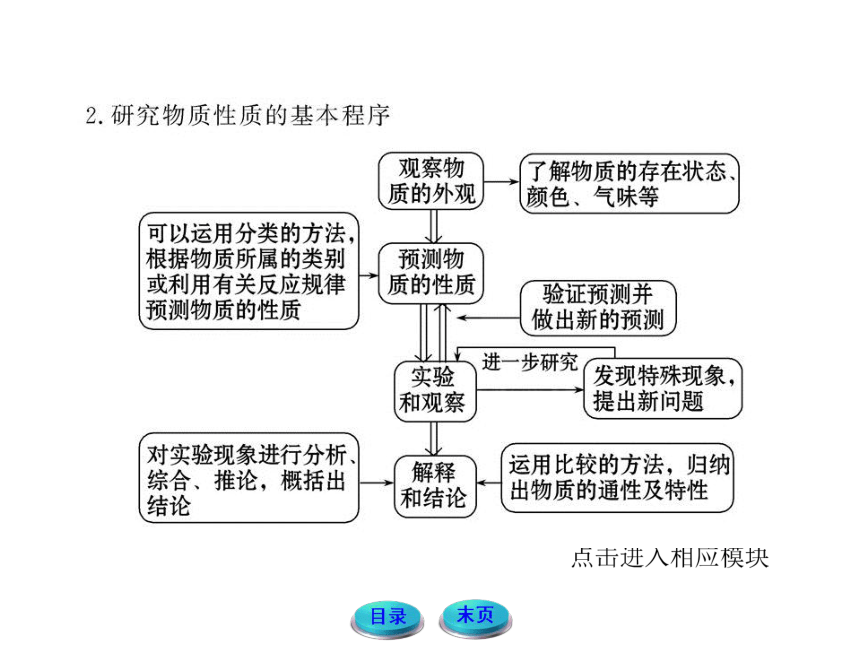
2.研究物质性质的基本程序
第一、要观察物质的外观性质(包括物质的存在状态、颜色、气味等);
第二、要对物质的性质进行预测;
第三、设计并实施实验来验证所做的预测。通过对实验现象的观察和分析,归纳出与预测相一致的性质,并对实验中所出现的特殊现象进行进一步的研究;
第四、对实验现象进行分析、综合、推论,概括出物质的通性及特性。
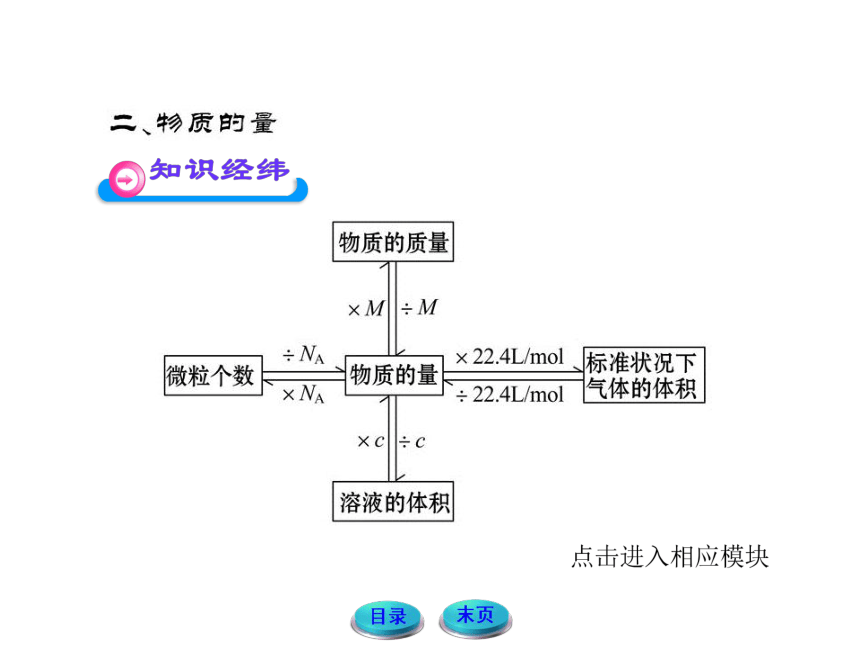
1.物质的量:用0.012 kg 12C中所含的原子数目作为标准来衡量其他微粒集体所含微粒数目多少的物理量,符号为n,单位是摩尔(mol)。
2.摩尔:是物质的量的单位;国际上规定, 1 mol任何微粒所含的微粒数与0.012 kg 12C中所含的碳原子数相等,为6.02×1023。
使用摩尔这个单位时要注意:
①使用范围,只能用于微观粒子(如原子、离子、电子等),不适用于宏观物质;
②使用时应指明粒子的种类。
3.阿伏加德罗常数:6.02×1023 mol-1称为阿伏加德罗常
数,用符号NA表示。n、N、NA存在如下关系:
4.摩尔质量:单位物质的量的物质所具有的质量叫做摩
尔质量,用符号M表示,单位是g/mol,M、m、n存在如下
关系: 。
注意:摩尔质量与相对分子质量、相对原子质量的关系:
摩尔质量以g·mol-1为单位时,数值上与相对分子质量或
相对原子质量相等,相对原子质量或相对分子质量的单位
为1。
5.气体摩尔体积:一定温度和压强下,单位物质的量的
气体所占的体积叫做气体摩尔体积,用符号Vm表示,单位
是L/mol。
Vm、V、n存在如下关系: 。
此概念要具备的要点:
①必须是气体(可以是混合气体,也可以是单一气体);
②要看气体所处的状况。
6.阿伏加德罗定律:同温同压下,相同体积的任何气体含有相同数目的分子。(T、p恒定时V1/V2=n1/n2=N1/N2)。
阿伏加德罗定律推论:
(1)T、p恒定时:V1/V2=n1/n2=N1/N2
(2)T、p恒定时:ρ1/ρ2=M1/M2
(3)T、p、V恒定时:m1/m2=M1/M2
(4)T、p、m恒定时:V1/V2=M2/M1
(5)T、V恒定时:p1/p2=n1/n2=N1/N2
(6)T、V、m恒定时:p1/p2=M2/M1
7.物质的量浓度:表示单位体积溶液所含溶质B的物质的量。符号cB ,单位: mol·L-1
8.物质的量浓度c与质量分数w之间的关系:
c=1000 ρw/M (密度的单位:g/cm3)
9.一定物质的量浓度溶液的配制
(1)主要仪器:容量瓶、烧杯、玻璃棒、药匙、胶头滴管、托盘天平、量筒。
(2)步骤:计算、称量(量取)、溶解、转移、洗涤、定容、颠倒摇匀、装入试剂瓶备用。
10.物质的量可以应用于化学反应的计算
1.钠的性质
2.过氧化钠的性质及用途
(1)物理性质
淡黄色固体,由Na在空气中燃烧制得。
(2)化学性质
2Na2O2+2H2O ==== 4NaOH+O2↑
2Na2O2+2CO2 ==== 2Na2CO3+O2
(3)用途
可作为呼吸面具和潜水艇里氧气的来源。
1.氯气的性质
2.氯水
Cl2溶于水可以得到淡黄绿色的氯水,Cl2通入水中能发生如下反应:Cl2+H2O ==== HCl+HClO。发生反应的Cl2只是一小部分,大部分以Cl2分子形式存在于氯水中,氯水的淡黄绿色即是Cl2的颜色。生成物中的盐酸是一种强酸,在水溶液中完全电离;而HClO是一种弱酸,在水溶液中只能部分电离。
1.研究物质性质的基本方法
(1)观察法 (2)实验法 (3)分类法 (4)比较法
2.研究物质性质的基本程序
第一、要观察物质的外观性质(包括物质的存在状态、颜色、气味等);
第二、要对物质的性质进行预测;
第三、设计并实施实验来验证所做的预测。通过对实验现象的观察和分析,归纳出与预测相一致的性质,并对实验中所出现的特殊现象进行进一步的研究;
第四、对实验现象进行分析、综合、推论,概括出物质的通性及特性。
1.物质的量:用0.012 kg 12C中所含的原子数目作为标准来衡量其他微粒集体所含微粒数目多少的物理量,符号为n,单位是摩尔(mol)。
2.摩尔:是物质的量的单位;国际上规定, 1 mol任何微粒所含的微粒数与0.012 kg 12C中所含的碳原子数相等,为6.02×1023。
使用摩尔这个单位时要注意:
①使用范围,只能用于微观粒子(如原子、离子、电子等),不适用于宏观物质;
②使用时应指明粒子的种类。
3.阿伏加德罗常数:6.02×1023 mol-1称为阿伏加德罗常
数,用符号NA表示。n、N、NA存在如下关系:
4.摩尔质量:单位物质的量的物质所具有的质量叫做摩
尔质量,用符号M表示,单位是g/mol,M、m、n存在如下
关系: 。
注意:摩尔质量与相对分子质量、相对原子质量的关系:
摩尔质量以g·mol-1为单位时,数值上与相对分子质量或
相对原子质量相等,相对原子质量或相对分子质量的单位
为1。
5.气体摩尔体积:一定温度和压强下,单位物质的量的
气体所占的体积叫做气体摩尔体积,用符号Vm表示,单位
是L/mol。
Vm、V、n存在如下关系: 。
此概念要具备的要点:
①必须是气体(可以是混合气体,也可以是单一气体);
②要看气体所处的状况。
6.阿伏加德罗定律:同温同压下,相同体积的任何气体含有相同数目的分子。(T、p恒定时V1/V2=n1/n2=N1/N2)。
阿伏加德罗定律推论:
(1)T、p恒定时:V1/V2=n1/n2=N1/N2
(2)T、p恒定时:ρ1/ρ2=M1/M2
(3)T、p、V恒定时:m1/m2=M1/M2
(4)T、p、m恒定时:V1/V2=M2/M1
(5)T、V恒定时:p1/p2=n1/n2=N1/N2
(6)T、V、m恒定时:p1/p2=M2/M1
7.物质的量浓度:表示单位体积溶液所含溶质B的物质的量。符号cB ,单位: mol·L-1
8.物质的量浓度c与质量分数w之间的关系:
c=1000 ρw/M (密度的单位:g/cm3)
9.一定物质的量浓度溶液的配制
(1)主要仪器:容量瓶、烧杯、玻璃棒、药匙、胶头滴管、托盘天平、量筒。
(2)步骤:计算、称量(量取)、溶解、转移、洗涤、定容、颠倒摇匀、装入试剂瓶备用。
10.物质的量可以应用于化学反应的计算
1.钠的性质
2.过氧化钠的性质及用途
(1)物理性质
淡黄色固体,由Na在空气中燃烧制得。
(2)化学性质
2Na2O2+2H2O ==== 4NaOH+O2↑
2Na2O2+2CO2 ==== 2Na2CO3+O2
(3)用途
可作为呼吸面具和潜水艇里氧气的来源。
1.氯气的性质
2.氯水
Cl2溶于水可以得到淡黄绿色的氯水,Cl2通入水中能发生如下反应:Cl2+H2O ==== HCl+HClO。发生反应的Cl2只是一小部分,大部分以Cl2分子形式存在于氯水中,氯水的淡黄绿色即是Cl2的颜色。生成物中的盐酸是一种强酸,在水溶液中完全电离;而HClO是一种弱酸,在水溶液中只能部分电离。
