11-12版高中化学课时讲练通配套课件:2 元素与物质世界(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:2 元素与物质世界(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 694.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 20:32:45 | ||
图片预览






文档简介
(共16张PPT)
1.分散系
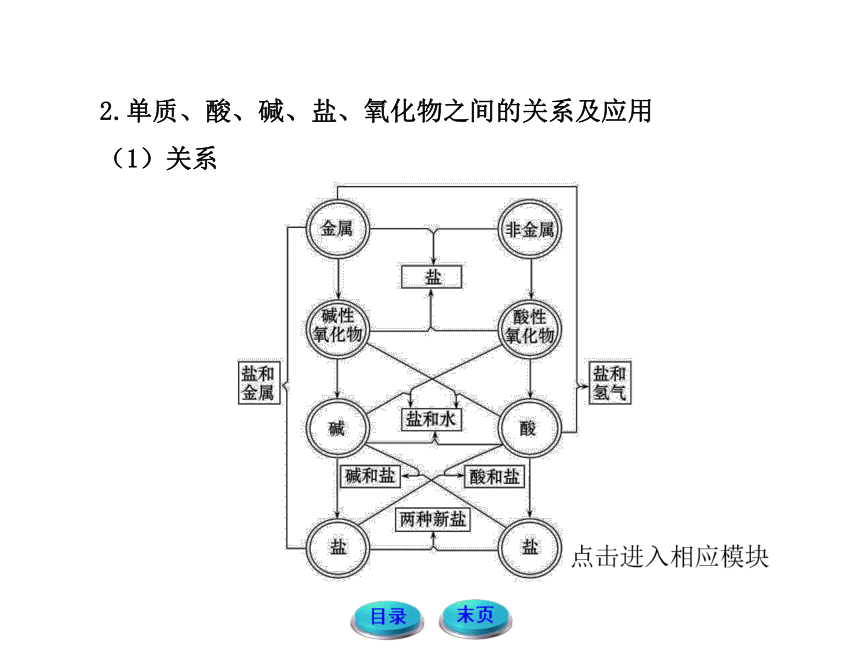
2.单质、酸、碱、盐、氧化物之间的关系及应用
(1)关系
(2)应用
①研究一类物质的性质(完成从单个物质向一类物质的过渡);如类比CO2可预测SO2的性质。
②制备有关物质
③鉴别物质
④提纯物质
1.电解质及非电解质的判断
(1)判断电解质和非电解质的基本前提是化合物,不是电解质的物质不一定是非电解质,如单质和混合物。
(2)有些化合物如SO2、SO3、NH3、CO2等与水发生反应产生电解质而引起导电,但它们是非电解质。
(3)导电的物质不一定是电解质,如Cu和硫酸溶液;不导电的物质不一定不是电解质,如BaSO4。
(4)一般来说,酸、碱、盐都是电解质,Na2O、CaO、Al2O3等大部分金属氧化物也是电解质。
2.离子方程式的书写
(1)步骤:
(2)书写要点
①化学式的书写:能拆成离子的物质为易溶的强电解质,包括强酸、强碱、盐;不能拆成离子的物质包括难溶物、难电离物(弱酸、弱碱、水)、气体、单质、氧化物。
②对于微溶物的处理:若在反应物中处于溶液状态,一般改写成离子形式;处于浊液或固态时或在生成物中一般写成化学式。
3.离子方程式正误判断
4.离子共存
(1)能发生反应的离子不能大量共存,如复分解反应、氧化还原反应等。
(2)审题时特别注意限制条件,如颜色、酸碱性等。
5.离子检验
常见离子如Fe2+、Fe3+、Al3+、Na+、S2-、X-、OH-等。
2.氧化还原反应的基本规律及应用
(1)强弱规律
强氧化剂+强还原剂弱还原剂+弱氧化剂
应用:强制弱,比较氧化性或还原性的强弱。
(2)先后规律
一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应。(先强后弱)
一种还原剂与多种氧化剂相遇时,氧化性最强的优先发生反应。(先强后弱)
应用:判断物质的稳定性及反应的先后顺序。
(3)价态规律
应用:判断元素或物质的氧化性或还原性的有无或强弱。
1.分散系
2.单质、酸、碱、盐、氧化物之间的关系及应用
(1)关系
(2)应用
①研究一类物质的性质(完成从单个物质向一类物质的过渡);如类比CO2可预测SO2的性质。
②制备有关物质
③鉴别物质
④提纯物质
1.电解质及非电解质的判断
(1)判断电解质和非电解质的基本前提是化合物,不是电解质的物质不一定是非电解质,如单质和混合物。
(2)有些化合物如SO2、SO3、NH3、CO2等与水发生反应产生电解质而引起导电,但它们是非电解质。
(3)导电的物质不一定是电解质,如Cu和硫酸溶液;不导电的物质不一定不是电解质,如BaSO4。
(4)一般来说,酸、碱、盐都是电解质,Na2O、CaO、Al2O3等大部分金属氧化物也是电解质。
2.离子方程式的书写
(1)步骤:
(2)书写要点
①化学式的书写:能拆成离子的物质为易溶的强电解质,包括强酸、强碱、盐;不能拆成离子的物质包括难溶物、难电离物(弱酸、弱碱、水)、气体、单质、氧化物。
②对于微溶物的处理:若在反应物中处于溶液状态,一般改写成离子形式;处于浊液或固态时或在生成物中一般写成化学式。
3.离子方程式正误判断
4.离子共存
(1)能发生反应的离子不能大量共存,如复分解反应、氧化还原反应等。
(2)审题时特别注意限制条件,如颜色、酸碱性等。
5.离子检验
常见离子如Fe2+、Fe3+、Al3+、Na+、S2-、X-、OH-等。
2.氧化还原反应的基本规律及应用
(1)强弱规律
强氧化剂+强还原剂弱还原剂+弱氧化剂
应用:强制弱,比较氧化性或还原性的强弱。
(2)先后规律
一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应。(先强后弱)
一种还原剂与多种氧化剂相遇时,氧化性最强的优先发生反应。(先强后弱)
应用:判断物质的稳定性及反应的先后顺序。
(3)价态规律
应用:判断元素或物质的氧化性或还原性的有无或强弱。
