11-12版高中化学课时讲练通配套课件:3 自然界中的元素(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:3 自然界中的元素(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 752.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 20:32:45 | ||
图片预览






文档简介
(共30张PPT)
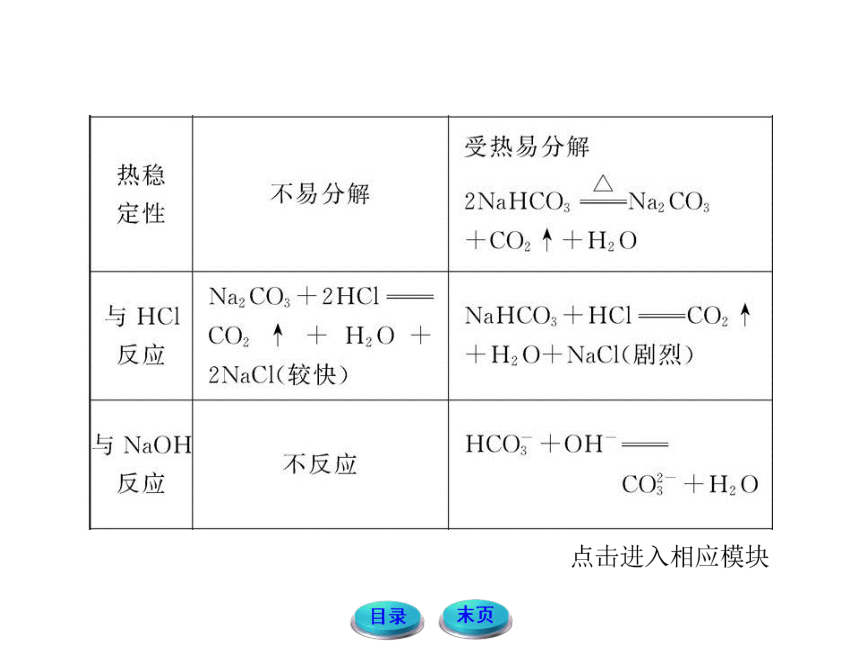
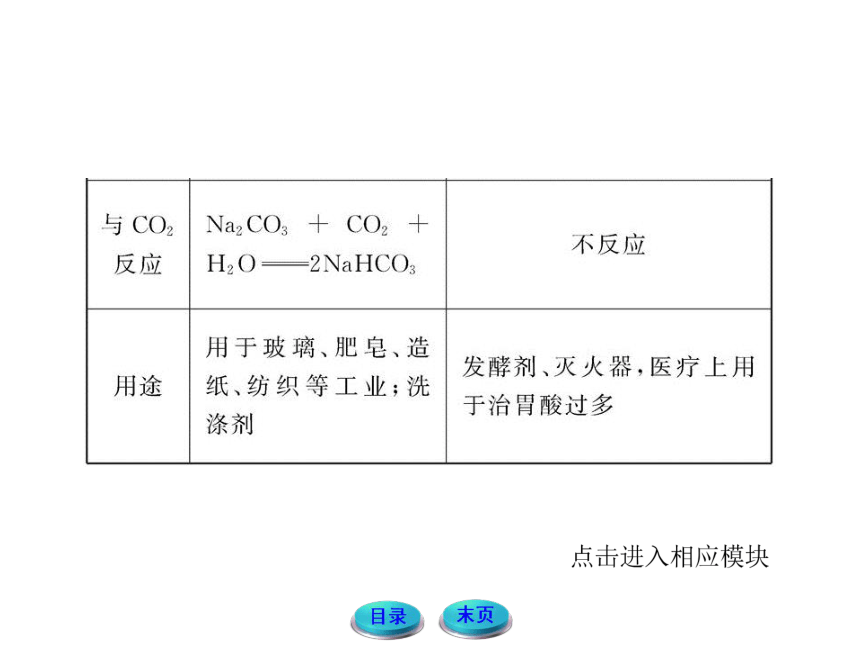
1.碳酸钠和碳酸氢钠
(1)碳酸钠和碳酸氢钠的比较
(2)碳酸钠和碳酸氢钠的鉴别方法
①热稳定性不同。分别加热少量固体,若发生分解反应,将产生的气体通入澄清的石灰水中,石灰水变浑浊的试剂是碳酸氢钠,另一个为碳酸钠。
②和酸反应生成气体的速率不同。分别取一定量的固体,加入等浓度等体积的盐酸,反应快、产生气体相对多的为碳酸氢钠,另一个为碳酸钠。
③阴离子不同。分别取其稀溶液,滴加氯化钡稀溶液或CaCl2溶液,产生沉淀的原试剂为碳酸钠,另一个为碳酸氢钠(特别注意:该方法必须取极稀溶液)。
(3)Na2CO3和NaHCO3在一定条件下的相互转化:
溶液中:NaHCO3+NaOH ==== Na2CO3+H2O
Na2CO3+CO2+H2O ==== 2NaHCO3
固体:NaOH+NaHCO3 Na2CO3+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
△
====
△
====
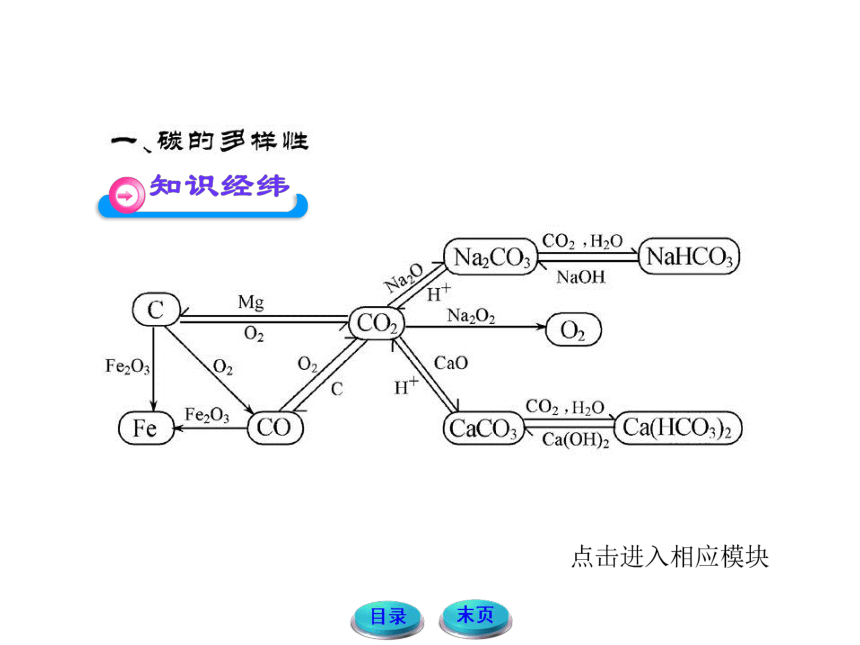
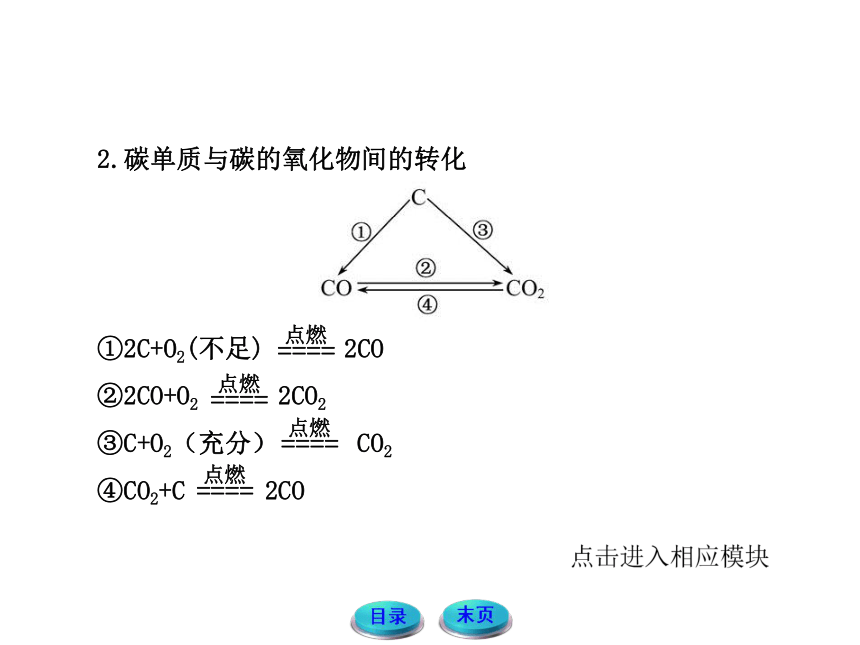
2.碳单质与碳的氧化物间的转化
①2C+O2(不足) 2CO
②2CO+O2 2CO2
③C+O2(充分) CO2
④CO2+C 2CO
点燃
====
点燃
====
点燃
====
点燃
====
3.碳酸盐与碳酸氢盐的转化
Ca(OH)2+CO2 ==== CaCO3↓+H2O
CaCO3+CO2+H2O ==== Ca(HCO3)2
Ca(HCO3)2 CaCO3↓+CO2↑+H2O
加热
====
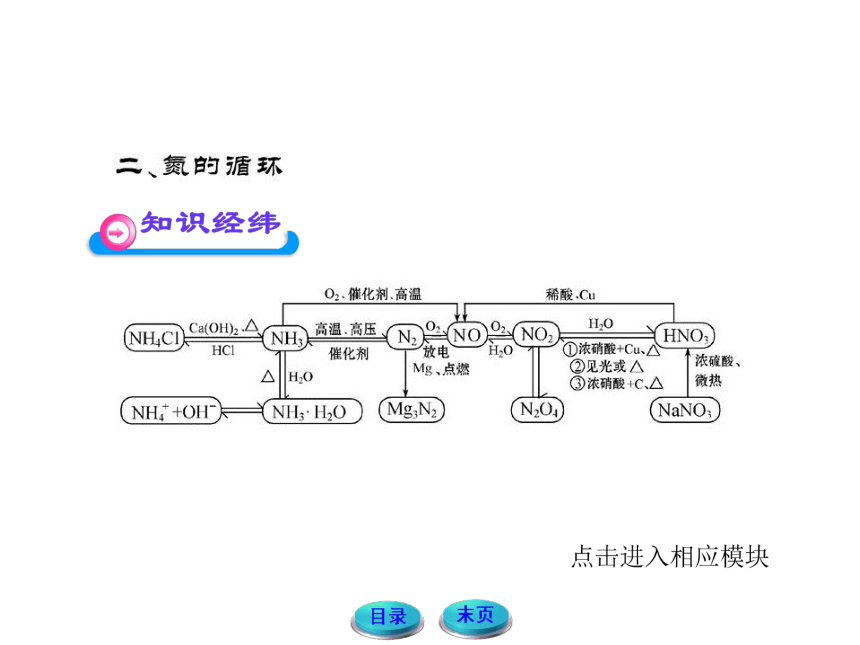
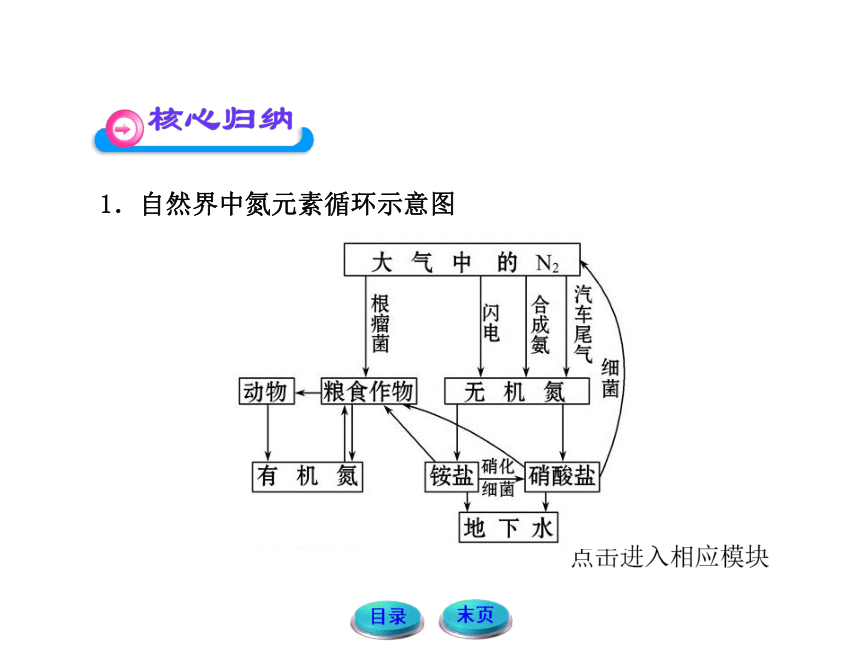
1.自然界中氮元素循环示意图
2.氮氧化物溶于水的计算
(1)有关化学方程式
3NO2+H2O ==== 2HNO3+NO ①
4NO2+O2+2H2O ==== 4HNO3 ②
4NO+3O2+2H2O ==== 4HNO3 ③
2NO+O2 ==== 2NO2 ④
(2)不同情况及剩余气体的体积
3.铵盐
(1)铵盐受热分解
NH4Cl NH3↑+HCl↑
NH4HCO3 NH3↑+CO2↑+H2O↑
(2)铵盐与碱反应
NH4Cl+NaOH NaCl+NH3↑+H2O
(3)氨的实验室制取
①药品:NH4Cl、消石灰。
②反应原理:
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。
△
====
△
====
△
====
△
====
③装置:与制氧气相同。
④收集:向下排空气法。在收集容器口部塞一疏松棉团防止与空气对流。
⑤验满:用湿润的红色石蕊试纸或沾有浓盐酸的玻璃棒。
⑥防止多余氨气污染空气的方法:收集NH3后的导管口处塞一团湿棉花或用稀硫酸浸湿的棉花,或用防倒吸装置吸收。
⑦干燥:NH3通过盛有碱石灰的干燥管。
⑧实验室制取氨的其他方法:加热浓氨水、氧化钙与浓氨水反应等。
4.硝酸
硝酸除了具有酸的通性以外,还具有以下特性:
(1)硝酸的不稳定性:硝酸见光或受热易分解。
4HNO3 4NO2↑+O2↑+2H2O
一般将它保存在棕色试剂瓶里,放置在阴凉处。
(2)硝酸的强氧化性:硝酸具有强氧化性,是因为硝酸分子里氮呈+5价。
光或热
=====
①与金属反应:HNO3几乎能与所有的金属(除金、铂、钛
以外)发生氧化还原反应。
Cu+4HNO3(浓) ==== Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀) ==== 3Cu(NO3)2+2NO↑+4H2O
②与非金属反应:硝酸能与许多非金属及某些有机物发生氧化还原反应:C+4HNO3(浓) CO2↑+4NO2↑+2H2O
△
====
1.硫单质的氧化性和还原性
硫单质中硫元素化合价为0,在化学反应中,化合价既可
以升高又可以降低,表现出还原性和氧化性。
(1)表现还原性
当硫与氧化性较强的物质反应时,通常失电子,化合价升
高,表现一定的还原性,如S+O2 SO2。
点燃
====
(2)表现氧化性
①当硫与H2、部分金属等还原性较强的物质反应时,通常得电子,化合价降低,表现氧化性,如:
S+H2 H2S
S+2Cu Cu2S
S+Hg ==== HgS
②在黑火药爆炸的反应中,硫的化合价降低,表现氧化性,化学方程式为:S+2KNO3+3C K2S+3CO2↑+N2↑。
(3)既表现氧化性又表现还原性
硫与热的碱溶液反应时,既表现氧化性,又表现还原性,如3S+6NaOH 2Na2S+Na2SO3+3H2O。
△
====
△
====
△
====
△
====
2.SO2的化学性质
3.浓硫酸的强氧化性
(1)Fe、Al的钝化
常温下,Fe、Al遇到浓硫酸会反应生成一层致密的氧化膜覆在金属表面而出现“钝化”现象。
(2)与氢之前的活泼金属反应:
Zn+2H2SO4(浓) ==== ZnSO4+SO2↑+2H2O
规律:
①浓硫酸既表现氧化性,又表现酸性;
②浓硫酸一旦变稀,就发生反应:Zn+H2SO4 ==== ZnSO4+H2↑。
(3)与氢之后的不活泼金属(除Au、Pt外)反应:
Cu+2H2SO4 CuSO4+SO2↑+2H2O
规律:
①反应需加热,否则不反应;
②氧化产物是硫酸盐,金属显高价,还原产物为SO2;
③浓硫酸既表现氧化性,又表现酸性;
④随反应进行,硫酸浓度变小,一旦变为稀硫酸,反应就
会停止。
△
====
(4)与非金属反应:
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
规律:
①反应要加热,否则不反应;
②氧化产物是含氧酸或非金属氧化物;还原产物为SO2;
③浓硫酸只表现氧化性;
④随反应进行,硫酸浓度变小,一旦变为稀硫酸,反应就停止;
⑤不能氧化H2、N2、O2、Si、Cl2、F2、Br2等。
△
====
1.氯碱工业
(1)原料:饱和食盐水。
(2)反应原理:2NaCl+2H2O 2NaOH+Cl2↑+H2↑
(3)过程、用途
通电
====
2.海水提镁的流程和原理
(1)原料:苦卤(晒盐后的母液)、贝壳、盐酸
(2)生产流程
(3)反应的化学方程式或离子方程式
①制碱:CaCO3 CaO+CO2↑
CaO+H2O ==== Ca(OH)2
②沉淀:Mg2++Ca(OH)2 ==== Ca2++Mg(OH)2↓
③酸化:Mg(OH)2+2HCl ==== MgCl2+2H2O
④蒸发、结晶、脱水:
MgCl2·6H2O MgCl2+6H2O
⑤电解熔融MgCl2:MgCl2(熔融) Mg+Cl2↑
通电
====
高温
====
HCl气体加热
=========
1.碳酸钠和碳酸氢钠
(1)碳酸钠和碳酸氢钠的比较
(2)碳酸钠和碳酸氢钠的鉴别方法
①热稳定性不同。分别加热少量固体,若发生分解反应,将产生的气体通入澄清的石灰水中,石灰水变浑浊的试剂是碳酸氢钠,另一个为碳酸钠。
②和酸反应生成气体的速率不同。分别取一定量的固体,加入等浓度等体积的盐酸,反应快、产生气体相对多的为碳酸氢钠,另一个为碳酸钠。
③阴离子不同。分别取其稀溶液,滴加氯化钡稀溶液或CaCl2溶液,产生沉淀的原试剂为碳酸钠,另一个为碳酸氢钠(特别注意:该方法必须取极稀溶液)。
(3)Na2CO3和NaHCO3在一定条件下的相互转化:
溶液中:NaHCO3+NaOH ==== Na2CO3+H2O
Na2CO3+CO2+H2O ==== 2NaHCO3
固体:NaOH+NaHCO3 Na2CO3+H2O
2NaHCO3 Na2CO3+CO2↑+H2O
△
====
△
====
2.碳单质与碳的氧化物间的转化
①2C+O2(不足) 2CO
②2CO+O2 2CO2
③C+O2(充分) CO2
④CO2+C 2CO
点燃
====
点燃
====
点燃
====
点燃
====
3.碳酸盐与碳酸氢盐的转化
Ca(OH)2+CO2 ==== CaCO3↓+H2O
CaCO3+CO2+H2O ==== Ca(HCO3)2
Ca(HCO3)2 CaCO3↓+CO2↑+H2O
加热
====
1.自然界中氮元素循环示意图
2.氮氧化物溶于水的计算
(1)有关化学方程式
3NO2+H2O ==== 2HNO3+NO ①
4NO2+O2+2H2O ==== 4HNO3 ②
4NO+3O2+2H2O ==== 4HNO3 ③
2NO+O2 ==== 2NO2 ④
(2)不同情况及剩余气体的体积
3.铵盐
(1)铵盐受热分解
NH4Cl NH3↑+HCl↑
NH4HCO3 NH3↑+CO2↑+H2O↑
(2)铵盐与碱反应
NH4Cl+NaOH NaCl+NH3↑+H2O
(3)氨的实验室制取
①药品:NH4Cl、消石灰。
②反应原理:
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。
△
====
△
====
△
====
△
====
③装置:与制氧气相同。
④收集:向下排空气法。在收集容器口部塞一疏松棉团防止与空气对流。
⑤验满:用湿润的红色石蕊试纸或沾有浓盐酸的玻璃棒。
⑥防止多余氨气污染空气的方法:收集NH3后的导管口处塞一团湿棉花或用稀硫酸浸湿的棉花,或用防倒吸装置吸收。
⑦干燥:NH3通过盛有碱石灰的干燥管。
⑧实验室制取氨的其他方法:加热浓氨水、氧化钙与浓氨水反应等。
4.硝酸
硝酸除了具有酸的通性以外,还具有以下特性:
(1)硝酸的不稳定性:硝酸见光或受热易分解。
4HNO3 4NO2↑+O2↑+2H2O
一般将它保存在棕色试剂瓶里,放置在阴凉处。
(2)硝酸的强氧化性:硝酸具有强氧化性,是因为硝酸分子里氮呈+5价。
光或热
=====
①与金属反应:HNO3几乎能与所有的金属(除金、铂、钛
以外)发生氧化还原反应。
Cu+4HNO3(浓) ==== Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀) ==== 3Cu(NO3)2+2NO↑+4H2O
②与非金属反应:硝酸能与许多非金属及某些有机物发生氧化还原反应:C+4HNO3(浓) CO2↑+4NO2↑+2H2O
△
====
1.硫单质的氧化性和还原性
硫单质中硫元素化合价为0,在化学反应中,化合价既可
以升高又可以降低,表现出还原性和氧化性。
(1)表现还原性
当硫与氧化性较强的物质反应时,通常失电子,化合价升
高,表现一定的还原性,如S+O2 SO2。
点燃
====
(2)表现氧化性
①当硫与H2、部分金属等还原性较强的物质反应时,通常得电子,化合价降低,表现氧化性,如:
S+H2 H2S
S+2Cu Cu2S
S+Hg ==== HgS
②在黑火药爆炸的反应中,硫的化合价降低,表现氧化性,化学方程式为:S+2KNO3+3C K2S+3CO2↑+N2↑。
(3)既表现氧化性又表现还原性
硫与热的碱溶液反应时,既表现氧化性,又表现还原性,如3S+6NaOH 2Na2S+Na2SO3+3H2O。
△
====
△
====
△
====
△
====
2.SO2的化学性质
3.浓硫酸的强氧化性
(1)Fe、Al的钝化
常温下,Fe、Al遇到浓硫酸会反应生成一层致密的氧化膜覆在金属表面而出现“钝化”现象。
(2)与氢之前的活泼金属反应:
Zn+2H2SO4(浓) ==== ZnSO4+SO2↑+2H2O
规律:
①浓硫酸既表现氧化性,又表现酸性;
②浓硫酸一旦变稀,就发生反应:Zn+H2SO4 ==== ZnSO4+H2↑。
(3)与氢之后的不活泼金属(除Au、Pt外)反应:
Cu+2H2SO4 CuSO4+SO2↑+2H2O
规律:
①反应需加热,否则不反应;
②氧化产物是硫酸盐,金属显高价,还原产物为SO2;
③浓硫酸既表现氧化性,又表现酸性;
④随反应进行,硫酸浓度变小,一旦变为稀硫酸,反应就
会停止。
△
====
(4)与非金属反应:
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
规律:
①反应要加热,否则不反应;
②氧化产物是含氧酸或非金属氧化物;还原产物为SO2;
③浓硫酸只表现氧化性;
④随反应进行,硫酸浓度变小,一旦变为稀硫酸,反应就停止;
⑤不能氧化H2、N2、O2、Si、Cl2、F2、Br2等。
△
====
1.氯碱工业
(1)原料:饱和食盐水。
(2)反应原理:2NaCl+2H2O 2NaOH+Cl2↑+H2↑
(3)过程、用途
通电
====
2.海水提镁的流程和原理
(1)原料:苦卤(晒盐后的母液)、贝壳、盐酸
(2)生产流程
(3)反应的化学方程式或离子方程式
①制碱:CaCO3 CaO+CO2↑
CaO+H2O ==== Ca(OH)2
②沉淀:Mg2++Ca(OH)2 ==== Ca2++Mg(OH)2↓
③酸化:Mg(OH)2+2HCl ==== MgCl2+2H2O
④蒸发、结晶、脱水:
MgCl2·6H2O MgCl2+6H2O
⑤电解熔融MgCl2:MgCl2(熔融) Mg+Cl2↑
通电
====
高温
====
HCl气体加热
=========
