11-12版高中化学课时讲练通配套课件:单元质量评估(一)(鲁科版必修1)
文档属性
| 名称 | 11-12版高中化学课时讲练通配套课件:单元质量评估(一)(鲁科版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 520.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-09 00:00:00 | ||
图片预览











文档简介
(共50张PPT)
(一)
第1章 认识化学科学
(90分钟 100分)
一、选择题(本题包括15小题,每小题3分,共45分)
1.(2011·济南高一检测)为中国近代化学发展做出突出贡献的科学家是( )
A.李四光 B.华罗庚 C.侯德榜 D.钱学森
【解析】选C。题述四个选项中的科学家均为我国科学事业的发展做出了突出的贡献。其中,李四光是我国著名的地质学家;华罗庚是著名的数学家;钱学森是著名的物理学家;侯德榜被称为中国近代化学史上的第一颗明星,为中国化学工业的发展做出了卓越贡献,是中国近代化工工业的奠基人之一,他发明的联合制碱法为中华民族争得了荣誉。
2.钠露置在空气中,其变质过程中不可能产生的物质( )
A.Na2O B.NaOH C.Na2CO3 D.NaHCO3
【解析】选D。钠露置在空气中的变质过程如下:
3.当不慎有大量Cl2扩散到周围空间时,处在该环境中的人可以用浸有一定浓度某种物质的水溶液的毛巾捂住鼻子,以防中毒,该物质最适宜采用的是( )
A.NaOH B.NaCl
C.NaHCO3 D.NH3·H2O
【解析】选C。选择合适的物质时必须同时比较几个方面:一是要能够吸收氯气;二是本身无毒无腐蚀性,对人体无害;三是吸收氯气时生成的产物也应对人体无害。NaOH有强腐蚀性,NH3·H2O对人有很强的刺激作用,NaCl不能与Cl2反应,NaHCO3无腐蚀性,吸收Cl2能力强且快。
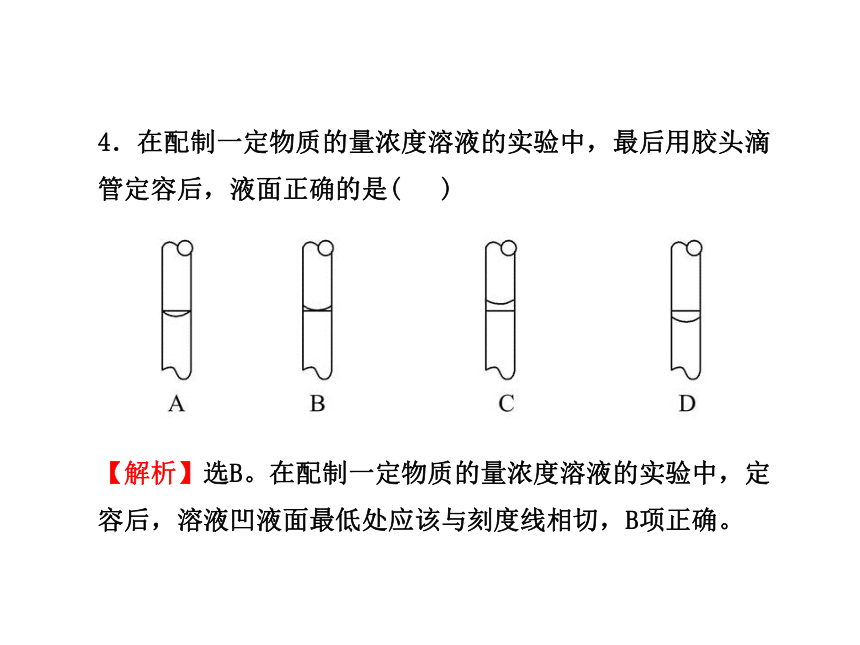
4.在配制一定物质的量浓度溶液的实验中,最后用胶头滴管定容后,液面正确的是( )
【解析】选B。在配制一定物质的量浓度溶液的实验中,定容后,溶液凹液面最低处应该与刻度线相切,B项正确。
5.下列叙述正确的是( )
A.1 mol O2的质量为32 g·mol-1
B.物质的量浓度为1 mol·L-1的溶液就是1 mol物质溶解在1 L水中形成的
C.SO42-的摩尔质量为96 g·mol-1
D.等体积、等物质的量浓度的两溶液中所含溶质的物质的量为1 mol
【解析】选C。质量的单位是“g”,摩尔质量的单位是“g·mol-1”, A项单位使用不正确;B项,应该是溶液的体积为1 L;D项,等体积不一定为1 L,等物质的量浓度不一定为1 mol·L-1。
6.精确配制一定物质的量浓度的NaOH溶液,下面实验操作中正确的是( )
A.称量时将NaOH固体直接放在托盘天平上面的纸上
B.将称好的NaOH固体放入容量瓶中,加入少量水溶解
C.在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中
D.将烧杯中已冷却的NaOH溶液注入未经干燥的容量瓶中
【解析】选D。A错误,称量NaOH时需放在玻璃器皿中称量,因为NaOH有腐蚀性;B、C两项错误,应先将称量好的NaOH放入烧杯中溶解,冷却至室温后再转移至容量瓶中,不能用容量瓶溶解;D正确,容量瓶未干燥对结果无影响。
7.(2011·厦门高一检测)下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气态物质的体积大小由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质的体积大小由构成气体的分子数决定
C.非标准状况下,1 mol任何气体的体积都不可能为
22.4 L
D.0.5 mol气体A和0.5 mol气体B的混合气体在标准状况下的体积一定约为22.4 L
【解析】选B 。由于气体分子间的距离远远大于分子本身的体积,所以在一定的温度和压强下,各种气态物质的体积大小由构成气体的分子数决定;非标准状况下,1 mol气体的体积也可能为22.4 L;D项中若两气体发生反应则无法判断反应后的体积。
8.下列说法不正确的是( )
①钠、氢气都能在氯气中燃烧生成白色烟雾
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯气的水溶液,它能使干燥的有色布条退色
④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A.① B.①和② C.①和④ D.①②③④
【解析】选D。①Na在Cl2中燃烧时生成白色烟,无雾产生,氢气在氯气中燃烧生成白雾,无烟产生;②CuCl2为棕黄色固体;③液氯为液态的氯气,为纯净物,不能使干燥的有色布条退色;④久置的氯水中,因HClO分解,已变为稀盐酸。
9.下列说法中错误的是( )
A.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.制成0.5 L 10 mol·L-1的盐酸,需要氯化氢气体
112 L(标准状况)
C.0.5 L 2 mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%硫酸(密度为1.84 g·cm-3)与10 mL
18.4 mol·L-1硫酸的浓度是不同的
【解析】选D。D项98%的硫酸的物质的量浓度为
。
10.实验室里需要480 mL 0.1 mol·L-1的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾,配成500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL 水
D.称取12.5 g胆矾,配成500 mL溶液
【解析】选D。500 mL容量瓶只能配500 mL溶液,因而配500 mL 0.1 mol·L-1 CuSO4溶液时,需CuSO4的质量为
0.1 mol·L-1×0.5 L×160 g·mol-1=8 g,或需CuSO4·5H2O的质量为0.1 mol·L-1×0.5 L×250 g·mol-1
=12.5 g,加水配成500 mL溶液。
11.下列实验操作完全正确的是( )
【解析】选C。A中应该用滤纸吸干钠表面的煤油且烧杯中的水不能装满;B中氯化钾固体应该在烧杯中溶解;D中过滤时不能用玻璃棒搅拌。
12.(双选)下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.在常温常压下,11.2 L N2含有的分子数为0.5 NA
B.在常温常压下,1 mol Ne含有的原子数为NA
C.71 g Cl2所含原子数为2NA
D.在同温同压下,相同体积的任何气体单质所含的原子数相同
【解析】选B、C。本题着重考查气体摩尔体积的概念和适用条件,阿伏加德罗定律以及稀有气体的组成。常温常压下,11.2 L N2并不是0.5 mol,含有的分子数也就不为
0.5NA; Ne是由单原子构成的分子,1 mol Ne含有的原子数为NA,与状况无关;71 g Cl2恰好是1 mol Cl2,含原子数为2NA;在同温同压时,相同体积的任何气体单质所含的分子数相同,由于气体单质分子中所含原子数不同,如O3由3个原子构成,H2由2个原子构成,而Ne由1个原子构成,相同状况下,相同体积的上述气体单质所含原子数就不相同。
13.(2011·西城区高一检测)体积相同的某营养液两份,其配方如下:
两份营养液中各离子的浓度( )
A.完全相同 B.完全不同
C.仅c(K+)相同 D.仅c(Cl-)相同
【解析】选A。两份营养液配方不同,但各离子的物质的量都相同:n(K+)=0.7 mol;n(Cl-)=0.3 mol;n(Zn2+)=0.1 mol;n(SO42-)=0.3 mol;溶于水后所得营养液中各离子的浓度完全相同。
14.有一瓶14%的KOH溶液,加热蒸发掉100 g 水后,变为
28%的KOH溶液80 mL(蒸发过程中无溶质析出),该80 mL
溶液的物质的量浓度为( )
A.5 mol/L B.6 mol/L
C.6.25 mol/L D.6.75 mol/L
【解析】选C。设原溶液的质量为m,则m×14%=
(m-100 g)×28%,解得m=200 g,溶质的物质的量为
,蒸发后溶液的体积为80 mL,可求出该
溶液的物质的量浓度为6.25 mol/L。
15.将钠、铁、铝各0.3 mol分别放入100 mL 1 mol·L-1的盐酸中,同温同压下产生的气体体积比是( )
A.1∶2∶3 B.6∶3∶2
C.3∶1∶1 D.1∶1∶1
【解析】选C。由题意知:钠、铁、铝的物质的量均为
0.3 mol,n(HCl)=0.1 L×1 mol·L-1=0.1 mol。
经分析知,钠、铁、铝与盐酸反应时,金属均过量,盐酸不足。
当钠与盐酸反应时,因为过量的钠也能与H2O反应产生H2,所以产生H2的量以钠为准进行计算:
2Na ~ H2↑
2 mol 1 mol
0.3 mol n(H2)
n(H2)=0.15 mol
当铁、铝分别与盐酸反应时,产生H2的量以盐酸为准进行计算:
2HCl ~ H2↑
2 mol 1 mol
0.1 mol n′(H2)
n′(H2)=0.05 mol。
二、非选择题(本题包括6小题,共55分)
16.(6分)(1)在40.0 g某三价金属的硫酸盐中含
0.3 mol SO42-,此硫酸盐的摩尔质量为______;该金属元素的相对原子质量为_______。
(2)已知N2、CO2的混合气体的质量共10.0 g,标准状况下,体积为6.72 L ,原混合气体中N2、CO2的体积之比为
___________。
【解析】(1)某三价金属的硫酸盐的化学式可设为
R2(SO4)3,由化学式知:
0.1 mol R2(SO4)3中含0.3 mol SO42-
M=400 g/mol。
金属元素的相对原子质量= 。
(2)设标准状况下,N2的体积为V1,CO2的体积为V2,由题意
知:
V1=4.48 L
V2=2.24 L
V1∶V2=4.48 L∶2.24 L=2∶1。
答案:(1)400 g/mol 56 (2)2∶1
17.(6分)100 mL A2气体跟50 mL B2气体恰好完全反应,生成的气体体积为100 mL(同温同压条件下),试推断气体生成物的化学式_________,推断的依据是_________
_____________。
【解析】题目给出的已知条件有两个:一是根据反应物分子式可知它们都是双原子分子;二是在相同条件下各反应物和生成物气体的体积比A2∶B2∶AxBy=100∶50∶100=
2∶1∶2。根据阿伏加德罗定律知体积比就是该反应的化学方程式中各反应物和生成物的系数比,即2A2+B2 ==== 2AxBy。再结合质量守恒定律(反应前后各种原子的个数不变),就能推出:2x=2×2,x=2;2y=2,y=1。
答案:A2B 阿伏加德罗定律和质量守恒定律
18.(6分)一定量的氢气在氯气中燃烧,所得混合物被100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 mol。
(1)原NaOH溶液的质量分数为_______。
(2)所得溶液中Cl-的物质的量为______mol。
(3)所用氯气和参加反应的氢气的物质的量之比
n(Cl2)∶n(H2)=_______。
【解析】题目中没有给出氢气和氯气的具体量,但因为反
应后的混合物与NaOH溶液反应有NaClO生成,这意味着反应
中氯气过量。混合物恰好被完全吸收后,最后所得的溶液
为NaCl和NaClO的混合液。由Na、Cl的原子个数比为1︰1易
求得答案。
(1)
≈10.7%。
(2)据反应Cl2+H2 2HCl,Cl2+2NaOH ==== NaCl+NaClO
+H2O,HCl+NaOH ==== NaCl+H2O可知溶液中:n(Na+)=
n(Cl-)+n(ClO-)=0.1 L×3.00 mol·L-1=n(Cl-)+0.050 mol
n(C1-)=0.25 mol。
点燃
====
(3)利用相同条件下,体积比等于物质的量之比来求解。先根据NaClO的量确定与H2反应后过量的氯气的量,再根据NaCl与NaClO的差量确定氢气的量。
n(与H2反应后过量的Cl2)=n(NaClO)=0.050 mol,
则n(H2)=n(与H2反应的Cl2)=(0.25-0.050)/2=
0.10(mol)
故V(Cl2)︰V(H2)=(0.050+0.10)mol︰0.10 mol=3︰2。
答案:(1)10.7% (2)0.25 (3)3︰2
19.(16分)(2011·昆明高一检测)在呼吸面具和潜水艇中可用过氧化钠作供氧剂。请选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:____________________________________。
(2)填写表中空格。
(3)写出过氧化钠与二氧化碳反应的化学方程式:
_____________________________________________。
(4)试管F中收集满气体后,下一步实验操作是:
_____________________________________________。
【解析】(1)根据装置图联想实验室制取CO2的原理,反应方程式应为:
CaCO3+2HCl ==== CaCl2+CO2↑+H2O
(2)实验要求证明过氧化钠可作供氧剂,因此最后应该收集到纯净的O2并进行验证,所以加入饱和NaHCO3溶液的目的是除去CO2中混入的HCl,C中应该放过氧化钠,让其与CO2和H2O(g)反应产生O2,因剩余的CO2影响O2的收集和检验,所以D中应放NaOH溶液以除去未反应完的CO2。
(3)CO2与Na2O2反应的方程式是历年高考中的常考内容,要求熟记。
(4)试管F中收集满气体后应对O2进行检验,其操作步骤是:把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,将带火星的木条伸入试管内,若木条复燃,则证明试管中收集的气体是氧气。
答案:(1)CaCO3+2HCl ==== CaCl2+H2O+CO2↑
(2)
(3)2Na2O2+2CO2 ==== 2Na2CO3+O2
(4)把E中的导管移出水面,关闭分液漏斗活塞,用拇指
堵住试管口,取出试管,将带火星的木条伸入试管内,若
木条复燃,则证明试管中收集的气体是氧气
20.(12分)如图为配制250 mL 0.2 mol·L-1Na2CO3溶液的示意图。
回答下列问题:
(1)①中称得Na2CO3______g。
(2)玻璃棒在②、③两步中的作用分别是______、______。
(3)若出现如下情况,对所配溶液浓度有何影响 (填“偏高”、“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视________;
B.没有进行操作步骤④和⑤__________;
C.在第⑤步不慎有少量液体流到容量瓶外________。
【解析】(1)n(Na2CO3)=c(Na2CO3)×V(Na2CO3)=
0.2 mol·L-1×0.25 L=0.05 mol
m(Na2CO3)=n(Na2CO3)×M(Na2CO3)
=0.05 mol×106 g/mol
=5.3 g
(2)玻璃棒是中学化学实验中常用的仪器,在第②步中,用玻璃棒搅拌,可加速Na2CO3固体的溶解;在第③步中,用玻璃棒引流,可防止Na2CO3溶液流到容量瓶外。
(3)所有的定量实验都存在一个“误差”的问题,在本实验的误差分析中,一定要紧扣物质的量浓度的定义式,即c= n/V。如果在第⑧步观察液面时俯视,V偏小,结果偏高;如果没有进行操作步骤④和⑤,n偏小,结果偏低;如果在第⑤步不慎有少量液体流到容量瓶外,n偏小,结果偏低。
答案:(1)5.3 (2)搅拌 引流
(3)偏高 偏低 偏低
21.(9分)(2011·上海高一检测)生态农业涉及农家肥料
的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、
氮气的混合气体。2.016 L(标准状况)的该气体通过盛有红
热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管
的质量减轻4.8 g。将反应后产生的气体通过过量的澄清石
灰水,充分吸收,生成沉淀8.5 g。
(1)原混合气体中甲烷的物质的量是________。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
△
【解析】设CH4为x mol,原混合气体中CO2为y mol,则有
CH4+4CuO CO2+2H2O+4Cu Δm
1 mol 1 mol 4×16 g
x x 4.8 g
x=0.075 mol
又因为n(总)= =0.09 mol,
n(CO2)= =0.085 mol,
△
所以y=0.085 mol-0.075 mol=0.01 mol
n(N2)=0.09 mol-0.01 mol-0.075 mol=0.005 mol
所以N2的体积分数为 ≈5.56%。
答案:(1)0.075 mol (2)5.56%
(一)
第1章 认识化学科学
(90分钟 100分)
一、选择题(本题包括15小题,每小题3分,共45分)
1.(2011·济南高一检测)为中国近代化学发展做出突出贡献的科学家是( )
A.李四光 B.华罗庚 C.侯德榜 D.钱学森
【解析】选C。题述四个选项中的科学家均为我国科学事业的发展做出了突出的贡献。其中,李四光是我国著名的地质学家;华罗庚是著名的数学家;钱学森是著名的物理学家;侯德榜被称为中国近代化学史上的第一颗明星,为中国化学工业的发展做出了卓越贡献,是中国近代化工工业的奠基人之一,他发明的联合制碱法为中华民族争得了荣誉。
2.钠露置在空气中,其变质过程中不可能产生的物质( )
A.Na2O B.NaOH C.Na2CO3 D.NaHCO3
【解析】选D。钠露置在空气中的变质过程如下:
3.当不慎有大量Cl2扩散到周围空间时,处在该环境中的人可以用浸有一定浓度某种物质的水溶液的毛巾捂住鼻子,以防中毒,该物质最适宜采用的是( )
A.NaOH B.NaCl
C.NaHCO3 D.NH3·H2O
【解析】选C。选择合适的物质时必须同时比较几个方面:一是要能够吸收氯气;二是本身无毒无腐蚀性,对人体无害;三是吸收氯气时生成的产物也应对人体无害。NaOH有强腐蚀性,NH3·H2O对人有很强的刺激作用,NaCl不能与Cl2反应,NaHCO3无腐蚀性,吸收Cl2能力强且快。
4.在配制一定物质的量浓度溶液的实验中,最后用胶头滴管定容后,液面正确的是( )
【解析】选B。在配制一定物质的量浓度溶液的实验中,定容后,溶液凹液面最低处应该与刻度线相切,B项正确。
5.下列叙述正确的是( )
A.1 mol O2的质量为32 g·mol-1
B.物质的量浓度为1 mol·L-1的溶液就是1 mol物质溶解在1 L水中形成的
C.SO42-的摩尔质量为96 g·mol-1
D.等体积、等物质的量浓度的两溶液中所含溶质的物质的量为1 mol
【解析】选C。质量的单位是“g”,摩尔质量的单位是“g·mol-1”, A项单位使用不正确;B项,应该是溶液的体积为1 L;D项,等体积不一定为1 L,等物质的量浓度不一定为1 mol·L-1。
6.精确配制一定物质的量浓度的NaOH溶液,下面实验操作中正确的是( )
A.称量时将NaOH固体直接放在托盘天平上面的纸上
B.将称好的NaOH固体放入容量瓶中,加入少量水溶解
C.在烧杯中溶解NaOH固体后,立即将所得溶液注入容量瓶中
D.将烧杯中已冷却的NaOH溶液注入未经干燥的容量瓶中
【解析】选D。A错误,称量NaOH时需放在玻璃器皿中称量,因为NaOH有腐蚀性;B、C两项错误,应先将称量好的NaOH放入烧杯中溶解,冷却至室温后再转移至容量瓶中,不能用容量瓶溶解;D正确,容量瓶未干燥对结果无影响。
7.(2011·厦门高一检测)下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气态物质的体积大小由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质的体积大小由构成气体的分子数决定
C.非标准状况下,1 mol任何气体的体积都不可能为
22.4 L
D.0.5 mol气体A和0.5 mol气体B的混合气体在标准状况下的体积一定约为22.4 L
【解析】选B 。由于气体分子间的距离远远大于分子本身的体积,所以在一定的温度和压强下,各种气态物质的体积大小由构成气体的分子数决定;非标准状况下,1 mol气体的体积也可能为22.4 L;D项中若两气体发生反应则无法判断反应后的体积。
8.下列说法不正确的是( )
①钠、氢气都能在氯气中燃烧生成白色烟雾
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯气的水溶液,它能使干燥的有色布条退色
④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A.① B.①和② C.①和④ D.①②③④
【解析】选D。①Na在Cl2中燃烧时生成白色烟,无雾产生,氢气在氯气中燃烧生成白雾,无烟产生;②CuCl2为棕黄色固体;③液氯为液态的氯气,为纯净物,不能使干燥的有色布条退色;④久置的氯水中,因HClO分解,已变为稀盐酸。
9.下列说法中错误的是( )
A.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.制成0.5 L 10 mol·L-1的盐酸,需要氯化氢气体
112 L(标准状况)
C.0.5 L 2 mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%硫酸(密度为1.84 g·cm-3)与10 mL
18.4 mol·L-1硫酸的浓度是不同的
【解析】选D。D项98%的硫酸的物质的量浓度为
。
10.实验室里需要480 mL 0.1 mol·L-1的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾,配成500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL 水
D.称取12.5 g胆矾,配成500 mL溶液
【解析】选D。500 mL容量瓶只能配500 mL溶液,因而配500 mL 0.1 mol·L-1 CuSO4溶液时,需CuSO4的质量为
0.1 mol·L-1×0.5 L×160 g·mol-1=8 g,或需CuSO4·5H2O的质量为0.1 mol·L-1×0.5 L×250 g·mol-1
=12.5 g,加水配成500 mL溶液。
11.下列实验操作完全正确的是( )
【解析】选C。A中应该用滤纸吸干钠表面的煤油且烧杯中的水不能装满;B中氯化钾固体应该在烧杯中溶解;D中过滤时不能用玻璃棒搅拌。
12.(双选)下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A.在常温常压下,11.2 L N2含有的分子数为0.5 NA
B.在常温常压下,1 mol Ne含有的原子数为NA
C.71 g Cl2所含原子数为2NA
D.在同温同压下,相同体积的任何气体单质所含的原子数相同
【解析】选B、C。本题着重考查气体摩尔体积的概念和适用条件,阿伏加德罗定律以及稀有气体的组成。常温常压下,11.2 L N2并不是0.5 mol,含有的分子数也就不为
0.5NA; Ne是由单原子构成的分子,1 mol Ne含有的原子数为NA,与状况无关;71 g Cl2恰好是1 mol Cl2,含原子数为2NA;在同温同压时,相同体积的任何气体单质所含的分子数相同,由于气体单质分子中所含原子数不同,如O3由3个原子构成,H2由2个原子构成,而Ne由1个原子构成,相同状况下,相同体积的上述气体单质所含原子数就不相同。
13.(2011·西城区高一检测)体积相同的某营养液两份,其配方如下:
两份营养液中各离子的浓度( )
A.完全相同 B.完全不同
C.仅c(K+)相同 D.仅c(Cl-)相同
【解析】选A。两份营养液配方不同,但各离子的物质的量都相同:n(K+)=0.7 mol;n(Cl-)=0.3 mol;n(Zn2+)=0.1 mol;n(SO42-)=0.3 mol;溶于水后所得营养液中各离子的浓度完全相同。
14.有一瓶14%的KOH溶液,加热蒸发掉100 g 水后,变为
28%的KOH溶液80 mL(蒸发过程中无溶质析出),该80 mL
溶液的物质的量浓度为( )
A.5 mol/L B.6 mol/L
C.6.25 mol/L D.6.75 mol/L
【解析】选C。设原溶液的质量为m,则m×14%=
(m-100 g)×28%,解得m=200 g,溶质的物质的量为
,蒸发后溶液的体积为80 mL,可求出该
溶液的物质的量浓度为6.25 mol/L。
15.将钠、铁、铝各0.3 mol分别放入100 mL 1 mol·L-1的盐酸中,同温同压下产生的气体体积比是( )
A.1∶2∶3 B.6∶3∶2
C.3∶1∶1 D.1∶1∶1
【解析】选C。由题意知:钠、铁、铝的物质的量均为
0.3 mol,n(HCl)=0.1 L×1 mol·L-1=0.1 mol。
经分析知,钠、铁、铝与盐酸反应时,金属均过量,盐酸不足。
当钠与盐酸反应时,因为过量的钠也能与H2O反应产生H2,所以产生H2的量以钠为准进行计算:
2Na ~ H2↑
2 mol 1 mol
0.3 mol n(H2)
n(H2)=0.15 mol
当铁、铝分别与盐酸反应时,产生H2的量以盐酸为准进行计算:
2HCl ~ H2↑
2 mol 1 mol
0.1 mol n′(H2)
n′(H2)=0.05 mol。
二、非选择题(本题包括6小题,共55分)
16.(6分)(1)在40.0 g某三价金属的硫酸盐中含
0.3 mol SO42-,此硫酸盐的摩尔质量为______;该金属元素的相对原子质量为_______。
(2)已知N2、CO2的混合气体的质量共10.0 g,标准状况下,体积为6.72 L ,原混合气体中N2、CO2的体积之比为
___________。
【解析】(1)某三价金属的硫酸盐的化学式可设为
R2(SO4)3,由化学式知:
0.1 mol R2(SO4)3中含0.3 mol SO42-
M=400 g/mol。
金属元素的相对原子质量= 。
(2)设标准状况下,N2的体积为V1,CO2的体积为V2,由题意
知:
V1=4.48 L
V2=2.24 L
V1∶V2=4.48 L∶2.24 L=2∶1。
答案:(1)400 g/mol 56 (2)2∶1
17.(6分)100 mL A2气体跟50 mL B2气体恰好完全反应,生成的气体体积为100 mL(同温同压条件下),试推断气体生成物的化学式_________,推断的依据是_________
_____________。
【解析】题目给出的已知条件有两个:一是根据反应物分子式可知它们都是双原子分子;二是在相同条件下各反应物和生成物气体的体积比A2∶B2∶AxBy=100∶50∶100=
2∶1∶2。根据阿伏加德罗定律知体积比就是该反应的化学方程式中各反应物和生成物的系数比,即2A2+B2 ==== 2AxBy。再结合质量守恒定律(反应前后各种原子的个数不变),就能推出:2x=2×2,x=2;2y=2,y=1。
答案:A2B 阿伏加德罗定律和质量守恒定律
18.(6分)一定量的氢气在氯气中燃烧,所得混合物被100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 mol。
(1)原NaOH溶液的质量分数为_______。
(2)所得溶液中Cl-的物质的量为______mol。
(3)所用氯气和参加反应的氢气的物质的量之比
n(Cl2)∶n(H2)=_______。
【解析】题目中没有给出氢气和氯气的具体量,但因为反
应后的混合物与NaOH溶液反应有NaClO生成,这意味着反应
中氯气过量。混合物恰好被完全吸收后,最后所得的溶液
为NaCl和NaClO的混合液。由Na、Cl的原子个数比为1︰1易
求得答案。
(1)
≈10.7%。
(2)据反应Cl2+H2 2HCl,Cl2+2NaOH ==== NaCl+NaClO
+H2O,HCl+NaOH ==== NaCl+H2O可知溶液中:n(Na+)=
n(Cl-)+n(ClO-)=0.1 L×3.00 mol·L-1=n(Cl-)+0.050 mol
n(C1-)=0.25 mol。
点燃
====
(3)利用相同条件下,体积比等于物质的量之比来求解。先根据NaClO的量确定与H2反应后过量的氯气的量,再根据NaCl与NaClO的差量确定氢气的量。
n(与H2反应后过量的Cl2)=n(NaClO)=0.050 mol,
则n(H2)=n(与H2反应的Cl2)=(0.25-0.050)/2=
0.10(mol)
故V(Cl2)︰V(H2)=(0.050+0.10)mol︰0.10 mol=3︰2。
答案:(1)10.7% (2)0.25 (3)3︰2
19.(16分)(2011·昆明高一检测)在呼吸面具和潜水艇中可用过氧化钠作供氧剂。请选用适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:____________________________________。
(2)填写表中空格。
(3)写出过氧化钠与二氧化碳反应的化学方程式:
_____________________________________________。
(4)试管F中收集满气体后,下一步实验操作是:
_____________________________________________。
【解析】(1)根据装置图联想实验室制取CO2的原理,反应方程式应为:
CaCO3+2HCl ==== CaCl2+CO2↑+H2O
(2)实验要求证明过氧化钠可作供氧剂,因此最后应该收集到纯净的O2并进行验证,所以加入饱和NaHCO3溶液的目的是除去CO2中混入的HCl,C中应该放过氧化钠,让其与CO2和H2O(g)反应产生O2,因剩余的CO2影响O2的收集和检验,所以D中应放NaOH溶液以除去未反应完的CO2。
(3)CO2与Na2O2反应的方程式是历年高考中的常考内容,要求熟记。
(4)试管F中收集满气体后应对O2进行检验,其操作步骤是:把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,将带火星的木条伸入试管内,若木条复燃,则证明试管中收集的气体是氧气。
答案:(1)CaCO3+2HCl ==== CaCl2+H2O+CO2↑
(2)
(3)2Na2O2+2CO2 ==== 2Na2CO3+O2
(4)把E中的导管移出水面,关闭分液漏斗活塞,用拇指
堵住试管口,取出试管,将带火星的木条伸入试管内,若
木条复燃,则证明试管中收集的气体是氧气
20.(12分)如图为配制250 mL 0.2 mol·L-1Na2CO3溶液的示意图。
回答下列问题:
(1)①中称得Na2CO3______g。
(2)玻璃棒在②、③两步中的作用分别是______、______。
(3)若出现如下情况,对所配溶液浓度有何影响 (填“偏高”、“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视________;
B.没有进行操作步骤④和⑤__________;
C.在第⑤步不慎有少量液体流到容量瓶外________。
【解析】(1)n(Na2CO3)=c(Na2CO3)×V(Na2CO3)=
0.2 mol·L-1×0.25 L=0.05 mol
m(Na2CO3)=n(Na2CO3)×M(Na2CO3)
=0.05 mol×106 g/mol
=5.3 g
(2)玻璃棒是中学化学实验中常用的仪器,在第②步中,用玻璃棒搅拌,可加速Na2CO3固体的溶解;在第③步中,用玻璃棒引流,可防止Na2CO3溶液流到容量瓶外。
(3)所有的定量实验都存在一个“误差”的问题,在本实验的误差分析中,一定要紧扣物质的量浓度的定义式,即c= n/V。如果在第⑧步观察液面时俯视,V偏小,结果偏高;如果没有进行操作步骤④和⑤,n偏小,结果偏低;如果在第⑤步不慎有少量液体流到容量瓶外,n偏小,结果偏低。
答案:(1)5.3 (2)搅拌 引流
(3)偏高 偏低 偏低
21.(9分)(2011·上海高一检测)生态农业涉及农家肥料
的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、
氮气的混合气体。2.016 L(标准状况)的该气体通过盛有红
热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管
的质量减轻4.8 g。将反应后产生的气体通过过量的澄清石
灰水,充分吸收,生成沉淀8.5 g。
(1)原混合气体中甲烷的物质的量是________。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
△
【解析】设CH4为x mol,原混合气体中CO2为y mol,则有
CH4+4CuO CO2+2H2O+4Cu Δm
1 mol 1 mol 4×16 g
x x 4.8 g
x=0.075 mol
又因为n(总)= =0.09 mol,
n(CO2)= =0.085 mol,
△
所以y=0.085 mol-0.075 mol=0.01 mol
n(N2)=0.09 mol-0.01 mol-0.075 mol=0.005 mol
所以N2的体积分数为 ≈5.56%。
答案:(1)0.075 mol (2)5.56%
