11-12版高中化学全程学习方略配套课件:4.1无机非金属材料的主角——硅(人教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:4.1无机非金属材料的主角——硅(人教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 08:11:39 | ||
图片预览









文档简介
(共83张PPT)
【典例1】下列叙述正确的是
A.CO2和SiO2都是酸性氧化物,所以两者物理性质相似
B.因为CaCO3+SiO2 CaSiO3+CO2↑,所以硅酸的酸性比
碳酸强
C.CO2和SiO2都能与碳反应,且都作氧化剂
D.SiO2既能和NaOH反应,又能和HF反应,所以二氧化硅属
于两性氧化物
高温
====
【思路点拨】解答本题要注意以下三点:
【自主解答】选C。CO2的熔沸点低,溶于水,SiO2的熔沸点高,硬度大,不溶于水,两者是酸性氧化物和其物理性质没有因果关系,A错;CaCO3和SiO2反应是SiO2的特殊性质,不能说明H2CO3的酸性比H2SiO3的弱,B错;SiO2和HF反应也是SiO2的特殊性质,不能说明SiO2是两性氧化物,D错。
【互动探究】(1)小马同学认为“因SiO2不溶于水,故SiO2不是酸性氧化物”,小马同学的理解对吗?
提示:不对,SiO2不溶于水,但它能与碱反应生成硅酸盐和水,是酸性氧化物。
(2)在化学反应2C+SiO2 2CO↑+Si中,氧化剂与还原剂的物质的量之比是多少?
提示:该反应中氧化剂是SiO2,还原剂是C,二者的物质的量之比为1∶2。
高温
====
【变式训练】高温时不和碳反应的是( )
A.CO B.CO2 C.SiO2 D.CuO
【解析】选A。高温时,CO2、SiO2、CuO都能与碳反应,
化学方程式分别为:C+CO2 2CO,
2C+SiO2 2CO↑+Si,C+2CuO 2Cu+CO2↑,CO与碳
不反应。
高温
====
高温
====
高温
====
【典例2】有关硅元素的下列叙述中正确的是
A.硅与任何酸都不反应
B.硅元素是构成矿物岩石的主要成分之一,其化合态几乎全部是氧化物和硅酸盐
C.硅的性质很稳定,能以游离态形式存在于自然界中
D.常温时硅不与任何物质反应
【思路点拨】解答本题要注意以下两点:
【自主解答】选B。硅是亲氧元素,在自然界中全以化合态形式存在,主要是氧化物和硅酸盐的形式,B对,C错;常温时,硅能与氟气、氢氟酸、氢氧化钠溶液等发生反应,A、D都错。
【互动探究】(1)硅可以作半导体材料,利用了它的什么性质?
提示:晶体硅的导电性介于导体和绝缘体之间,常作半导体材料。
(2)硅与氢氧化钠溶液反应是置换反应吗?反应中还原剂是什么?
提示:硅与氢氧化钠溶液反应的化学方程式为Si+2NaOH+H2O====Na2SiO3+2H2↑,该反应不是置换反应,但属氧化还原反应,反应中还原剂是硅。
【变式训练】下列关于碳和硅的说法中正确的是( )
A.其对应氧化物均为酸性氧化物
B.碳和硅的最高正价都是+4价
C.硅元素在地壳中的含量占第二位,碳占第一位
D.碳和硅在自然界中的存在形式都是既有游离态也有化合态
【解析】选B。CO2、SiO2属于酸性氧化物,但CO则不是,A错;碳和硅都是非金属,其原子最外层都是4个电子,最高正价为+4价,B正确;在地壳中占第一位的是氧,不是碳,C错;硅在自然界只能以化合态形式存在,D错。
【典例】(2010·福建高考)下列各组物质中,满足下图物质一步转化关系的选项是
【思路点拨】解答本题要注意以下三点:
【自主解答】选C。选项A中:NaHCO3不能一步得到Na,所以A错误;选项B中:Cu(OH)2不能一步得到Cu ,所以B错误;选项C中:C在氧气中不完全燃烧会得到CO,CO在氧气中燃烧会得到CO2,CO2在一定条件下与单质钠反应可以生成金刚石和碳酸钠,所以C正确;选项D中:SiO2不能一步生成H2SiO3,H2SiO3也不能一步生成Si,所以D项错误。
【互动探究】(1)你能写出A项中由Y→Z的化学方程式吗?
提示:二氧化碳足量时即可生成,化学方程式为
NaOH+CO2====NaHCO3。
(2)D项中可以实现Y→X的转化,请写出该反应的化学方程式。
提示:2C+SiO2 2CO↑+Si。
高温
====
【变式训练】下列物质的变化,不能通过一步化学反应完成的是( )
A.CO2→H2CO3 B.SiO2→Na2SiO3
C.Na2O2→Na2CO3 D.SiO2→H2SiO3
【解析】选D。A项另一反应物为水,B项另一反应物为氧化钠或氢氧化钠,C项另一反应物为二氧化碳,D项二氧化硅与水不反应。
【典例】下列有关硅的化合物说法正确的是
A.SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子
B.硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分
C.H2SiO3既可由SiO2溶于水制得,也可由Na2SiO3和其他酸(如盐酸)反应制得
D.SiO2是酸性氧化物,能和碱反应,不能和酸反应
【易错选项】A
【易错剖析】
(1)易错选项分析
错选A的原因在于对SiO2这个化学式分析不到位。SiO2并不是说一个硅原子结合两个氧原子形成一个SiO2分子;正确的是SiO2是由硅原子和氧原子形成的立体网状结构,在这个网状结构中,硅原子与氧原子个数比是1∶2。
(2)其他错误选项分析
【标准答案】B
1.Na2O·CaO·6SiO2是一种( )
A.含氧酸 B.硅酸盐 C.氧化物 D.混合物
【解析】选B。Na2O·CaO·6SiO2是硅酸盐的氧化物的表示形式。
2.SiO2和CO2都具有的性质是( )
A.都能与水反应
B.都能与强碱溶液反应生成盐和水
C.熔点、沸点都比较低
D.常温下都是固体
【解析】选B。CO2常温下为气体,熔点低,能与水化合生成相应的酸;而SiO2则为固体,熔点很高,但不能与水化合生成相应的酸。SiO2和CO2都能与强碱溶液反应生成盐和水。
3.(2011·黄石高一检测)下列关于硅的说法中错误的是
( )
A.自然界中硅元素的储量丰富
B.自然界中存在大量的单质硅
C.高纯度的硅被用作计算机芯片
D.二氧化硅是光导纤维的基本原料
【解析】选B。自然界中硅元素的储量丰富,占第二位,全部以化合态存在,硅可作半导体材料,被用作计算机芯片,光导纤维的基本原料是二氧化硅,故A、C、D正确,B错误。
4.在下列所示的转化关系中,X可能是( )
X 氧化物 氧化物
A.Al B.Si C.Mg D.C
【解析】选D。铝与氧气反应生成氧化铝,硅与氧气反应生
成二氧化硅,镁与氧气反应生成氧化镁,三者均不能继续
被氧化;2C+O2(不足) 2CO,2CO+O2 2CO2 ,所以
碳能连续被氧化。
O2
O2
点燃
====
点燃
====
5.已知A是灰黑色的、有金属光泽的固体单质。
根据如图所示的物质之间的转化关系,回答下列有关问题。
(1)写出B、C两物质的名称:
B______________________,C__________________。
(2)写出D→B的化学方程式:_________________。
(3)写出B→C的离子方程式:_________________。
【解析】据A是灰黑色的、有金属光泽的固体单质知A是硅,则B是硅酸钠,C是硅酸,D是二氧化硅。
答案:(1)硅酸钠 硅酸
(2)SiO2+2NaOH====Na2SiO3+H2O
(3)SiO32-+H2O+CO2====CO32-+H2SiO3↓
一、选择题(本题包括5小题,每小题4分,共20分)
1.关于地壳中含量占第一位和第二位的元素之间形成的化合物,有关其说法正确的是( )
A.化学性质不活泼
B.可溶于水且显酸性
C.熔沸点较低,物理性质与CO2相似
D.是酸性氧化物,不溶于任何酸
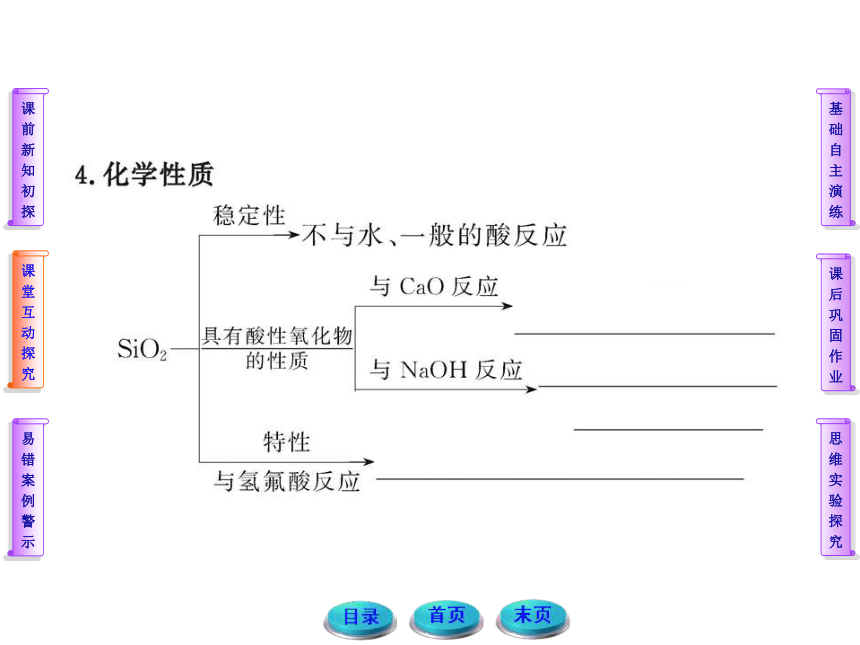
【解析】选A。地壳中含量占第一位和第二位的元素分别是氧、硅,因此二者形成的化合物是SiO2,SiO2的熔沸点较高,不溶于水,物理性质与CO2的差别较大;SiO2的化学性质较稳定,不活泼,是酸性氧化物,能与氢氟酸发生反应,A正确。
2.(2011·长春高一检测)下列试剂不能用带磨口玻璃塞的
试剂瓶存放的是( )
A.盐酸 B.NaCl溶液
C.NaOH溶液 D.CuSO4溶液
【解析】选C。盛放强碱液的试剂瓶不能用磨口玻璃塞,因
为会发生反应SiO2+2NaOH Na2SiO3+H2O,硅酸钠溶液具
有黏合性,使瓶塞打不开。
====
3.能证明硅酸的酸性弱于碳酸的酸性的实验事实是( )
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸盐反应生成CO2
D.Na2CO3、Na2SiO3均易溶于水
【解析】选B。利用强酸制取弱酸的反应原理,CO2溶于水形成碳酸,碳酸与硅酸盐溶液反应得到硅酸沉淀,从而证明碳酸的酸性强于硅酸。
4.(2011·烟台高一检测)北京奥运金牌“金镶玉”环形玉璧由
昆仑玉制成,昆仑玉的成分可简单看成是Ca2Mg5Si8O22(OH)2,
则其用二氧化硅和金属氧化物的形式可表示为( )
A.CaO·MgO·SiO2·H2O
B.2CaO·5MgO·8SiO2·H2O
C.2CaO·MgO·SiO2·2H2O
D.5CaO·2MgO·8SiO2·H2O
【解析】选B。硅酸盐改写成氧化物的形式为:活泼金属氧化物·较活泼金属氧化物· SiO2·H2O,同时要遵循原子守恒,故B正确。
【方法技巧】硅酸盐的氧化物表示形式的书写技巧
硅酸盐由于组成比较复杂,通常改写成氧化物的形式,具体方法为:
(1)遵循各元素种类和原子个数比不变的原则,分别写成氧化物的形式;
(2)氧化物一般按活泼金属氧化物、较活泼金属氧化物、二氧化硅,最后为水的顺序排列;
(3)氧化物之间用圆点隔开,各氧化物前面的化学计量数均为整数。
5.(双选)向下列物质的溶液中滴加盐酸有沉淀产生,当盐酸过量时,沉淀仍不消失的是( )
A.Na2SiO3 B.Ca(OH)2
C.AgNO3 D.NaAlO2
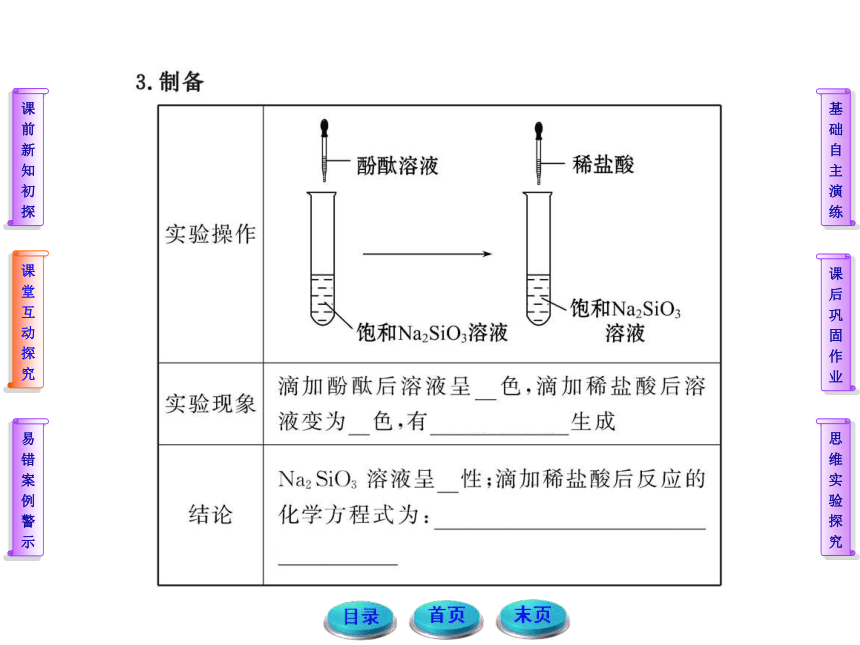
【解析】选A、C。A项产生硅酸沉淀,C项产生氯化银沉淀,二者均不溶于过量的盐酸,B项不产生沉淀,D项开始产生沉淀,后来沉淀溶解消失。
二、非选择题(本题包括3小题,共30分)
6.(10分)A、B、X、Y均为中学阶段的常见物质,它们之间
的转化关系如下图所示,
试写出符合下列条件的化学方程式:
(1)若物质A为氧化物,B为红棕色粉末 ;
(2)若A和X均为非金属固体单质 。
(3)若A为金属,X为非金属,小芳同学写出反应
2Na+2H2O 2NaOH+H2↑,对吗?为什么? 。
====
【解析】(1)红棕色粉末为Fe2O3,结合反应特点可知,A为
CO,则反应为3CO+Fe2O3 2Fe+3CO2。
(2)因为A和X均为非金属固体单质,且A能置换X,所以该反
应为2C+SiO2 2CO↑+Si。
(3)不对,因为Y是氧化物,所写的反应不符合。
答案:(1)3CO+Fe2O3 2Fe+3CO2
(2)2C+SiO2 2CO↑+Si
(3) 不对。因为Y是氧化物,所写的反应不符合
高温
====
高温
====
高温
====
高温
====
7.(10分)(1)用两种方法鉴别下列两种白色粉末物质。
Na2CO3和SiO2
;
。
(2)欲鉴别CaCO3和Na2SiO3,某同学分别取少许待测粉末,滴加稀盐酸,指出他观察到的现象:
CaCO3 : ;
Na2SiO3: 。
【解析】(1)可利用加水溶解的方法,能溶于水的是
Na2CO3,不溶于水的是SiO2;
可用焰色反应法:焰色反应为黄色的是Na2CO3,余者为
SiO2;
可用酸液产气法:分别取少许待测粉末,滴加稀盐酸,能
够产生气体的是Na2CO3;不反应的是SiO2。化学方程式:
Na2CO3+2HCl 2NaCl+H2O+CO2↑。
(2)分别取少许待测粉末,滴加稀盐酸,CaCO3能够产生无
色气体, Na2SiO3则能产生白色沉淀。
====
答案:(1)加水溶解法:能溶于水的是Na2CO3,不溶于
水的是SiO2
焰色反应法:焰色反应为黄色的是Na2CO3,余者为SiO2
或酸液产气法:分别取少许待测粉末,滴加稀盐酸,能够产
生气体的是Na2CO3;不反应的是SiO2。化学方程式:Na2CO3+
2HCl 2NaCl+H2O+CO2↑ (答两种合理方法即可)
(2)产生无色气体 产生白色沉淀
====
8.(10分)(挑战能力)为确认下面三种酸的酸性强弱:HCl>H2CO3>H2SiO3,想想同学设计了如图所示的装置,通过一次实验即可达到目的。请回答下列问题:
(1)锥形瓶中装有某可溶性正盐溶液,该盐在分类上属于
(填“碳酸盐”、“硫酸盐”或“硅酸盐”)。
(2)装置B中所盛的试剂为饱和NaHCO3溶液,其作用是 。
(3)装置C中所盛的试剂是 (填“NaCl”、“Na2CO3”或“Na2SiO3”)溶液,C中反应的离子方程式是 。
【解析】由所给装置及HCl、H2CO3、H2SiO3的性质可知,在
装置A中应产生二氧化碳,所以锥形瓶中应装有碳酸盐,产
生的二氧化碳经过除杂(除去挥发出的HCl),通入到硅酸钠
溶液中,得到硅酸沉淀,即可判断酸性HCl>H2CO3>
H2SiO3。
答案:(1)碳酸盐
(2)除去CO2中的HCl气体
(3)Na2SiO3 +CO2(少)+H2O H2SiO3↓+
[或 +2CO2(过)+2H2O H2SiO3↓+2 ]
====
====
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:
Si+3HCl====SiHCl3+H2;
③SiHCl3(沸点:33.0 ℃)与过量H2在1 000~1 100 ℃反应制得纯硅。(已知SiHCl3能与H2O剧烈反应,在空气中易自燃)
用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去)。
【思考探究】
(1)请写出第①步制备粗硅,装置D中发生反应的化学方程
式,并指出三个步骤中发生的反应属于置换反应的是哪几
个?
提示:在高温条件下,用C还原SiO2生成CO和粗硅,化学方
程式为2C+SiO2 2CO↑+Si;据步骤③可写出装置D中发
生的反应为
所以三个步骤中发生的反应都属于置换反应。
高温
====
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点
33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点
-84.7 ℃),那么该如何提纯SiHCl3?
提示:分离、提纯不同沸点的液体可以采用分馏或蒸馏。
(3)装置B中的试剂是什么?其作用是什么?
提示:用Zn和稀硫酸制得的H2中会混有少量H2O,而SiHCl3能与H2O剧烈反应,所以要进行干燥,根据装置应选择液态干燥剂浓硫酸。
【典例1】下列叙述正确的是
A.CO2和SiO2都是酸性氧化物,所以两者物理性质相似
B.因为CaCO3+SiO2 CaSiO3+CO2↑,所以硅酸的酸性比
碳酸强
C.CO2和SiO2都能与碳反应,且都作氧化剂
D.SiO2既能和NaOH反应,又能和HF反应,所以二氧化硅属
于两性氧化物
高温
====
【思路点拨】解答本题要注意以下三点:
【自主解答】选C。CO2的熔沸点低,溶于水,SiO2的熔沸点高,硬度大,不溶于水,两者是酸性氧化物和其物理性质没有因果关系,A错;CaCO3和SiO2反应是SiO2的特殊性质,不能说明H2CO3的酸性比H2SiO3的弱,B错;SiO2和HF反应也是SiO2的特殊性质,不能说明SiO2是两性氧化物,D错。
【互动探究】(1)小马同学认为“因SiO2不溶于水,故SiO2不是酸性氧化物”,小马同学的理解对吗?
提示:不对,SiO2不溶于水,但它能与碱反应生成硅酸盐和水,是酸性氧化物。
(2)在化学反应2C+SiO2 2CO↑+Si中,氧化剂与还原剂的物质的量之比是多少?
提示:该反应中氧化剂是SiO2,还原剂是C,二者的物质的量之比为1∶2。
高温
====
【变式训练】高温时不和碳反应的是( )
A.CO B.CO2 C.SiO2 D.CuO
【解析】选A。高温时,CO2、SiO2、CuO都能与碳反应,
化学方程式分别为:C+CO2 2CO,
2C+SiO2 2CO↑+Si,C+2CuO 2Cu+CO2↑,CO与碳
不反应。
高温
====
高温
====
高温
====
【典例2】有关硅元素的下列叙述中正确的是
A.硅与任何酸都不反应
B.硅元素是构成矿物岩石的主要成分之一,其化合态几乎全部是氧化物和硅酸盐
C.硅的性质很稳定,能以游离态形式存在于自然界中
D.常温时硅不与任何物质反应
【思路点拨】解答本题要注意以下两点:
【自主解答】选B。硅是亲氧元素,在自然界中全以化合态形式存在,主要是氧化物和硅酸盐的形式,B对,C错;常温时,硅能与氟气、氢氟酸、氢氧化钠溶液等发生反应,A、D都错。
【互动探究】(1)硅可以作半导体材料,利用了它的什么性质?
提示:晶体硅的导电性介于导体和绝缘体之间,常作半导体材料。
(2)硅与氢氧化钠溶液反应是置换反应吗?反应中还原剂是什么?
提示:硅与氢氧化钠溶液反应的化学方程式为Si+2NaOH+H2O====Na2SiO3+2H2↑,该反应不是置换反应,但属氧化还原反应,反应中还原剂是硅。
【变式训练】下列关于碳和硅的说法中正确的是( )
A.其对应氧化物均为酸性氧化物
B.碳和硅的最高正价都是+4价
C.硅元素在地壳中的含量占第二位,碳占第一位
D.碳和硅在自然界中的存在形式都是既有游离态也有化合态
【解析】选B。CO2、SiO2属于酸性氧化物,但CO则不是,A错;碳和硅都是非金属,其原子最外层都是4个电子,最高正价为+4价,B正确;在地壳中占第一位的是氧,不是碳,C错;硅在自然界只能以化合态形式存在,D错。
【典例】(2010·福建高考)下列各组物质中,满足下图物质一步转化关系的选项是
【思路点拨】解答本题要注意以下三点:
【自主解答】选C。选项A中:NaHCO3不能一步得到Na,所以A错误;选项B中:Cu(OH)2不能一步得到Cu ,所以B错误;选项C中:C在氧气中不完全燃烧会得到CO,CO在氧气中燃烧会得到CO2,CO2在一定条件下与单质钠反应可以生成金刚石和碳酸钠,所以C正确;选项D中:SiO2不能一步生成H2SiO3,H2SiO3也不能一步生成Si,所以D项错误。
【互动探究】(1)你能写出A项中由Y→Z的化学方程式吗?
提示:二氧化碳足量时即可生成,化学方程式为
NaOH+CO2====NaHCO3。
(2)D项中可以实现Y→X的转化,请写出该反应的化学方程式。
提示:2C+SiO2 2CO↑+Si。
高温
====
【变式训练】下列物质的变化,不能通过一步化学反应完成的是( )
A.CO2→H2CO3 B.SiO2→Na2SiO3
C.Na2O2→Na2CO3 D.SiO2→H2SiO3
【解析】选D。A项另一反应物为水,B项另一反应物为氧化钠或氢氧化钠,C项另一反应物为二氧化碳,D项二氧化硅与水不反应。
【典例】下列有关硅的化合物说法正确的是
A.SiO2与CO2相似,由一个硅原子和两个氧原子构成一个SiO2分子
B.硅酸盐一般不溶于水,它是水泥、陶瓷、玻璃的主要成分
C.H2SiO3既可由SiO2溶于水制得,也可由Na2SiO3和其他酸(如盐酸)反应制得
D.SiO2是酸性氧化物,能和碱反应,不能和酸反应
【易错选项】A
【易错剖析】
(1)易错选项分析
错选A的原因在于对SiO2这个化学式分析不到位。SiO2并不是说一个硅原子结合两个氧原子形成一个SiO2分子;正确的是SiO2是由硅原子和氧原子形成的立体网状结构,在这个网状结构中,硅原子与氧原子个数比是1∶2。
(2)其他错误选项分析
【标准答案】B
1.Na2O·CaO·6SiO2是一种( )
A.含氧酸 B.硅酸盐 C.氧化物 D.混合物
【解析】选B。Na2O·CaO·6SiO2是硅酸盐的氧化物的表示形式。
2.SiO2和CO2都具有的性质是( )
A.都能与水反应
B.都能与强碱溶液反应生成盐和水
C.熔点、沸点都比较低
D.常温下都是固体
【解析】选B。CO2常温下为气体,熔点低,能与水化合生成相应的酸;而SiO2则为固体,熔点很高,但不能与水化合生成相应的酸。SiO2和CO2都能与强碱溶液反应生成盐和水。
3.(2011·黄石高一检测)下列关于硅的说法中错误的是
( )
A.自然界中硅元素的储量丰富
B.自然界中存在大量的单质硅
C.高纯度的硅被用作计算机芯片
D.二氧化硅是光导纤维的基本原料
【解析】选B。自然界中硅元素的储量丰富,占第二位,全部以化合态存在,硅可作半导体材料,被用作计算机芯片,光导纤维的基本原料是二氧化硅,故A、C、D正确,B错误。
4.在下列所示的转化关系中,X可能是( )
X 氧化物 氧化物
A.Al B.Si C.Mg D.C
【解析】选D。铝与氧气反应生成氧化铝,硅与氧气反应生
成二氧化硅,镁与氧气反应生成氧化镁,三者均不能继续
被氧化;2C+O2(不足) 2CO,2CO+O2 2CO2 ,所以
碳能连续被氧化。
O2
O2
点燃
====
点燃
====
5.已知A是灰黑色的、有金属光泽的固体单质。
根据如图所示的物质之间的转化关系,回答下列有关问题。
(1)写出B、C两物质的名称:
B______________________,C__________________。
(2)写出D→B的化学方程式:_________________。
(3)写出B→C的离子方程式:_________________。
【解析】据A是灰黑色的、有金属光泽的固体单质知A是硅,则B是硅酸钠,C是硅酸,D是二氧化硅。
答案:(1)硅酸钠 硅酸
(2)SiO2+2NaOH====Na2SiO3+H2O
(3)SiO32-+H2O+CO2====CO32-+H2SiO3↓
一、选择题(本题包括5小题,每小题4分,共20分)
1.关于地壳中含量占第一位和第二位的元素之间形成的化合物,有关其说法正确的是( )
A.化学性质不活泼
B.可溶于水且显酸性
C.熔沸点较低,物理性质与CO2相似
D.是酸性氧化物,不溶于任何酸
【解析】选A。地壳中含量占第一位和第二位的元素分别是氧、硅,因此二者形成的化合物是SiO2,SiO2的熔沸点较高,不溶于水,物理性质与CO2的差别较大;SiO2的化学性质较稳定,不活泼,是酸性氧化物,能与氢氟酸发生反应,A正确。
2.(2011·长春高一检测)下列试剂不能用带磨口玻璃塞的
试剂瓶存放的是( )
A.盐酸 B.NaCl溶液
C.NaOH溶液 D.CuSO4溶液
【解析】选C。盛放强碱液的试剂瓶不能用磨口玻璃塞,因
为会发生反应SiO2+2NaOH Na2SiO3+H2O,硅酸钠溶液具
有黏合性,使瓶塞打不开。
====
3.能证明硅酸的酸性弱于碳酸的酸性的实验事实是( )
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸盐反应生成CO2
D.Na2CO3、Na2SiO3均易溶于水
【解析】选B。利用强酸制取弱酸的反应原理,CO2溶于水形成碳酸,碳酸与硅酸盐溶液反应得到硅酸沉淀,从而证明碳酸的酸性强于硅酸。
4.(2011·烟台高一检测)北京奥运金牌“金镶玉”环形玉璧由
昆仑玉制成,昆仑玉的成分可简单看成是Ca2Mg5Si8O22(OH)2,
则其用二氧化硅和金属氧化物的形式可表示为( )
A.CaO·MgO·SiO2·H2O
B.2CaO·5MgO·8SiO2·H2O
C.2CaO·MgO·SiO2·2H2O
D.5CaO·2MgO·8SiO2·H2O
【解析】选B。硅酸盐改写成氧化物的形式为:活泼金属氧化物·较活泼金属氧化物· SiO2·H2O,同时要遵循原子守恒,故B正确。
【方法技巧】硅酸盐的氧化物表示形式的书写技巧
硅酸盐由于组成比较复杂,通常改写成氧化物的形式,具体方法为:
(1)遵循各元素种类和原子个数比不变的原则,分别写成氧化物的形式;
(2)氧化物一般按活泼金属氧化物、较活泼金属氧化物、二氧化硅,最后为水的顺序排列;
(3)氧化物之间用圆点隔开,各氧化物前面的化学计量数均为整数。
5.(双选)向下列物质的溶液中滴加盐酸有沉淀产生,当盐酸过量时,沉淀仍不消失的是( )
A.Na2SiO3 B.Ca(OH)2
C.AgNO3 D.NaAlO2
【解析】选A、C。A项产生硅酸沉淀,C项产生氯化银沉淀,二者均不溶于过量的盐酸,B项不产生沉淀,D项开始产生沉淀,后来沉淀溶解消失。
二、非选择题(本题包括3小题,共30分)
6.(10分)A、B、X、Y均为中学阶段的常见物质,它们之间
的转化关系如下图所示,
试写出符合下列条件的化学方程式:
(1)若物质A为氧化物,B为红棕色粉末 ;
(2)若A和X均为非金属固体单质 。
(3)若A为金属,X为非金属,小芳同学写出反应
2Na+2H2O 2NaOH+H2↑,对吗?为什么? 。
====
【解析】(1)红棕色粉末为Fe2O3,结合反应特点可知,A为
CO,则反应为3CO+Fe2O3 2Fe+3CO2。
(2)因为A和X均为非金属固体单质,且A能置换X,所以该反
应为2C+SiO2 2CO↑+Si。
(3)不对,因为Y是氧化物,所写的反应不符合。
答案:(1)3CO+Fe2O3 2Fe+3CO2
(2)2C+SiO2 2CO↑+Si
(3) 不对。因为Y是氧化物,所写的反应不符合
高温
====
高温
====
高温
====
高温
====
7.(10分)(1)用两种方法鉴别下列两种白色粉末物质。
Na2CO3和SiO2
;
。
(2)欲鉴别CaCO3和Na2SiO3,某同学分别取少许待测粉末,滴加稀盐酸,指出他观察到的现象:
CaCO3 : ;
Na2SiO3: 。
【解析】(1)可利用加水溶解的方法,能溶于水的是
Na2CO3,不溶于水的是SiO2;
可用焰色反应法:焰色反应为黄色的是Na2CO3,余者为
SiO2;
可用酸液产气法:分别取少许待测粉末,滴加稀盐酸,能
够产生气体的是Na2CO3;不反应的是SiO2。化学方程式:
Na2CO3+2HCl 2NaCl+H2O+CO2↑。
(2)分别取少许待测粉末,滴加稀盐酸,CaCO3能够产生无
色气体, Na2SiO3则能产生白色沉淀。
====
答案:(1)加水溶解法:能溶于水的是Na2CO3,不溶于
水的是SiO2
焰色反应法:焰色反应为黄色的是Na2CO3,余者为SiO2
或酸液产气法:分别取少许待测粉末,滴加稀盐酸,能够产
生气体的是Na2CO3;不反应的是SiO2。化学方程式:Na2CO3+
2HCl 2NaCl+H2O+CO2↑ (答两种合理方法即可)
(2)产生无色气体 产生白色沉淀
====
8.(10分)(挑战能力)为确认下面三种酸的酸性强弱:HCl>H2CO3>H2SiO3,想想同学设计了如图所示的装置,通过一次实验即可达到目的。请回答下列问题:
(1)锥形瓶中装有某可溶性正盐溶液,该盐在分类上属于
(填“碳酸盐”、“硫酸盐”或“硅酸盐”)。
(2)装置B中所盛的试剂为饱和NaHCO3溶液,其作用是 。
(3)装置C中所盛的试剂是 (填“NaCl”、“Na2CO3”或“Na2SiO3”)溶液,C中反应的离子方程式是 。
【解析】由所给装置及HCl、H2CO3、H2SiO3的性质可知,在
装置A中应产生二氧化碳,所以锥形瓶中应装有碳酸盐,产
生的二氧化碳经过除杂(除去挥发出的HCl),通入到硅酸钠
溶液中,得到硅酸沉淀,即可判断酸性HCl>H2CO3>
H2SiO3。
答案:(1)碳酸盐
(2)除去CO2中的HCl气体
(3)Na2SiO3 +CO2(少)+H2O H2SiO3↓+
[或 +2CO2(过)+2H2O H2SiO3↓+2 ]
====
====
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:
Si+3HCl====SiHCl3+H2;
③SiHCl3(沸点:33.0 ℃)与过量H2在1 000~1 100 ℃反应制得纯硅。(已知SiHCl3能与H2O剧烈反应,在空气中易自燃)
用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去)。
【思考探究】
(1)请写出第①步制备粗硅,装置D中发生反应的化学方程
式,并指出三个步骤中发生的反应属于置换反应的是哪几
个?
提示:在高温条件下,用C还原SiO2生成CO和粗硅,化学方
程式为2C+SiO2 2CO↑+Si;据步骤③可写出装置D中发
生的反应为
所以三个步骤中发生的反应都属于置换反应。
高温
====
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点
33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点
-84.7 ℃),那么该如何提纯SiHCl3?
提示:分离、提纯不同沸点的液体可以采用分馏或蒸馏。
(3)装置B中的试剂是什么?其作用是什么?
提示:用Zn和稀硫酸制得的H2中会混有少量H2O,而SiHCl3能与H2O剧烈反应,所以要进行干燥,根据装置应选择液态干燥剂浓硫酸。
