11-12版高中化学全程学习方略配套课件:1.1.1化学实验安全 过滤和蒸发(人教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:1.1.1化学实验安全 过滤和蒸发(人教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 5.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 08:34:21 | ||
图片预览








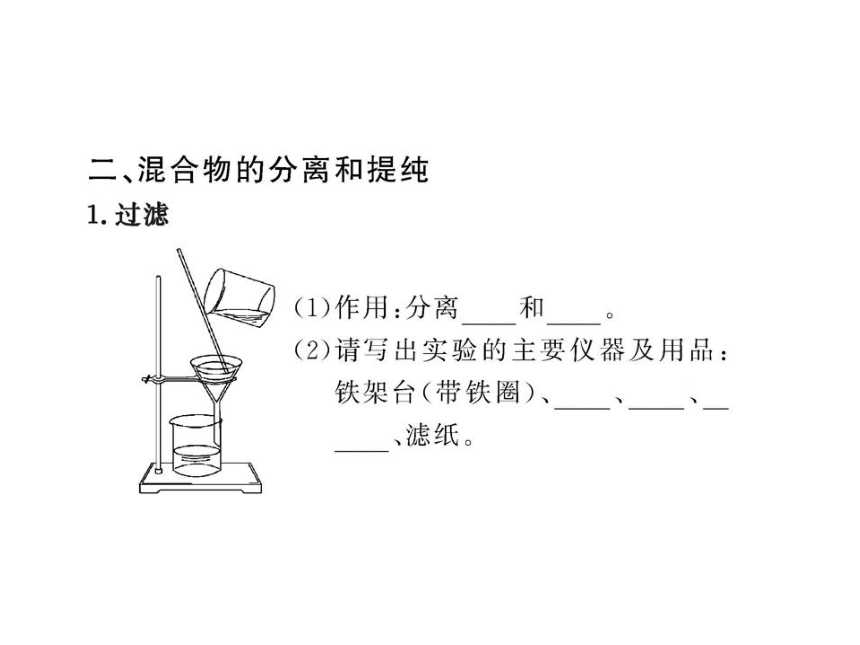
文档简介
(共97张PPT)
【典例1】进行化学实验必须注意安全,下列说法中正确的组合是
①点燃氢气前要检验氢气的纯度,以免发生爆炸
②CO气体有毒,处理CO气体时可将其点燃,转化为无毒的CO2
③在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底部铺上一层沙子
④用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气
⑤稀释浓硫酸的操作图为:
A.①②③④ B.①②③
C.①②④ D.①②③④⑤
【思路点拨】
【自主解答】选B。
【互动探究】(1)用排水法收集氢气时如何检验氢气的纯度?试叙述其操作过程。
提示:用排水法收集一试管氢气,用拇指堵住试管口,管口向下移近酒精灯火焰,松开拇指,如果听到尖锐的爆鸣声,表明氢气不纯,若听到“噗噗”的声音,表明氢气纯净。
(2)CO气体点燃前是否需要检验其纯度?
提示:CO也是易燃气体,与空气或氧气混合点燃时也易发生爆炸,所以在点燃前也需要先检验其纯度。
【变式训练】(2011·梅州高一检测)下列实验基本操作(或实验注意事项)中,主要是出于实验安全考虑的是( )
A.实验剩余的药品不能放回原试剂瓶
B.可燃性气体的验纯
C.气体实验装置在实验前进行气密性检查
D.滴管不能交叉使用
【解析】选B。A、D两项主要是从防止污染试剂的角度考虑的。为防爆炸,可燃性气体点燃之前必须验纯。为防漏气,实验装置在实验前要进行气密性检查。
【典例2】为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按下列步骤操作:
(1)写出三种试剂的化学式:
A ____________ ,B____________,C__________。
(2)根据题意,回答下列问题:
①加入过量A的目的是___________________________,
②加入过量B的目的是___________________________,
③加热煮沸的目的是____________________________。
(3)操作Ⅰ是_________,操作Ⅱ是_________。
【思路点拨】解答本题要注意以下三点:
【自主解答】当有多种杂质共存时,应认真分析。要使杂质一一除去,必须考虑到所加试剂是过量的,而且过量的试剂在后面步骤中必须能除去,要除去Mg2+,可用含OH-的试剂,除SO42-可用含Ba2+的试剂,故先加入Ba(OH)2。加入的过量Ba(OH)2中的Ba2+可用K2CO3除去,过量Ba(OH)2中的OH-,以及过量K2CO3中的CO32-,可用稀盐酸除去,最后加热煮沸可除去HCl。
答案:(1)Ba(OH)2 K2CO3 HCl
(2)①除尽Mg2+和SO42-
②除尽过量的Ba2+
③使HCl挥发
(3)过滤 蒸发
【互动探究】(1)能否去掉“加热煮沸”这步操作?
提示:可以。加热煮沸的目的是使溶液中的HCl挥发,而后一步操作蒸发,也可起到相同的作用,所以可以去掉这步操作。
(2)K2CO3能否用Na2CO3代替?
提示:不能。若用Na2CO3代替K2CO3,则会引入新杂质Na+,而Na+在后面的操作中无法除去。
【规律方法】提纯物质的化学方法
(1)将杂质转化为沉淀过滤除去。
(2)将杂质转化为气体逸出溶液。
(3)将杂质转化为所要提纯的物质,变废为宝。
【变式训练】(2011·中山高一检测)提纯含有少量硝酸钡杂质的硝酸钾溶液,设计实验方案为:
则X试剂为( )
A.Na2CO3 B.K2CO3 C.Na2SO4 D.K2SO4
【解析】选B。沉淀Ba2+应选用碳酸盐而不可选用硫酸盐,碳酸盐过量才能保证Ba2+被除净,而过量的碳酸盐还能用HNO3除去;而硫酸盐虽能保证Ba2+被除净,但过量的硫酸盐无法用HNO3除去;因为是钾盐溶液,故不能用Na2CO3。
【典例】(双选)以下关于化学实验中“先与后”的说法中正确的是
A.加热试管时,先均匀加热,后集中加热
B.用排水法收集气体后,先撤酒精灯后移出导管
C.制取气体时,先装药品后检验装置气密性
D.称量NaCl固体时,先在托盘上各放两张完全相同的纸,再加药品
【思路点拨】解答本题要注意以下两点:
【自主解答】选A、D。用排水法收集气体后,应先移出导管后撤酒精灯,否则会引起倒吸,B错误;C项操作应先检查装置气密性再加药品。
【互动探究】称量NaOH固体时,先在托盘上各放两张完全相同的滤纸,再加药品,是否正确?
提示:不正确,因为NaOH易潮解,潮解后会有少量粘附在滤纸上,一般用小烧杯称量NaOH固体。
【变式训练】如图所示的实验操作正确的是( )
A.①②④ B.②③④
C.①③④ D.①②③④
【解析】选B。加热液体时试管内液体体积不得超过试管容积的1/3,①错误;取用粉末或小颗粒药品时应用药匙或纸槽,②正确;取用较多液体时,可直接倾倒,且使试剂瓶的标签朝向手心,③正确;读数时,视线应与凹液面的最低点相切,④正确。
【典例1】下列对化学实验的探究正确的是
A.用H2还原CuO时,应在加热的同时立即通H2
B.稀释浓硫酸时,先在量筒中加入一定量的水,再慢慢地加入浓硫酸并搅拌
C.给试管中的液体加热时,试管口不能对着他人或自己
D.某溶液中加入BaCl2溶液,有白色沉淀生成,证明其中含有SO42-
【易错选项】A
【易错剖析】
(1)易错选项分析
错选A的原因在于分析不全面,忽略H2不纯点燃易发生爆炸。故应先通H2,待排尽装置中的空气后再加热。
(2)其他错误选项分析
【标准答案】C
【典例2】如表为各物质所含有杂质及除去这些杂质选用的试剂和操作方法,正确的是
【易错选项】C
【易错剖析】
(1)易错选项分析
错选C的原因在于对题目要求挖掘不透彻,仅仅只是为了除去H2中的CO2,而忽视了除CO2的同时又混入了水蒸气。故应该洗气后再通入浓硫酸加以干燥。
(2)其他错误选项分析
【标准答案】B
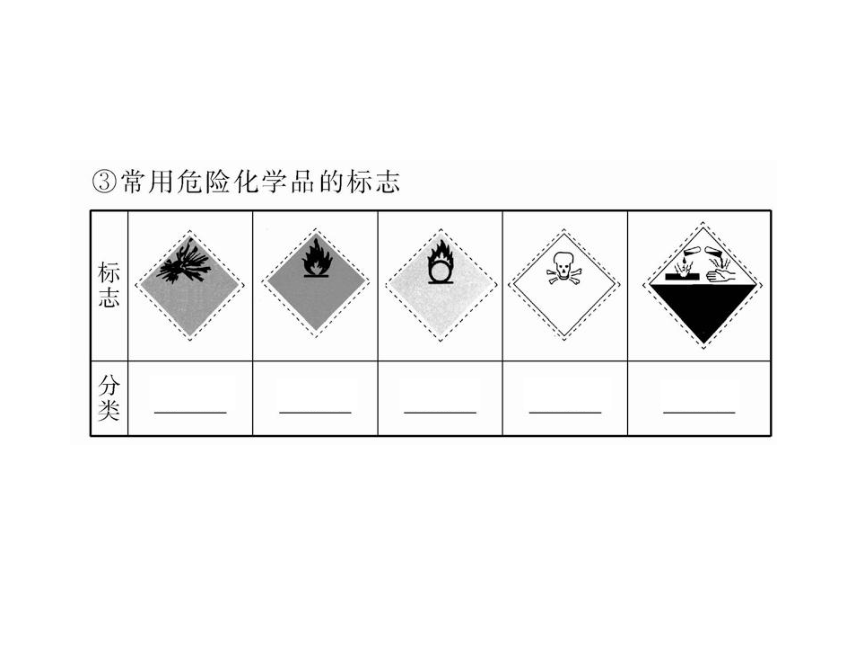
1.在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的( )
【解析】选A。浓硫酸具有强腐蚀性,属于腐蚀品,故选A。
2.进行化学实验必须注意安全。下列说法正确的是( )
A.不能用手直接接触药品
B.可用酒精灯对烧杯直接加热
C.用鼻孔凑到容器口去闻气体的气味
D.尝一下实验室里酒精的味道
【解析】选A。实验室中药品不能用手直接接触,也不能品尝,不能直接将鼻孔凑到容器口闻气体气味,而应用扇动法闻气味,对烧杯加热时,必须垫石棉网,不能对烧杯直接加热。故选A。
3.下列事故或药品的处理正确的是( )
A.一般用药匙取用粉末状或块状药品
B.当出现CO中毒时,应立即将中毒者抬到室外新鲜空气处
C.制取并收集氧气结束后,应立即停止加热
D.将含硫酸的废液倒入水槽,用水冲入下水道
【解析】选B。块状药品一般用镊子夹取,A项错误;若用排水法收集O2,应先撤导管后熄灭酒精灯,否则会发生倒吸,C项错误;含硫酸的废液经处理后,倒入指定位置,不能用水冲入下水道,D项错误。
4.实验室进行氯化钠溶液的蒸发时,一般有以下操作过程,其正确的操作顺序为( )
①放置酒精灯 ②固定铁圈
③放蒸发皿 ④加热搅拌
⑤停止加热,余热蒸干
A.②③④⑤① B.①②③④⑤
C.②③①④⑤ D.②①③④⑤
【解析】选B。装置的安装顺序为:先下后上,从左到右,故先放置酒精灯,根据酒精灯的高度固定铁圈,再放蒸发皿。
5.在实验室中进行过滤和蒸发的实验操作,都必须用到的仪器是( )
A.烧杯 B.蒸发皿
C.玻璃棒 D.酒精灯
【解析】选C。过滤时用到的仪器是:铁架台(带铁圈)、漏斗、烧杯、玻璃棒。蒸发时用到的仪器是:铁架台(带铁圈)、酒精灯、蒸发皿、玻璃棒,题给仪器均用到的是玻璃棒。
6.加热固体药品时,试管口应______________,目的是________________________________________________。
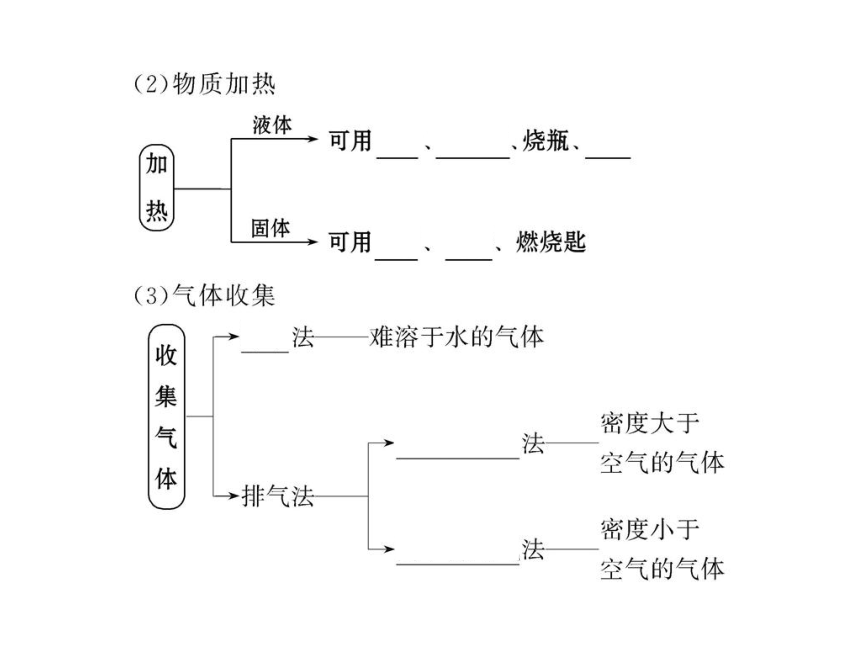
制取气体时,反应前应先__________________________;
制取有毒气体时,必须在装置的最后连接______________装置;而制取可燃性气体时,在检验其性质之前必须进行______________操作,并在装置的最后连接一导气管,将多余的气体___________处理。
【解析】加热固体时,应防止水滴回流使试管炸裂,故试管口应略微向下倾斜;制取气体必须检查装置的气密性,以防漏气;有毒气体的制取必须进行尾气处理,一般用溶液吸收,可燃性气体可用燃烧的方法处理。
答案:略微向下倾斜 防止水滴回流使试管炸裂 检查装置的气密性 尾气吸收 气体纯度检验 燃烧
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列事故处理方法正确的是( )
A.汽油失火时,立即用水灭火
B.电线短路失火时,首先要用泡沫灭火器灭火
C.浓氢氧化钠溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D.浓硫酸溅到皮肤上,立即用稀氢氧化钠溶液洗涤
【解析】选C。汽油不溶于水且密度比水小,所以不能用水灭火,应用沙土灭火;电线短路失火时应先拔掉电源再用泡沫灭火器灭火;浓氢氧化钠溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液;浓硫酸溅到皮肤上,立即用大量水冲洗,再涂上稀的碳酸氢钠溶液。
2.在“粗盐提纯”实验中,下列操作正确的是( )
A.过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤
B.蒸发到析出晶体时才需要用玻璃棒搅拌
C.待溶液蒸干后即停止加热
D.当蒸发皿中出现较多晶体时就应停止加热
【解析】选D。在“粗盐提纯”实验中,过滤时不能用玻璃棒搅拌漏斗内的液体,否则易将滤纸捅破;蒸发溶剂的过程中要用玻璃棒不断搅拌,目的是防止滤液局部温度过高而发生飞溅;当蒸发皿中出现较多的固体时,即停止加热,利用蒸发皿的余热将滤液蒸干。
3.(2011·合肥高一检测)如果食用花生油中混有水分,你将采用下列何种方法分离( )
A.过滤 B.蒸馏 C.分液 D.萃取
【解析】选C。花生油与水不混溶,分离用分液的方法即可。
4.蒸发操作中必须用到蒸发皿,下面对蒸发皿的操作叙述正确的是( )
A.将蒸发皿放置在铁架台的铁圈上直接用酒精灯火焰加热
B.将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热
C.将灼热的蒸发皿直接放在冷水中冲洗
D.将灼热的蒸发皿用手拿离火焰,直接放在实验台上
【解析】选A。蒸发皿直接用酒精灯火焰加热,不垫石棉网,A正确,B错误;移动灼热的蒸发皿不能用手拿,应用坩埚钳,不能直接放在实验台上,以防烧坏实验台,也不能直接用冷水冲洗,否则蒸发皿会因骤冷而炸裂,故C、D错误。
5.(2011·滨州高一检测)能用溶解、过滤、结晶的方法来分离的一组物质是( )
A.NaCl和Na2SO4 B.CuO和KCl
C.BaSO4和CaCO3 D.NaNO3和NaOH
【解析】选B。A、D两项中两种物质均溶于水,无法用过滤法分离;B项中CuO不溶于水,KCl易溶于水,可通过过滤的方法分离,再蒸发滤液可得KCl ;C项中两种物质均不溶于水,无法用过滤法分离。
二、非选择题(本题包括3小题,共30分)
6.(10分)实验小组的同学欲对一粗盐样品进行初步提纯。所用实验仪器或用品如下:
(1)D的名称是_____________;
(2)提纯的步骤是:溶解、过滤、_____、计算产率;
(3)“过滤”操作的要点可概括为“一贴、二低、三靠”,其中“二低”的含义是_______________________;
(4)实验小组通过正确的计算发现,所得实验结果与该粗盐的实际含量对比,实验测得的结果比实际偏低,请分析可能的原因:____________________________________。
【解析】粗盐提纯的步骤是溶解、过滤、蒸发。过滤操作中的“二低”是:滤纸上沿低于漏斗边缘;液面低于滤纸上沿。引起误差的操作可能是称量时出错、溶解搅拌或过滤时有液体溅出,蒸发时有液体溅出等。
答案:(1)蒸发皿
(2)蒸发
(3)滤纸上沿低于漏斗边缘;液面低于滤纸上沿
(4)称取时出错、蒸发时有液体溅出等(合理答案均可)
7.(10分)(2011·长沙高一检测)为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
(1)第①步中,操作A是_____,第⑤步中,操作B是_____。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)_________,__________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是________________________。
(4)判断BaCl2已过量的方法是_______________。
【解析】粗盐提纯须先过滤出不溶性杂质,再加入试剂BaCl2、NaOH、Na2CO3除去可溶性的SO42-、Mg2+、Ca2+,过滤后,加入盐酸除去过量的NaOH、Na2CO3,最后蒸发、结晶得到精盐。若先用盐酸调pH再过滤,将使产生的Mg(OH)2、CaCO3、BaCO3沉淀溶解而无法过滤除去,影响精盐的纯度。BaCl2过量时,不存在SO42-,故再滴入几滴BaCl2溶液,看是否有白色沉淀生成,即可判断BaCl2是否过量。
答案:(1)溶解 过滤
(2)CaCl2+Na2CO3====CaCO3↓+2NaCl
BaCl2+Na2CO3====BaCO3↓+2NaCl
(3)操作③④中生成的Mg(OH)2、CaCO3、BaCO3沉淀会与盐酸反应无法过滤除去,从而影响精盐的纯度
(4)取第②步后的上层清液,滴入几滴BaCl2溶液,看是否有白色沉淀生成,若无沉淀生成,则表明BaCl2已过量
【方法技巧】检验SO42-的注意事项
检验SO42-的正确方法为:
加入的试剂及试剂的先后顺序均不得互换,否则,不能有
效排除干扰因素,从而无法判断原溶液中是否有SO42-。
例如:
此时不能说明原溶液中含有
SO42-,因为Ag+能造成干扰。
8.(10分)(挑战能力)现有含NaCl和Na2SO4的混合溶液,选择适当的试剂将其转化为相应的沉淀,从而实现Cl-和SO42-的相互分离。相应的实验过程可用图表示:
(1)写出上述实验过程中所用试剂的名称:
试剂1___________,试剂2_________。
(2)试剂1和试剂2的加入顺序是否可以颠倒__________(填
“是”或“否”),原因是:___________________。
(3)溶液B的主要成分是________________________。
【解析】要实现Cl-和SO42-的相互分离,可根据这两种离子之间的性质差异来选择合适的试剂、合适的加试剂顺序和合适的分离方法。首先用过量的BaCl2或Ba(NO3)2溶液(试剂1)将SO42-转化为BaSO4沉淀(沉淀A),然后用AgNO3溶液(试剂2)将Cl-转化为AgCl沉淀(沉淀B)。试剂1和试剂2的加入顺序不能颠倒,因为若先加AgNO3溶液,除生成AgCl沉淀外,由于Ag2SO4微溶于水,沉淀中也会含有Ag2SO4,达不到完全分离Cl-和SO42-的目的。溶液B的主要成分为NaNO3。
答案:(1)BaCl2或Ba(NO3)2溶液 AgNO3溶液
(2)否 因为Ag2SO4微溶于水,Cl-沉淀的同时,SO42-也部分沉淀,不能使Cl-和SO42-完全分离
(3)NaNO3
草木灰中含有可溶性钾盐(主要成分
是K2SO4、K2CO3、KCl)。某学生按
下列操作提取草木灰中的钾盐:
①取草木灰加水溶解;②过滤,取
滤液,过滤装置和操作如图;③蒸
发滤液;④冷却结晶。已知硝酸银
与氯化钾反应生成硝酸钾和不溶于
水的氯化银,化学方程式为:
AgNO3+KCl====AgCl↓+KNO3。
【思考探究】
(1)指出图中的两处错误。
提示:(1)没有用玻璃棒引流;(2)漏斗下端管口没有紧靠烧杯内壁。
(2)在操作①、②、③中均用到玻璃棒,该仪器的作用依次是什么?
提示:搅拌,加速溶解;引流,使待滤液体沿玻璃棒流入漏斗,防止外洒;搅拌,防止因局部过热致使液滴或晶体飞溅。
(3)为检验草木灰中的阴离子,取少量晶体溶于水,用一支小试管取适量溶液,加入适量HCl,会观察到什么实验现象?
提示:有气泡产生,因HCl与K2CO3发生反应生成CO2气体,化学方程式为:K2CO3+2HCl====2KCl+H2O+CO2↑。
【典例1】进行化学实验必须注意安全,下列说法中正确的组合是
①点燃氢气前要检验氢气的纯度,以免发生爆炸
②CO气体有毒,处理CO气体时可将其点燃,转化为无毒的CO2
③在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底部铺上一层沙子
④用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气
⑤稀释浓硫酸的操作图为:
A.①②③④ B.①②③
C.①②④ D.①②③④⑤
【思路点拨】
【自主解答】选B。
【互动探究】(1)用排水法收集氢气时如何检验氢气的纯度?试叙述其操作过程。
提示:用排水法收集一试管氢气,用拇指堵住试管口,管口向下移近酒精灯火焰,松开拇指,如果听到尖锐的爆鸣声,表明氢气不纯,若听到“噗噗”的声音,表明氢气纯净。
(2)CO气体点燃前是否需要检验其纯度?
提示:CO也是易燃气体,与空气或氧气混合点燃时也易发生爆炸,所以在点燃前也需要先检验其纯度。
【变式训练】(2011·梅州高一检测)下列实验基本操作(或实验注意事项)中,主要是出于实验安全考虑的是( )
A.实验剩余的药品不能放回原试剂瓶
B.可燃性气体的验纯
C.气体实验装置在实验前进行气密性检查
D.滴管不能交叉使用
【解析】选B。A、D两项主要是从防止污染试剂的角度考虑的。为防爆炸,可燃性气体点燃之前必须验纯。为防漏气,实验装置在实验前要进行气密性检查。
【典例2】为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按下列步骤操作:
(1)写出三种试剂的化学式:
A ____________ ,B____________,C__________。
(2)根据题意,回答下列问题:
①加入过量A的目的是___________________________,
②加入过量B的目的是___________________________,
③加热煮沸的目的是____________________________。
(3)操作Ⅰ是_________,操作Ⅱ是_________。
【思路点拨】解答本题要注意以下三点:
【自主解答】当有多种杂质共存时,应认真分析。要使杂质一一除去,必须考虑到所加试剂是过量的,而且过量的试剂在后面步骤中必须能除去,要除去Mg2+,可用含OH-的试剂,除SO42-可用含Ba2+的试剂,故先加入Ba(OH)2。加入的过量Ba(OH)2中的Ba2+可用K2CO3除去,过量Ba(OH)2中的OH-,以及过量K2CO3中的CO32-,可用稀盐酸除去,最后加热煮沸可除去HCl。
答案:(1)Ba(OH)2 K2CO3 HCl
(2)①除尽Mg2+和SO42-
②除尽过量的Ba2+
③使HCl挥发
(3)过滤 蒸发
【互动探究】(1)能否去掉“加热煮沸”这步操作?
提示:可以。加热煮沸的目的是使溶液中的HCl挥发,而后一步操作蒸发,也可起到相同的作用,所以可以去掉这步操作。
(2)K2CO3能否用Na2CO3代替?
提示:不能。若用Na2CO3代替K2CO3,则会引入新杂质Na+,而Na+在后面的操作中无法除去。
【规律方法】提纯物质的化学方法
(1)将杂质转化为沉淀过滤除去。
(2)将杂质转化为气体逸出溶液。
(3)将杂质转化为所要提纯的物质,变废为宝。
【变式训练】(2011·中山高一检测)提纯含有少量硝酸钡杂质的硝酸钾溶液,设计实验方案为:
则X试剂为( )
A.Na2CO3 B.K2CO3 C.Na2SO4 D.K2SO4
【解析】选B。沉淀Ba2+应选用碳酸盐而不可选用硫酸盐,碳酸盐过量才能保证Ba2+被除净,而过量的碳酸盐还能用HNO3除去;而硫酸盐虽能保证Ba2+被除净,但过量的硫酸盐无法用HNO3除去;因为是钾盐溶液,故不能用Na2CO3。
【典例】(双选)以下关于化学实验中“先与后”的说法中正确的是
A.加热试管时,先均匀加热,后集中加热
B.用排水法收集气体后,先撤酒精灯后移出导管
C.制取气体时,先装药品后检验装置气密性
D.称量NaCl固体时,先在托盘上各放两张完全相同的纸,再加药品
【思路点拨】解答本题要注意以下两点:
【自主解答】选A、D。用排水法收集气体后,应先移出导管后撤酒精灯,否则会引起倒吸,B错误;C项操作应先检查装置气密性再加药品。
【互动探究】称量NaOH固体时,先在托盘上各放两张完全相同的滤纸,再加药品,是否正确?
提示:不正确,因为NaOH易潮解,潮解后会有少量粘附在滤纸上,一般用小烧杯称量NaOH固体。
【变式训练】如图所示的实验操作正确的是( )
A.①②④ B.②③④
C.①③④ D.①②③④
【解析】选B。加热液体时试管内液体体积不得超过试管容积的1/3,①错误;取用粉末或小颗粒药品时应用药匙或纸槽,②正确;取用较多液体时,可直接倾倒,且使试剂瓶的标签朝向手心,③正确;读数时,视线应与凹液面的最低点相切,④正确。
【典例1】下列对化学实验的探究正确的是
A.用H2还原CuO时,应在加热的同时立即通H2
B.稀释浓硫酸时,先在量筒中加入一定量的水,再慢慢地加入浓硫酸并搅拌
C.给试管中的液体加热时,试管口不能对着他人或自己
D.某溶液中加入BaCl2溶液,有白色沉淀生成,证明其中含有SO42-
【易错选项】A
【易错剖析】
(1)易错选项分析
错选A的原因在于分析不全面,忽略H2不纯点燃易发生爆炸。故应先通H2,待排尽装置中的空气后再加热。
(2)其他错误选项分析
【标准答案】C
【典例2】如表为各物质所含有杂质及除去这些杂质选用的试剂和操作方法,正确的是
【易错选项】C
【易错剖析】
(1)易错选项分析
错选C的原因在于对题目要求挖掘不透彻,仅仅只是为了除去H2中的CO2,而忽视了除CO2的同时又混入了水蒸气。故应该洗气后再通入浓硫酸加以干燥。
(2)其他错误选项分析
【标准答案】B
1.在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的( )
【解析】选A。浓硫酸具有强腐蚀性,属于腐蚀品,故选A。
2.进行化学实验必须注意安全。下列说法正确的是( )
A.不能用手直接接触药品
B.可用酒精灯对烧杯直接加热
C.用鼻孔凑到容器口去闻气体的气味
D.尝一下实验室里酒精的味道
【解析】选A。实验室中药品不能用手直接接触,也不能品尝,不能直接将鼻孔凑到容器口闻气体气味,而应用扇动法闻气味,对烧杯加热时,必须垫石棉网,不能对烧杯直接加热。故选A。
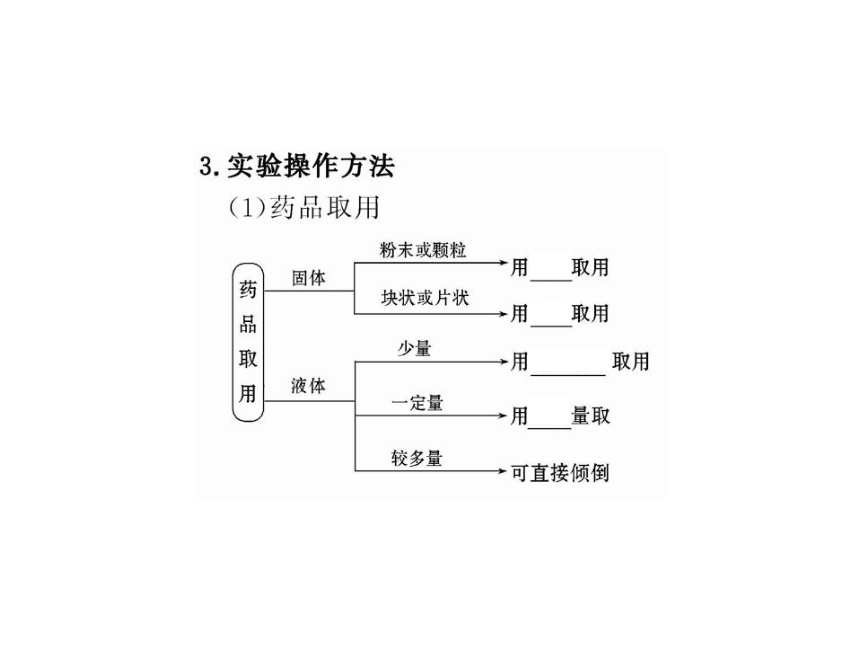
3.下列事故或药品的处理正确的是( )
A.一般用药匙取用粉末状或块状药品
B.当出现CO中毒时,应立即将中毒者抬到室外新鲜空气处
C.制取并收集氧气结束后,应立即停止加热
D.将含硫酸的废液倒入水槽,用水冲入下水道
【解析】选B。块状药品一般用镊子夹取,A项错误;若用排水法收集O2,应先撤导管后熄灭酒精灯,否则会发生倒吸,C项错误;含硫酸的废液经处理后,倒入指定位置,不能用水冲入下水道,D项错误。
4.实验室进行氯化钠溶液的蒸发时,一般有以下操作过程,其正确的操作顺序为( )
①放置酒精灯 ②固定铁圈
③放蒸发皿 ④加热搅拌
⑤停止加热,余热蒸干
A.②③④⑤① B.①②③④⑤
C.②③①④⑤ D.②①③④⑤
【解析】选B。装置的安装顺序为:先下后上,从左到右,故先放置酒精灯,根据酒精灯的高度固定铁圈,再放蒸发皿。
5.在实验室中进行过滤和蒸发的实验操作,都必须用到的仪器是( )
A.烧杯 B.蒸发皿
C.玻璃棒 D.酒精灯
【解析】选C。过滤时用到的仪器是:铁架台(带铁圈)、漏斗、烧杯、玻璃棒。蒸发时用到的仪器是:铁架台(带铁圈)、酒精灯、蒸发皿、玻璃棒,题给仪器均用到的是玻璃棒。
6.加热固体药品时,试管口应______________,目的是________________________________________________。
制取气体时,反应前应先__________________________;
制取有毒气体时,必须在装置的最后连接______________装置;而制取可燃性气体时,在检验其性质之前必须进行______________操作,并在装置的最后连接一导气管,将多余的气体___________处理。
【解析】加热固体时,应防止水滴回流使试管炸裂,故试管口应略微向下倾斜;制取气体必须检查装置的气密性,以防漏气;有毒气体的制取必须进行尾气处理,一般用溶液吸收,可燃性气体可用燃烧的方法处理。
答案:略微向下倾斜 防止水滴回流使试管炸裂 检查装置的气密性 尾气吸收 气体纯度检验 燃烧
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列事故处理方法正确的是( )
A.汽油失火时,立即用水灭火
B.电线短路失火时,首先要用泡沫灭火器灭火
C.浓氢氧化钠溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D.浓硫酸溅到皮肤上,立即用稀氢氧化钠溶液洗涤
【解析】选C。汽油不溶于水且密度比水小,所以不能用水灭火,应用沙土灭火;电线短路失火时应先拔掉电源再用泡沫灭火器灭火;浓氢氧化钠溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液;浓硫酸溅到皮肤上,立即用大量水冲洗,再涂上稀的碳酸氢钠溶液。
2.在“粗盐提纯”实验中,下列操作正确的是( )
A.过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤
B.蒸发到析出晶体时才需要用玻璃棒搅拌
C.待溶液蒸干后即停止加热
D.当蒸发皿中出现较多晶体时就应停止加热
【解析】选D。在“粗盐提纯”实验中,过滤时不能用玻璃棒搅拌漏斗内的液体,否则易将滤纸捅破;蒸发溶剂的过程中要用玻璃棒不断搅拌,目的是防止滤液局部温度过高而发生飞溅;当蒸发皿中出现较多的固体时,即停止加热,利用蒸发皿的余热将滤液蒸干。
3.(2011·合肥高一检测)如果食用花生油中混有水分,你将采用下列何种方法分离( )
A.过滤 B.蒸馏 C.分液 D.萃取
【解析】选C。花生油与水不混溶,分离用分液的方法即可。
4.蒸发操作中必须用到蒸发皿,下面对蒸发皿的操作叙述正确的是( )
A.将蒸发皿放置在铁架台的铁圈上直接用酒精灯火焰加热
B.将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热
C.将灼热的蒸发皿直接放在冷水中冲洗
D.将灼热的蒸发皿用手拿离火焰,直接放在实验台上
【解析】选A。蒸发皿直接用酒精灯火焰加热,不垫石棉网,A正确,B错误;移动灼热的蒸发皿不能用手拿,应用坩埚钳,不能直接放在实验台上,以防烧坏实验台,也不能直接用冷水冲洗,否则蒸发皿会因骤冷而炸裂,故C、D错误。
5.(2011·滨州高一检测)能用溶解、过滤、结晶的方法来分离的一组物质是( )
A.NaCl和Na2SO4 B.CuO和KCl
C.BaSO4和CaCO3 D.NaNO3和NaOH
【解析】选B。A、D两项中两种物质均溶于水,无法用过滤法分离;B项中CuO不溶于水,KCl易溶于水,可通过过滤的方法分离,再蒸发滤液可得KCl ;C项中两种物质均不溶于水,无法用过滤法分离。
二、非选择题(本题包括3小题,共30分)
6.(10分)实验小组的同学欲对一粗盐样品进行初步提纯。所用实验仪器或用品如下:
(1)D的名称是_____________;
(2)提纯的步骤是:溶解、过滤、_____、计算产率;
(3)“过滤”操作的要点可概括为“一贴、二低、三靠”,其中“二低”的含义是_______________________;
(4)实验小组通过正确的计算发现,所得实验结果与该粗盐的实际含量对比,实验测得的结果比实际偏低,请分析可能的原因:____________________________________。
【解析】粗盐提纯的步骤是溶解、过滤、蒸发。过滤操作中的“二低”是:滤纸上沿低于漏斗边缘;液面低于滤纸上沿。引起误差的操作可能是称量时出错、溶解搅拌或过滤时有液体溅出,蒸发时有液体溅出等。
答案:(1)蒸发皿
(2)蒸发
(3)滤纸上沿低于漏斗边缘;液面低于滤纸上沿
(4)称取时出错、蒸发时有液体溅出等(合理答案均可)
7.(10分)(2011·长沙高一检测)为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
(1)第①步中,操作A是_____,第⑤步中,操作B是_____。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)_________,__________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是________________________。
(4)判断BaCl2已过量的方法是_______________。
【解析】粗盐提纯须先过滤出不溶性杂质,再加入试剂BaCl2、NaOH、Na2CO3除去可溶性的SO42-、Mg2+、Ca2+,过滤后,加入盐酸除去过量的NaOH、Na2CO3,最后蒸发、结晶得到精盐。若先用盐酸调pH再过滤,将使产生的Mg(OH)2、CaCO3、BaCO3沉淀溶解而无法过滤除去,影响精盐的纯度。BaCl2过量时,不存在SO42-,故再滴入几滴BaCl2溶液,看是否有白色沉淀生成,即可判断BaCl2是否过量。
答案:(1)溶解 过滤
(2)CaCl2+Na2CO3====CaCO3↓+2NaCl
BaCl2+Na2CO3====BaCO3↓+2NaCl
(3)操作③④中生成的Mg(OH)2、CaCO3、BaCO3沉淀会与盐酸反应无法过滤除去,从而影响精盐的纯度
(4)取第②步后的上层清液,滴入几滴BaCl2溶液,看是否有白色沉淀生成,若无沉淀生成,则表明BaCl2已过量
【方法技巧】检验SO42-的注意事项
检验SO42-的正确方法为:
加入的试剂及试剂的先后顺序均不得互换,否则,不能有
效排除干扰因素,从而无法判断原溶液中是否有SO42-。
例如:
此时不能说明原溶液中含有
SO42-,因为Ag+能造成干扰。
8.(10分)(挑战能力)现有含NaCl和Na2SO4的混合溶液,选择适当的试剂将其转化为相应的沉淀,从而实现Cl-和SO42-的相互分离。相应的实验过程可用图表示:
(1)写出上述实验过程中所用试剂的名称:
试剂1___________,试剂2_________。
(2)试剂1和试剂2的加入顺序是否可以颠倒__________(填
“是”或“否”),原因是:___________________。
(3)溶液B的主要成分是________________________。
【解析】要实现Cl-和SO42-的相互分离,可根据这两种离子之间的性质差异来选择合适的试剂、合适的加试剂顺序和合适的分离方法。首先用过量的BaCl2或Ba(NO3)2溶液(试剂1)将SO42-转化为BaSO4沉淀(沉淀A),然后用AgNO3溶液(试剂2)将Cl-转化为AgCl沉淀(沉淀B)。试剂1和试剂2的加入顺序不能颠倒,因为若先加AgNO3溶液,除生成AgCl沉淀外,由于Ag2SO4微溶于水,沉淀中也会含有Ag2SO4,达不到完全分离Cl-和SO42-的目的。溶液B的主要成分为NaNO3。
答案:(1)BaCl2或Ba(NO3)2溶液 AgNO3溶液
(2)否 因为Ag2SO4微溶于水,Cl-沉淀的同时,SO42-也部分沉淀,不能使Cl-和SO42-完全分离
(3)NaNO3
草木灰中含有可溶性钾盐(主要成分
是K2SO4、K2CO3、KCl)。某学生按
下列操作提取草木灰中的钾盐:
①取草木灰加水溶解;②过滤,取
滤液,过滤装置和操作如图;③蒸
发滤液;④冷却结晶。已知硝酸银
与氯化钾反应生成硝酸钾和不溶于
水的氯化银,化学方程式为:
AgNO3+KCl====AgCl↓+KNO3。
【思考探究】
(1)指出图中的两处错误。
提示:(1)没有用玻璃棒引流;(2)漏斗下端管口没有紧靠烧杯内壁。
(2)在操作①、②、③中均用到玻璃棒,该仪器的作用依次是什么?
提示:搅拌,加速溶解;引流,使待滤液体沿玻璃棒流入漏斗,防止外洒;搅拌,防止因局部过热致使液滴或晶体飞溅。
(3)为检验草木灰中的阴离子,取少量晶体溶于水,用一支小试管取适量溶液,加入适量HCl,会观察到什么实验现象?
提示:有气泡产生,因HCl与K2CO3发生反应生成CO2气体,化学方程式为:K2CO3+2HCl====2KCl+H2O+CO2↑。
