11-12版高中化学全程学习方略配套课件:1.2.2气体摩尔体积(人教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:1.2.2气体摩尔体积(人教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 08:38:33 | ||
图片预览










文档简介
(共64张PPT)
【典例】下列说法正确的是
A.(2010·广东高考)常温常压下,22.4 L CO2中含有NA个CO2分子
B.(2010·福建高考)标准状况下,22.4 L空气含有NA个单质分子
C.(2009·广东理基)22.4 L Cl2中含有NA个Cl2分子
D.标准状况下,1.12 L O2和1.12 L CO2均含0.1 NA个氧原子
【思路点拨】使用Vm=22.4 L/mol计算时注意以下两点:
【自主解答】选D。
【互动探究】(1)若将D项改为“标准状况下,1.12 L O2和CO2的混合气体含有0.1NA个氧原子”是否正确?
(2)若将C项改为“标准状况下,22.4 L四氯化碳中含有NA个四氯化碳分子”是否正确?
提示:(1)正确。1.12 L O2和CO2的混合气体的物质的量为0.05 mol,分子数为0.05NA,1个氧气分子有2个氧原子,
1个二氧化碳分子也有2个氧原子,所以氧原子数是0.05NA×2=0.1NA,故正确。
(2)不正确。标准状况下,四氯化碳是液体,故22.4 L四氯化碳不是1 mol。
【变式训练】下列叙述正确的是( )
A.气体的摩尔体积为22.4 L/mol
B.1 mol O2的质量为32 g,它所占的体积是22.4 L
C.标准状况下,1 mol H2O所占的体积是22.4 L
D.标准状况下,22.4 L的任何气体的物质的量都是1 mol
【解析】选D。在标准状况下气体的摩尔体积为
22.4 L/mol,A项没有指出所处的状况,A项错误;
1 mol O2的质量为32 g,B项未指明是在标准状况下,故它所占的体积不一定是22.4 L, B项错误;气体摩尔体积仅适用于气体,水在标准状况下不是气体,C项错误。
【典例】同温同压下,向两个密闭容器中分别充满等质量的O2、O3气体,下列说法正确的是
A.两气体的物质的量之比为3∶2
B.两种容器的体积比为2∶3
C.两种气体的分子数目相等
D.两种气体的密度之比是3∶2
【思路点拨】(1)同温同压下,气体的体积之比等于其物质的量之比;
(2)气体的分子数目之比等于其物质的量之比;
(3)同温同压下,气体的密度之比等于其摩尔质量之比。
【自主解答】选A。因O2和O3质量相等,故其物质的量与摩尔质量成反比,即48∶32=3∶2,A正确;同温同压下,气体的体积之比等于其物质的量之比,即3∶2,B错误;分子数目之比等于其物质的量之比,即3∶2,C错误;同温同压下,气体的密度之比等于其摩尔质量之比,即32∶48=
2∶3,D错误。
【互动探究】(1)同温同压下,向两个体积相同的密闭容器中分别充满O2、O3气体,则两气体的质量之比为多少?
(2)若将C项改为“两种气体的氧原子数目相等”,C项是否正确?
提示:(1)同温同压同体积,即两气体的物质的量相同,故其质量之比等于摩尔质量之比,为2∶3。
(2)正确,两种气体的分子数之比是3∶2,故其原子数之比为(3×2)∶(2×3)=1∶1。
【变式训练】(2011·三明高一检测)在一定温度和压强下,1体积X2气体和3体积Y2气体化合生成2体积的一种气态化合物,则该化合物的分子式为( )
A.XY3 B.XY C.X3Y D.X2Y3
【解析】选A。同温同压下,气体的体积比等于物质的量之比,即1 mol X2气体和3 mol Y2气体化合生成2 mol的一种气态化合物,根据质量守恒,可知2 mol的一种气态化合物中含有2 mol X和6 mol Y,故其化学式为XY3。
【典例1】下列关于气体摩尔体积的说法中正确的是
A.标准状况下,1 mol H2O的体积是22.4 L
B.22 g CO2的物质的量是0.5 mol,其体积为11.2 L
C.只有标准状况下的气体摩尔体积是22.4 L/mol,其他条件下一定不是该值
D.标准状况下,1摩尔任何气体的体积都是22.4 L
【易错选项】C
【易错剖析】
(1)易错选项分析
错选C的原因在于对概念的理解不透彻,不能认识到问题的根本所在。一定量的气体其体积是由压强和温度两个因素共同决定的。在标准状况下,气体摩尔体积是22.4 L/mol,但是在其他条件下,如果温度和压强合适的话,气体摩尔体积也可能是22.4 L/mol。
(2)其他错误选项分析
【标准答案】D
【典例2】下列说法中正确的是
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.1 L一氧化碳气体一定比1 L氧气的质量小
C.28 g N2和CO的混合气体在标准状况下的体积一定是
22.4 L
D.常温常压下,1 mol C完全燃烧能反应掉22.4 L氧气
【易错选项】A、B
【易错剖析】
(1)易错选项分析
错选A的原因在于对所学知识掌握不到位,不能很好地掌握理论成立所具备的条件。A项很容易在所学知识的影响下认为是正确的,往往忽视本项中并没有指明物质的状态都是气态。
错选B的原因在于忽视选项中并没有指明两种气体所处的环境条件,在条件不明的情况下,两种气体不能进行比较。
(2)其他错误选项分析
D项中1 mol C完全燃烧将反应掉1 mol O2。但常温常压下,1 mol O2的体积不是22.4 L。
【标准答案】C
【正确选项错误理解】
错误认为并不知道两种气体的具体含量,因此,也就无法计算混合气体的总物质的量,从而认为根本无法计算该混合气体的体积,这是对知识理解的不透彻,不能对其进行迁移应用。实际上因为CO和N2的摩尔质量相等(28 g/mol),28 g混合气体一定是1 mol(与两者含量的多少没有关系),故在标准状况下的体积一定是22.4 L。
1.标准状况下,若两种气体所占体积不同,其主要原因是
( )
A.气体性质不同 B.气体分子的大小不同
C.气体分子间平均距离不同 D.气体的物质的量不同
【解析】选D。影响气体体积大小的因素有:分子数目、分子间平均距离、分子本身的大小,同一条件下,因气体分子间平均距离几乎完全相同,且远远大于气体分子本身的大小,故气体分子本身的大小可忽略不计,因此影响气体体积大小的主要因素是分子数目,即气体的物质的量,故选D。
2.(双选)下列有关气体摩尔体积的描述中正确的是( )
A.单位物质的量的气体所占的体积就是气体摩尔体积
B.通常状况(室温、101 kPa)下,气体摩尔体积约为
22.4 L/mol
C.标准状况(0 ℃、101 kPa)下,气体摩尔体积约为
22.4 L/mol
D.标准状况(0 ℃、101 kPa)下,1 mol H2O的体积是
22.4 L
【解析】选A、C。标准状况(0 ℃、101 kPa)下,气体摩尔体积约为22.4 L/mol,通常状况(室温、101 kPa)下,气体摩尔体积大于22.4 L/mol,B错误;标准状况
(0 ℃、101 kPa)下,H2O不是气体,不能用22.4 L/mol来计算,D错误。
3.(2011·蚌埠高一检测)物质的体积一定是22.4 L的是
( )
A.1 mol氧气
B.17 g氨气
C.标准状况下44 g二氧化碳
D.0 ℃、2×105 Pa时2 g氢气
【解析】选C。A、B两项未指明标准状况,D项气体所处的不是标准状况(0 ℃、1×105 Pa),故气体的体积不一定是22.4 L,均错误;标准状况下1 mol二氧化碳的体积是
22.4 L,故C项正确。
4.下列说法正确的是( )
A.22.4 L任何气体的物质的量均为1 mol
B.非标准状况下,1 mol任何气体不可能占有22.4 L体积
C.0.3 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体,在标准状况下的体积约为22.4 L
D.标准状况下,1 mol CO和1 mol CO2的体积比为1∶2
【解析】选C。A项没有指明气体所处状况是标准状况,故22.4 L 气体的体积不一定是1 mol,A错误;若对非标准状况下的1 mol任何气体在温度和压强适当的情况下,气体体积也可能为22.4 L,B错误;C项中气体一共是1 mol,故在标准状况下的体积约为22.4 L,C正确;标准状况下,
1 mol CO和1 mol CO2的体积均为22.4 L,体积比为1∶1,D错误。
5.(2011·福州高一检测)下列物质中,与0.1 mol H2O含相同氢原子数的物质是( )
A.0.3 mol HNO3
B.0.1 NA个H3PO4分子
C.2.4 g CH4
D.标准状况下4.48 L HCl
【解析】选D。0.1 mol H2O含氢原子数为0.2 NA,A项含氢原子数为0.3 NA,B项含氢原子数为0.3 NA,C项含氢原子数为2.4 g÷16 g/mol×4×NA=0.6 NA,D项含氢原子数为
4.48 L÷22.4 L/mol×NA=0.2 NA,故选D。
6.某气体的分子组成是RO2 ,在标准状况下,1.28 g该气体的体积是448 mL。求此气体的相对分子质量和R的相对原子质量。
【解析】在标准状态下,448 mL该气体的物质的量是
448×10-3 L÷22.4 L/mol=0.02 mol,质量为1.28 g,故其摩尔质量M=1.28 g÷0.02 mol=64 g/mol,此气体的相对分子质量为64,R的相对原子质量为64-2×16=32。
答案:64 32
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列叙述正确的是( )
A.同温同压下,相同物质的量的物质,其体积一定相等
B.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等
C.1 L氢气一定比1 L氧气的质量小
D.质量相等的一氧化碳和氮气,则体积也相等
【解析】选B。同温同压下,相同物质的量的气体,其体积一定相等,A项未指明是气体,错误;甲烷和一氧化碳物质的量相等,分子数一定相等,与所处的条件无关,B项正确;C、D两项未指明同温同压,均错误。
2.质量为16 g的下列气体,在标准状况下体积约为11.2 L的是( )
A.H2 B.O2 C.CO2 D.CH4
【解析】选B。标准状况下气体的物质的量为
11.2 L÷22.4 L/mol=0.5 mol,则该气体的摩尔质量为
16 g÷0.5 mol=32 g/mol,即为氧气。
3.标准状况下,若1 L H2有n个分子,则阿伏加德罗常数可
表示为( )
A.22.4n mol-1 B.44.8n mol-1
C.n/22.4 mol-1 D.n/44.8 mol-1
【解析】选A。1 L H2的物质的量为 分子数为
1/22.4 mol ×NA =NA/22.4,即n=NA/22.4,
NA=22.4n mol-1,故选A。
4.(2011·南通高一检测)在标准状况下,占体积最大的是
( )
A.98 g H2SO4 B.6.02×1023个N2分子
C.44.8 L HCl D.6 g H2
【解析】选D。在标准状况下,H2SO4为液体,体积最小;6.02×1023个N2分子,其物质的量是1 mol,体积是
22.4 L;6 g H2的物质的量是3 mol,体积是67.2 L,故选D。
5.(2011·浏阳高一检测)下列说法正确的是( )
A.32 g O2占有的体积约为22.4 L
B.22.4 L N2含有阿伏加德罗常数个氮气分子
C.在标准状况下,22.4 L水的质量约为18 g
D.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
【解析】选D。A、B都没有指明“标准状况”是错误的;C指明“标准状况”,但在此条件下水是液体,所以22.4 L水不是1 mol,故其质量不是18 g;D项中22 g CO2的物质的量为0.5 mol,标准状况下11.2 L HCl的物质的量也为0.5 mol,两种气体的物质的量相同,所以含有的分子数也相同,因此选项D符合题意。
【方法技巧】应用气体摩尔体积进行计算时应注意的一些问题
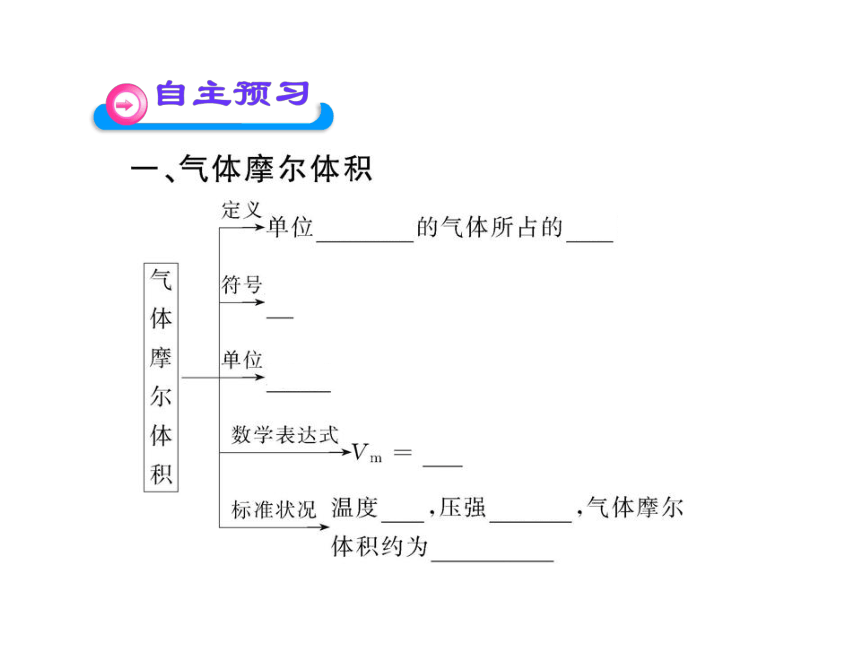
(1)只适用于气态物质,对于固态物质和液态物质来讲是不适用的,如标准状况下水、酒精、四氯化碳等不是气体。
(2)在相同的温度和压强下,1 mol任何气体所占的体积在数值上近似相等。任何气体包括纯净气体和混合气体。
(3)标准状况下,气体的摩尔体积约为22.4 L·mol-1。
(4)1 mol任何气体的体积若为22.4 L,它所处的状况。不一定就是标准状况,如对气体升温的同时增大压强,体积可能保持不变。因此不能简单地认为,只有在标准状况下,1 mol任何气体的体积才约为22.4 L。
(5)不可将1 mol气体的体积与气体摩尔体积的单位混淆,前者单位可以为L,后者单位为L/mol。
二、非选择题(本题包括3小题,共30分)
6.(12分)(1)在标准状况下,22 g CO2的体积是____ L,
与_________g N2含有相同的分子数。
(2)等物质的量的CO和CO2其质量之比是______________,分子数之比是_____________。
【解析】(1)22 g CO2的物质的量为
标准状况下的体积为0.5 mol×22.4 L/mol=11.2 L。相同
分子数的N2的质量为0.5 mol×28 g/mol=14 g。
(2)相等物质的量时,质量之比等于摩尔质量之比,
m(CO)∶m(CO2)=28∶44=7∶11,
N(CO)∶N(CO2)=1∶1。
答案:(1)11.2 14 (2)7∶11 1∶1
7.(8分)标准状况下,44.8 L由CO和H2组成的混合气体的质量为30 g,则H2的质量为_______;CO和H2的物质的量之比为__________。
【解析】设H2和CO的物质的量分别是x、y,则
解得x=1 mol y=1 mol,则H2的质量是2 g,CO和H2的物质的量之比为1∶1。
答案: 2 g 1∶1
8.(10分)(2011·漳州高一检测)(1)标准状况下,
①4 g氢气、②33.6 L甲烷(CH4)、 ③6.02×1023个水分子中,物质的量最大的是___________(填写序号,下同),
体积最小的是_________。
(2)质量相等的两种物质SO2和SO3,它们的物质的量之比为________,所含氧原子个数之比为__________。
【解析】(1)
(2)根据n=m/M知,质量相等时,物质的量与摩尔质量成反比,故SO2和SO3的物质的量之比为80∶64=5∶4,所含氧原子个数之比为(5×2)∶(4×3)=5∶6。
答案:(1)① ③ (2)5∶4 5∶6
【实验设计】已知化学反应:S(s)+O2(g) SO2(g),加热使硫粉与O2反应,冷却至室温时观察水银柱变化,通过水银柱是否变化确定大试管中气体体积与分子数之间的关系。
【实验用品】大试管、带弯曲玻璃管的橡皮塞、铁架台、酒精灯、研细的硫粉、氧气、水银、红笔。
点燃
====
【实验装置及步骤】
(1)将如图装置装好后固定到铁架台上。待内外气体压强不再变化时,用红笔在玻璃管上标出水银柱液面刻度。
(2)用酒精灯加热试管底部,可以看到研细的硫粉在试管中燃烧,当瓶中氧气消耗完时火焰熄灭。已知该反应是放热反应。
(3)反应结束后,让其自然冷却。
【思考探究】
(1)保证本实验成功的关键是什么?
提示:应保证装置气密性良好。
(2)硫粉在大试管中充分燃烧后,水银柱液面如何变化?
提示:水银柱左管液面上升,右管液面下降。
(3)大试管自然冷却到室温,水银柱液面如何变化?
提示:水银柱液面又回到原来标定的刻度。
(4)硫粉燃烧后,再恢复到室温时,水银柱液面和硫粉燃烧前相同。据此,你能得出什么样的结论?
提示:相同温度和压强下,相同体积的任何气体都有相同的粒子数。
【典例】下列说法正确的是
A.(2010·广东高考)常温常压下,22.4 L CO2中含有NA个CO2分子
B.(2010·福建高考)标准状况下,22.4 L空气含有NA个单质分子
C.(2009·广东理基)22.4 L Cl2中含有NA个Cl2分子
D.标准状况下,1.12 L O2和1.12 L CO2均含0.1 NA个氧原子
【思路点拨】使用Vm=22.4 L/mol计算时注意以下两点:
【自主解答】选D。
【互动探究】(1)若将D项改为“标准状况下,1.12 L O2和CO2的混合气体含有0.1NA个氧原子”是否正确?
(2)若将C项改为“标准状况下,22.4 L四氯化碳中含有NA个四氯化碳分子”是否正确?
提示:(1)正确。1.12 L O2和CO2的混合气体的物质的量为0.05 mol,分子数为0.05NA,1个氧气分子有2个氧原子,
1个二氧化碳分子也有2个氧原子,所以氧原子数是0.05NA×2=0.1NA,故正确。
(2)不正确。标准状况下,四氯化碳是液体,故22.4 L四氯化碳不是1 mol。
【变式训练】下列叙述正确的是( )
A.气体的摩尔体积为22.4 L/mol
B.1 mol O2的质量为32 g,它所占的体积是22.4 L
C.标准状况下,1 mol H2O所占的体积是22.4 L
D.标准状况下,22.4 L的任何气体的物质的量都是1 mol
【解析】选D。在标准状况下气体的摩尔体积为
22.4 L/mol,A项没有指出所处的状况,A项错误;
1 mol O2的质量为32 g,B项未指明是在标准状况下,故它所占的体积不一定是22.4 L, B项错误;气体摩尔体积仅适用于气体,水在标准状况下不是气体,C项错误。
【典例】同温同压下,向两个密闭容器中分别充满等质量的O2、O3气体,下列说法正确的是
A.两气体的物质的量之比为3∶2
B.两种容器的体积比为2∶3
C.两种气体的分子数目相等
D.两种气体的密度之比是3∶2
【思路点拨】(1)同温同压下,气体的体积之比等于其物质的量之比;
(2)气体的分子数目之比等于其物质的量之比;
(3)同温同压下,气体的密度之比等于其摩尔质量之比。
【自主解答】选A。因O2和O3质量相等,故其物质的量与摩尔质量成反比,即48∶32=3∶2,A正确;同温同压下,气体的体积之比等于其物质的量之比,即3∶2,B错误;分子数目之比等于其物质的量之比,即3∶2,C错误;同温同压下,气体的密度之比等于其摩尔质量之比,即32∶48=
2∶3,D错误。
【互动探究】(1)同温同压下,向两个体积相同的密闭容器中分别充满O2、O3气体,则两气体的质量之比为多少?
(2)若将C项改为“两种气体的氧原子数目相等”,C项是否正确?
提示:(1)同温同压同体积,即两气体的物质的量相同,故其质量之比等于摩尔质量之比,为2∶3。
(2)正确,两种气体的分子数之比是3∶2,故其原子数之比为(3×2)∶(2×3)=1∶1。
【变式训练】(2011·三明高一检测)在一定温度和压强下,1体积X2气体和3体积Y2气体化合生成2体积的一种气态化合物,则该化合物的分子式为( )
A.XY3 B.XY C.X3Y D.X2Y3
【解析】选A。同温同压下,气体的体积比等于物质的量之比,即1 mol X2气体和3 mol Y2气体化合生成2 mol的一种气态化合物,根据质量守恒,可知2 mol的一种气态化合物中含有2 mol X和6 mol Y,故其化学式为XY3。
【典例1】下列关于气体摩尔体积的说法中正确的是
A.标准状况下,1 mol H2O的体积是22.4 L
B.22 g CO2的物质的量是0.5 mol,其体积为11.2 L
C.只有标准状况下的气体摩尔体积是22.4 L/mol,其他条件下一定不是该值
D.标准状况下,1摩尔任何气体的体积都是22.4 L
【易错选项】C
【易错剖析】
(1)易错选项分析
错选C的原因在于对概念的理解不透彻,不能认识到问题的根本所在。一定量的气体其体积是由压强和温度两个因素共同决定的。在标准状况下,气体摩尔体积是22.4 L/mol,但是在其他条件下,如果温度和压强合适的话,气体摩尔体积也可能是22.4 L/mol。
(2)其他错误选项分析
【标准答案】D
【典例2】下列说法中正确的是
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.1 L一氧化碳气体一定比1 L氧气的质量小
C.28 g N2和CO的混合气体在标准状况下的体积一定是
22.4 L
D.常温常压下,1 mol C完全燃烧能反应掉22.4 L氧气
【易错选项】A、B
【易错剖析】
(1)易错选项分析
错选A的原因在于对所学知识掌握不到位,不能很好地掌握理论成立所具备的条件。A项很容易在所学知识的影响下认为是正确的,往往忽视本项中并没有指明物质的状态都是气态。
错选B的原因在于忽视选项中并没有指明两种气体所处的环境条件,在条件不明的情况下,两种气体不能进行比较。
(2)其他错误选项分析
D项中1 mol C完全燃烧将反应掉1 mol O2。但常温常压下,1 mol O2的体积不是22.4 L。
【标准答案】C
【正确选项错误理解】
错误认为并不知道两种气体的具体含量,因此,也就无法计算混合气体的总物质的量,从而认为根本无法计算该混合气体的体积,这是对知识理解的不透彻,不能对其进行迁移应用。实际上因为CO和N2的摩尔质量相等(28 g/mol),28 g混合气体一定是1 mol(与两者含量的多少没有关系),故在标准状况下的体积一定是22.4 L。
1.标准状况下,若两种气体所占体积不同,其主要原因是
( )
A.气体性质不同 B.气体分子的大小不同
C.气体分子间平均距离不同 D.气体的物质的量不同
【解析】选D。影响气体体积大小的因素有:分子数目、分子间平均距离、分子本身的大小,同一条件下,因气体分子间平均距离几乎完全相同,且远远大于气体分子本身的大小,故气体分子本身的大小可忽略不计,因此影响气体体积大小的主要因素是分子数目,即气体的物质的量,故选D。
2.(双选)下列有关气体摩尔体积的描述中正确的是( )
A.单位物质的量的气体所占的体积就是气体摩尔体积
B.通常状况(室温、101 kPa)下,气体摩尔体积约为
22.4 L/mol
C.标准状况(0 ℃、101 kPa)下,气体摩尔体积约为
22.4 L/mol
D.标准状况(0 ℃、101 kPa)下,1 mol H2O的体积是
22.4 L
【解析】选A、C。标准状况(0 ℃、101 kPa)下,气体摩尔体积约为22.4 L/mol,通常状况(室温、101 kPa)下,气体摩尔体积大于22.4 L/mol,B错误;标准状况
(0 ℃、101 kPa)下,H2O不是气体,不能用22.4 L/mol来计算,D错误。
3.(2011·蚌埠高一检测)物质的体积一定是22.4 L的是
( )
A.1 mol氧气
B.17 g氨气
C.标准状况下44 g二氧化碳
D.0 ℃、2×105 Pa时2 g氢气
【解析】选C。A、B两项未指明标准状况,D项气体所处的不是标准状况(0 ℃、1×105 Pa),故气体的体积不一定是22.4 L,均错误;标准状况下1 mol二氧化碳的体积是
22.4 L,故C项正确。
4.下列说法正确的是( )
A.22.4 L任何气体的物质的量均为1 mol
B.非标准状况下,1 mol任何气体不可能占有22.4 L体积
C.0.3 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体,在标准状况下的体积约为22.4 L
D.标准状况下,1 mol CO和1 mol CO2的体积比为1∶2
【解析】选C。A项没有指明气体所处状况是标准状况,故22.4 L 气体的体积不一定是1 mol,A错误;若对非标准状况下的1 mol任何气体在温度和压强适当的情况下,气体体积也可能为22.4 L,B错误;C项中气体一共是1 mol,故在标准状况下的体积约为22.4 L,C正确;标准状况下,
1 mol CO和1 mol CO2的体积均为22.4 L,体积比为1∶1,D错误。
5.(2011·福州高一检测)下列物质中,与0.1 mol H2O含相同氢原子数的物质是( )
A.0.3 mol HNO3
B.0.1 NA个H3PO4分子
C.2.4 g CH4
D.标准状况下4.48 L HCl
【解析】选D。0.1 mol H2O含氢原子数为0.2 NA,A项含氢原子数为0.3 NA,B项含氢原子数为0.3 NA,C项含氢原子数为2.4 g÷16 g/mol×4×NA=0.6 NA,D项含氢原子数为
4.48 L÷22.4 L/mol×NA=0.2 NA,故选D。
6.某气体的分子组成是RO2 ,在标准状况下,1.28 g该气体的体积是448 mL。求此气体的相对分子质量和R的相对原子质量。
【解析】在标准状态下,448 mL该气体的物质的量是
448×10-3 L÷22.4 L/mol=0.02 mol,质量为1.28 g,故其摩尔质量M=1.28 g÷0.02 mol=64 g/mol,此气体的相对分子质量为64,R的相对原子质量为64-2×16=32。
答案:64 32
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列叙述正确的是( )
A.同温同压下,相同物质的量的物质,其体积一定相等
B.任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等
C.1 L氢气一定比1 L氧气的质量小
D.质量相等的一氧化碳和氮气,则体积也相等
【解析】选B。同温同压下,相同物质的量的气体,其体积一定相等,A项未指明是气体,错误;甲烷和一氧化碳物质的量相等,分子数一定相等,与所处的条件无关,B项正确;C、D两项未指明同温同压,均错误。
2.质量为16 g的下列气体,在标准状况下体积约为11.2 L的是( )
A.H2 B.O2 C.CO2 D.CH4
【解析】选B。标准状况下气体的物质的量为
11.2 L÷22.4 L/mol=0.5 mol,则该气体的摩尔质量为
16 g÷0.5 mol=32 g/mol,即为氧气。
3.标准状况下,若1 L H2有n个分子,则阿伏加德罗常数可
表示为( )
A.22.4n mol-1 B.44.8n mol-1
C.n/22.4 mol-1 D.n/44.8 mol-1
【解析】选A。1 L H2的物质的量为 分子数为
1/22.4 mol ×NA =NA/22.4,即n=NA/22.4,
NA=22.4n mol-1,故选A。
4.(2011·南通高一检测)在标准状况下,占体积最大的是
( )
A.98 g H2SO4 B.6.02×1023个N2分子
C.44.8 L HCl D.6 g H2
【解析】选D。在标准状况下,H2SO4为液体,体积最小;6.02×1023个N2分子,其物质的量是1 mol,体积是
22.4 L;6 g H2的物质的量是3 mol,体积是67.2 L,故选D。
5.(2011·浏阳高一检测)下列说法正确的是( )
A.32 g O2占有的体积约为22.4 L
B.22.4 L N2含有阿伏加德罗常数个氮气分子
C.在标准状况下,22.4 L水的质量约为18 g
D.22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
【解析】选D。A、B都没有指明“标准状况”是错误的;C指明“标准状况”,但在此条件下水是液体,所以22.4 L水不是1 mol,故其质量不是18 g;D项中22 g CO2的物质的量为0.5 mol,标准状况下11.2 L HCl的物质的量也为0.5 mol,两种气体的物质的量相同,所以含有的分子数也相同,因此选项D符合题意。
【方法技巧】应用气体摩尔体积进行计算时应注意的一些问题
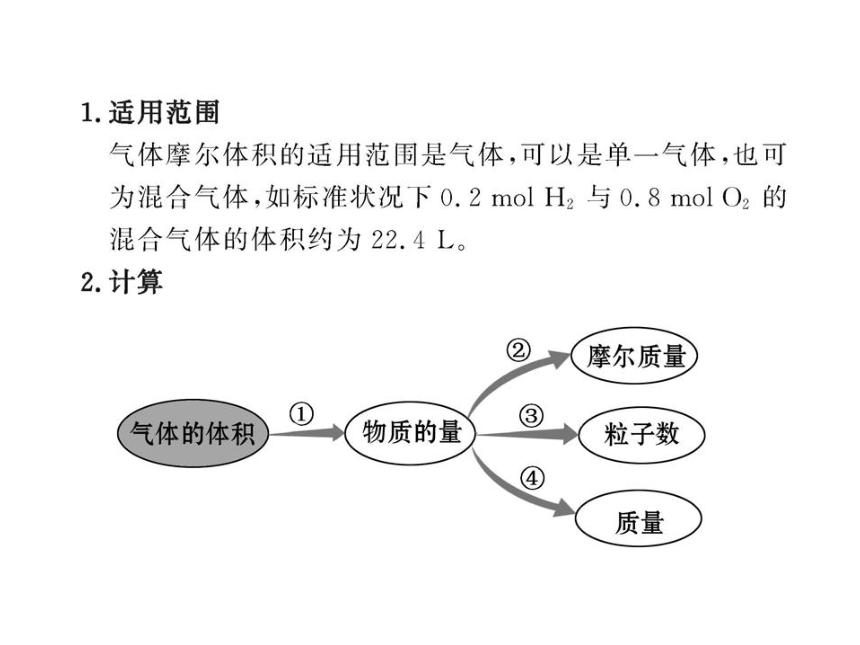
(1)只适用于气态物质,对于固态物质和液态物质来讲是不适用的,如标准状况下水、酒精、四氯化碳等不是气体。
(2)在相同的温度和压强下,1 mol任何气体所占的体积在数值上近似相等。任何气体包括纯净气体和混合气体。
(3)标准状况下,气体的摩尔体积约为22.4 L·mol-1。
(4)1 mol任何气体的体积若为22.4 L,它所处的状况。不一定就是标准状况,如对气体升温的同时增大压强,体积可能保持不变。因此不能简单地认为,只有在标准状况下,1 mol任何气体的体积才约为22.4 L。
(5)不可将1 mol气体的体积与气体摩尔体积的单位混淆,前者单位可以为L,后者单位为L/mol。
二、非选择题(本题包括3小题,共30分)
6.(12分)(1)在标准状况下,22 g CO2的体积是____ L,
与_________g N2含有相同的分子数。
(2)等物质的量的CO和CO2其质量之比是______________,分子数之比是_____________。
【解析】(1)22 g CO2的物质的量为
标准状况下的体积为0.5 mol×22.4 L/mol=11.2 L。相同
分子数的N2的质量为0.5 mol×28 g/mol=14 g。
(2)相等物质的量时,质量之比等于摩尔质量之比,
m(CO)∶m(CO2)=28∶44=7∶11,
N(CO)∶N(CO2)=1∶1。
答案:(1)11.2 14 (2)7∶11 1∶1
7.(8分)标准状况下,44.8 L由CO和H2组成的混合气体的质量为30 g,则H2的质量为_______;CO和H2的物质的量之比为__________。
【解析】设H2和CO的物质的量分别是x、y,则
解得x=1 mol y=1 mol,则H2的质量是2 g,CO和H2的物质的量之比为1∶1。
答案: 2 g 1∶1
8.(10分)(2011·漳州高一检测)(1)标准状况下,
①4 g氢气、②33.6 L甲烷(CH4)、 ③6.02×1023个水分子中,物质的量最大的是___________(填写序号,下同),
体积最小的是_________。
(2)质量相等的两种物质SO2和SO3,它们的物质的量之比为________,所含氧原子个数之比为__________。
【解析】(1)
(2)根据n=m/M知,质量相等时,物质的量与摩尔质量成反比,故SO2和SO3的物质的量之比为80∶64=5∶4,所含氧原子个数之比为(5×2)∶(4×3)=5∶6。
答案:(1)① ③ (2)5∶4 5∶6
【实验设计】已知化学反应:S(s)+O2(g) SO2(g),加热使硫粉与O2反应,冷却至室温时观察水银柱变化,通过水银柱是否变化确定大试管中气体体积与分子数之间的关系。
【实验用品】大试管、带弯曲玻璃管的橡皮塞、铁架台、酒精灯、研细的硫粉、氧气、水银、红笔。
点燃
====
【实验装置及步骤】
(1)将如图装置装好后固定到铁架台上。待内外气体压强不再变化时,用红笔在玻璃管上标出水银柱液面刻度。
(2)用酒精灯加热试管底部,可以看到研细的硫粉在试管中燃烧,当瓶中氧气消耗完时火焰熄灭。已知该反应是放热反应。
(3)反应结束后,让其自然冷却。
【思考探究】
(1)保证本实验成功的关键是什么?
提示:应保证装置气密性良好。
(2)硫粉在大试管中充分燃烧后,水银柱液面如何变化?
提示:水银柱左管液面上升,右管液面下降。
(3)大试管自然冷却到室温,水银柱液面如何变化?
提示:水银柱液面又回到原来标定的刻度。
(4)硫粉燃烧后,再恢复到室温时,水银柱液面和硫粉燃烧前相同。据此,你能得出什么样的结论?
提示:相同温度和压强下,相同体积的任何气体都有相同的粒子数。
