11-12版高中化学全程学习方略配套课件:4.4.2硝酸和硫酸的氧化性(人教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:4.4.2硝酸和硫酸的氧化性(人教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 5.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 08:40:51 | ||
图片预览











文档简介
(共94张PPT)
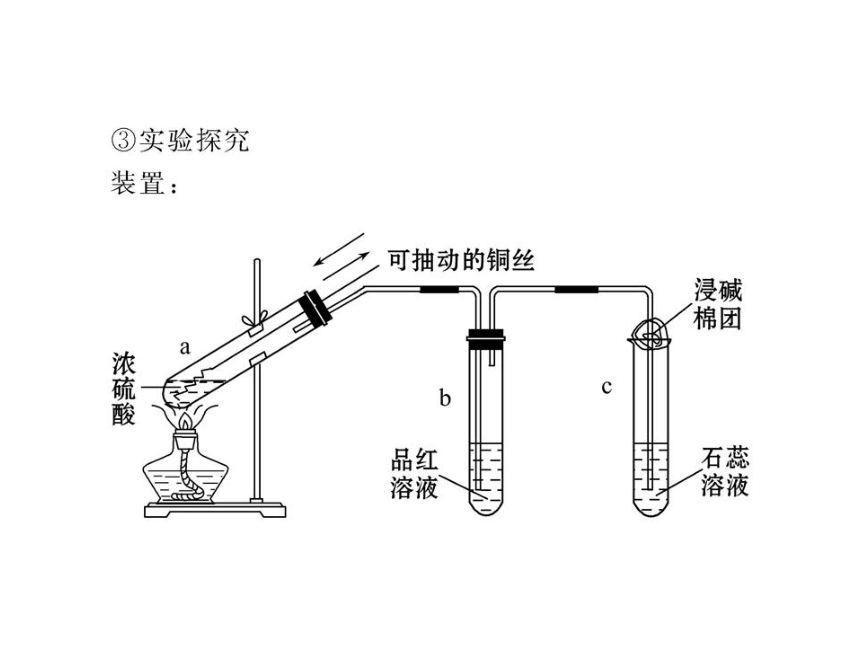
【典例1】(2010·北京高考)用如图所示
实验装置(夹持仪器已略去)探究铜丝与
过量浓硫酸的反应。下列实验操作不合理的
是
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
【思路点拨】解答该题要注意以下三点:
(1)通过上下移动铜丝可控制反应进行;
(2)检验SO2要用品红溶液,有毒气体要进行尾气处理;
(3)不能把水倒入浓硫酸中。
【自主解答】选D。Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑,
题中当向上移动①中铜丝时,铜丝与浓硫酸脱离接触,反
应停止;当向下移动时,铜丝与浓硫酸接触,生成SO2,
因此可控制SO2的量,故A正确。SO2可以使品红溶液褪色,
加热后又可恢复原色,因此可用品红溶液检验SO2,故B正
确。SO2会污染大气造成酸雨,因此不能直接排放,可用
△
====
NaOH溶液吸收,故C也正确。反应后,①中含有大量硫酸,若直接向①中加水,容易使水沸腾而溅出,造成危险,可以先将上层清液倒出,然后再向试管中残留的固体上加入水,若溶液变蓝,则可以确认有CuSO4生成,故D不正确。
【互动探究】(1)②中的品红溶液换为石蕊溶液,会观察到怎样的现象?
(2)能利用铜与浓硫酸反应制取硫酸铜吗?
提示:(1)SO2的水溶液显酸性,所以石蕊溶液变红。
(2)不能,这样会产生大气污染物而且浪费原料。
【变式训练】下列关于浓硫酸的叙述中,正确的是
( )
A.浓硫酸具有吸水性,因而能使蔗糖碳化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属形成氧化膜而钝化
【解析】选D。使蔗糖碳化体现了浓硫酸的脱水性;在常温下浓硫酸与铜片不反应,加热时发生反应;浓硫酸与氨气反应;浓硫酸在常温下能够使铁、铝等金属形成氧化膜而钝化,故D正确。
【典例2】将8 g Fe置于40 mL HNO3中微热,生成气体的颜色随反应的进行由深变浅,充分反应后得标准状况下的气体为1.792 L,此时剩余2.4 g固体,求:
(1)该反应中被还原的硝酸和未被还原的硝酸的质量比;
(2)求混合气体中NO和NO2的体积比。
【思路点拨】解答该题注意以下三点:
(1)铁过量,溶液中溶质只有Fe(NO3)2;
(2)n(被还原HNO3)=n(NO2或NO),
n(未被还原HNO3)=2n(Fe);
(3)利用电子守恒与原子守恒计算NO和NO2的体积比。
【自主解答】
(1)根据元素守恒,被还原的硝酸物质的量为:
未被还原的硝酸物质的量为:
被还原的HNO3和未被还原的HNO3的物质的量之比为:0.08∶0.2=2∶5
(2)
n(NO)+n(NO2)=0.08 mol
据电子守恒:2n(Fe)=3n(NO)+n(NO2)
所以:n(NO)=0.06 mol n(NO2)=0.02 mol
所以:n(NO)/n(NO2)=3∶1,则V(NO)/V(NO2)=3∶1
答案:(1)2∶5 (2)3∶1
【互动探究】(1)原硝酸的物质的量浓度是多少?
(2)若将2.4 g固体过滤出来,向溶液中再加入硝酸,还反应吗?
提示:(1)据例题可知总的硝酸的物质的量为
0.08 mol+0.2 mol=0.28 mol,所以原硝酸的物质的量浓度是0.28 mol÷0.04 L=7 mol/L。
(2)溶液中溶质只有Fe(NO3)2,能被硝酸氧化为Fe(NO3)3,所以还能继续消耗硝酸。
【变式训练】(2011·天水高一检测)将1.92 g铜粉与一定量的浓硝酸反应,当铜粉完全反应时收集到气体1.12 L(标准状况),则所消耗的硝酸的物质的量是( )
A.0.12 mol B.0.11 mol
C.0.09 mol D.0.08 mol
【解析】选B。铜与硝酸反应时,消耗的HNO3中的N进入
Cu(NO3)2和氮的氧化物(NO2或NO)中。
所以共消耗硝酸的物质的量
故正确答案为B。
【典例】已知硝酸具有强氧化性,在某溶液中先滴加稀硝酸,再滴加氯化钡溶液,有白色沉淀产生,该溶液中
A.一定含有SO42-
B.一定含有SO32-和SO42-
C.一定含有SO32-
D.可能无SO42-和SO32-
【思路点拨】解答本题时应注意两方面问题:
(1)硝酸具有强氧化性,可以将HSO3-或SO32-氧化成SO42-,进而产生沉淀。
(2)在溶液中滴加稀硝酸时,不能排除Cl-的干扰。
【自主解答】选D。白色沉淀不溶于稀硝酸,该沉淀可能是Ba2+所引起而生成的BaSO4沉淀,也可能是Cl-所引起而生成的AgCl沉淀。
【互动探究】题干中改成先滴加氯化钡溶液,产生白色沉淀,再加入稀硝酸,沉淀不消失,能不能证明溶液中一定含有SO42-
提示:不能。若原溶液中含有Ag+,加入BaCl2后产生不溶于稀硝酸的白色沉淀,干扰实验;若原溶液中含有SO32-,加入BaCl2后,产生BaSO3白色沉淀,再滴加稀硝酸时,BaSO3被氧化为BaSO4,从而干扰实验。
【变式训练】在检验SO42-的过程中,下列操作中正确的是
( )
A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在
B.先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在
C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在
D.先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在
【解析】选C。A项,先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,溶液中也可能含有SO32-或HSO3-;B项,先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,溶液中也可能含有SO32-或HSO3-;D项,先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,溶液中也可能含有Ag+。
【典例1】下列有关浓硫酸的说法中正确的是
A.浓硫酸常用作干燥剂,它是利用了浓硫酸的脱水性
B.浓硫酸具有极强的氧化性,故把铁片放入浓硫酸中会生成Fe2(SO4)3
C.浓硫酸是酸,故在和金属反应时,符合酸与金属反应的通式:酸+金属====盐+H2↑
D.浓硫酸稀释会放出大量的热,故正确的稀释过程是把浓硫酸加入到水中,并不断搅拌
【易错选项】B
【易错剖析】
(1)易错选项分析
错选B的原因在于对所学基础知识掌握不到位,对知识不能灵活的使用导致片面的分析问题。浓硫酸是酸,且具有强氧化性,但它又有其自己的特性。如常温时使铁、铝钝化,故不能使铁与浓硫酸进一步反应而生成Fe2(SO4)3。
(2)其他错误选项分析
(3)正确选项分析
对浓硫酸的稀释一定要注意过程中的操作(例如用烧杯做实验器皿):烧杯中放入一定量水,将浓硫酸沿烧杯内壁缓缓加入到水中,并用玻璃棒不断搅拌,以使热量及时地扩散。反之,把水加入到浓硫酸中是不正确的,这样很容易发生危险。
【标准答案】D
【典例2】关于硝酸的说法中正确的是
A.Cu可以溶解在稀硝酸中并生成H2
B.浓硝酸不能与非金属单质反应
C.硝酸与金属反应时,主要是+5价的氮元素得电子
D.常温下,向浓硝酸中投入Fe片,会产生大量的红棕色气体
【易错选项】D
【易错剖析】
(1)易错选项分析
原因在于对重要知识点掌握的不透彻,根据常规判断物质性质的方法直接判断,导致分析错误。不清楚一些物质除了常见的性质外,还有一些特性。在常温下浓硝酸中加入Fe,会钝化,不会有NO2生成。
(2)其他错误选项分析
【标准答案】C
1.下列溶液中不与单质Cu反应(必要时可加热)的是( )
A.浓盐酸 B.稀硝酸
C.浓硫酸 D.FeCl3溶液
【解析】选A。浓盐酸不与铜反应,稀硝酸与铜反应生成硝酸铜、一氧化氮和水,浓硫酸与铜在加热时生成硫酸铜、二氧化硫和水,FeCl3溶液与铜反应生成氯化亚铁和氯化铜,故选A。
2.下列反应中既体现硝酸的氧化性又体现其酸性的是( )
A.木炭与浓硝酸 B.铜与稀硝酸
C.氢氧化铜与硝酸 D.氧化铁与硝酸
【解析】选B。C+4HNO3(浓) CO2↑+4NO2↑+2H2O,
只体现浓硝酸的强氧化性;3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O,这个反应体现硝酸的氧化性与酸性;
Cu(OH)2+2HNO3====Cu(NO3)2+2H2O,
Fe2O3+6HNO3====2Fe(NO3)3+3H2O,只体现酸性,故选B。
△
====
3.下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.在空气中敞口久置的浓硫酸,溶液质量增大(难挥发性)
B.在加热条件下铜与浓硫酸反应(强氧化性、酸性)
C.蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性)
D.浓硫酸可用来干燥某些气体(脱水性)
【解析】选B。A、D两项表现出浓硫酸的吸水性;B正确;C项体现浓硫酸的脱水性。
4.从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是( )
A.铜和浓硝酸反应 B.铜和稀硝酸反应
C.氧化铜和硝酸反应 D.氯化铜和硝酸银反应
【解析】选C。A、B两项既浪费原料,又产生大气污染物;D项硝酸银价格较高,成本较高,C项符合。
5.将一定量铜与足量浓硝酸充分反应,可以得到6.72 L NO2气体(气体体积在标准状况下测定)。
(1)写出铜与浓硝酸反应的化学方程式
___________________________________。
(2)若反应后溶液体积为100 mL,则所得溶液中Cu2+的物质的量浓度是多少?
(3)若改用排水法收集气体,则可收集到气体的体积为多少?
【解析】
Cu+4HNO3(浓)====Cu(NO3)2 + 2NO2↑+2H2O
1 mol 2 mol
n(Cu2+) 0.3 mol
n(Cu2+)=0.15 mol
若用排水法收集反应产生的气体,由于发生反应:
3NO2+H2O====2HNO3+NO
3 L 1 L
6.72 L V(NO)
则得到NO气体的体积为
答案:(1)Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
(2)1.5 mol/L (3)2.24 L
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列关于硝酸和硫酸的叙述中,正确的是( )
A.浓硝酸和浓硫酸都具有脱水性
B.浓硫酸和浓硝酸都可以用铝、铁的容器盛装,加热也不反应
C.稀硫酸和稀硝酸都是氧化性酸
D.硫酸和硝酸都是重要的化工原料
【解析】选D。浓硝酸无脱水性;加热时浓硫酸和浓硝酸都可以与铝、铁反应;稀硝酸是氧化性酸,稀硫酸也有氧化性,但不是氧化性酸;硫酸和硝酸都是重要的化工原料,故D正确。
2.一定量的浓硫酸跟过量的锌充分反应,产生的气体可能
有( )
①SO2 ②SO3 ③H2S ④H2
A.①② B.①③
C.①④ D.只有①
【解析】选C。2H2SO4(浓)+Zn ZnSO4+2H2O+SO2↑,随着
反应的进行,硫酸的浓度减小,当变成稀硫酸时,发生反应
H2SO4+Zn ZnSO4+H2↑,故选C。
△
====
====
3.(2011·荆州高一检测)下列关于浓硝酸和浓硫酸的叙述错误的是( )
A.都是常用的干燥剂
B.都能与木炭反应
C.常温下都可以储存于铝制槽罐中
D.和铜反应中都表现出氧化性和酸性
【解析】选A。浓硝酸不作干燥剂,A错误;浓硝酸和浓硫酸在加热时都能与木炭反应,B正确;常温下都能使铝钝化,C正确;浓硝酸和浓硫酸和铜反应中都表现出氧化性和酸性,D正确。
4.下列的各组离子在酸性溶液中能大量共存的是( )
A.Na+、Fe2+、 、SCN-
B.Ca2+、K+、Cl-、
C.Al3+、K+、OH-、
D.Na+、K+、 、Cl-
【解析】选B。酸性溶液中含有H+,则A项相当于存在硝
酸,能将Fe2+氧化;C项OH-被H+中和;D项 与H+作用产
生硅酸沉淀。
5.检验某未知溶液中是否含 的下列操作中,合理的是 ( )
A.先加硝酸酸化,再加氯化钡溶液
B.先加硝酸酸化,再加硝酸钡溶液
C.先加盐酸酸化,再加氯化钡溶液
D.先加盐酸酸化,再加硝酸钡溶液
【解析】选C。先用盐酸酸化的目的是排除 、 、
、Ag+ 等离子对硫酸根离子检验的干扰,再加入氯化
钡溶液产生白色沉淀,证明原溶液中含有 。
【方法技巧】 的检验方法
二、非选择题(本题包括3小题,共30分)
6.(10分)为了验证Cu和浓硫酸反应的产物中有SO2和H2O,选用下图所示仪器(内含物质)组装成实验装置。B中有无水硫酸铜、C中有品红溶液、D中有氢氧化钠溶液。
(1)如按气流由左向右流动,连接上述装置的正确顺序是(填各接口字母):a接 , 接 , 接f。
(2) 仪器B、C应有怎样的实验现象才表明已检验出SO2和H2O
B中 ,C中 。
若将B、C装置前后对调,对实验有何影响 。
(3)D中氢氧化钠溶液的作用是 。
(4)写出A中反应的化学方程式 。
【解析】(1)A为铜与浓硫酸的发生装置,B为检验水的装
置,C为检验SO2的装置,D是尾气处理装置,洗气瓶中遵循
长管进短管出,所以接口顺序为a→b,c→e,d→f。
(2)白色粉末变为蓝色证明反应中有水生成,品红溶液褪
色,证明反应有二氧化硫生成。若将 B、C装置前后对调,
则无法检验是否有水生成。
(3)氢氧化钠溶液是吸收过量的二氧化硫,防止污染环境。
(4)铜与浓硫酸的反应是
2H2SO4(浓)+Cu CuSO4+2H2O+SO2↑。
△
====
答案:(1)b c e d
(2)白色粉末变为蓝色 品红溶液褪色
无法检验是否有水生成
(3)吸收过量的二氧化硫,防止污染环境
(4)2H2SO4(浓)+Cu CuSO4+2H2O+SO2↑
△
====
7.(10分)黑色固体A加热至红热投入到无色浓溶液B中发生如下转化关系,已知X是两种气体组成的混合气体,其中一种为红棕色气体。
(1)由此可以推断:A为 ,B为 ,C为 ,E
为 。
(2)写出D与F反应的化学方程式 。
【解析】因为X中一种气体为红棕色,则该气体为NO2,黑
色固体A为C,B为浓硝酸,该反应为
C+4HNO3(浓) CO2↑+4NO2↑+2H2O,X为CO2和NO2,因
此C为CO2和NO,E为NO,D为稀硝酸,F为铜,G为硝酸铜。
答案:(1) C 浓硝酸 NO和CO2 NO
(2)3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O
△
====
====
8.(10分)(挑战能力)a mol某单质M与含b mol HNO3的溶液恰好完全反应。
(1)若M为Cu,则被还原的HNO3的物质的量一定是
mol。(用含a、b的式子表示)
(2)若a=0.6,M仍为Cu,充分反应后,共收集到标准状况下的气体22.4 L,则此时b= 。
【解析】(1)n(被还原HNO3)
=n(总HNO3)-n(未被还原HNO3)=b-2a。
(2)n(总HNO3)=n(被还原HNO3)+n(未被还原HNO3)
=1 mol+0.6 mol×2=2.2 mol。
答案:(1)b-2a (2)2.2
铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同。
Ⅰ.某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置,实验步骤如下:
①检查装置的气密性;
②向试管中加入一定量CaCO3固体;
③向试管中倒入过量的稀硝酸,并迅速盖上带铜丝和导管的橡皮塞;
④待反应完全后,将右边导管插入试管内接近液面;
⑤将铜丝插入到溶液中;
⑥用注射器向大试管内推入氧气(或空气)。
【思考探究】(1)设计步骤②、③的目的是什么?
提示:生成CO2排除试管内的空气,防止NO被氧化。
(2)设计步骤⑥的目的是什么?
提示:根据无色气体变为红棕色,证明铜与稀硝酸反应生成NO。
Ⅱ.分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色。
【思考探究】
(3)某同学提出这可能是Cu2+浓度差异引起的,你同意这种看法吗?
提示:不同意,原因是铜的质量相等,则Cu2+的物质的量相等,而溶液的体积相等,故Cu2+的物质的量浓度相等,所以不可能是Cu2+浓度差异引起的。
【典例1】(2010·北京高考)用如图所示
实验装置(夹持仪器已略去)探究铜丝与
过量浓硫酸的反应。下列实验操作不合理的
是
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
【思路点拨】解答该题要注意以下三点:
(1)通过上下移动铜丝可控制反应进行;
(2)检验SO2要用品红溶液,有毒气体要进行尾气处理;
(3)不能把水倒入浓硫酸中。
【自主解答】选D。Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑,
题中当向上移动①中铜丝时,铜丝与浓硫酸脱离接触,反
应停止;当向下移动时,铜丝与浓硫酸接触,生成SO2,
因此可控制SO2的量,故A正确。SO2可以使品红溶液褪色,
加热后又可恢复原色,因此可用品红溶液检验SO2,故B正
确。SO2会污染大气造成酸雨,因此不能直接排放,可用
△
====
NaOH溶液吸收,故C也正确。反应后,①中含有大量硫酸,若直接向①中加水,容易使水沸腾而溅出,造成危险,可以先将上层清液倒出,然后再向试管中残留的固体上加入水,若溶液变蓝,则可以确认有CuSO4生成,故D不正确。
【互动探究】(1)②中的品红溶液换为石蕊溶液,会观察到怎样的现象?
(2)能利用铜与浓硫酸反应制取硫酸铜吗?
提示:(1)SO2的水溶液显酸性,所以石蕊溶液变红。
(2)不能,这样会产生大气污染物而且浪费原料。
【变式训练】下列关于浓硫酸的叙述中,正确的是
( )
A.浓硫酸具有吸水性,因而能使蔗糖碳化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属形成氧化膜而钝化
【解析】选D。使蔗糖碳化体现了浓硫酸的脱水性;在常温下浓硫酸与铜片不反应,加热时发生反应;浓硫酸与氨气反应;浓硫酸在常温下能够使铁、铝等金属形成氧化膜而钝化,故D正确。
【典例2】将8 g Fe置于40 mL HNO3中微热,生成气体的颜色随反应的进行由深变浅,充分反应后得标准状况下的气体为1.792 L,此时剩余2.4 g固体,求:
(1)该反应中被还原的硝酸和未被还原的硝酸的质量比;
(2)求混合气体中NO和NO2的体积比。
【思路点拨】解答该题注意以下三点:
(1)铁过量,溶液中溶质只有Fe(NO3)2;
(2)n(被还原HNO3)=n(NO2或NO),
n(未被还原HNO3)=2n(Fe);
(3)利用电子守恒与原子守恒计算NO和NO2的体积比。
【自主解答】
(1)根据元素守恒,被还原的硝酸物质的量为:
未被还原的硝酸物质的量为:
被还原的HNO3和未被还原的HNO3的物质的量之比为:0.08∶0.2=2∶5
(2)
n(NO)+n(NO2)=0.08 mol
据电子守恒:2n(Fe)=3n(NO)+n(NO2)
所以:n(NO)=0.06 mol n(NO2)=0.02 mol
所以:n(NO)/n(NO2)=3∶1,则V(NO)/V(NO2)=3∶1
答案:(1)2∶5 (2)3∶1
【互动探究】(1)原硝酸的物质的量浓度是多少?
(2)若将2.4 g固体过滤出来,向溶液中再加入硝酸,还反应吗?
提示:(1)据例题可知总的硝酸的物质的量为
0.08 mol+0.2 mol=0.28 mol,所以原硝酸的物质的量浓度是0.28 mol÷0.04 L=7 mol/L。
(2)溶液中溶质只有Fe(NO3)2,能被硝酸氧化为Fe(NO3)3,所以还能继续消耗硝酸。
【变式训练】(2011·天水高一检测)将1.92 g铜粉与一定量的浓硝酸反应,当铜粉完全反应时收集到气体1.12 L(标准状况),则所消耗的硝酸的物质的量是( )
A.0.12 mol B.0.11 mol
C.0.09 mol D.0.08 mol
【解析】选B。铜与硝酸反应时,消耗的HNO3中的N进入
Cu(NO3)2和氮的氧化物(NO2或NO)中。
所以共消耗硝酸的物质的量
故正确答案为B。
【典例】已知硝酸具有强氧化性,在某溶液中先滴加稀硝酸,再滴加氯化钡溶液,有白色沉淀产生,该溶液中
A.一定含有SO42-
B.一定含有SO32-和SO42-
C.一定含有SO32-
D.可能无SO42-和SO32-
【思路点拨】解答本题时应注意两方面问题:
(1)硝酸具有强氧化性,可以将HSO3-或SO32-氧化成SO42-,进而产生沉淀。
(2)在溶液中滴加稀硝酸时,不能排除Cl-的干扰。
【自主解答】选D。白色沉淀不溶于稀硝酸,该沉淀可能是Ba2+所引起而生成的BaSO4沉淀,也可能是Cl-所引起而生成的AgCl沉淀。
【互动探究】题干中改成先滴加氯化钡溶液,产生白色沉淀,再加入稀硝酸,沉淀不消失,能不能证明溶液中一定含有SO42-
提示:不能。若原溶液中含有Ag+,加入BaCl2后产生不溶于稀硝酸的白色沉淀,干扰实验;若原溶液中含有SO32-,加入BaCl2后,产生BaSO3白色沉淀,再滴加稀硝酸时,BaSO3被氧化为BaSO4,从而干扰实验。
【变式训练】在检验SO42-的过程中,下列操作中正确的是
( )
A.先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,证明有SO42-存在
B.先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,证明有SO42-存在
C.先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在
D.先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在
【解析】选C。A项,先加入稀硝酸,没有产生沉淀,然后再加硝酸钡,产生白色沉淀,溶液中也可能含有SO32-或HSO3-;B项,先加入硝酸钡,产生白色沉淀,然后再加稀硝酸,沉淀不溶解,溶液中也可能含有SO32-或HSO3-;D项,先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,溶液中也可能含有Ag+。
【典例1】下列有关浓硫酸的说法中正确的是
A.浓硫酸常用作干燥剂,它是利用了浓硫酸的脱水性
B.浓硫酸具有极强的氧化性,故把铁片放入浓硫酸中会生成Fe2(SO4)3
C.浓硫酸是酸,故在和金属反应时,符合酸与金属反应的通式:酸+金属====盐+H2↑
D.浓硫酸稀释会放出大量的热,故正确的稀释过程是把浓硫酸加入到水中,并不断搅拌
【易错选项】B
【易错剖析】
(1)易错选项分析
错选B的原因在于对所学基础知识掌握不到位,对知识不能灵活的使用导致片面的分析问题。浓硫酸是酸,且具有强氧化性,但它又有其自己的特性。如常温时使铁、铝钝化,故不能使铁与浓硫酸进一步反应而生成Fe2(SO4)3。
(2)其他错误选项分析
(3)正确选项分析
对浓硫酸的稀释一定要注意过程中的操作(例如用烧杯做实验器皿):烧杯中放入一定量水,将浓硫酸沿烧杯内壁缓缓加入到水中,并用玻璃棒不断搅拌,以使热量及时地扩散。反之,把水加入到浓硫酸中是不正确的,这样很容易发生危险。
【标准答案】D
【典例2】关于硝酸的说法中正确的是
A.Cu可以溶解在稀硝酸中并生成H2
B.浓硝酸不能与非金属单质反应
C.硝酸与金属反应时,主要是+5价的氮元素得电子
D.常温下,向浓硝酸中投入Fe片,会产生大量的红棕色气体
【易错选项】D
【易错剖析】
(1)易错选项分析
原因在于对重要知识点掌握的不透彻,根据常规判断物质性质的方法直接判断,导致分析错误。不清楚一些物质除了常见的性质外,还有一些特性。在常温下浓硝酸中加入Fe,会钝化,不会有NO2生成。
(2)其他错误选项分析
【标准答案】C
1.下列溶液中不与单质Cu反应(必要时可加热)的是( )
A.浓盐酸 B.稀硝酸
C.浓硫酸 D.FeCl3溶液
【解析】选A。浓盐酸不与铜反应,稀硝酸与铜反应生成硝酸铜、一氧化氮和水,浓硫酸与铜在加热时生成硫酸铜、二氧化硫和水,FeCl3溶液与铜反应生成氯化亚铁和氯化铜,故选A。
2.下列反应中既体现硝酸的氧化性又体现其酸性的是( )
A.木炭与浓硝酸 B.铜与稀硝酸
C.氢氧化铜与硝酸 D.氧化铁与硝酸
【解析】选B。C+4HNO3(浓) CO2↑+4NO2↑+2H2O,
只体现浓硝酸的强氧化性;3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O,这个反应体现硝酸的氧化性与酸性;
Cu(OH)2+2HNO3====Cu(NO3)2+2H2O,
Fe2O3+6HNO3====2Fe(NO3)3+3H2O,只体现酸性,故选B。
△
====
3.下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.在空气中敞口久置的浓硫酸,溶液质量增大(难挥发性)
B.在加热条件下铜与浓硫酸反应(强氧化性、酸性)
C.蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性)
D.浓硫酸可用来干燥某些气体(脱水性)
【解析】选B。A、D两项表现出浓硫酸的吸水性;B正确;C项体现浓硫酸的脱水性。
4.从降低成本和减少环境污染的角度考虑,制取硝酸铜最好的方法是( )
A.铜和浓硝酸反应 B.铜和稀硝酸反应
C.氧化铜和硝酸反应 D.氯化铜和硝酸银反应
【解析】选C。A、B两项既浪费原料,又产生大气污染物;D项硝酸银价格较高,成本较高,C项符合。
5.将一定量铜与足量浓硝酸充分反应,可以得到6.72 L NO2气体(气体体积在标准状况下测定)。
(1)写出铜与浓硝酸反应的化学方程式
___________________________________。
(2)若反应后溶液体积为100 mL,则所得溶液中Cu2+的物质的量浓度是多少?
(3)若改用排水法收集气体,则可收集到气体的体积为多少?
【解析】
Cu+4HNO3(浓)====Cu(NO3)2 + 2NO2↑+2H2O
1 mol 2 mol
n(Cu2+) 0.3 mol
n(Cu2+)=0.15 mol
若用排水法收集反应产生的气体,由于发生反应:
3NO2+H2O====2HNO3+NO
3 L 1 L
6.72 L V(NO)
则得到NO气体的体积为
答案:(1)Cu+4HNO3(浓)====Cu(NO3)2+2NO2↑+2H2O
(2)1.5 mol/L (3)2.24 L
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列关于硝酸和硫酸的叙述中,正确的是( )
A.浓硝酸和浓硫酸都具有脱水性
B.浓硫酸和浓硝酸都可以用铝、铁的容器盛装,加热也不反应
C.稀硫酸和稀硝酸都是氧化性酸
D.硫酸和硝酸都是重要的化工原料
【解析】选D。浓硝酸无脱水性;加热时浓硫酸和浓硝酸都可以与铝、铁反应;稀硝酸是氧化性酸,稀硫酸也有氧化性,但不是氧化性酸;硫酸和硝酸都是重要的化工原料,故D正确。
2.一定量的浓硫酸跟过量的锌充分反应,产生的气体可能
有( )
①SO2 ②SO3 ③H2S ④H2
A.①② B.①③
C.①④ D.只有①
【解析】选C。2H2SO4(浓)+Zn ZnSO4+2H2O+SO2↑,随着
反应的进行,硫酸的浓度减小,当变成稀硫酸时,发生反应
H2SO4+Zn ZnSO4+H2↑,故选C。
△
====
====
3.(2011·荆州高一检测)下列关于浓硝酸和浓硫酸的叙述错误的是( )
A.都是常用的干燥剂
B.都能与木炭反应
C.常温下都可以储存于铝制槽罐中
D.和铜反应中都表现出氧化性和酸性
【解析】选A。浓硝酸不作干燥剂,A错误;浓硝酸和浓硫酸在加热时都能与木炭反应,B正确;常温下都能使铝钝化,C正确;浓硝酸和浓硫酸和铜反应中都表现出氧化性和酸性,D正确。
4.下列的各组离子在酸性溶液中能大量共存的是( )
A.Na+、Fe2+、 、SCN-
B.Ca2+、K+、Cl-、
C.Al3+、K+、OH-、
D.Na+、K+、 、Cl-
【解析】选B。酸性溶液中含有H+,则A项相当于存在硝
酸,能将Fe2+氧化;C项OH-被H+中和;D项 与H+作用产
生硅酸沉淀。
5.检验某未知溶液中是否含 的下列操作中,合理的是 ( )
A.先加硝酸酸化,再加氯化钡溶液
B.先加硝酸酸化,再加硝酸钡溶液
C.先加盐酸酸化,再加氯化钡溶液
D.先加盐酸酸化,再加硝酸钡溶液
【解析】选C。先用盐酸酸化的目的是排除 、 、
、Ag+ 等离子对硫酸根离子检验的干扰,再加入氯化
钡溶液产生白色沉淀,证明原溶液中含有 。
【方法技巧】 的检验方法
二、非选择题(本题包括3小题,共30分)
6.(10分)为了验证Cu和浓硫酸反应的产物中有SO2和H2O,选用下图所示仪器(内含物质)组装成实验装置。B中有无水硫酸铜、C中有品红溶液、D中有氢氧化钠溶液。
(1)如按气流由左向右流动,连接上述装置的正确顺序是(填各接口字母):a接 , 接 , 接f。
(2) 仪器B、C应有怎样的实验现象才表明已检验出SO2和H2O
B中 ,C中 。
若将B、C装置前后对调,对实验有何影响 。
(3)D中氢氧化钠溶液的作用是 。
(4)写出A中反应的化学方程式 。
【解析】(1)A为铜与浓硫酸的发生装置,B为检验水的装
置,C为检验SO2的装置,D是尾气处理装置,洗气瓶中遵循
长管进短管出,所以接口顺序为a→b,c→e,d→f。
(2)白色粉末变为蓝色证明反应中有水生成,品红溶液褪
色,证明反应有二氧化硫生成。若将 B、C装置前后对调,
则无法检验是否有水生成。
(3)氢氧化钠溶液是吸收过量的二氧化硫,防止污染环境。
(4)铜与浓硫酸的反应是
2H2SO4(浓)+Cu CuSO4+2H2O+SO2↑。
△
====
答案:(1)b c e d
(2)白色粉末变为蓝色 品红溶液褪色
无法检验是否有水生成
(3)吸收过量的二氧化硫,防止污染环境
(4)2H2SO4(浓)+Cu CuSO4+2H2O+SO2↑
△
====
7.(10分)黑色固体A加热至红热投入到无色浓溶液B中发生如下转化关系,已知X是两种气体组成的混合气体,其中一种为红棕色气体。
(1)由此可以推断:A为 ,B为 ,C为 ,E
为 。
(2)写出D与F反应的化学方程式 。
【解析】因为X中一种气体为红棕色,则该气体为NO2,黑
色固体A为C,B为浓硝酸,该反应为
C+4HNO3(浓) CO2↑+4NO2↑+2H2O,X为CO2和NO2,因
此C为CO2和NO,E为NO,D为稀硝酸,F为铜,G为硝酸铜。
答案:(1) C 浓硝酸 NO和CO2 NO
(2)3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O
△
====
====
8.(10分)(挑战能力)a mol某单质M与含b mol HNO3的溶液恰好完全反应。
(1)若M为Cu,则被还原的HNO3的物质的量一定是
mol。(用含a、b的式子表示)
(2)若a=0.6,M仍为Cu,充分反应后,共收集到标准状况下的气体22.4 L,则此时b= 。
【解析】(1)n(被还原HNO3)
=n(总HNO3)-n(未被还原HNO3)=b-2a。
(2)n(总HNO3)=n(被还原HNO3)+n(未被还原HNO3)
=1 mol+0.6 mol×2=2.2 mol。
答案:(1)b-2a (2)2.2
铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同。
Ⅰ.某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置,实验步骤如下:
①检查装置的气密性;
②向试管中加入一定量CaCO3固体;
③向试管中倒入过量的稀硝酸,并迅速盖上带铜丝和导管的橡皮塞;
④待反应完全后,将右边导管插入试管内接近液面;
⑤将铜丝插入到溶液中;
⑥用注射器向大试管内推入氧气(或空气)。
【思考探究】(1)设计步骤②、③的目的是什么?
提示:生成CO2排除试管内的空气,防止NO被氧化。
(2)设计步骤⑥的目的是什么?
提示:根据无色气体变为红棕色,证明铜与稀硝酸反应生成NO。
Ⅱ.分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色。
【思考探究】
(3)某同学提出这可能是Cu2+浓度差异引起的,你同意这种看法吗?
提示:不同意,原因是铜的质量相等,则Cu2+的物质的量相等,而溶液的体积相等,故Cu2+的物质的量浓度相等,所以不可能是Cu2+浓度差异引起的。
