2.1. 化学反应速率ppt 2021-2022学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.1. 化学反应速率ppt 2021-2022学年上学期高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-05 20:50:39 | ||
图片预览








文档简介
(共20张PPT)
第二章 化学反应速率和化学平衡
2019人教版选择性必修一
第一节 化学反应速率
在化学实验和日常生活中,我们经常观察到这样的现象:有的反应进行的快,有的进行的慢。
【思考与讨论】
很快
较快
较慢
很慢
思考:如何科学衡量化学反应速率的快慢?
新问题
那么化学上又是如何定量地判断一个化学反应的快慢的呢?
学科链接
在物理中我们是如何定量地判断一个物体移动速度快慢的?
用速度来描述:单位时间内物体移动的距离的大小
v =
△s
△t
小组讨论
对于一个化学反应: mA +nB=pC +qD,可以用单位时间内某物质浓度(或质量、物质的量等)的改变量来表示该物质的化学反应速率。
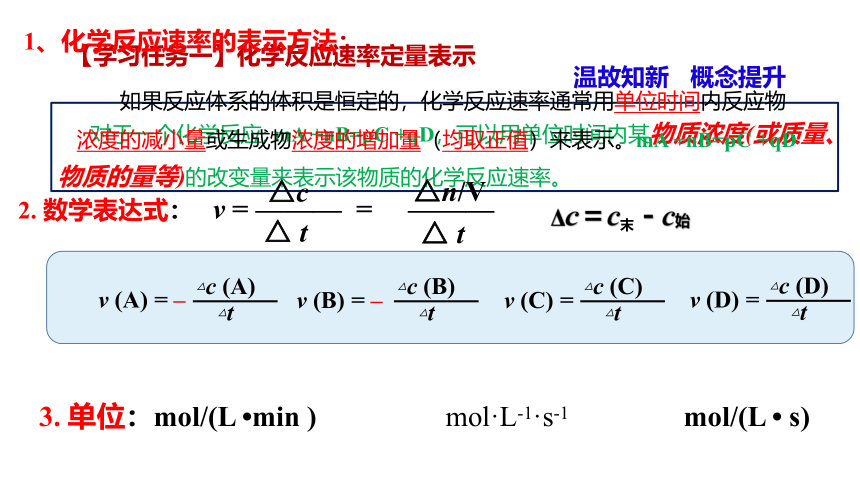
【学习任务一】化学反应速率定量表示
温故知新 概念提升
1、化学反应速率的表示方法:
如果反应体系的体积是恒定的,化学反应速率通常用单位时间内反应物浓度的减小量或生成物浓度的增加量(均取正值)来表示。mA +nB=pC +qD
△c
2. 数学表达式: v = ——— = ———
△ t
△n/V
△ t
3. 单位:mol/(L min ) mol·L-1·s-1 mol/(L s)
Δc=c末-c始
v (A) = –
△c (A)
△t
v (B) = –
△c (B)
△t
v (C) =
△c (C)
△t
v (D) =
△c (D)
△t
例题1:
在密闭容器中发生反应: N2 + 3H2 2NH3,反应开始时N2的浓度为0.8mol/L,5min后N2的浓度变为0.7 mol/L。求这5min内N2的反应速率。
= 0.02mol · (L · min)-1
v (N2) = –
△c (N2)
△t
= –
(0.7 – 0.8 ) mol · L -1
5min
思考:计算所得速率数值是平均速率还是瞬时速率?该表达式能否表示固体或纯液体的化学反应速率。
计算所得速率数值是平均速率。固体或纯液体物质的量浓度是一个常数,所以该表达式不能表示固体或纯液体的化学反应速率。
1.判断正误(正确的打“√”,错误的打“x”)。
(1)化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1( )
(2)由v计算平均速率,用反应物表示为正值,用生成物表示为负值。( )
(3)根据化学反应速率的大小可以推知化学反应进行的快慢( )
(4)对于化学反应来说,反应速率越大,反应现象就越明显( )
(5)有时也可以用单位时间内生成某物质质量的变化量来表示化学反应速率。( )
√
×
×
√
×
随堂练习
例题2:
在密闭容器中发生反应: N2 + 3H2 2NH3,反应开始时N2的浓度为0.6mol/L,5min后N2的浓度变为0.5 mol/L。求这5min内N2的反应速率。
= 0.02mol · (L · min)-1
v (N2) = –
△c (N2)
△t
= –
(0.5 – 0.6 ) mol · L -1
5min
思考: 如何计算这5min内H2、NH3的反应速率?
“三段式”法计算模板
计算中注意以下量的关系
①对反应物:c(起始)-c(转化)=c(某时刻)
②对生成物:c(起始)+c(转化)=c(某时刻)
③转化率 =
A的转化率=
B的转化率=
化学反应速率的计算
例:在2L密闭容器中加入1molN2 和3molH2发生反应
N2 + 3H2 2NH3 ,2s末时测得容器中含有0.4 moNH3, 求该反应的化学反应速率。
催化剂
高温、高压
1.三段式的应用
N2 + 3H2 2NH3
催化剂
高温、高压
C起始 0.5 1.5 0
ΔC
C2s末
0.2
0.2
0.1
0.3
0.4 1.2
等于系数比
υ(N2)=
Δc(N2)
Δt
=
0.1 mol/L
2 s
= 0.05 mol/(L.min)
υ(NH3)=
Δc(NH3)
Δt
=
0.2 mol/L
2 s
= 0.10 mol/(L.min)
υ(H2)=
Δc(H2)
Δt
=
0.3 mol/L
2 s
= 0.15 mol/(L.min)
速率之比等于方程式前的系数比
υ(A)︰υ(B)︰υ(C)︰υ(D) = m︰n︰p︰q
也可表达为
m
n
υ(A)
υ(B)
=
υ(B)
n
υ(A)
m
=
同一化学反应 m A + n B p C + q D
υ(A)
m
υ(B)
n
υ(C)
p
υ(D)
q
=
=
=
化学反应速率的计算
例:反应 A(g) + 3B(g) = 2C(g) + 2D (g) 在四种不同情况下的反应速率为:①v(A)=0.15mol·L-1·s-1 ②v(B)=0.6mol·L-1·s-1
③v(C)=0.4mol·L-1·s-1 ④v(D)=0.45mol·L-1·s-1
则该反应在不同条件下速率的快慢顺序为:
化学反应速率的计算
④>③=②>①
②v(B)=0.6mol·L-1·s-1
③v(C)=0.4mol·L-1·s-1
④v(D)=0.45mol·L-1·s-1
v(A)=0.2mol·L-1·s-1
v(A)=0.2mol·L-1·s-1
v(A)=0.225mol·L-1·s-1
v(A)
1
①
=0.15mol·L-1·s-1
v(B)
3
②
=0.2mol·L-1·s-1
v(C)
2
③
=0.2mol·L-1·s-1
v(D)
2
④
=0.225mol·L-1·s-1
①v(A)=0.15mol·L-1·s-1
方法二:比值法
方法一:归一法
2.比较化学反应速率的快慢
注意:换算成同一物质、同一
单位表示,再比较数值的大小
化学反应速率的计算
选择可观测、
易操作的变量
pH计
气体
离子浓度
电导率
pH
颜色
浑浊度
颜色
体积
压强
υ=
Δc
Δt
实验原理
找与该物理量化学变化对应的时间
化学反应速率的测定
找与化学反应物质的浓度相关的物理量
浊度仪
高锰酸钾溶液与草酸反应,记录溶液褪色的时间
离子浓度检测仪
例:在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。测定0 ~ 6 min内的化学反应速率。
2H2O2 2H2O + O2↑
催化剂
υ(O2)
υ(H2O2)
测量
化学反应速率的测定
选择可观测、易操作的变量
浓度变化容易测量吗?我们有没有测量浓度的仪器呢?
如果没有,那么我们可以测哪些物理量呢?
化学反应速率的测定
(3)视线与量气管凹液面最低处相平
气体体积的测定
(2)调节量气管高度,使量气管与水准管两端液面相平
(1)恢复到室温状态
读数时注意:
用实验法比较化学反应速率大小
思考:采用如图所示实验装置测定锌与稀硫酸反应的速率。(1)检查该装置气密性的操作方法是:
(2)同学们在实验操作中发现本实验设计存在明显不足,例如:
(3)如何改进?
关闭分液温斗活塞,向外拉注射器的活塞,若活塞能回到原位,则气密性良好。
漏斗中稀硫酸滴入锥形瓶中,即使不生成气体,也会将瓶中的空气排出,使所测气体的体积偏大
导管作用:①使分液温斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时液体能顺利滴下。
②滴入锥形瓶的液体体积等于进入分液漏斗的气体体积,从而消除由于加入液体引起的氢气体积误差。
t/min 0 2 4 6 8 10
V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9
在一定温度下,10 mL 0.40 mol/L H2O2 溶液发生催化分解,不同时刻测得生成的 O2 的体积(已折算为标准状况)如下表(溶液体积变化忽略不计)。求0~6 min时段的化学反应速率。
化学反应速率的测定
0~6 min:
Δn(O2)=
0.0224 L
22.4 L/mol
= 1.0×10-3 mol
Vm
Δ V(O2)
=
2H2O2 2H2O + O2↑
催化剂
1.0×10-3
n /(mol)
2.0×10-3
≈ 3.3×10-2 mol/(L·min)
υ(H2O2)= =
Δc(H2O2)
Δt
=
0.01L×6 min
2.0×10-3 mol
Δn(H2O2)
V ·Δt
定性描述:化学反应特征现象出现的快、慢
定量描述:
实验测定:控制单一变量,找与浓度相关
可测量、易操作变量
化学反应速率
小结:如何表征化学反应速率
Δc
Δt
υ =
Δn
VΔt
=
达标检测
1.反应4A(s)+3B(g) == 2C(g)+D(g),经2 min,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )A.用A表示的反应速率是0.4 mol·L-1·min-1B.用B表示的反应速率是0.3 mol·L-1·min-1C.2 min末时的反应速率用B表示是0.3 mol·L-1·min-1D.在这2 min内用B表示的反应速率的值是减小的,用C表示的反应速率的值逐渐增大
B
达标检测
2、在2A(g)+B(g)==3C(g)+4D(s)反应中,表示该反应速率最快的数据是( )
A. v(A) =0.05mol/(L s) B. v(B)=0.03mol/(L s)
C. v(C) =3.6mol/(L min) D. v(D) =0.16mol/(L s)
B
3、将4molA气体和2molB气体置于2L的密闭容器中,混合后发生如下反应:
2A(g) + B(g) =2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法
正确的是( )
A.用物质A表示的反应速率为0.6mol/(L·s)
B.用物质B表示的反应速率为0.3mol/(L·s)
C.2s时物质A的转化率为30%
D.2s时物质B的浓度为0.3mol/L
C
第二章 化学反应速率和化学平衡
2019人教版选择性必修一
第一节 化学反应速率
在化学实验和日常生活中,我们经常观察到这样的现象:有的反应进行的快,有的进行的慢。
【思考与讨论】
很快
较快
较慢
很慢
思考:如何科学衡量化学反应速率的快慢?
新问题
那么化学上又是如何定量地判断一个化学反应的快慢的呢?
学科链接
在物理中我们是如何定量地判断一个物体移动速度快慢的?
用速度来描述:单位时间内物体移动的距离的大小
v =
△s
△t
小组讨论
对于一个化学反应: mA +nB=pC +qD,可以用单位时间内某物质浓度(或质量、物质的量等)的改变量来表示该物质的化学反应速率。
【学习任务一】化学反应速率定量表示
温故知新 概念提升
1、化学反应速率的表示方法:
如果反应体系的体积是恒定的,化学反应速率通常用单位时间内反应物浓度的减小量或生成物浓度的增加量(均取正值)来表示。mA +nB=pC +qD
△c
2. 数学表达式: v = ——— = ———
△ t
△n/V
△ t
3. 单位:mol/(L min ) mol·L-1·s-1 mol/(L s)
Δc=c末-c始
v (A) = –
△c (A)
△t
v (B) = –
△c (B)
△t
v (C) =
△c (C)
△t
v (D) =
△c (D)
△t
例题1:
在密闭容器中发生反应: N2 + 3H2 2NH3,反应开始时N2的浓度为0.8mol/L,5min后N2的浓度变为0.7 mol/L。求这5min内N2的反应速率。
= 0.02mol · (L · min)-1
v (N2) = –
△c (N2)
△t
= –
(0.7 – 0.8 ) mol · L -1
5min
思考:计算所得速率数值是平均速率还是瞬时速率?该表达式能否表示固体或纯液体的化学反应速率。
计算所得速率数值是平均速率。固体或纯液体物质的量浓度是一个常数,所以该表达式不能表示固体或纯液体的化学反应速率。
1.判断正误(正确的打“√”,错误的打“x”)。
(1)化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1( )
(2)由v计算平均速率,用反应物表示为正值,用生成物表示为负值。( )
(3)根据化学反应速率的大小可以推知化学反应进行的快慢( )
(4)对于化学反应来说,反应速率越大,反应现象就越明显( )
(5)有时也可以用单位时间内生成某物质质量的变化量来表示化学反应速率。( )
√
×
×
√
×
随堂练习
例题2:
在密闭容器中发生反应: N2 + 3H2 2NH3,反应开始时N2的浓度为0.6mol/L,5min后N2的浓度变为0.5 mol/L。求这5min内N2的反应速率。
= 0.02mol · (L · min)-1
v (N2) = –
△c (N2)
△t
= –
(0.5 – 0.6 ) mol · L -1
5min
思考: 如何计算这5min内H2、NH3的反应速率?
“三段式”法计算模板
计算中注意以下量的关系
①对反应物:c(起始)-c(转化)=c(某时刻)
②对生成物:c(起始)+c(转化)=c(某时刻)
③转化率 =
A的转化率=
B的转化率=
化学反应速率的计算
例:在2L密闭容器中加入1molN2 和3molH2发生反应
N2 + 3H2 2NH3 ,2s末时测得容器中含有0.4 moNH3, 求该反应的化学反应速率。
催化剂
高温、高压
1.三段式的应用
N2 + 3H2 2NH3
催化剂
高温、高压
C起始 0.5 1.5 0
ΔC
C2s末
0.2
0.2
0.1
0.3
0.4 1.2
等于系数比
υ(N2)=
Δc(N2)
Δt
=
0.1 mol/L
2 s
= 0.05 mol/(L.min)
υ(NH3)=
Δc(NH3)
Δt
=
0.2 mol/L
2 s
= 0.10 mol/(L.min)
υ(H2)=
Δc(H2)
Δt
=
0.3 mol/L
2 s
= 0.15 mol/(L.min)
速率之比等于方程式前的系数比
υ(A)︰υ(B)︰υ(C)︰υ(D) = m︰n︰p︰q
也可表达为
m
n
υ(A)
υ(B)
=
υ(B)
n
υ(A)
m
=
同一化学反应 m A + n B p C + q D
υ(A)
m
υ(B)
n
υ(C)
p
υ(D)
q
=
=
=
化学反应速率的计算
例:反应 A(g) + 3B(g) = 2C(g) + 2D (g) 在四种不同情况下的反应速率为:①v(A)=0.15mol·L-1·s-1 ②v(B)=0.6mol·L-1·s-1
③v(C)=0.4mol·L-1·s-1 ④v(D)=0.45mol·L-1·s-1
则该反应在不同条件下速率的快慢顺序为:
化学反应速率的计算
④>③=②>①
②v(B)=0.6mol·L-1·s-1
③v(C)=0.4mol·L-1·s-1
④v(D)=0.45mol·L-1·s-1
v(A)=0.2mol·L-1·s-1
v(A)=0.2mol·L-1·s-1
v(A)=0.225mol·L-1·s-1
v(A)
1
①
=0.15mol·L-1·s-1
v(B)
3
②
=0.2mol·L-1·s-1
v(C)
2
③
=0.2mol·L-1·s-1
v(D)
2
④
=0.225mol·L-1·s-1
①v(A)=0.15mol·L-1·s-1
方法二:比值法
方法一:归一法
2.比较化学反应速率的快慢
注意:换算成同一物质、同一
单位表示,再比较数值的大小
化学反应速率的计算
选择可观测、
易操作的变量
pH计
气体
离子浓度
电导率
pH
颜色
浑浊度
颜色
体积
压强
υ=
Δc
Δt
实验原理
找与该物理量化学变化对应的时间
化学反应速率的测定
找与化学反应物质的浓度相关的物理量
浊度仪
高锰酸钾溶液与草酸反应,记录溶液褪色的时间
离子浓度检测仪
例:在一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。测定0 ~ 6 min内的化学反应速率。
2H2O2 2H2O + O2↑
催化剂
υ(O2)
υ(H2O2)
测量
化学反应速率的测定
选择可观测、易操作的变量
浓度变化容易测量吗?我们有没有测量浓度的仪器呢?
如果没有,那么我们可以测哪些物理量呢?
化学反应速率的测定
(3)视线与量气管凹液面最低处相平
气体体积的测定
(2)调节量气管高度,使量气管与水准管两端液面相平
(1)恢复到室温状态
读数时注意:
用实验法比较化学反应速率大小
思考:采用如图所示实验装置测定锌与稀硫酸反应的速率。(1)检查该装置气密性的操作方法是:
(2)同学们在实验操作中发现本实验设计存在明显不足,例如:
(3)如何改进?
关闭分液温斗活塞,向外拉注射器的活塞,若活塞能回到原位,则气密性良好。
漏斗中稀硫酸滴入锥形瓶中,即使不生成气体,也会将瓶中的空气排出,使所测气体的体积偏大
导管作用:①使分液温斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时液体能顺利滴下。
②滴入锥形瓶的液体体积等于进入分液漏斗的气体体积,从而消除由于加入液体引起的氢气体积误差。
t/min 0 2 4 6 8 10
V(O2)/mL 0.0 9.9 17.2 22.4 26.5 29.9
在一定温度下,10 mL 0.40 mol/L H2O2 溶液发生催化分解,不同时刻测得生成的 O2 的体积(已折算为标准状况)如下表(溶液体积变化忽略不计)。求0~6 min时段的化学反应速率。
化学反应速率的测定
0~6 min:
Δn(O2)=
0.0224 L
22.4 L/mol
= 1.0×10-3 mol
Vm
Δ V(O2)
=
2H2O2 2H2O + O2↑
催化剂
1.0×10-3
n /(mol)
2.0×10-3
≈ 3.3×10-2 mol/(L·min)
υ(H2O2)= =
Δc(H2O2)
Δt
=
0.01L×6 min
2.0×10-3 mol
Δn(H2O2)
V ·Δt
定性描述:化学反应特征现象出现的快、慢
定量描述:
实验测定:控制单一变量,找与浓度相关
可测量、易操作变量
化学反应速率
小结:如何表征化学反应速率
Δc
Δt
υ =
Δn
VΔt
=
达标检测
1.反应4A(s)+3B(g) == 2C(g)+D(g),经2 min,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )A.用A表示的反应速率是0.4 mol·L-1·min-1B.用B表示的反应速率是0.3 mol·L-1·min-1C.2 min末时的反应速率用B表示是0.3 mol·L-1·min-1D.在这2 min内用B表示的反应速率的值是减小的,用C表示的反应速率的值逐渐增大
B
达标检测
2、在2A(g)+B(g)==3C(g)+4D(s)反应中,表示该反应速率最快的数据是( )
A. v(A) =0.05mol/(L s) B. v(B)=0.03mol/(L s)
C. v(C) =3.6mol/(L min) D. v(D) =0.16mol/(L s)
B
3、将4molA气体和2molB气体置于2L的密闭容器中,混合后发生如下反应:
2A(g) + B(g) =2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法
正确的是( )
A.用物质A表示的反应速率为0.6mol/(L·s)
B.用物质B表示的反应速率为0.3mol/(L·s)
C.2s时物质A的转化率为30%
D.2s时物质B的浓度为0.3mol/L
C
