11-12版高中化学全程学习方略配套课件:3.1.2金属与酸和水的反应 铝与氢氧化钠溶液的反应(人教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:3.1.2金属与酸和水的反应 铝与氢氧化钠溶液的反应(人教版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 00:00:00 | ||
图片预览








文档简介
(共76张PPT)
【典例1】(2011·蚌埠高一检测)将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是
A.盐酸 B.饱和氢氧化钠溶液
C.FeCl3溶液 D.CuSO4溶液
【思路点拨】解答该题要注意以下三点:
【自主解答】选A。钠与水溶液反应均放出氢气;
A项,发生反应为2Na+2HCl====2NaCl+H2↑,只有气体无沉淀;
B项,NaOH溶液是饱和溶液,投入钠后,消耗水,析出氢氧化钠晶体;
C项,钠与水反应生成的氢氧化钠还能进一步与FeCl3反应产生氢氧化铁沉淀;
D项,钠与水反应生成的氢氧化钠还能进一步与CuSO4反应产生氢氧化铜沉淀。
【互动探究】(1)若忽略温度的变化,该题B项Na+的
浓度如何变化?
提示:不变,因为析出氢氧化钠后溶液仍为原温度下的饱
和溶液,故氢氧化钠的浓度不变化,Na+的浓度也不变化。
(2)钠投入到硫酸铜溶液中时溶液的质量如何变化?
提示:Na与CuSO4溶液的反应:2Na+2H2O====2NaOH+H2↑,2NaOH+CuSO4====Cu(OH)2↓+Na2SO4,因此每有
2 mol Na(即46 g)反应,就有1 mol H2(即2 g)放出和
1 mol Cu(OH)2(即98 g)析出,故溶液的质量减轻。
【变式训练】将一小块金属钠投入盛有5 mL饱和澄清石灰水的试管中,不可能观察到的现象是( )
A.有气体产生
B.有沉淀产生
C.有银白色金属产生
D.金属钠熔化成闪亮的小球在液面上游动
【解析】选C。钠投入碱溶液中实质是钠与水的反应,故A、D所述现象可以观察到,不可能置换出钙,C不能观察到;钠与水反应,消耗了饱和澄清石灰水中的水,所以有部分氢氧化钙结晶析出,B所述现象可以观察到。
【典例2】(2011·西城高一检测)等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5∶7,则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
【思路点拨】解答该题可按以下三步分析:
【自主解答】选B。因为等量的铝分别与足量的盐酸和氢氧
化钠溶液反应,产生H2的体积比为1∶1,足量的铝分别与
等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,产
生H2的体积比为1∶3,而今产生H2的体积比:
所以反应的情况为:铝过量,盐酸不足;铝不足,氢氧化
钠过量。
【互动探究】该题目中若甲、乙两烧杯中产生的H2的体积均为22.4 L(换算为标准状况),则:
(1)两个烧杯中Al均不足还是均足量?
(2)铝的质量为多少?
提示:(1)因为铝分别与盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶1,所以此时酸、碱均足量,铝均不足或铝与盐酸恰好反应,氢氧化钠溶液过量。
(2)因为铝与酸、碱反应时,量的关系均为2 mol Al~
3 mol H2,所以铝的质量为22.4 L÷22.4 L/mol×2÷3×
27g/mol=18 g。
【变式训练】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的盐酸和NaOH物质的量之比为( )
A.1∶1 B.2∶1 C.3∶1 D.1∶3
【解析】选C。根据铝与盐酸以及铝与NaOH溶液反应的化学方程式:2Al+6HCl====2AlCl3+3H2↑,
6 mol 3 mol
2Al+2NaOH+2H2O====2NaAlO2+3H2↑
2 mol 3 mol
可直接得到答案:n(HCl)∶n(NaOH)=3∶1。
【典例】下列各项正确的是
A.钠与水反应的离子方程式:
Na+H2O====Na++OH-+H2↑
B.铁与水蒸气的反应的化学方程式:
3Fe+4H2O(g) Fe3O4+4H2
C.镁、铝与沸水也不可能反应
D.钠和硫酸铜溶液反应的离子方程式:
2Na+Cu2+====2Na++Cu
高温
====
【思路点拨】解答本题要注意以下三点:
【自主解答】选B。钠与水反应的离子反应:2Na+2H2O====
2Na++2OH-+H2↑,A错误;铁在高温下与水蒸气的反应:
3Fe+4H2O(g) Fe3O4+4H2,B正确;镁可以与热水反应,
铝可以与沸水反应,C错误;钠先与水反应,生成的氢氧化
钠和硫酸铜发生复分解反应,离子方程式:2Na+2H2O+Cu2+====
Cu(OH)2↓+H2↑+2Na+,D错误。
高温
====
【互动探究】(1)在反应2Na+2H2O====2NaOH+H2↑中,水
作氧化剂还是还原剂?在金属与水的反应中金属作氧化剂
还是还原剂?
(2)反应3Fe+4H2O(g) Fe3O4+4H2与反应Fe3O4+4H2
3Fe+4H2O矛盾吗?
提示:(1)在反应2Na+2H2O====2NaOH+H2↑中,水作氧
化剂,在金属与水的反应中均是金属失去电子,金属作
还原剂。
(2)这两个反应不矛盾,因为这两个反应发生的条件不同。
高温
====
△
====
【变式训练】钾(K)与钠(Na)在性质上有很大的相似性,但钾比钠更活泼,下列说法不正确的是( )
A.钾应密闭保存
B.钾与水能发生反应,但是不如钠与水的反应剧烈
C.钾与水能剧烈反应
D.钾与氧气的反应产物不止一种
【解析】选B。钠能与空气中的氧气、水等发生反应,故钠应密闭保存,而钾比钠更活泼,所以钾也应密闭保存,A正确;因为钾比钠更活泼,所以钾与水能发生反应,并且比钠与水的反应更剧烈,钠与氧气反应能生成氧化钠、过氧化钠,则钾与氧气的反应产物也很复杂,B错误,C、D正确。
【典例】把0.46克钠放入滴有酚酞的蒸馏水中:
(1)请说明实验现象并解释现象的原因
( ) _______________________________
( ) _______________________________
( ) _______________________________
( ) _______________________________
( ) _______________________________
(2)写出反应的化学方程式______________;
离子方程式__________________。
(3)如何证明反应中生成的气体?_______________。
(4)向反应后的溶液中加入足量的Al片,开始________(填“是”或“否”)有气体产生,写出反应的离子方程式
______________________________________,
产生的气体体积(标准状况下)最多为______,此时反应掉的Al为 ____________mol。
【错因剖析】
【标准答案】(1)浮 钠的密度比水的密度小
熔 反应放热,而且钠的熔点低
游 反应时有气体生成
响 反应剧烈
红 生成显碱性的物质
(2)2Na+2H2O====2NaOH+H2↑
2Na+2H2O====2Na++2OH-+H2↑
(3)收集一小试管反应中生成的气体,点燃,发出轻微的爆鸣声,证明该气体是H2
(4)是 2Al+2OH-+2H2O====2AlO2-+3H2↑
0.672 L 0.02
1.钠与水反应时的现象与钠的下列性质无关的是( )
A.钠熔点低 B.钠的密度小
C.钠的硬度小 D.有强还原性
【解析】选C。钠与水反应时浮在水面上(说明钠的密度小),熔化成闪亮的小球(说明反应放热,钠熔点低),剧烈反应(说明钠有强还原性,较活泼)。故选C。
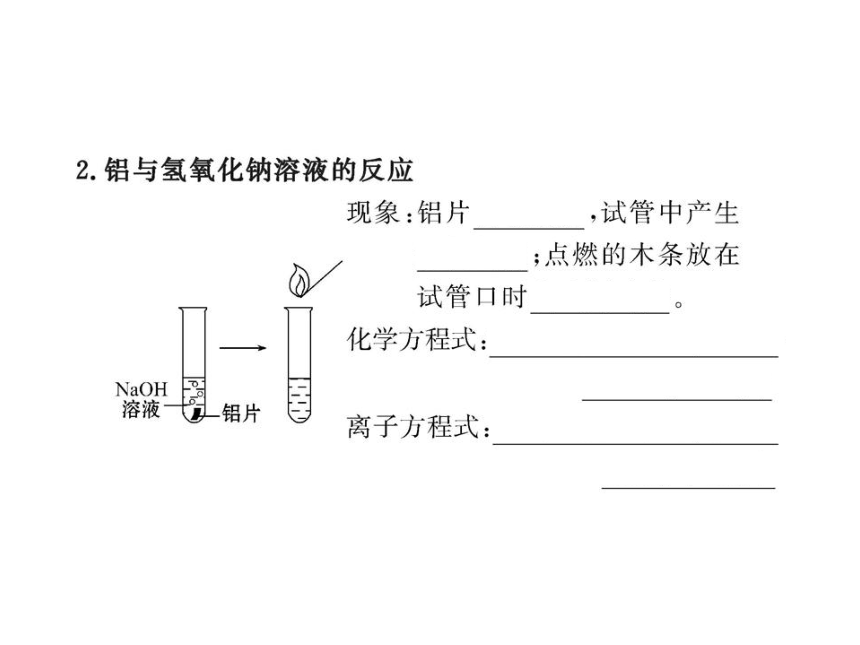
2.对于铝和烧碱溶液的反应,下列说法不正确的是( )
A.铝是还原剂
B.该反应是氧化还原反应
C.该反应说明所有金属都能与碱反应
D.铝与碱或酸反应均能产生氢气
【解析】选C。2Al+2NaOH+2H2O====2NaAlO2+3H2↑,该反应是氧化还原反应,其中还原剂为Al;铝能与氢氧化钠溶液反应生成偏铝酸钠和氢气,这是铝的特性,而不是金属的共性;铝与碱或酸反应均能产生氢气。故选C。
3.把下列金属投入0.1 mol/L盐酸中,能发生反应且反应最剧烈的是( )
A.Cu B.Fe C.Mg D.Al
【解析】选C。金属越活泼,与等浓度的盐酸反应时反应越剧烈,故选C。
4.下列说法正确的是( )
A.钠在溶液中可置换出铁
B.铁在溶液中可置换出铜
C.Fe不与H2O反应
D.Fe比Al活泼
【解析】选B。钠在铁盐溶液中先与H2O发生反应2Na+2H2O
====2NaOH+H2↑,NaOH再与铁盐发生复分解反应,故不能置换出铁;铁可置换出铜盐溶液中的铜,如:Fe+CuSO4
====FeSO4+Cu;Fe在高温下可以与H2O(g)发生反应而生成Fe3O4和H2;在金属活动性顺序表中Al排在Fe的前面,故Al比Fe活泼。
5.在进行钠和水的反应实验中,有如下操作和实验现象,回答下列各问题。
(1)新切开的金属钠表面呈________色,在空气中放置几分钟后会_________。
(2)金属钠块投入水中后,观察到___________(说明反应放热),并______________(说明钠的密度小)。
(3)钠小球在水面上迅速游动,发出“嘶嘶”的声响,说明反应有___________生成。
(4)如果水中事先已滴入酚酞试剂,反应后溶液由无色变为______________色,说明反应生成了_____________。
【解析】(1)刚用小刀切开的金属钠断面呈银白色,并很快变暗,这是因为钠与氧气反应,在钠的表面生成了一薄层氧化物所致。
(2)钠的密度比水小,浮在水面上,与水反应,放热,使钠熔化形成银白色小球。
(3)钠与水反应放出氢气,推动钠球在水面上运动。
(4)钠与水反应生成NaOH,使酚酞变红。
答案:(1)银白 变暗
(2)钠熔化成闪亮的小球 浮在水面上
(3)气体
(4)红 氢氧化钠
一、选择题(本题包括5小题,每小题4分,共20分)
1.(2011·渭南高一检测)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一块绿豆大小的金属钠,可能观察到的现象符合下图中的( )
【解析】选A。钠比煤油的密度大,比水的密度小,再结合钠与水的反应情况,可知A项正确。
2.下列物质中不能与NaOH溶液反应的是( )
A.Na B.Fe C.Al D.CuSO4
【解析】选B。金属钠与NaOH溶液中的水反应生成氢气和氢氧化钠,氢氧化钠与铝反应生成氢气和偏铝酸钠,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,铁与氢氧化钠溶液不反应。
3.下列关于钠的说法正确的是( )
A.钠是活泼的非金属
B.钠与水反应放出氧气
C.钠与水反应放出氢气
D.钠不与盐酸反应
【解析】选C。钠是活泼金属,A错误;钠与水反应生成氢氧化钠和氢气,B错误、C正确;钠与盐酸反应生成氯化钠和氢气,D错误。
4.下列反应的离子方程式书写错误的是( )
A.钠和冷水反应:Na+2H2O Na++2OH-+H2↑
B.锌溶于稀硫酸:Zn+2H+ Zn2++H2↑
C.铝溶于氢氧化钠溶液中:
2Al+2OH-+2H2O 2AlO2-+3H2↑
D.铁跟稀硫酸反应:Fe+2H+ Fe2++H2↑
【解析】选A。钠和冷水反应的离子方程式为
2Na+2H2O 2Na++2OH-+H2↑;B、C、D三项离子方程式
原子守恒、电荷守恒,符合实际情况。
====
====
====
====
====
5.将钠、镁、铝各0.3 mol分别放入100 mL 1 mol/L 的盐
酸中,同温同压下产生的气体体积比是( )
A.1∶2∶3
B.6∶3∶2
C.3∶1∶1
D.1∶1∶1
【解析】选C。由2Na+2H+ 2Na++H2↑及
2Na+2H2O 2Na++2OH-+H2↑;Mg+2H+ Mg2++H2↑;2Al+6H+ 2Al3++3H2↑可知,盐酸完全反应,Mg、Al有剩
余,生成0.05 mol H2,但Na因与水反应也可产生H2,其全部
反应共放出0.15 mol H2。
====
====
====
====
【方法技巧】金属与非氧化性酸反应的有关规律
金属与非氧化性酸反应的实质是金属与酸电离出的H+反应
生成H2的过程,反应生成的H2的量取决于金属与酸的相对多
少,但是,若金属还能与水反应,如钠,产生的H2的量取
决于金属(钠)的多少。(以钠、镁、铝与酸的反应为例)
钠、镁、铝与产生氢气的物质的量的关系式:
1mol Na~ mol H2 1mol Mg~1mol H2
1mol Al~ mol H2
(1)酸足量时
①等物质的量的钠、镁、铝与足量酸反应时,产生H2的物质的量之比为1∶2∶3。
②等质量的钠、镁、铝与足量酸反应时,产生H2的物质的量之比为 ∶ ∶
(2)酸不足时
过量的金属与等量的酸反应时,钠产生氢气的量较多,镁、铝产生的氢气的量相等。
二、非选择题(本题包括3小题,共30分)
6. (8分)某无色透明溶液与铝反应放出氢气,该溶液中可能含有大量的H+、K+、Mg2+、Cl-、OH-、CO32-等离子,试推断:
第一种情况:一定有H+和 ,可能有 。
第二种情况:一定有OH-和 ,可能有 。
【解析】与铝反应放出氢气的溶液可能为酸性溶液也可能为强碱性溶液,若为酸性溶液(含H+),则阴离子不可能有OH-、CO32-,只能有Cl-,阳离子还可能有K+、Mg2+;若为强碱性溶液(含OH-),则阳离子不能有H+、Mg2+,只能有K+,阴离子还可能有Cl-、 CO32- 。
答案:Cl- K+、Mg2+ K+ Cl-、CO32-
7.(10分)
用如图所示的方法研究钠与水反应的性质,A表示带孔铝箔包住的一小块钠,回答下列各问题。
(1)假如在实验刚开始以后就将镊子松开并拿出水面,“A”表现出的现象是 。
(2)根据预测,钠跟水反应生成氢氧化钠和氢气,该反应的离子方程式是 ,可用一种酸碱指示剂证明反应生成了氢氧化钠,这种酸碱指示剂是 。
(3)若实验中金属钠为0.1 mol,则收集到的气体为 。
A.O2和H2的混合气体
B.0.05 mol的H2
C.大于0.05 mol的H2
D.小于0.05 mol的H2
【解析】(1)因为钠比水的密度小,且反应非常剧烈,同时
产生氢气,所以看到“A”浮上水面并上下跳动。
(2)钠跟水反应生成氢氧化钠和氢气,反应的离子方程式是
2Na+2H2O 2Na++2OH-+H2↑,检验氢氧化钠用酚酞试
剂,现象为溶液变红。
(3)0.1 mol金属钠与水反应生成氢气0.05 mol,生成氢氧
化钠0.1 mol,氢氧化钠与铝反应生成氢气和偏铝酸钠,所
以收集到的气体为大于0.05 mol的H2。
====
答案:(1)“A”浮在水面上并四处游动
(2)2Na+2H2O====2Na++2OH-+H2↑ 酚酞试剂
(3)C
8.(12分)(挑战能力)某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题。
(1)A装置的作用是 ,B中反应的化学方程式为 _____________________________________________。
(2)D的作用是 。
(3)E中的现象是黑色固体变为 ,硬质玻璃管右端有生成 。
(4)A、B两个装置中应先点燃 处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是 。
【解析】(1)B中进行的反应是3Fe+4H2O(g) Fe3O4+4H2,
故A为提供水蒸气的装置。(2)D的作用是除去未反应的水蒸
气,干燥H2。 (3)E中反应为H2+CuO Cu+H2O,故黑色粉
末变红,同时硬质玻璃管右端会有水珠生成。(4)应先点A
处,若先点燃B处,B中的Fe会与空气中O2反应生成Fe2O3,点
燃E处酒精灯前要收集H2,检验纯度。
高温
====
△
====
答案:(1)产生水蒸气
3Fe+4H2O(g) Fe3O4+4H2
(2)吸收未反应的水蒸气
(3)红色 水珠
(4)A 收集H2,并检验其纯度
高温
====
为探究金属与盐发生反应的规律,某化学实验小组在老师的指导下设计了如下实验方案。
【思考探究】
(1)比较A、C两组实验你能比较出三种金属的活泼性吗?还能得出什么规律?
提示:从A、C两组实验可以看出,铁比铜活泼,铜比银活泼,也就是说,活泼性顺序为铁>铜>银。活泼性较强的金属能够把活泼性较弱的金属从其盐溶液中置换出来。
(2)比较D、F两组实验你能比较银、铜、铁的活泼性吗?还能得出什么规律?
提示:从D、F两组实验可以看出,银没有铜活泼,铜没有铁活泼,也就是说,活泼性较弱的金属不能把活泼性较强的金属从其盐溶液中置换出来。
(3)B组实验说明什么?发生的化学反应有哪些?
提示:从B组实验可以看出,活泼性很强的金属钠与盐溶液反应不同于其他金属。因为它的活泼性很强,它与盐溶液反应时首先与溶液中的水反应,之后生成的碱再与盐溶液中的溶质反应生成沉淀和其他物质。发生反应的方程式为2Na+2H2O====2NaOH+H2↑,2NaOH+CuSO4====Cu(OH)2↓+Na2SO4。
(4)从E组实验你能得出金属与盐反应需在什么条件下进行吗?
提示:从E组实验可以看出,跟金属反应的盐必须是溶液,即金属与盐的反应是溶液中的离子反应。
【典例1】(2011·蚌埠高一检测)将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是
A.盐酸 B.饱和氢氧化钠溶液
C.FeCl3溶液 D.CuSO4溶液
【思路点拨】解答该题要注意以下三点:
【自主解答】选A。钠与水溶液反应均放出氢气;
A项,发生反应为2Na+2HCl====2NaCl+H2↑,只有气体无沉淀;
B项,NaOH溶液是饱和溶液,投入钠后,消耗水,析出氢氧化钠晶体;
C项,钠与水反应生成的氢氧化钠还能进一步与FeCl3反应产生氢氧化铁沉淀;
D项,钠与水反应生成的氢氧化钠还能进一步与CuSO4反应产生氢氧化铜沉淀。
【互动探究】(1)若忽略温度的变化,该题B项Na+的
浓度如何变化?
提示:不变,因为析出氢氧化钠后溶液仍为原温度下的饱
和溶液,故氢氧化钠的浓度不变化,Na+的浓度也不变化。
(2)钠投入到硫酸铜溶液中时溶液的质量如何变化?
提示:Na与CuSO4溶液的反应:2Na+2H2O====2NaOH+H2↑,2NaOH+CuSO4====Cu(OH)2↓+Na2SO4,因此每有
2 mol Na(即46 g)反应,就有1 mol H2(即2 g)放出和
1 mol Cu(OH)2(即98 g)析出,故溶液的质量减轻。
【变式训练】将一小块金属钠投入盛有5 mL饱和澄清石灰水的试管中,不可能观察到的现象是( )
A.有气体产生
B.有沉淀产生
C.有银白色金属产生
D.金属钠熔化成闪亮的小球在液面上游动
【解析】选C。钠投入碱溶液中实质是钠与水的反应,故A、D所述现象可以观察到,不可能置换出钙,C不能观察到;钠与水反应,消耗了饱和澄清石灰水中的水,所以有部分氢氧化钙结晶析出,B所述现象可以观察到。
【典例2】(2011·西城高一检测)等体积、等物质的量浓度的盐酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5∶7,则甲、乙两烧杯中的反应情况可能分别是
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
【思路点拨】解答该题可按以下三步分析:
【自主解答】选B。因为等量的铝分别与足量的盐酸和氢氧
化钠溶液反应,产生H2的体积比为1∶1,足量的铝分别与
等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,产
生H2的体积比为1∶3,而今产生H2的体积比:
所以反应的情况为:铝过量,盐酸不足;铝不足,氢氧化
钠过量。
【互动探究】该题目中若甲、乙两烧杯中产生的H2的体积均为22.4 L(换算为标准状况),则:
(1)两个烧杯中Al均不足还是均足量?
(2)铝的质量为多少?
提示:(1)因为铝分别与盐酸和氢氧化钠溶液反应,产生H2的体积比为1∶1,所以此时酸、碱均足量,铝均不足或铝与盐酸恰好反应,氢氧化钠溶液过量。
(2)因为铝与酸、碱反应时,量的关系均为2 mol Al~
3 mol H2,所以铝的质量为22.4 L÷22.4 L/mol×2÷3×
27g/mol=18 g。
【变式训练】铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的盐酸和NaOH物质的量之比为( )
A.1∶1 B.2∶1 C.3∶1 D.1∶3
【解析】选C。根据铝与盐酸以及铝与NaOH溶液反应的化学方程式:2Al+6HCl====2AlCl3+3H2↑,
6 mol 3 mol
2Al+2NaOH+2H2O====2NaAlO2+3H2↑
2 mol 3 mol
可直接得到答案:n(HCl)∶n(NaOH)=3∶1。
【典例】下列各项正确的是
A.钠与水反应的离子方程式:
Na+H2O====Na++OH-+H2↑
B.铁与水蒸气的反应的化学方程式:
3Fe+4H2O(g) Fe3O4+4H2
C.镁、铝与沸水也不可能反应
D.钠和硫酸铜溶液反应的离子方程式:
2Na+Cu2+====2Na++Cu
高温
====
【思路点拨】解答本题要注意以下三点:
【自主解答】选B。钠与水反应的离子反应:2Na+2H2O====
2Na++2OH-+H2↑,A错误;铁在高温下与水蒸气的反应:
3Fe+4H2O(g) Fe3O4+4H2,B正确;镁可以与热水反应,
铝可以与沸水反应,C错误;钠先与水反应,生成的氢氧化
钠和硫酸铜发生复分解反应,离子方程式:2Na+2H2O+Cu2+====
Cu(OH)2↓+H2↑+2Na+,D错误。
高温
====
【互动探究】(1)在反应2Na+2H2O====2NaOH+H2↑中,水
作氧化剂还是还原剂?在金属与水的反应中金属作氧化剂
还是还原剂?
(2)反应3Fe+4H2O(g) Fe3O4+4H2与反应Fe3O4+4H2
3Fe+4H2O矛盾吗?
提示:(1)在反应2Na+2H2O====2NaOH+H2↑中,水作氧
化剂,在金属与水的反应中均是金属失去电子,金属作
还原剂。
(2)这两个反应不矛盾,因为这两个反应发生的条件不同。
高温
====
△
====
【变式训练】钾(K)与钠(Na)在性质上有很大的相似性,但钾比钠更活泼,下列说法不正确的是( )
A.钾应密闭保存
B.钾与水能发生反应,但是不如钠与水的反应剧烈
C.钾与水能剧烈反应
D.钾与氧气的反应产物不止一种
【解析】选B。钠能与空气中的氧气、水等发生反应,故钠应密闭保存,而钾比钠更活泼,所以钾也应密闭保存,A正确;因为钾比钠更活泼,所以钾与水能发生反应,并且比钠与水的反应更剧烈,钠与氧气反应能生成氧化钠、过氧化钠,则钾与氧气的反应产物也很复杂,B错误,C、D正确。
【典例】把0.46克钠放入滴有酚酞的蒸馏水中:
(1)请说明实验现象并解释现象的原因
( ) _______________________________
( ) _______________________________
( ) _______________________________
( ) _______________________________
( ) _______________________________
(2)写出反应的化学方程式______________;
离子方程式__________________。
(3)如何证明反应中生成的气体?_______________。
(4)向反应后的溶液中加入足量的Al片,开始________(填“是”或“否”)有气体产生,写出反应的离子方程式
______________________________________,
产生的气体体积(标准状况下)最多为______,此时反应掉的Al为 ____________mol。
【错因剖析】
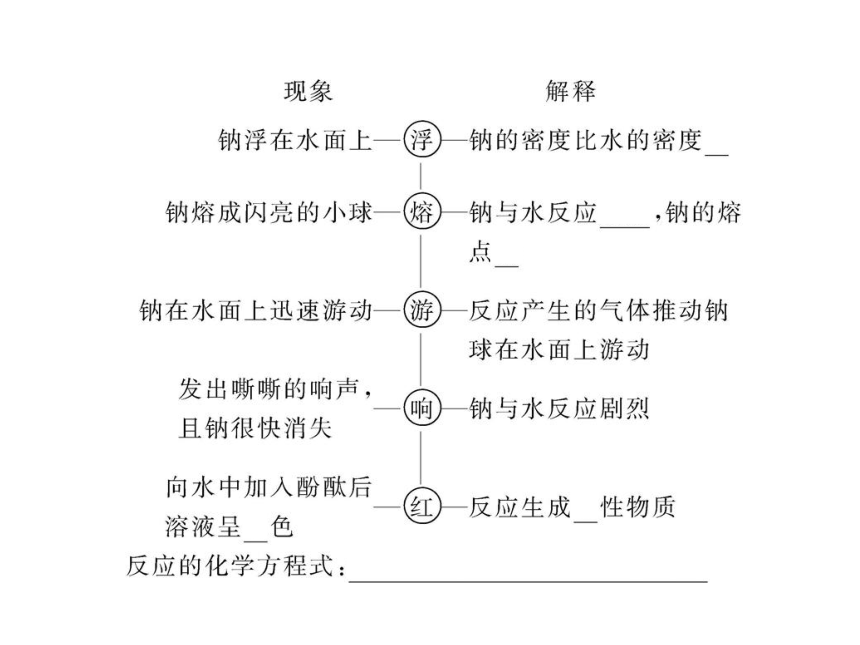
【标准答案】(1)浮 钠的密度比水的密度小
熔 反应放热,而且钠的熔点低
游 反应时有气体生成
响 反应剧烈
红 生成显碱性的物质
(2)2Na+2H2O====2NaOH+H2↑
2Na+2H2O====2Na++2OH-+H2↑
(3)收集一小试管反应中生成的气体,点燃,发出轻微的爆鸣声,证明该气体是H2
(4)是 2Al+2OH-+2H2O====2AlO2-+3H2↑
0.672 L 0.02
1.钠与水反应时的现象与钠的下列性质无关的是( )
A.钠熔点低 B.钠的密度小
C.钠的硬度小 D.有强还原性
【解析】选C。钠与水反应时浮在水面上(说明钠的密度小),熔化成闪亮的小球(说明反应放热,钠熔点低),剧烈反应(说明钠有强还原性,较活泼)。故选C。
2.对于铝和烧碱溶液的反应,下列说法不正确的是( )
A.铝是还原剂
B.该反应是氧化还原反应
C.该反应说明所有金属都能与碱反应
D.铝与碱或酸反应均能产生氢气
【解析】选C。2Al+2NaOH+2H2O====2NaAlO2+3H2↑,该反应是氧化还原反应,其中还原剂为Al;铝能与氢氧化钠溶液反应生成偏铝酸钠和氢气,这是铝的特性,而不是金属的共性;铝与碱或酸反应均能产生氢气。故选C。
3.把下列金属投入0.1 mol/L盐酸中,能发生反应且反应最剧烈的是( )
A.Cu B.Fe C.Mg D.Al
【解析】选C。金属越活泼,与等浓度的盐酸反应时反应越剧烈,故选C。
4.下列说法正确的是( )
A.钠在溶液中可置换出铁
B.铁在溶液中可置换出铜
C.Fe不与H2O反应
D.Fe比Al活泼
【解析】选B。钠在铁盐溶液中先与H2O发生反应2Na+2H2O
====2NaOH+H2↑,NaOH再与铁盐发生复分解反应,故不能置换出铁;铁可置换出铜盐溶液中的铜,如:Fe+CuSO4
====FeSO4+Cu;Fe在高温下可以与H2O(g)发生反应而生成Fe3O4和H2;在金属活动性顺序表中Al排在Fe的前面,故Al比Fe活泼。
5.在进行钠和水的反应实验中,有如下操作和实验现象,回答下列各问题。
(1)新切开的金属钠表面呈________色,在空气中放置几分钟后会_________。
(2)金属钠块投入水中后,观察到___________(说明反应放热),并______________(说明钠的密度小)。
(3)钠小球在水面上迅速游动,发出“嘶嘶”的声响,说明反应有___________生成。
(4)如果水中事先已滴入酚酞试剂,反应后溶液由无色变为______________色,说明反应生成了_____________。
【解析】(1)刚用小刀切开的金属钠断面呈银白色,并很快变暗,这是因为钠与氧气反应,在钠的表面生成了一薄层氧化物所致。
(2)钠的密度比水小,浮在水面上,与水反应,放热,使钠熔化形成银白色小球。
(3)钠与水反应放出氢气,推动钠球在水面上运动。
(4)钠与水反应生成NaOH,使酚酞变红。
答案:(1)银白 变暗
(2)钠熔化成闪亮的小球 浮在水面上
(3)气体
(4)红 氢氧化钠
一、选择题(本题包括5小题,每小题4分,共20分)
1.(2011·渭南高一检测)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一块绿豆大小的金属钠,可能观察到的现象符合下图中的( )
【解析】选A。钠比煤油的密度大,比水的密度小,再结合钠与水的反应情况,可知A项正确。
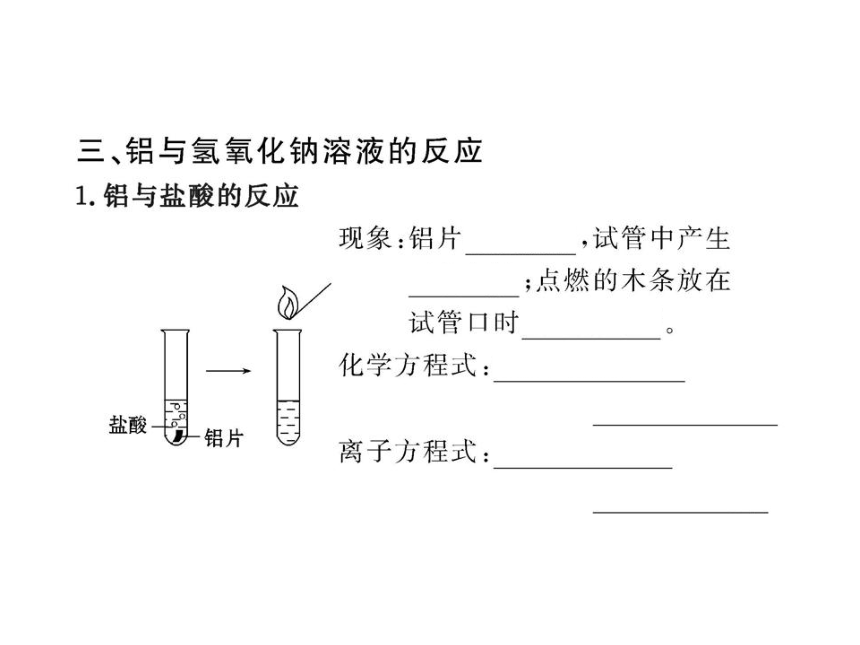
2.下列物质中不能与NaOH溶液反应的是( )
A.Na B.Fe C.Al D.CuSO4
【解析】选B。金属钠与NaOH溶液中的水反应生成氢气和氢氧化钠,氢氧化钠与铝反应生成氢气和偏铝酸钠,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,铁与氢氧化钠溶液不反应。
3.下列关于钠的说法正确的是( )
A.钠是活泼的非金属
B.钠与水反应放出氧气
C.钠与水反应放出氢气
D.钠不与盐酸反应
【解析】选C。钠是活泼金属,A错误;钠与水反应生成氢氧化钠和氢气,B错误、C正确;钠与盐酸反应生成氯化钠和氢气,D错误。
4.下列反应的离子方程式书写错误的是( )
A.钠和冷水反应:Na+2H2O Na++2OH-+H2↑
B.锌溶于稀硫酸:Zn+2H+ Zn2++H2↑
C.铝溶于氢氧化钠溶液中:
2Al+2OH-+2H2O 2AlO2-+3H2↑
D.铁跟稀硫酸反应:Fe+2H+ Fe2++H2↑
【解析】选A。钠和冷水反应的离子方程式为
2Na+2H2O 2Na++2OH-+H2↑;B、C、D三项离子方程式
原子守恒、电荷守恒,符合实际情况。
====
====
====
====
====
5.将钠、镁、铝各0.3 mol分别放入100 mL 1 mol/L 的盐
酸中,同温同压下产生的气体体积比是( )
A.1∶2∶3
B.6∶3∶2
C.3∶1∶1
D.1∶1∶1
【解析】选C。由2Na+2H+ 2Na++H2↑及
2Na+2H2O 2Na++2OH-+H2↑;Mg+2H+ Mg2++H2↑;2Al+6H+ 2Al3++3H2↑可知,盐酸完全反应,Mg、Al有剩
余,生成0.05 mol H2,但Na因与水反应也可产生H2,其全部
反应共放出0.15 mol H2。
====
====
====
====
【方法技巧】金属与非氧化性酸反应的有关规律
金属与非氧化性酸反应的实质是金属与酸电离出的H+反应
生成H2的过程,反应生成的H2的量取决于金属与酸的相对多
少,但是,若金属还能与水反应,如钠,产生的H2的量取
决于金属(钠)的多少。(以钠、镁、铝与酸的反应为例)
钠、镁、铝与产生氢气的物质的量的关系式:
1mol Na~ mol H2 1mol Mg~1mol H2
1mol Al~ mol H2
(1)酸足量时
①等物质的量的钠、镁、铝与足量酸反应时,产生H2的物质的量之比为1∶2∶3。
②等质量的钠、镁、铝与足量酸反应时,产生H2的物质的量之比为 ∶ ∶
(2)酸不足时
过量的金属与等量的酸反应时,钠产生氢气的量较多,镁、铝产生的氢气的量相等。
二、非选择题(本题包括3小题,共30分)
6. (8分)某无色透明溶液与铝反应放出氢气,该溶液中可能含有大量的H+、K+、Mg2+、Cl-、OH-、CO32-等离子,试推断:
第一种情况:一定有H+和 ,可能有 。
第二种情况:一定有OH-和 ,可能有 。
【解析】与铝反应放出氢气的溶液可能为酸性溶液也可能为强碱性溶液,若为酸性溶液(含H+),则阴离子不可能有OH-、CO32-,只能有Cl-,阳离子还可能有K+、Mg2+;若为强碱性溶液(含OH-),则阳离子不能有H+、Mg2+,只能有K+,阴离子还可能有Cl-、 CO32- 。
答案:Cl- K+、Mg2+ K+ Cl-、CO32-
7.(10分)
用如图所示的方法研究钠与水反应的性质,A表示带孔铝箔包住的一小块钠,回答下列各问题。
(1)假如在实验刚开始以后就将镊子松开并拿出水面,“A”表现出的现象是 。
(2)根据预测,钠跟水反应生成氢氧化钠和氢气,该反应的离子方程式是 ,可用一种酸碱指示剂证明反应生成了氢氧化钠,这种酸碱指示剂是 。
(3)若实验中金属钠为0.1 mol,则收集到的气体为 。
A.O2和H2的混合气体
B.0.05 mol的H2
C.大于0.05 mol的H2
D.小于0.05 mol的H2
【解析】(1)因为钠比水的密度小,且反应非常剧烈,同时
产生氢气,所以看到“A”浮上水面并上下跳动。
(2)钠跟水反应生成氢氧化钠和氢气,反应的离子方程式是
2Na+2H2O 2Na++2OH-+H2↑,检验氢氧化钠用酚酞试
剂,现象为溶液变红。
(3)0.1 mol金属钠与水反应生成氢气0.05 mol,生成氢氧
化钠0.1 mol,氢氧化钠与铝反应生成氢气和偏铝酸钠,所
以收集到的气体为大于0.05 mol的H2。
====
答案:(1)“A”浮在水面上并四处游动
(2)2Na+2H2O====2Na++2OH-+H2↑ 酚酞试剂
(3)C
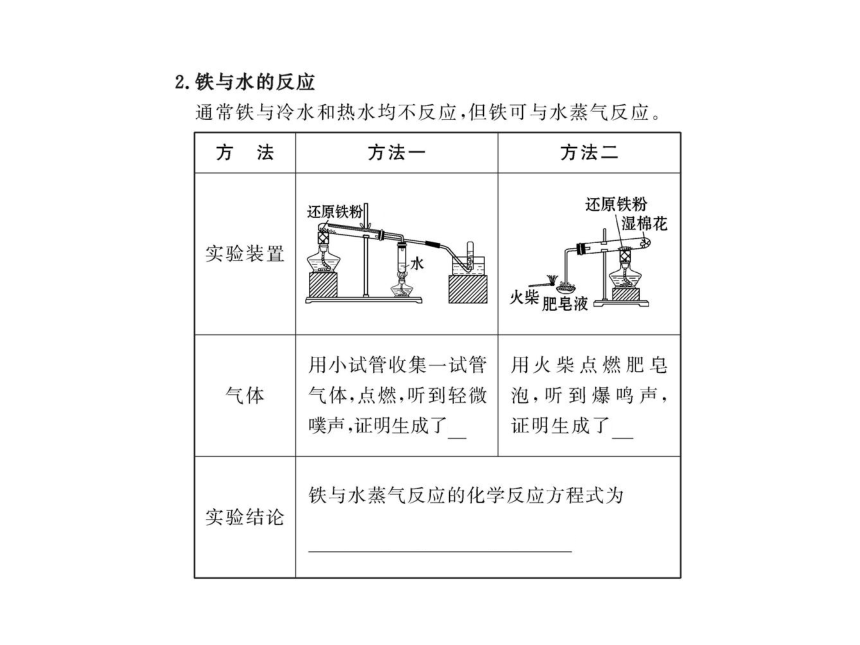
8.(12分)(挑战能力)某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题。
(1)A装置的作用是 ,B中反应的化学方程式为 _____________________________________________。
(2)D的作用是 。
(3)E中的现象是黑色固体变为 ,硬质玻璃管右端有生成 。
(4)A、B两个装置中应先点燃 处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是 。
【解析】(1)B中进行的反应是3Fe+4H2O(g) Fe3O4+4H2,
故A为提供水蒸气的装置。(2)D的作用是除去未反应的水蒸
气,干燥H2。 (3)E中反应为H2+CuO Cu+H2O,故黑色粉
末变红,同时硬质玻璃管右端会有水珠生成。(4)应先点A
处,若先点燃B处,B中的Fe会与空气中O2反应生成Fe2O3,点
燃E处酒精灯前要收集H2,检验纯度。
高温
====
△
====
答案:(1)产生水蒸气
3Fe+4H2O(g) Fe3O4+4H2
(2)吸收未反应的水蒸气
(3)红色 水珠
(4)A 收集H2,并检验其纯度
高温
====
为探究金属与盐发生反应的规律,某化学实验小组在老师的指导下设计了如下实验方案。
【思考探究】
(1)比较A、C两组实验你能比较出三种金属的活泼性吗?还能得出什么规律?
提示:从A、C两组实验可以看出,铁比铜活泼,铜比银活泼,也就是说,活泼性顺序为铁>铜>银。活泼性较强的金属能够把活泼性较弱的金属从其盐溶液中置换出来。
(2)比较D、F两组实验你能比较银、铜、铁的活泼性吗?还能得出什么规律?
提示:从D、F两组实验可以看出,银没有铜活泼,铜没有铁活泼,也就是说,活泼性较弱的金属不能把活泼性较强的金属从其盐溶液中置换出来。
(3)B组实验说明什么?发生的化学反应有哪些?
提示:从B组实验可以看出,活泼性很强的金属钠与盐溶液反应不同于其他金属。因为它的活泼性很强,它与盐溶液反应时首先与溶液中的水反应,之后生成的碱再与盐溶液中的溶质反应生成沉淀和其他物质。发生反应的方程式为2Na+2H2O====2NaOH+H2↑,2NaOH+CuSO4====Cu(OH)2↓+Na2SO4。
(4)从E组实验你能得出金属与盐反应需在什么条件下进行吗?
提示:从E组实验可以看出,跟金属反应的盐必须是溶液,即金属与盐的反应是溶液中的离子反应。
