11-12版高中化学全程学习方略配套课件:3.2.3铁的重要化合物(人教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:3.2.3铁的重要化合物(人教版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 00:00:00 | ||
图片预览









文档简介
(共83张PPT)
【典例1】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
(1)写出A、C、F、G的化学式
A、_____ C、_________ F、 ______ G、________。
(2)保存C溶液时要加固体A的原因___________________
___________________________。
(3)写出下列转化的离子方程式或化学方程式。
①E→F:____________________________。
②C→D:____________________________。
【思路点拨】解答本题要注意以下三点:
【自主解答】根据F是红褐色沉淀知F是Fe(OH)3,从而推知A为Fe,B为Fe3O4,C是FeCl2,D是FeCl3,E为Fe(OH)2,F为Fe(OH)3,G为Fe2O3,X为H2。
答案:(1)Fe FeCl2 Fe(OH)3 Fe2O3
(2)防止Fe2+被O2氧化
(3)①4Fe(OH)2+O2+2H2O====4Fe(OH)3
②2Fe2++Cl2====2Fe3++2Cl-
【互动探究】(1)如何检验C中的阳离子?
提示:取C溶液少许于试管中,加入几滴KSCN溶液,溶液不变红色,然后向其中滴加少量氯水,溶液变红色,证明含Fe2+。
(2)在向C溶液逐渐滴加氢氧化钠的过程中,你会观察到怎样的现象?
提示:开始产生白色沉淀,然后迅速变为灰绿色,最后变成红褐色。
【变式训练】下列反应中,能置换出铁的是( )
A.Cu和FeCl3(溶液)
B.Na和FeSO4(溶液)
C.C和Fe2O3(高温)
D.Ag和FeSO4(溶液)
【解析】选C。A项离子反应为2Fe3++Cu====2Fe2++Cu2+;B
项钠与水反应生成氢氧化钠和氢气,氢氧化钠与硫酸亚铁
反应产生氢氧化亚铁沉淀;C项反应为3C+Fe2O3
2Fe+3CO;D项不发生反应。
高温
====
【典例2】某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是
A.一定有Fe2+,一定没有Fe3+、Mg2+
B.一定有Fe3+,一定没有Fe2+、Mg2+
C.一定有Fe3+,可能有Fe2+,一定没有Mg2+
D.一定有Fe2+,可能有Mg2+,一定没有Fe3+
【思路点拨】解答该题要注意以下三点:
【自主解答】选D。加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色的现象是溶液中含有亚铁离子的特性,若有Fe3+,则产生氢氧化铁的红褐色沉淀会掩盖Fe(OH)2的白色,所以不可能存在,而Mg(OH)2是白色,有可能存在。
【互动探究】(1)该题中若加入NaOH溶液时,立即产生红褐色沉淀,则离子的存在情况又将怎样?
提示:一定含有Fe3+,Mg2+、Fe2+无法确定。
(2)若某溶液中加入NaOH溶液时有白色沉淀生成,继续滴加NaOH溶液时白色沉淀部分溶解,则溶液中可能含有什么离子?
提示:含有Mg2+、Al3+,Mg(OH)2和Al(OH)3均是白色沉淀,但是前者不溶于过量的NaOH溶液,后者却溶于过量的NaOH溶液。
【变式训练】某物质溶于盐酸后,再向溶液中滴加KSCN溶液,结果溶液颜色无变化,然后加入新制的氯水后溶液呈红色,则这种物质是( )
A.FeCl3 B.FeCl2
C.Fe2O3 D.Fe3O4
【解析】选B。FeCl3、Fe2O3、Fe3O4溶于盐酸后,都能产生Fe3+,滴加KSCN溶液时,溶液颜色都会变为红色;只有FeCl2遇KSCN溶液不变色。
【典例】如图所示装置,可用来
制取和观察Fe(OH)2在空气中被
氧化的颜色变化。实验时必须
使用铁屑和6 mol/L的硫酸,其他
试剂任选。
填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是_________,A中反应的离子方程式是_____________。
(2)实验开始时应先将活塞a___________(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:_______________
_____________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为_____________________。
(5)如图中_______能较长时间看到Fe(OH)2白色沉淀。
【思路点拨】解答该题要注意以下两点:
【自主解答】A装置是产生H2的装置,利用H2赶走装置B中
的O2,降低Fe2+被氧化的速度,能较长时间观察到Fe(OH)2
白色沉淀,故A装置中装的试剂为铁屑,Fe+H2SO4====
FeSO4+H2↑。实验开始时打开活塞a,A装置产生的H2沿导
管进入B装置的溶液中,赶走装置中的空气,关闭活塞a,
气体不能逸出,压迫液体通过导气管进入B装置,FeSO4与NaOH混合产生Fe(OH)2白色沉淀,实验完毕后打开活塞b,
空气进入B装置,O2与Fe(OH)2发生反应,转化为红褐色沉
淀。提供的4套装置皆能产生Fe(OH)2,关键看隔绝O2的程
度大小:①用H2SO4与Fe反应产生的H2赶出装置中的O2;
②与①原理相似,只不过在两个试管中进行;③中胶头滴管插入液面以下,防止滴加过程中接触O2;④中胶头滴管插入液面以下,且有苯在上层隔离空气,故4套装置都能较长时间看到Fe(OH)2白色沉淀。
答案:(1)铁屑 Fe+2H+====Fe2++H2↑ (2)打开
(3)关闭活塞a,使FeSO4溶液被压入装置B中进行反应
(4)4Fe(OH)2+2H2O+O2====4Fe(OH)3
(5)①、②、③、④
【互动探究】将第(5)小题中装置④中苯换为煤油,并向其中加入黄豆粒大小的钠,探究:
(1)你将观察到怎样的现象?
提示:钠在煤油和FeSO4溶液之间剧烈反应,上下浮动,产生无色气泡,同时溶液中产生白色沉淀,且较长时间不变色。
(2)能写出试管中发生的离子反应吗?
提示:试管中发生的离子反应为2Na+2H2O====2Na++2OH-+H2↑,Fe2++2OH-====Fe(OH)2↓。
【变式训练】某化学小组欲制得白色的Fe(OH)2沉淀。设计原理为:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2。
(1)配制FeSO4溶液时通常向溶液中加入_______,目的是除去可能存在的Fe3+,发生的离子反应是___________。
(2)除去蒸馏水中溶解的O2常采用_______的方法。
(3)生成白色Fe(OH)2沉淀的操作是用胶头滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是______________________。
【解析】配制FeSO4溶液时为除去可能存在的Fe3+,通常向溶液中加入铁粉,离子反应为2Fe3++Fe====3Fe2+。常采用加热煮沸的方法除去蒸馏水中溶解的O2。避免生成的Fe(OH)2沉淀接触O2而被氧化,所以实验采用如上的操作。
答案:(1)铁粉 2Fe3++Fe====3Fe2+
(2)煮沸
(3)避免生成的Fe(OH)2沉淀接触O2而被氧化
【典例】下列叙述正确的是
A.向某溶液中加入KSCN后无明显现象,证明溶液中不含有Fe3+
B.FeCl2无法直接通过化合反应而得到
C.向某溶液中通入Cl2,再加入KSCN溶液变红色,说明原溶液中含有Fe2+
D.因为在金属活动性顺序表中Cu排在Fe后面,故把铜粉加入到FeCl3溶液中不发生反应
【易错选项】B、C
【易错剖析】
(1)易错选项分析
错选B的原因在于对基础知识的积累不到位,对于常见的化
学反应不熟练,不能灵活的加以利用。制备FeCl2时我们往
往首先想到的是用Fe和HCl或者Fe和Cl2反应,以上两个反
应一个不是化合反应,一个生成的不是FeCl2。因此就错误
地认为FeCl2不能通过化合反应而得到。但是利用FeCl3与
铁粉的反应也可以得到FeCl2,而且该反应就是化合反应。
错选C的原因是考虑问题不全面。加入KSCN后溶液变红色,
说明溶液中此时一定含有Fe3+,但是该Fe3+可能是原溶液中
含有的Fe2+加入Cl2后氧化而成的,还可能是原溶液中本
身就含有Fe3+而没有Fe2+。判断Fe2+的存在正确的方法是:先加入KSCN,溶液不变色(无Fe3+),再通入氯气后变为红色,从而证明Fe2+的存在。
(2)其他错误选项分析
错选D的原因在于对金属活动性顺序表中金属之间的置换规律理解不准确。在金属活动性顺序表中排在前面的金属可把排在后面的金属从其盐溶液中置换出来,此时Fe对应的盐溶液是亚铁盐。但是铜放入到FeCl3溶液中就可以反应,此时反应的实质不是发生置换反应,而是Fe3+具有强氧化性,可以氧化Cu单质,本身被还原为Fe2+。
【标准答案】A
1.实验室在配制FeSO4溶液时,为防止FeSO4被氧化而变质,常在溶液中加入少量的( )
A.锌粉 B.铁粉 C.硫酸铁 D.盐酸
【解析】选B。为防止Fe2+因氧化而变质需要加入还原剂,同时还不能引入新的杂质离子,选项中A会引入杂质,C不是还原剂,只有B符合题意。
2.下列物质的主要成分正确的是( )
A.赤铁矿:Fe3O4
B.铜绿:Cu2(OH)2CO3
C.磁铁矿:Fe2O3
D.明矾:2KAl(SO4)2
【解析】选B。常见矿物质的主要成分、某些物质的俗称与化学式要对应。赤铁矿为Fe2O3,磁铁矿为Fe3O4,明矾为KAl(SO4)2·12 H2O
3.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是( )
A.苹果汁中的Fe2+变成Fe3+
B.苹果汁中含有Cu2+
C.苹果汁中含有OH-
D.苹果汁中含有Fe3+
【解析】选A。苹果汁由淡绿色变为棕黄色的实质是Fe2+变成Fe3+,是Fe2+被氧化的过程。
4.将Fe(OH)2露置在空气中加热灼烧所得的产物为( )
A.FeO B.Fe2O3
C.Fe3O4 D.Fe(OH)3
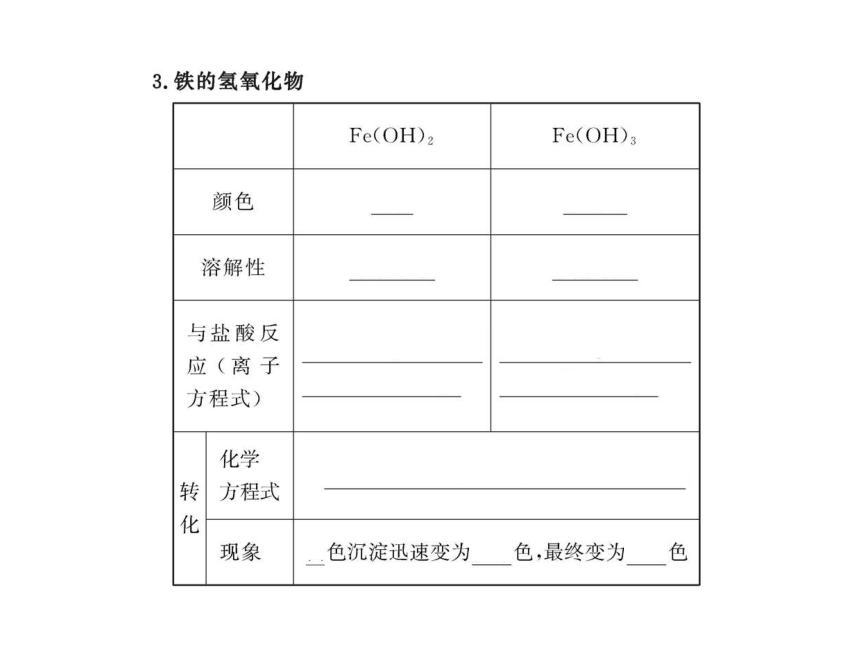
【解析】选B。因Fe(OH)2极易被空气中氧气氧化,当露置于空气中时,Fe(OH)2首先转化为Fe(OH)3,然后Fe(OH)3分解生成Fe2O3。
5.在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )
A.Fe2+ B.Fe3+ 和Fe2+
C.Cu2+和Fe2+ D.Cu2+
【解析】选A。因为铁粉过量,所以溶液中无Fe3+和Cu2+,发生的反应为2Fe3++Fe====3Fe2+,
Fe+Cu2+====Fe2++Cu,故选A。
6.根据下图各物质相互转化关系,试写出:
(1)化学式:沉淀1:______,A:________,B:______.
(2)沉淀2生成红褐色沉淀A的化学方程式__________。
【解析】银不与盐酸反应,故沉淀1为银,氧化铝与铁分别与盐酸反应,方程式为:Al2O3+6HCl====2AlCl3+3H2O ,
Fe+2HCl====FeCl2+H2↑,所以滤液1为AlCl3和FeCl2的混合物,加入过量的氢氧化钠时,发生反应为AlCl3+4NaOH
====NaAlO2+3NaCl+2H2O,FeCl2+2NaOH====Fe(OH)2↓+2NaCl,Fe(OH)2沉淀被空气氧化反应为4Fe(OH)2+O2+2H2O
====4Fe(OH)3。
答案:(1)Ag Fe(OH)3 Al2(SO4)3
(2)4Fe(OH)2+O2+2H2O====4Fe(OH)3
一、选择题(本题包括5小题,每小题4分,共20分)
1.含下列离子的溶液中滴入KSCN试剂,溶液变成红色的是
( )
A.Fe2+ B.Fe3+ C.Na+ D.Al3+
【解析】选B。滴入KSCN试剂溶液变成红色,说明溶液中有Fe3+,B正确。
2.(2011·福州高一检测)要除去氯化亚铁溶液中的少量氯化铁,可行的办法是( )
A.滴入KSCN溶液
B.通入氯气
C.滴入NaOH溶液
D.加入铁粉
【解析】选D。要除去氯化亚铁溶液中的少量氯化铁,应加入过量的铁粉,发生反应为2Fe3++Fe====3Fe2+,然后过滤即可。
3.将过量的Na2O2投入FeCl2溶液中,可观察到的实验现象是 ( )
A.有白色沉淀生成
B.有红褐色沉淀生成
C.溶液由浅绿色变为黄色
D.不可能有无色气体产生
【解析】选B。将过量的Na2O2投入FeCl2中,发生下列反
应:
2Na2O2+2H2O 4NaOH+O2↑
FeCl2+2NaOH Fe(OH)2↓+2NaCl
4Fe(OH)2+O2+2H2O 4Fe(OH)3
所以现象为有无色气体产生并有红褐色沉淀生成,故选B。
====
====
====
4.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中
A.②③①④
B.③②①④
C.③①②④
D.①②③④
【解析】选B。①钠在纯氧中燃烧生成淡黄色的Na2O2, ②FeSO4与NaOH反应生成Fe(OH)2,在空气中放置生成红褐色的Fe(OH)3, ③FeCl3与KSCN反应生成红色的Fe(SCN)3, ④CuSO4遇医用酒精中的水变蓝色,故选B。
5.(2011·万州高一检测)下列有关铁及其化合物的有关说
法中正确的是( )
A.Fe3O4为红棕色晶体
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl3溶液中的FeCl2杂质可以向溶液中通入氯气
D.Fe3+与KSCN试剂产生红色沉淀
【解析】选C。Fe3O4是黑色晶体,A错误;铁与水蒸气在高
温下的反应产物为Fe3O4和H2,B错误;除去FeCl3溶液中的
FeCl2杂质可以向溶液中通入氯气,发生的反应为
2Fe2++Cl2 2Fe3++2Cl-,C正确;Fe3+与KSCN作用溶
液呈红色,但不是沉淀,D错误。
====
二、非选择题(本题包括3小题,共30分)
6.(10分)已知给贫血者补充铁时,应给予含Fe2+的铁盐,如
硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,
有利于人体吸收
Fe2+ Fe3+
(1)在人体中进行转化时,
①中的Fe2+作 剂,
②中的Fe3+作 剂。
(2)从“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句
话可以推测维生素C在这一反应中作 剂,具有 性。
②
①
【解析】(1)①Fe2+ Fe3+,Fe2+失电子,化合价升
高,作还原剂;②Fe3+ Fe2+,Fe3+得电子,化合价降
低,作氧化剂。
(2)Fe3+ Fe2+中Fe3+得电子作氧化剂,则维生素C,失
电子作还原剂,具有还原性
答案:(1)还原 氧化
(2)还原 还原
7.(10分)(2011·潍坊高一检测)将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应)。试判断下列情况下,溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有的离子是:____;铜单质 (填“一定”或“可能”)存在。
(2)若氯化铁和氯化铜都有剩余,则容器中不可能有的单质是 ,Fe2+ _______(填“一定”或“可能”)存在。
【解析】解答时应首先弄清物质间可能发生的反应。凡是相互间能发生反应的物质就不可能大量共存。本题涉及的反应有:
①Fe+2FeCl3====3FeCl2 ②Fe+CuCl2====Cu+FeCl2
③Cu+2FeCl3====2FeCl2+CuCl2
(1)若铁粉有剩余,则容器中不可能有Fe3+、Cu2+,因为它们能发生上述①②反应。
(2)若FeCl3和CuCl2都有剩余,则容器中一定没有Fe、Cu,一定有Fe2+。
答案:(1)Fe3+、Cu2+ 一定 (2)Fe、Cu 一定
8.(10分)(挑战能力)已知有以下物质相互转化,其中A为常见金属,C为碱。
试回答:
(1)写出F的化学式 ,H的化学式 。
(2)写出由E转变成F的化学方程式: 。
(3)向G溶液加入A的有关离子反应方程式: 。
(4)写出A在一定条件下与水反应的化学方程式: 。
【解析】据框图转化可知,溶液D与硝酸酸化的硝酸银反应
后的溶液中含有K+,白色沉淀H是AgCl,则D为KCl;又根据
红褐色沉淀F为Fe(OH)3,则E为Fe(OH)2,结合复分解反应
的特点知B为FeCl2,C为KOH,A为Fe。
答案: (1)Fe(OH)3 AgCl
(2)4Fe(OH)2+O2+2H2O====4Fe(OH)3
(3)2Fe3++Fe====3Fe2+
(4)3Fe+4H2O(g) Fe3O4+4H2
高温
====
【方法技巧】解答无机框图推断题的思路和方法
抓住元素及其化合物的特性,挖掘解题“题眼”,并以此为突破口解题。此类试题常见的解题方法为“审→找→析(推)→验→答”五步。即:
(1)审:审清题意,题干→问题→框图,迅速浏览一遍,尽量在框图中把相关信息表示出来,明确求解要求。
(2)找:找“题眼”,即找到解题的突破口,此步非常关键。
(3)析(推):从“题眼”出发,联系新信息及所学知识,大胆猜测,应用正(逆)向思维、发散收敛思维、横向纵向思维等多种思维方式,进行综合分析、推理,初步得出结论。
(4)验:验证确认,将结果放入原题检验,完全符合条件才算正确。
(5)答:按题目的要求写出答案。
某化学兴趣小组利用下列试剂:铁粉、锌粉、
0.1 mol·L-1 FeCl3溶液,0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式_________________________________。
(2)设计实验方案,完成下列表格。
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_______________________。
(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是____________。
【解析】(1)在反应中Fe2+作还原剂,体现其还原性,因此应选择氧化剂,所以选用氯水,反应为2FeCl2+Cl2====
2FeCl3。
(2)向FeCl3溶液中加入铁粉,发生的反应为2Fe3++Fe
====3Fe2+,所以溶液由棕黄色变为浅绿色。向FeCl2的溶液中滴加硫氰化钾溶液不变红。
(3)向FeCl2的溶液中加入锌粉,离子反应为Zn+Fe2+====
Fe+Zn2+。
(4)FeCl3溶液腐蚀铜箔,发生的离子反应为2Fe3++Cu====
2Fe2++Cu2+。
答案:(1)2FeCl2+Cl2====2FeCl3
(2)浅绿色 不变色
(3)Fe2++Zn====Zn2++Fe
(4)2Fe3++Cu====2Fe2++Cu2+
【典例1】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
(1)写出A、C、F、G的化学式
A、_____ C、_________ F、 ______ G、________。
(2)保存C溶液时要加固体A的原因___________________
___________________________。
(3)写出下列转化的离子方程式或化学方程式。
①E→F:____________________________。
②C→D:____________________________。
【思路点拨】解答本题要注意以下三点:
【自主解答】根据F是红褐色沉淀知F是Fe(OH)3,从而推知A为Fe,B为Fe3O4,C是FeCl2,D是FeCl3,E为Fe(OH)2,F为Fe(OH)3,G为Fe2O3,X为H2。
答案:(1)Fe FeCl2 Fe(OH)3 Fe2O3
(2)防止Fe2+被O2氧化
(3)①4Fe(OH)2+O2+2H2O====4Fe(OH)3
②2Fe2++Cl2====2Fe3++2Cl-
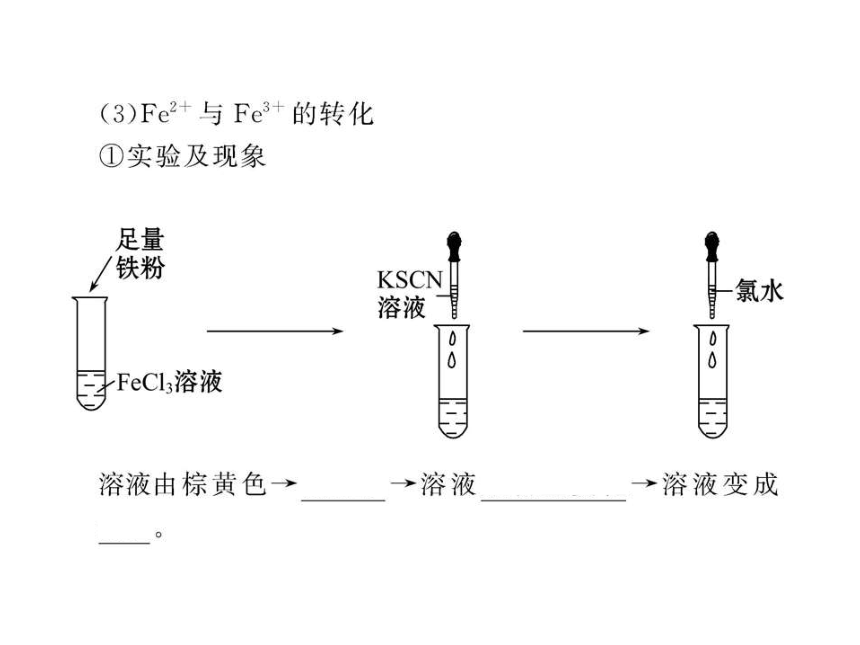
【互动探究】(1)如何检验C中的阳离子?
提示:取C溶液少许于试管中,加入几滴KSCN溶液,溶液不变红色,然后向其中滴加少量氯水,溶液变红色,证明含Fe2+。
(2)在向C溶液逐渐滴加氢氧化钠的过程中,你会观察到怎样的现象?
提示:开始产生白色沉淀,然后迅速变为灰绿色,最后变成红褐色。
【变式训练】下列反应中,能置换出铁的是( )
A.Cu和FeCl3(溶液)
B.Na和FeSO4(溶液)
C.C和Fe2O3(高温)
D.Ag和FeSO4(溶液)
【解析】选C。A项离子反应为2Fe3++Cu====2Fe2++Cu2+;B
项钠与水反应生成氢氧化钠和氢气,氢氧化钠与硫酸亚铁
反应产生氢氧化亚铁沉淀;C项反应为3C+Fe2O3
2Fe+3CO;D项不发生反应。
高温
====
【典例2】某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是
A.一定有Fe2+,一定没有Fe3+、Mg2+
B.一定有Fe3+,一定没有Fe2+、Mg2+
C.一定有Fe3+,可能有Fe2+,一定没有Mg2+
D.一定有Fe2+,可能有Mg2+,一定没有Fe3+
【思路点拨】解答该题要注意以下三点:
【自主解答】选D。加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色的现象是溶液中含有亚铁离子的特性,若有Fe3+,则产生氢氧化铁的红褐色沉淀会掩盖Fe(OH)2的白色,所以不可能存在,而Mg(OH)2是白色,有可能存在。
【互动探究】(1)该题中若加入NaOH溶液时,立即产生红褐色沉淀,则离子的存在情况又将怎样?
提示:一定含有Fe3+,Mg2+、Fe2+无法确定。
(2)若某溶液中加入NaOH溶液时有白色沉淀生成,继续滴加NaOH溶液时白色沉淀部分溶解,则溶液中可能含有什么离子?
提示:含有Mg2+、Al3+,Mg(OH)2和Al(OH)3均是白色沉淀,但是前者不溶于过量的NaOH溶液,后者却溶于过量的NaOH溶液。
【变式训练】某物质溶于盐酸后,再向溶液中滴加KSCN溶液,结果溶液颜色无变化,然后加入新制的氯水后溶液呈红色,则这种物质是( )
A.FeCl3 B.FeCl2
C.Fe2O3 D.Fe3O4
【解析】选B。FeCl3、Fe2O3、Fe3O4溶于盐酸后,都能产生Fe3+,滴加KSCN溶液时,溶液颜色都会变为红色;只有FeCl2遇KSCN溶液不变色。
【典例】如图所示装置,可用来
制取和观察Fe(OH)2在空气中被
氧化的颜色变化。实验时必须
使用铁屑和6 mol/L的硫酸,其他
试剂任选。
填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是_________,A中反应的离子方程式是_____________。
(2)实验开始时应先将活塞a___________(填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:_______________
_____________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为_____________________。
(5)如图中_______能较长时间看到Fe(OH)2白色沉淀。
【思路点拨】解答该题要注意以下两点:
【自主解答】A装置是产生H2的装置,利用H2赶走装置B中
的O2,降低Fe2+被氧化的速度,能较长时间观察到Fe(OH)2
白色沉淀,故A装置中装的试剂为铁屑,Fe+H2SO4====
FeSO4+H2↑。实验开始时打开活塞a,A装置产生的H2沿导
管进入B装置的溶液中,赶走装置中的空气,关闭活塞a,
气体不能逸出,压迫液体通过导气管进入B装置,FeSO4与NaOH混合产生Fe(OH)2白色沉淀,实验完毕后打开活塞b,
空气进入B装置,O2与Fe(OH)2发生反应,转化为红褐色沉
淀。提供的4套装置皆能产生Fe(OH)2,关键看隔绝O2的程
度大小:①用H2SO4与Fe反应产生的H2赶出装置中的O2;
②与①原理相似,只不过在两个试管中进行;③中胶头滴管插入液面以下,防止滴加过程中接触O2;④中胶头滴管插入液面以下,且有苯在上层隔离空气,故4套装置都能较长时间看到Fe(OH)2白色沉淀。
答案:(1)铁屑 Fe+2H+====Fe2++H2↑ (2)打开
(3)关闭活塞a,使FeSO4溶液被压入装置B中进行反应
(4)4Fe(OH)2+2H2O+O2====4Fe(OH)3
(5)①、②、③、④
【互动探究】将第(5)小题中装置④中苯换为煤油,并向其中加入黄豆粒大小的钠,探究:
(1)你将观察到怎样的现象?
提示:钠在煤油和FeSO4溶液之间剧烈反应,上下浮动,产生无色气泡,同时溶液中产生白色沉淀,且较长时间不变色。
(2)能写出试管中发生的离子反应吗?
提示:试管中发生的离子反应为2Na+2H2O====2Na++2OH-+H2↑,Fe2++2OH-====Fe(OH)2↓。
【变式训练】某化学小组欲制得白色的Fe(OH)2沉淀。设计原理为:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备Fe(OH)2。
(1)配制FeSO4溶液时通常向溶液中加入_______,目的是除去可能存在的Fe3+,发生的离子反应是___________。
(2)除去蒸馏水中溶解的O2常采用_______的方法。
(3)生成白色Fe(OH)2沉淀的操作是用胶头滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是______________________。
【解析】配制FeSO4溶液时为除去可能存在的Fe3+,通常向溶液中加入铁粉,离子反应为2Fe3++Fe====3Fe2+。常采用加热煮沸的方法除去蒸馏水中溶解的O2。避免生成的Fe(OH)2沉淀接触O2而被氧化,所以实验采用如上的操作。
答案:(1)铁粉 2Fe3++Fe====3Fe2+
(2)煮沸
(3)避免生成的Fe(OH)2沉淀接触O2而被氧化
【典例】下列叙述正确的是
A.向某溶液中加入KSCN后无明显现象,证明溶液中不含有Fe3+
B.FeCl2无法直接通过化合反应而得到
C.向某溶液中通入Cl2,再加入KSCN溶液变红色,说明原溶液中含有Fe2+
D.因为在金属活动性顺序表中Cu排在Fe后面,故把铜粉加入到FeCl3溶液中不发生反应
【易错选项】B、C
【易错剖析】
(1)易错选项分析
错选B的原因在于对基础知识的积累不到位,对于常见的化
学反应不熟练,不能灵活的加以利用。制备FeCl2时我们往
往首先想到的是用Fe和HCl或者Fe和Cl2反应,以上两个反
应一个不是化合反应,一个生成的不是FeCl2。因此就错误
地认为FeCl2不能通过化合反应而得到。但是利用FeCl3与
铁粉的反应也可以得到FeCl2,而且该反应就是化合反应。
错选C的原因是考虑问题不全面。加入KSCN后溶液变红色,
说明溶液中此时一定含有Fe3+,但是该Fe3+可能是原溶液中
含有的Fe2+加入Cl2后氧化而成的,还可能是原溶液中本
身就含有Fe3+而没有Fe2+。判断Fe2+的存在正确的方法是:先加入KSCN,溶液不变色(无Fe3+),再通入氯气后变为红色,从而证明Fe2+的存在。
(2)其他错误选项分析
错选D的原因在于对金属活动性顺序表中金属之间的置换规律理解不准确。在金属活动性顺序表中排在前面的金属可把排在后面的金属从其盐溶液中置换出来,此时Fe对应的盐溶液是亚铁盐。但是铜放入到FeCl3溶液中就可以反应,此时反应的实质不是发生置换反应,而是Fe3+具有强氧化性,可以氧化Cu单质,本身被还原为Fe2+。
【标准答案】A
1.实验室在配制FeSO4溶液时,为防止FeSO4被氧化而变质,常在溶液中加入少量的( )
A.锌粉 B.铁粉 C.硫酸铁 D.盐酸
【解析】选B。为防止Fe2+因氧化而变质需要加入还原剂,同时还不能引入新的杂质离子,选项中A会引入杂质,C不是还原剂,只有B符合题意。
2.下列物质的主要成分正确的是( )
A.赤铁矿:Fe3O4
B.铜绿:Cu2(OH)2CO3
C.磁铁矿:Fe2O3
D.明矾:2KAl(SO4)2
【解析】选B。常见矿物质的主要成分、某些物质的俗称与化学式要对应。赤铁矿为Fe2O3,磁铁矿为Fe3O4,明矾为KAl(SO4)2·12 H2O
3.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是( )
A.苹果汁中的Fe2+变成Fe3+
B.苹果汁中含有Cu2+
C.苹果汁中含有OH-
D.苹果汁中含有Fe3+
【解析】选A。苹果汁由淡绿色变为棕黄色的实质是Fe2+变成Fe3+,是Fe2+被氧化的过程。
4.将Fe(OH)2露置在空气中加热灼烧所得的产物为( )
A.FeO B.Fe2O3
C.Fe3O4 D.Fe(OH)3
【解析】选B。因Fe(OH)2极易被空气中氧气氧化,当露置于空气中时,Fe(OH)2首先转化为Fe(OH)3,然后Fe(OH)3分解生成Fe2O3。
5.在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )
A.Fe2+ B.Fe3+ 和Fe2+
C.Cu2+和Fe2+ D.Cu2+
【解析】选A。因为铁粉过量,所以溶液中无Fe3+和Cu2+,发生的反应为2Fe3++Fe====3Fe2+,
Fe+Cu2+====Fe2++Cu,故选A。
6.根据下图各物质相互转化关系,试写出:
(1)化学式:沉淀1:______,A:________,B:______.
(2)沉淀2生成红褐色沉淀A的化学方程式__________。
【解析】银不与盐酸反应,故沉淀1为银,氧化铝与铁分别与盐酸反应,方程式为:Al2O3+6HCl====2AlCl3+3H2O ,
Fe+2HCl====FeCl2+H2↑,所以滤液1为AlCl3和FeCl2的混合物,加入过量的氢氧化钠时,发生反应为AlCl3+4NaOH
====NaAlO2+3NaCl+2H2O,FeCl2+2NaOH====Fe(OH)2↓+2NaCl,Fe(OH)2沉淀被空气氧化反应为4Fe(OH)2+O2+2H2O
====4Fe(OH)3。
答案:(1)Ag Fe(OH)3 Al2(SO4)3
(2)4Fe(OH)2+O2+2H2O====4Fe(OH)3
一、选择题(本题包括5小题,每小题4分,共20分)
1.含下列离子的溶液中滴入KSCN试剂,溶液变成红色的是
( )
A.Fe2+ B.Fe3+ C.Na+ D.Al3+
【解析】选B。滴入KSCN试剂溶液变成红色,说明溶液中有Fe3+,B正确。
2.(2011·福州高一检测)要除去氯化亚铁溶液中的少量氯化铁,可行的办法是( )
A.滴入KSCN溶液
B.通入氯气
C.滴入NaOH溶液
D.加入铁粉
【解析】选D。要除去氯化亚铁溶液中的少量氯化铁,应加入过量的铁粉,发生反应为2Fe3++Fe====3Fe2+,然后过滤即可。
3.将过量的Na2O2投入FeCl2溶液中,可观察到的实验现象是 ( )
A.有白色沉淀生成
B.有红褐色沉淀生成
C.溶液由浅绿色变为黄色
D.不可能有无色气体产生
【解析】选B。将过量的Na2O2投入FeCl2中,发生下列反
应:
2Na2O2+2H2O 4NaOH+O2↑
FeCl2+2NaOH Fe(OH)2↓+2NaCl
4Fe(OH)2+O2+2H2O 4Fe(OH)3
所以现象为有无色气体产生并有红褐色沉淀生成,故选B。
====
====
====
4.下列反应,其产物的颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中
A.②③①④
B.③②①④
C.③①②④
D.①②③④
【解析】选B。①钠在纯氧中燃烧生成淡黄色的Na2O2, ②FeSO4与NaOH反应生成Fe(OH)2,在空气中放置生成红褐色的Fe(OH)3, ③FeCl3与KSCN反应生成红色的Fe(SCN)3, ④CuSO4遇医用酒精中的水变蓝色,故选B。
5.(2011·万州高一检测)下列有关铁及其化合物的有关说
法中正确的是( )
A.Fe3O4为红棕色晶体
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl3溶液中的FeCl2杂质可以向溶液中通入氯气
D.Fe3+与KSCN试剂产生红色沉淀
【解析】选C。Fe3O4是黑色晶体,A错误;铁与水蒸气在高
温下的反应产物为Fe3O4和H2,B错误;除去FeCl3溶液中的
FeCl2杂质可以向溶液中通入氯气,发生的反应为
2Fe2++Cl2 2Fe3++2Cl-,C正确;Fe3+与KSCN作用溶
液呈红色,但不是沉淀,D错误。
====
二、非选择题(本题包括3小题,共30分)
6.(10分)已知给贫血者补充铁时,应给予含Fe2+的铁盐,如
硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,
有利于人体吸收
Fe2+ Fe3+
(1)在人体中进行转化时,
①中的Fe2+作 剂,
②中的Fe3+作 剂。
(2)从“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句
话可以推测维生素C在这一反应中作 剂,具有 性。
②
①
【解析】(1)①Fe2+ Fe3+,Fe2+失电子,化合价升
高,作还原剂;②Fe3+ Fe2+,Fe3+得电子,化合价降
低,作氧化剂。
(2)Fe3+ Fe2+中Fe3+得电子作氧化剂,则维生素C,失
电子作还原剂,具有还原性
答案:(1)还原 氧化
(2)还原 还原
7.(10分)(2011·潍坊高一检测)将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应)。试判断下列情况下,溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有的离子是:____;铜单质 (填“一定”或“可能”)存在。
(2)若氯化铁和氯化铜都有剩余,则容器中不可能有的单质是 ,Fe2+ _______(填“一定”或“可能”)存在。
【解析】解答时应首先弄清物质间可能发生的反应。凡是相互间能发生反应的物质就不可能大量共存。本题涉及的反应有:
①Fe+2FeCl3====3FeCl2 ②Fe+CuCl2====Cu+FeCl2
③Cu+2FeCl3====2FeCl2+CuCl2
(1)若铁粉有剩余,则容器中不可能有Fe3+、Cu2+,因为它们能发生上述①②反应。
(2)若FeCl3和CuCl2都有剩余,则容器中一定没有Fe、Cu,一定有Fe2+。
答案:(1)Fe3+、Cu2+ 一定 (2)Fe、Cu 一定
8.(10分)(挑战能力)已知有以下物质相互转化,其中A为常见金属,C为碱。
试回答:
(1)写出F的化学式 ,H的化学式 。
(2)写出由E转变成F的化学方程式: 。
(3)向G溶液加入A的有关离子反应方程式: 。
(4)写出A在一定条件下与水反应的化学方程式: 。
【解析】据框图转化可知,溶液D与硝酸酸化的硝酸银反应
后的溶液中含有K+,白色沉淀H是AgCl,则D为KCl;又根据
红褐色沉淀F为Fe(OH)3,则E为Fe(OH)2,结合复分解反应
的特点知B为FeCl2,C为KOH,A为Fe。
答案: (1)Fe(OH)3 AgCl
(2)4Fe(OH)2+O2+2H2O====4Fe(OH)3
(3)2Fe3++Fe====3Fe2+
(4)3Fe+4H2O(g) Fe3O4+4H2
高温
====
【方法技巧】解答无机框图推断题的思路和方法
抓住元素及其化合物的特性,挖掘解题“题眼”,并以此为突破口解题。此类试题常见的解题方法为“审→找→析(推)→验→答”五步。即:
(1)审:审清题意,题干→问题→框图,迅速浏览一遍,尽量在框图中把相关信息表示出来,明确求解要求。
(2)找:找“题眼”,即找到解题的突破口,此步非常关键。
(3)析(推):从“题眼”出发,联系新信息及所学知识,大胆猜测,应用正(逆)向思维、发散收敛思维、横向纵向思维等多种思维方式,进行综合分析、推理,初步得出结论。
(4)验:验证确认,将结果放入原题检验,完全符合条件才算正确。
(5)答:按题目的要求写出答案。
某化学兴趣小组利用下列试剂:铁粉、锌粉、
0.1 mol·L-1 FeCl3溶液,0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题。
(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式_________________________________。
(2)设计实验方案,完成下列表格。
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_______________________。
(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是____________。
【解析】(1)在反应中Fe2+作还原剂,体现其还原性,因此应选择氧化剂,所以选用氯水,反应为2FeCl2+Cl2====
2FeCl3。
(2)向FeCl3溶液中加入铁粉,发生的反应为2Fe3++Fe
====3Fe2+,所以溶液由棕黄色变为浅绿色。向FeCl2的溶液中滴加硫氰化钾溶液不变红。
(3)向FeCl2的溶液中加入锌粉,离子反应为Zn+Fe2+====
Fe+Zn2+。
(4)FeCl3溶液腐蚀铜箔,发生的离子反应为2Fe3++Cu====
2Fe2++Cu2+。
答案:(1)2FeCl2+Cl2====2FeCl3
(2)浅绿色 不变色
(3)Fe2++Zn====Zn2++Fe
(4)2Fe3++Cu====2Fe2++Cu2+
