11-12版高中化学全程学习方略配套课件:3.2.2铝的重要化合物(人教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:3.2.2铝的重要化合物(人教版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 09:48:32 | ||
图片预览











文档简介
(共82张PPT)
【典例1】已知单质A、B、C和甲、乙、丙、
丁四种化合物有如图的转化关系,C为密度
最小的气体,甲是一种高熔点的物质,丙
常温下是一种液体。
根据以上转化关系回答:
(1)写出下列物质的化学式:A______;B____;乙______。
(2)A原子的原子结构示意图为___________。
(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式_______________。
②甲与NaOH溶液反应的离子方程式________________。
【思路点拨】解答本题要注意以下两点:
【自主解答】本题主要考查铝的化合物之间的相互转化关系,从物质A作为突破口,A与NaOH反应放出H2,判断A是Al;由C+B→水,判断B为O2;由A+B→甲,判断甲为Al2O3;其余则容易判断:乙为NaAlO2,丁为Al(OH)3。
答案:(1)Al O2 NaAlO2 (2)
(3)①2Al+2NaOH+2H2O====2NaAlO2+3H2↑
②Al2O3+2OH-====2AlO2-+H2O
【互动探究】结合题目中的信息,利用A通过两步反
应制备丁物质的方案还有哪些?请用简单的流程图表示。
提示:①Al NaAlO2 Al(OH)3
②Al AlCl3 Al(OH)3
③Al AlCl3 Al(OH)3
NaOH溶液
HCl
HCl
NaOH溶液
HCl
足量氨水
【变式训练】在Al3+→Al(OH)3→AlO2-→(x)→Al3+的系列变
化中,判断x为( )
A.HCl
B.NaOH
C.Al(OH)3
D.CO2
【解析】选C。这是化合态铝元素一系列变化的生成物,而
不是各步转化所需加入的试剂,其转化关系为:
Al3+ Al(OH)3 AlO2- Al(OH)3 Al3+,
故选C。
OH-
OH-
H+
H+
【典例2】下列图像中,横坐标表示加入溶
液的体积,纵坐标表示产生沉淀的质量,
回答下列问题:
(1)表示向AlCl3溶液中逐渐滴加NaOH溶液的是_______;
(2)表示向NaAlO2溶液中逐渐滴加稀盐酸的是______;
(3)表示向AlCl3溶液中逐渐滴加氨水的是_________。
【思路点拨】解答本题要注意以下两点:
【自主解答】(1)此时发生的离子反应为Al3++3OH―====
Al(OH)3↓,Al(OH)3+ OH―====AlO2-+2H2O,所以①符合;
(2)此时发生的离子反应为AlO2-+H++H2O====Al(OH)3↓,Al(OH)3+3H+====Al3++3H2O,所以⑤符合;
(3)此时发生的离子反应为
Al3++3NH3·H2O====Al(OH)3↓+3NH4+,所以⑥符合。
答案:(1)① (2)⑤ (3)⑥
【互动探究】若是向HCl和AlCl3的混合溶液中逐渐滴加NaOH溶液,则:
(1)该过程的离子反应有哪些?
(2)上述图像中哪个符合?
提示:(1)发生的离子反应有H++ OH―====H2O,
Al3++3OH―====Al(OH)3↓,Al(OH)3+ OH-====AlO2-+2H2O。
(2)据离子反应可知③符合。
【变式训练】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(X)与溶液中沉淀物的量(Y)的关系示意图中正确的是
( )
【解析】选C。该过程发生的离子反应为Mg2++2OH―====
Mg(OH)2↓,Al3++3OH―====Al(OH)3↓,Al(OH)3+OH-====
AlO2-+2H2O,所以C正确。
【典例】(2010·甘肃兰州高一检测)等体积的AlCl3溶液和NaOH溶液混合后,若沉淀中含 Al的质量与溶液中含Al的质量相等,则AlCl3溶液和NaOH溶液的物质的量浓度之比为
A.3∶2 B.2∶4 C.1∶4 D.2∶7
【思路点拨】解答本题要注意以下两点:
【自主解答】选D。设AlCl3、NaOH的物质的量分别为a、
b,
(1)若Al3+过量,Al3+ + 3OH―====Al(OH)3↓
1mol 3mol 1mol
则,
解得:a∶b=2∶3
(2)若OH―稍过量,Al3+ + 3OH―====Al(OH)3↓
1mol 3mol 1mol
a 3a a
Al(OH)3 + OH―====AlO2-+2H2O
1mol 1mol 1mol
(b-3a) (b-3a) (b-3a)
则,a-(b-3a)=(b-3a)
解得:a∶b=2∶7,故选D。
【互动探究】(1)当产生沉淀的量最大时,二者的物质的量浓度之比是多少?
(2)当二者的物质的量浓度之比是1∶4时,溶液中含铝元素的微粒是什么?
提示:(1)当二者的物质的量浓度之比是1∶3时产生沉淀的量最大。
(2)当二者的物质的量浓度之比是1∶4时,反应生成的氢氧化铝沉淀恰好溶解,铝元素只以AlO2-的形式存在。
【变式训练】(2011·福建师大附中高一检测)向100 mL
2 mol·L-1的AlCl3溶液中,逐滴加入NaOH溶液100 mL 时产生沉淀为7.8 g,则加入NaOH溶液的物质的量浓度是
( )
A.1 mol·L-1 B.1.5 mol·L-1
C.3 mol·L-1 D.6 moL·L-1
【解析】选C。7.8 g Al(OH)3的物质的量为0.1 mol,小于0.2 mol,不是最大值,则有两种情况。
(1)NaOH不足
设参加反应的NaOH的物质的量为n(NaOH)。
Al3++3OH-====Al(OH)3↓
3 1
n(NaOH) 0.1 mol
n(NaOH)=0.3 mol
c(NaOH)=0.3 mol/0.1 L=3 mol·L-1
(2)NaOH过量
Al3+全部沉淀为Al(OH)3,过量的NaOH溶解部分的Al(OH)3,只余0.1 mol Al(OH)3沉淀。
设使Al3+全部沉淀需NaOH的物质的量为n1(NaOH),溶解部分Al(OH)3需NaOH的物质的量为n2(NaOH)。
Al3+ + 3OH-====Al(OH)3↓
1 3 1
0.2 mol n1(NaOH) 0.2mol
n1(NaOH)=0.6 mol
Al(OH)3 + OH-====AlO2-+2H2O
1 1
0.1 mol n2(NaOH)
n2(NaOH)=0.1 mol
c(NaOH)=(0.6 mol+0.1 mol)/0.1 L=7 mol·L-1
【典例】向盛有蒸馏水的铝制易拉罐中投入2.3 g钠:
①写出发生反应的化学方程式__________。
②计算反应中生成的气体的体积(标准状况下)______L。
③把反应后的溶液倒入烧杯并均分成甲、乙两份,向甲中加入0.1 mol/L的HCl,当加入______L时,沉淀达到最大值;再加入_______L时,沉淀又恰好全部溶解。
④把③中最后所得的溶液再与乙混合,写出反应的离子方程式___________________________________________;
反应过程中生成的沉淀的质量为__________g。
【错因剖析】
【标准答案】
①2Na+2H2O====2NaOH+H2↑,
2NaOH+2Al+2H2O====2NaAlO2+3H2↑
②4.48
③0.5 1.5
④Al3++3AlO2-+6H2O====4Al(OH)3↓ 5.2
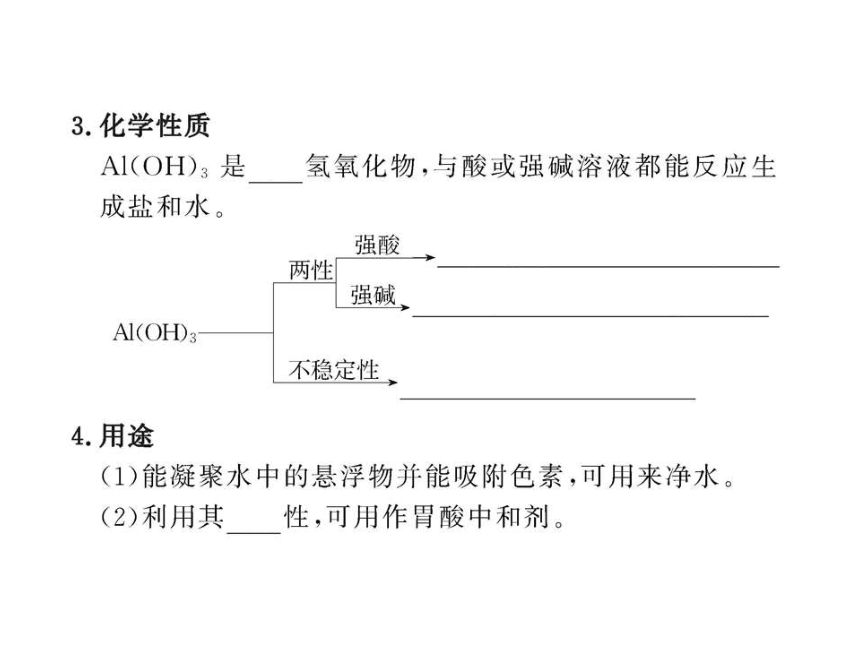
1.下列关于Al2O3的说法正确的是( )
A.Al2O3也可以通过分解反应制得
B.Al2O3加热分解为铝和氧气
C.Al2O3结构致密,所以可用铝制容器盛盐酸和NaOH溶液等
D.擦去表面氧化铝的铝条,在酒精灯上灼烧时,熔化的铝滴落下来
【解析】选A。A项:Al(OH)3是不溶性碱,所以Al(OH)3受
热分解也可制取Al2O3,2Al(OH)3 Al2O3+3H2O;B项:
Al2O3加热不分解,用电解法可制得铝;C项:Al2O3能与
HCl、NaOH溶液反应,所以HCl、NaOH溶液不能盛放在铝制
容器中;D项:擦去氧化膜的铝条,在酒精灯上加热时,由
于铝很活泼,接着与O2反应又生成一层氧化铝,包在熔化
的铝的外层,使得Al不会滴落下来。
△
====
2.要使氯化铝中的铝离子完全转化成氢氧化铝沉淀,应选的最佳试剂是( )
A.氢氧化钠溶液 B.稀盐酸
C.硝酸银溶液 D.氨水
【解析】选D。向氯化铝溶液中加入氨水,发生的离子反应为Al3++3NH3·H2O====Al(OH)3↓+3NH4+,若选用氢氧化钠溶液,易发生Al3++4OH―====AlO2-+2H2O,所以无法控制氢氧化钠的用量,而稀盐酸、硝酸银都不与氯化铝反应产生氢氧化铝沉淀,故选D。
3.向100 mL 1.0 mol·L-1的AlCl3溶液中逐滴加入
0.5 mol·L-1的NaOH溶液至过量,生成沉淀的物质的量与加入NaOH的量的理论曲线图正确的是( )
【解析】选D。向AlCl3溶液中逐滴加入NaOH溶液至过量,发生的反应依次是:Al3++3OH-====Al(OH)3↓、
Al(OH)3+OH-====AlO2-+2H2O,其现象是先产生白色沉淀,后沉淀逐渐减少,直到全部消失,而且沉淀最多和沉淀恰好消失时前后消耗的NaOH的物质的量之比为3∶1。
4. 铝、氧化铝、氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是( )
A.都有H2O生成
B.都有H2生成
C.都有AlO2-生成
D.都有Al3+生成
【解析】选C。2Al+2OH-+2H2O====2AlO2-+3H2↑,Al2O3+2OH―====2AlO2-+H2O,Al(OH)3+OH―====AlO2-+2H2O,Al3++4OH―====AlO2-+2H2O,据此可知C正确。
5.分析下图中各物质的转化关系。
(A) (溶液B) (无色溶液C) (白色沉淀D)
已知A是地壳中含量最高的金属元素单质。
(1)写出B、D的化学式:B________;D___________。
(2)写出下列离子方程式:
A→B:____________________;
C→D:____________________。
氢氧化钠
过量盐酸
氨水
【解析】因为A是地壳中含量最高的金属元素单质,则A为Al,B为NaAlO2,C为AlCl3,D为Al(OH)3。
答案:(1)NaAlO2 Al(OH)3
(2)2Al+2OH-+2H2O====2AlO2-+3H2↑
Al3++3NH3·H2O====Al(OH)3↓+3NH4+
一、选择题(本题包括5小题,每小题4分,共20分)
1.(2011·海淀高一检测) 氢氧化铝可作为治疗胃酸过多的内服药,这是利用了氢氧化铝的( )
A.两性 B.碱性 C.酸性 D.不稳定性
【解析】选B。氢氧化铝与酸反应,体现了氢氧化铝的碱性,B正确。
2.(2011·福州高一检测)既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
①Al(OH)3 ②Al2O3 ③Al ④NaHCO3
A.①③ B.①②③ C.全部 D.①④
【解析】选C。Al、Al2O3、Al(OH)3、NaHCO3四种物质既能与盐酸反应,又能与NaOH溶液反应。
3.向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )
【解析】选D。MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液,发生反应的离子方程式为Mg2++2OH-====Mg(OH)2↓,Al3++3OH- ==== Al(OH)3↓,沉淀逐渐增多,当Al3+、Mg2+完全沉淀后,由于Al(OH)3具有两性,可溶于NaOH溶液,Al(OH)3+OH- ====AlO2-+2H2O,而Mg(OH)2不溶,所以沉淀部分溶解后不再变化,故选D。
4.(2011·鞍山高一检测)下列变化不可能通过一步实验直
接完成的是( )
A.Al(OH)3 Al2O3
B.Al2O3 Al(OH)3
C.Al AlO2-
D.Al3+ Al(OH)3
【解析】选B。A项反应为2Al(OH)3 Al2O3+3H2O;B
项,Al2O3不溶于水,也不与水反应;C项,反应为2Al+2OH-
+2H2O====2AlO2-+3H2↑;D项反应为Al3++3OH―
====Al(OH)3↓,故选B。
△
====
5.下列离子在加入金属钠后的溶液中仍能大量存在的是 ( )
A. Al3+ B. AlO2- C. H+ D. HCO3-
【解析】选B。金属钠与水反应生成氢氧化钠和氢气,而Al3+、H+ 、HCO3-均能与OH-反应,离子反应为
Al3++4OH- ====AlO2- + 2H2O,H+ +OH- ====H2O,
HCO3-+OH- ==== CO32- +H2O,故选B。
【方法技巧】铝元素在酸、碱性环境中的存在形式
(1)在酸性环境中铝元素以Al3+形式存在
Al、Al2O3、Al(OH)3、 Al3+
(2)在强碱性环境中铝元素以 形式存在
Al、Al2O3、Al(OH)3、Al3+
OH-
H+
二、非选择题(本题包括3小题,共30分)
6.(8分)用作净水剂的明矾[KAl(SO4)2·12H2O]是电解
质,溶于水后,存在下列电离:
KAl(SO4)2 ==== K++Al3++2SO42-,在明矾溶液中加入下列
物质时,请按要求作答:
(1) 加入BaCl2溶液反应的离子方程式为: ;
(2) 加入过量的氨水反应的离子方程式为: ;
【解析】(1) 加入BaCl2溶液时,钡离子沉淀溶液中的硫酸根离子,反应为Ba2++SO42-====BaSO4↓;
(2) 加入过量的氨水时,一水合氨电离产生的氢氧根离子沉淀溶液中的铝离子,反应为
Al3++3NH3·H2O====Al(OH)3↓+ 3NH4+。
答案:(1)Ba2++SO42-====BaSO4↓
(2)Al3++3NH3·H2O====Al(OH)3↓+3NH4+
7.(10分)某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、 SO42- 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如下图所示:
[已知:Mg2++2OH- ==== Mg(OH)2↓,
Fe3++3OH- ==== Fe(OH)3↓,且Mg(OH)2、Fe(OH)3难溶于
水;NH4+ +OH- ====NH3· H2O]
由此可知,该溶液中肯定含有的离子是_____,肯定不含的阳离子是_____。
【解析】开始加入2 mol NaOH时,溶液无沉淀产生,说明溶液中有H+,且其物质的量为2 mol;因为最终沉淀完全溶解,所以溶液中无Mg2+、Fe3+,且产生沉淀和沉淀溶解所需的NaOH的物质的量为3∶1,所以溶液中有Al3+且其物质的量为1 mol;当加入5~8 mol NaOH时,发生的反应为
NH4++OH- ====NH3· H2O,所以溶液中NH4+为3 mol,而阴离子SO42-一定含有。
答案:H+、NH4+ 、Al3+、SO42- Mg2+、Fe3+
8.(12分)(挑战能力)向20 mL某浓度的AlCl3溶液中滴加
2 mol/L的NaOH溶液时,所得沉淀的质量与加入NaOH溶液的体积之间的关系如图所示:
(1)图中A点的意义是 。
(2)最大沉淀量为 g。
(3)图中V1的值为 。
(4)所用AlCl3溶液的物质的量浓度为 。
【解析】向AlCl3溶液中滴NaOH溶液发生的反应有
AlCl3+3NaOH Al(OH)3↓+3NaCl ①
Al(OH)3+NaOH NaAlO2+2H2O ②
故(1)A点的意义表示此时沉淀达最大值。
(2)A点时恰好发生①
n[Al(OH)3]= n(NaOH)= ×2 mol/L×0.015 L
=0.01 mol, m[Al(OH)3]=0.01 mol×78 g/mol=0.78 g。
====
====
(3)A点到B点发生反应,Al(OH)3+OH- +2H2O,使
Al(OH)3完全溶解,消耗NaOH 0.01 mol
V(NaOH)= =0.005 L=5 mL
所以V1=15+5=20
(4)n(AlCl3)=n[Al(OH)3]=0.01 mol,
c(AlCl3)= = =0.5 mol/L。
答案:(1)加入15 mL NaOH溶液时产生沉淀的质量最大
(2)0.78 (3)20 (4)0.5 mol/L
====
氢氧化铝是典型的两性氢氧化物,既能与强酸反应,又能
与强碱反应。今用较纯净的铝屑制取氢氧化铝有多种方
案:
方案一: Al Al2(SO4)3 Al(OH)3
反应原理:2Al+6H+====2Al3++3H2↑
Al3++3OH―====Al(OH)3↓或
Al3++3NH3·H2O====Al(OH)3↓+3NH4+
H2SO4
NaOH
或氨水
方案二: Al NaAlO2 Al(OH)3
反应原理:2Al+2OH―+2H2O====2AlO2-+3H2↑
AlO2-+H++H2O====Al(OH)3↓或
AlO2-+CO2(过量)+2H2O====Al(OH)3↓+HCO3-
方案三:
反应原理:2Al+6H+====2Al3++3H2↑
2Al+2OH―+2H2O====2AlO2-+3H2↑
Al3++3AlO2-+6H2O====4Al(OH)3↓
NaOH
H2SO4
或CO2(过量)
【思考探究】
(1)方案一中最好加入哪种碱,为什么?
提示:方案一中加入的碱最好是氨水,因为氢氧化铝易溶于过量强碱中,操作时不易控制。
(2)方案二中最好加入硫酸还是通入CO2,为什么?
提示:方案二中最好通入CO2,因为氢氧化铝易溶于过量强酸中,操作时不易控制。
(3)填一填下表,你能得出什么结论?
提示:根据三种方案的反应原理不难算出制取1 mol Al(OH)3所需的原料的物质的量。
结论:从以上三种方案的试剂用量来看,方案三制备1 mol Al(OH)3需3/4 mol H+和3/4 mol OH-,酸与碱的用量最少,是最佳方案。
【典例1】已知单质A、B、C和甲、乙、丙、
丁四种化合物有如图的转化关系,C为密度
最小的气体,甲是一种高熔点的物质,丙
常温下是一种液体。
根据以上转化关系回答:
(1)写出下列物质的化学式:A______;B____;乙______。
(2)A原子的原子结构示意图为___________。
(3)写出下列变化的方程式:
①A与NaOH溶液反应的化学方程式_______________。
②甲与NaOH溶液反应的离子方程式________________。
【思路点拨】解答本题要注意以下两点:
【自主解答】本题主要考查铝的化合物之间的相互转化关系,从物质A作为突破口,A与NaOH反应放出H2,判断A是Al;由C+B→水,判断B为O2;由A+B→甲,判断甲为Al2O3;其余则容易判断:乙为NaAlO2,丁为Al(OH)3。
答案:(1)Al O2 NaAlO2 (2)
(3)①2Al+2NaOH+2H2O====2NaAlO2+3H2↑
②Al2O3+2OH-====2AlO2-+H2O
【互动探究】结合题目中的信息,利用A通过两步反
应制备丁物质的方案还有哪些?请用简单的流程图表示。
提示:①Al NaAlO2 Al(OH)3
②Al AlCl3 Al(OH)3
③Al AlCl3 Al(OH)3
NaOH溶液
HCl
HCl
NaOH溶液
HCl
足量氨水
【变式训练】在Al3+→Al(OH)3→AlO2-→(x)→Al3+的系列变
化中,判断x为( )
A.HCl
B.NaOH
C.Al(OH)3
D.CO2
【解析】选C。这是化合态铝元素一系列变化的生成物,而
不是各步转化所需加入的试剂,其转化关系为:
Al3+ Al(OH)3 AlO2- Al(OH)3 Al3+,
故选C。
OH-
OH-
H+
H+
【典例2】下列图像中,横坐标表示加入溶
液的体积,纵坐标表示产生沉淀的质量,
回答下列问题:
(1)表示向AlCl3溶液中逐渐滴加NaOH溶液的是_______;
(2)表示向NaAlO2溶液中逐渐滴加稀盐酸的是______;
(3)表示向AlCl3溶液中逐渐滴加氨水的是_________。
【思路点拨】解答本题要注意以下两点:
【自主解答】(1)此时发生的离子反应为Al3++3OH―====
Al(OH)3↓,Al(OH)3+ OH―====AlO2-+2H2O,所以①符合;
(2)此时发生的离子反应为AlO2-+H++H2O====Al(OH)3↓,Al(OH)3+3H+====Al3++3H2O,所以⑤符合;
(3)此时发生的离子反应为
Al3++3NH3·H2O====Al(OH)3↓+3NH4+,所以⑥符合。
答案:(1)① (2)⑤ (3)⑥
【互动探究】若是向HCl和AlCl3的混合溶液中逐渐滴加NaOH溶液,则:
(1)该过程的离子反应有哪些?
(2)上述图像中哪个符合?
提示:(1)发生的离子反应有H++ OH―====H2O,
Al3++3OH―====Al(OH)3↓,Al(OH)3+ OH-====AlO2-+2H2O。
(2)据离子反应可知③符合。
【变式训练】在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化钠加入量(X)与溶液中沉淀物的量(Y)的关系示意图中正确的是
( )
【解析】选C。该过程发生的离子反应为Mg2++2OH―====
Mg(OH)2↓,Al3++3OH―====Al(OH)3↓,Al(OH)3+OH-====
AlO2-+2H2O,所以C正确。
【典例】(2010·甘肃兰州高一检测)等体积的AlCl3溶液和NaOH溶液混合后,若沉淀中含 Al的质量与溶液中含Al的质量相等,则AlCl3溶液和NaOH溶液的物质的量浓度之比为
A.3∶2 B.2∶4 C.1∶4 D.2∶7
【思路点拨】解答本题要注意以下两点:
【自主解答】选D。设AlCl3、NaOH的物质的量分别为a、
b,
(1)若Al3+过量,Al3+ + 3OH―====Al(OH)3↓
1mol 3mol 1mol
则,
解得:a∶b=2∶3
(2)若OH―稍过量,Al3+ + 3OH―====Al(OH)3↓
1mol 3mol 1mol
a 3a a
Al(OH)3 + OH―====AlO2-+2H2O
1mol 1mol 1mol
(b-3a) (b-3a) (b-3a)
则,a-(b-3a)=(b-3a)
解得:a∶b=2∶7,故选D。
【互动探究】(1)当产生沉淀的量最大时,二者的物质的量浓度之比是多少?
(2)当二者的物质的量浓度之比是1∶4时,溶液中含铝元素的微粒是什么?
提示:(1)当二者的物质的量浓度之比是1∶3时产生沉淀的量最大。
(2)当二者的物质的量浓度之比是1∶4时,反应生成的氢氧化铝沉淀恰好溶解,铝元素只以AlO2-的形式存在。
【变式训练】(2011·福建师大附中高一检测)向100 mL
2 mol·L-1的AlCl3溶液中,逐滴加入NaOH溶液100 mL 时产生沉淀为7.8 g,则加入NaOH溶液的物质的量浓度是
( )
A.1 mol·L-1 B.1.5 mol·L-1
C.3 mol·L-1 D.6 moL·L-1
【解析】选C。7.8 g Al(OH)3的物质的量为0.1 mol,小于0.2 mol,不是最大值,则有两种情况。
(1)NaOH不足
设参加反应的NaOH的物质的量为n(NaOH)。
Al3++3OH-====Al(OH)3↓
3 1
n(NaOH) 0.1 mol
n(NaOH)=0.3 mol
c(NaOH)=0.3 mol/0.1 L=3 mol·L-1
(2)NaOH过量
Al3+全部沉淀为Al(OH)3,过量的NaOH溶解部分的Al(OH)3,只余0.1 mol Al(OH)3沉淀。
设使Al3+全部沉淀需NaOH的物质的量为n1(NaOH),溶解部分Al(OH)3需NaOH的物质的量为n2(NaOH)。
Al3+ + 3OH-====Al(OH)3↓
1 3 1
0.2 mol n1(NaOH) 0.2mol
n1(NaOH)=0.6 mol
Al(OH)3 + OH-====AlO2-+2H2O
1 1
0.1 mol n2(NaOH)
n2(NaOH)=0.1 mol
c(NaOH)=(0.6 mol+0.1 mol)/0.1 L=7 mol·L-1
【典例】向盛有蒸馏水的铝制易拉罐中投入2.3 g钠:
①写出发生反应的化学方程式__________。
②计算反应中生成的气体的体积(标准状况下)______L。
③把反应后的溶液倒入烧杯并均分成甲、乙两份,向甲中加入0.1 mol/L的HCl,当加入______L时,沉淀达到最大值;再加入_______L时,沉淀又恰好全部溶解。
④把③中最后所得的溶液再与乙混合,写出反应的离子方程式___________________________________________;
反应过程中生成的沉淀的质量为__________g。
【错因剖析】
【标准答案】
①2Na+2H2O====2NaOH+H2↑,
2NaOH+2Al+2H2O====2NaAlO2+3H2↑
②4.48
③0.5 1.5
④Al3++3AlO2-+6H2O====4Al(OH)3↓ 5.2
1.下列关于Al2O3的说法正确的是( )
A.Al2O3也可以通过分解反应制得
B.Al2O3加热分解为铝和氧气
C.Al2O3结构致密,所以可用铝制容器盛盐酸和NaOH溶液等
D.擦去表面氧化铝的铝条,在酒精灯上灼烧时,熔化的铝滴落下来
【解析】选A。A项:Al(OH)3是不溶性碱,所以Al(OH)3受
热分解也可制取Al2O3,2Al(OH)3 Al2O3+3H2O;B项:
Al2O3加热不分解,用电解法可制得铝;C项:Al2O3能与
HCl、NaOH溶液反应,所以HCl、NaOH溶液不能盛放在铝制
容器中;D项:擦去氧化膜的铝条,在酒精灯上加热时,由
于铝很活泼,接着与O2反应又生成一层氧化铝,包在熔化
的铝的外层,使得Al不会滴落下来。
△
====
2.要使氯化铝中的铝离子完全转化成氢氧化铝沉淀,应选的最佳试剂是( )
A.氢氧化钠溶液 B.稀盐酸
C.硝酸银溶液 D.氨水
【解析】选D。向氯化铝溶液中加入氨水,发生的离子反应为Al3++3NH3·H2O====Al(OH)3↓+3NH4+,若选用氢氧化钠溶液,易发生Al3++4OH―====AlO2-+2H2O,所以无法控制氢氧化钠的用量,而稀盐酸、硝酸银都不与氯化铝反应产生氢氧化铝沉淀,故选D。
3.向100 mL 1.0 mol·L-1的AlCl3溶液中逐滴加入
0.5 mol·L-1的NaOH溶液至过量,生成沉淀的物质的量与加入NaOH的量的理论曲线图正确的是( )
【解析】选D。向AlCl3溶液中逐滴加入NaOH溶液至过量,发生的反应依次是:Al3++3OH-====Al(OH)3↓、
Al(OH)3+OH-====AlO2-+2H2O,其现象是先产生白色沉淀,后沉淀逐渐减少,直到全部消失,而且沉淀最多和沉淀恰好消失时前后消耗的NaOH的物质的量之比为3∶1。
4. 铝、氧化铝、氢氧化铝和可溶性铝盐与过量强碱溶液的反应,其生成物有一定的规律,下列说法中正确的是( )
A.都有H2O生成
B.都有H2生成
C.都有AlO2-生成
D.都有Al3+生成
【解析】选C。2Al+2OH-+2H2O====2AlO2-+3H2↑,Al2O3+2OH―====2AlO2-+H2O,Al(OH)3+OH―====AlO2-+2H2O,Al3++4OH―====AlO2-+2H2O,据此可知C正确。
5.分析下图中各物质的转化关系。
(A) (溶液B) (无色溶液C) (白色沉淀D)
已知A是地壳中含量最高的金属元素单质。
(1)写出B、D的化学式:B________;D___________。
(2)写出下列离子方程式:
A→B:____________________;
C→D:____________________。
氢氧化钠
过量盐酸
氨水
【解析】因为A是地壳中含量最高的金属元素单质,则A为Al,B为NaAlO2,C为AlCl3,D为Al(OH)3。
答案:(1)NaAlO2 Al(OH)3
(2)2Al+2OH-+2H2O====2AlO2-+3H2↑
Al3++3NH3·H2O====Al(OH)3↓+3NH4+
一、选择题(本题包括5小题,每小题4分,共20分)
1.(2011·海淀高一检测) 氢氧化铝可作为治疗胃酸过多的内服药,这是利用了氢氧化铝的( )
A.两性 B.碱性 C.酸性 D.不稳定性
【解析】选B。氢氧化铝与酸反应,体现了氢氧化铝的碱性,B正确。
2.(2011·福州高一检测)既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
①Al(OH)3 ②Al2O3 ③Al ④NaHCO3
A.①③ B.①②③ C.全部 D.①④
【解析】选C。Al、Al2O3、Al(OH)3、NaHCO3四种物质既能与盐酸反应,又能与NaOH溶液反应。
3.向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )
【解析】选D。MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液,发生反应的离子方程式为Mg2++2OH-====Mg(OH)2↓,Al3++3OH- ==== Al(OH)3↓,沉淀逐渐增多,当Al3+、Mg2+完全沉淀后,由于Al(OH)3具有两性,可溶于NaOH溶液,Al(OH)3+OH- ====AlO2-+2H2O,而Mg(OH)2不溶,所以沉淀部分溶解后不再变化,故选D。
4.(2011·鞍山高一检测)下列变化不可能通过一步实验直
接完成的是( )
A.Al(OH)3 Al2O3
B.Al2O3 Al(OH)3
C.Al AlO2-
D.Al3+ Al(OH)3
【解析】选B。A项反应为2Al(OH)3 Al2O3+3H2O;B
项,Al2O3不溶于水,也不与水反应;C项,反应为2Al+2OH-
+2H2O====2AlO2-+3H2↑;D项反应为Al3++3OH―
====Al(OH)3↓,故选B。
△
====
5.下列离子在加入金属钠后的溶液中仍能大量存在的是 ( )
A. Al3+ B. AlO2- C. H+ D. HCO3-
【解析】选B。金属钠与水反应生成氢氧化钠和氢气,而Al3+、H+ 、HCO3-均能与OH-反应,离子反应为
Al3++4OH- ====AlO2- + 2H2O,H+ +OH- ====H2O,
HCO3-+OH- ==== CO32- +H2O,故选B。
【方法技巧】铝元素在酸、碱性环境中的存在形式
(1)在酸性环境中铝元素以Al3+形式存在
Al、Al2O3、Al(OH)3、 Al3+
(2)在强碱性环境中铝元素以 形式存在
Al、Al2O3、Al(OH)3、Al3+
OH-
H+
二、非选择题(本题包括3小题,共30分)
6.(8分)用作净水剂的明矾[KAl(SO4)2·12H2O]是电解
质,溶于水后,存在下列电离:
KAl(SO4)2 ==== K++Al3++2SO42-,在明矾溶液中加入下列
物质时,请按要求作答:
(1) 加入BaCl2溶液反应的离子方程式为: ;
(2) 加入过量的氨水反应的离子方程式为: ;
【解析】(1) 加入BaCl2溶液时,钡离子沉淀溶液中的硫酸根离子,反应为Ba2++SO42-====BaSO4↓;
(2) 加入过量的氨水时,一水合氨电离产生的氢氧根离子沉淀溶液中的铝离子,反应为
Al3++3NH3·H2O====Al(OH)3↓+ 3NH4+。
答案:(1)Ba2++SO42-====BaSO4↓
(2)Al3++3NH3·H2O====Al(OH)3↓+3NH4+
7.(10分)某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、 SO42- 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如下图所示:
[已知:Mg2++2OH- ==== Mg(OH)2↓,
Fe3++3OH- ==== Fe(OH)3↓,且Mg(OH)2、Fe(OH)3难溶于
水;NH4+ +OH- ====NH3· H2O]
由此可知,该溶液中肯定含有的离子是_____,肯定不含的阳离子是_____。
【解析】开始加入2 mol NaOH时,溶液无沉淀产生,说明溶液中有H+,且其物质的量为2 mol;因为最终沉淀完全溶解,所以溶液中无Mg2+、Fe3+,且产生沉淀和沉淀溶解所需的NaOH的物质的量为3∶1,所以溶液中有Al3+且其物质的量为1 mol;当加入5~8 mol NaOH时,发生的反应为
NH4++OH- ====NH3· H2O,所以溶液中NH4+为3 mol,而阴离子SO42-一定含有。
答案:H+、NH4+ 、Al3+、SO42- Mg2+、Fe3+
8.(12分)(挑战能力)向20 mL某浓度的AlCl3溶液中滴加
2 mol/L的NaOH溶液时,所得沉淀的质量与加入NaOH溶液的体积之间的关系如图所示:
(1)图中A点的意义是 。
(2)最大沉淀量为 g。
(3)图中V1的值为 。
(4)所用AlCl3溶液的物质的量浓度为 。
【解析】向AlCl3溶液中滴NaOH溶液发生的反应有
AlCl3+3NaOH Al(OH)3↓+3NaCl ①
Al(OH)3+NaOH NaAlO2+2H2O ②
故(1)A点的意义表示此时沉淀达最大值。
(2)A点时恰好发生①
n[Al(OH)3]= n(NaOH)= ×2 mol/L×0.015 L
=0.01 mol, m[Al(OH)3]=0.01 mol×78 g/mol=0.78 g。
====
====
(3)A点到B点发生反应,Al(OH)3+OH- +2H2O,使
Al(OH)3完全溶解,消耗NaOH 0.01 mol
V(NaOH)= =0.005 L=5 mL
所以V1=15+5=20
(4)n(AlCl3)=n[Al(OH)3]=0.01 mol,
c(AlCl3)= = =0.5 mol/L。
答案:(1)加入15 mL NaOH溶液时产生沉淀的质量最大
(2)0.78 (3)20 (4)0.5 mol/L
====
氢氧化铝是典型的两性氢氧化物,既能与强酸反应,又能
与强碱反应。今用较纯净的铝屑制取氢氧化铝有多种方
案:
方案一: Al Al2(SO4)3 Al(OH)3
反应原理:2Al+6H+====2Al3++3H2↑
Al3++3OH―====Al(OH)3↓或
Al3++3NH3·H2O====Al(OH)3↓+3NH4+
H2SO4
NaOH
或氨水
方案二: Al NaAlO2 Al(OH)3
反应原理:2Al+2OH―+2H2O====2AlO2-+3H2↑
AlO2-+H++H2O====Al(OH)3↓或
AlO2-+CO2(过量)+2H2O====Al(OH)3↓+HCO3-
方案三:
反应原理:2Al+6H+====2Al3++3H2↑
2Al+2OH―+2H2O====2AlO2-+3H2↑
Al3++3AlO2-+6H2O====4Al(OH)3↓
NaOH
H2SO4
或CO2(过量)
【思考探究】
(1)方案一中最好加入哪种碱,为什么?
提示:方案一中加入的碱最好是氨水,因为氢氧化铝易溶于过量强碱中,操作时不易控制。
(2)方案二中最好加入硫酸还是通入CO2,为什么?
提示:方案二中最好通入CO2,因为氢氧化铝易溶于过量强酸中,操作时不易控制。
(3)填一填下表,你能得出什么结论?
提示:根据三种方案的反应原理不难算出制取1 mol Al(OH)3所需的原料的物质的量。
结论:从以上三种方案的试剂用量来看,方案三制备1 mol Al(OH)3需3/4 mol H+和3/4 mol OH-,酸与碱的用量最少,是最佳方案。
