【开学大礼包】2012高二化学课件:4.1原电池(人教版选修4)
文档属性
| 名称 | 【开学大礼包】2012高二化学课件:4.1原电池(人教版选修4) |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 12:59:12 | ||
图片预览









文档简介
(共61张PPT)
1.在必修2曾经学习过的将锌片和铜片直接置于CuSO4溶液的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?
提示:由于锌片与CuSO4溶液直接接触,反应一段时间后,难以避免溶液中有Cu2+在锌片表面被直接还原,一旦有少量铜在锌片表面析出,指示向外输出的电流强度减弱,当锌片表面完全被铜覆盖后,反应就终止了,也就无电流再产生。
2.从原电池装置中取出盐桥,为什么就不会产生电流了?
提示:盐桥中的盐溶液是电解质溶液,能使两个烧杯中的溶液连成一个通路。取出盐桥不再形成闭合回路,同时由于Zn原子失去电子成为Zn2+进入溶液,使ZnSO4溶液因Zn2+增加而带正电;同时Cu2+获得电子成为金属铜沉淀在铜片上,使CuSO4溶液因SO42-相对增加而带负电。这两种因素均会阻止电子从锌片流向铜片,造成不产生电流的现象。
3.有盐桥装置的原电池为什么能够持续、稳定的产生电流?
提示:当有盐桥存在时,随着反应的进行,盐桥中的Cl-会移向ZnSO4溶液,K+移向CuSO4溶液,使ZnSO4溶液和CuSO4溶液均保持电中性,氧化还原反应得以继续进行,从而使原电池不断地产生电流。
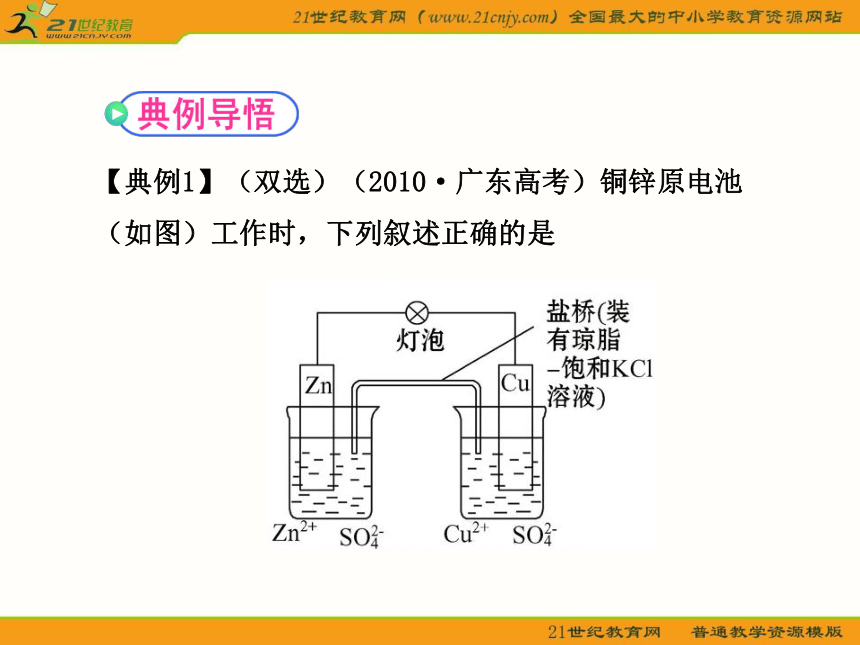
【典例1】(双选)(2010·广东高考)铜锌原电池(如图)工作时,下列叙述正确的是
A.正极反应为:Zn-2e- ==== Zn2+
B.电池反应为:Zn+Cu2+ ==== Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
【思路点拨】先由图示条件判断原电池的正负极→再结合原电池原理及原电池的有关性质进行判断。
【自主解答】选B、C。Zn是原电池的负极,故A错;原电池总反应与没有形成原电池时的氧化还原反应相同,故B正确;根据闭合回路的电流方向,在外电路中,电流由正极流向负极,因电子流向与电流的方向相反,即电子由负极流向正极,故C正确;在溶液中,阳离子向正极移动,故D错。
1.请依据原电池原理,将反应2FeCl3+Cu2 ==== FeCl2+
CuCl2设计成一个原电池。写出电极反应,确定电极材料和电解质溶液。
提示:(1)电极反应:将氧化还原反应拆成氧化反应和还原反应两个半反应,分别作原电池的负极和正极的电极反应式。
负极:Cu-2e- ==== Cu2+
正极:2Fe3++2e- ==== 2Fe2+。
(2)电极材料
如发生氧化反应的物质为金属单质,可用该金属直接作负极;如生成气体(如H2)或溶液中的还原性离子发生氧化反应,可用惰性电极(如Pt、碳棒)作负极。
发生还原反应的电极材料必须比负极材料活泼性差。
本例中可用铜棒作负极,用铂丝或碳棒作正极。
(3)电解质溶液
一般选用含反应物的电解质溶液即可。如本例中可用FeCl3溶液作电解质溶液。
2.为什么原电池反应可以加快化学反应速率?
提示:以铜-锌-稀硫酸原电池为例:如果直接将锌放入稀硫酸中,氢离子要在锌板表面得电子,生成氢气逸出,同时锌被氧化成锌离子从锌板上脱落聚集在锌板附近;因氢离子和锌离子都带正电,相互排斥,所以氢离子不易直接连续从锌板上得电子。而构成原电池后,氢离子在铜板上得电子,就解决了这一矛盾,因而加快了反应速率。还有:锌铜两极的电势差还有助于电子的转移,也对加快反应速率起作用。
【典例2】依据氧化还原反应:
2Ag+(aq)+Cu(s)====
Cu2+(aq)+2Ag(s)设计的原
电池如图所示。
请回答下列问题:
(1)电极X的材料是_____;电解质溶液Y是_____。
(2)银电极为电池的_____极,发生的电极反应为__________,X电极上发生的电极反应为__________。
(3)外电路中的电子是从_____电极流向_____电极。
【思路点拨】电极X的材料应是发生氧化反应的物质,电解质溶液Y应是含有发生还原反应的阳离子的电解质溶液,此题中Y应是含有Ag+的可溶性的电解质溶液。
【自主解答】根据所给氧化还原反应方程式,结合原电池反应原理以及所给原电池装置,Cu作负极,AgNO3溶液为电解质溶液,从而推知:(1)X的材料为铜,Y是AgNO3溶液(或其他Ag+的可溶性溶液)。(2)银为原电池的正极,发生的电极反应为Ag++e- ==== Ag;X电极上发生的电极反应为Cu-2e- === Cu2+。(3)外电路中的电子从铜电极流向银电极。
答案:(1)铜 AgNO3溶液(或其他Ag+的可溶性溶液)
(2)正 Ag++e- ==== Ag Cu-2e- ==== Cu2+
(3)铜 银
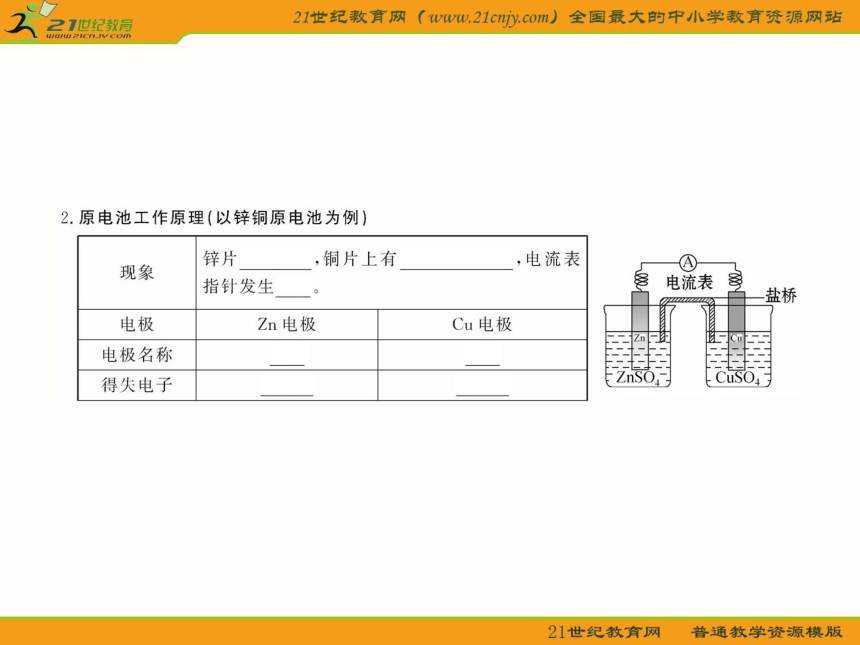
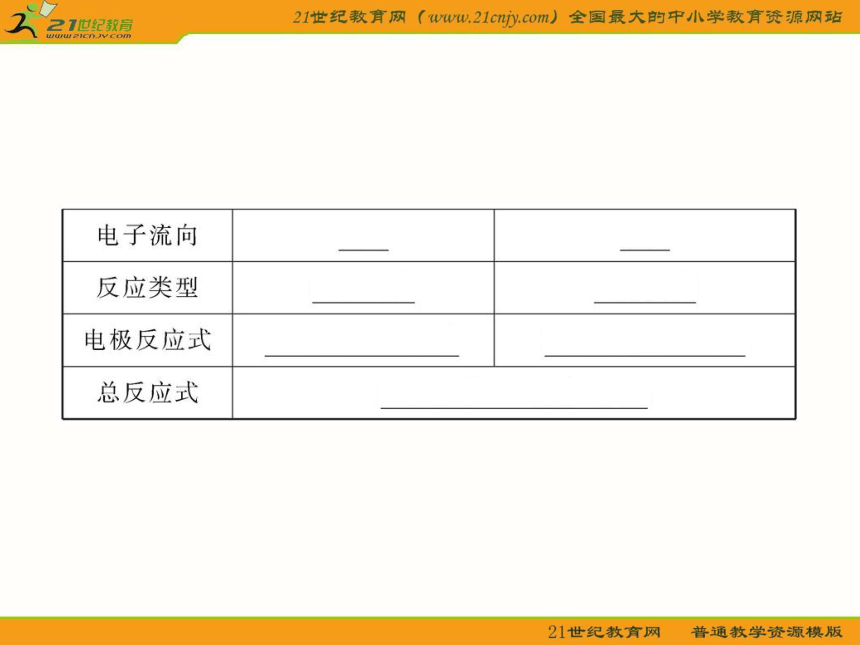
知识点一:原电池的工作原理
1.如图所示的装置能构成原电池产生电流的是( )
A.①③④⑤⑥ B.①②③④⑤
C.①②③④ D.①②③
【解析】选D。依据构成原电池的条件分析:④中没有构成闭合回路;⑤中两电极相同;⑥中酒精是非电解质;只有①②③符合条件,故选D。
2.某单质能和盐酸反应生成氢气,该单质与锌组成原电池时,锌为负极,该金属可能为( )
A.铝 B.铜 C.锡 D.石墨
【解析】选C。铜、石墨和盐酸不反应,铝、锡能和盐酸反应生成氢气;与锌组成原电池时,锌为负极,说明该金属不如锌活泼,故只有锡符合题意。
3.在盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO42-浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
【解析】选D。本题符合铜锌原电池的形成条件,原电池工作时,电子由负极(锌)经外电路(导线)流向正极(铜)。负极锌片:Zn-2e- ==== Zn2+;正极铜片:2H++2e- ==== H2↑,总反应为:Zn+2H+ ==== Zn2++ H2↑,原电池中没有产生O2。没有参与反应的SO42-浓度不会逐渐增大。
知识点二:原电池的设计
4.理论上不能设计为原电池的化学反应是( )
A.CH4(g)+2O2(g) ==== CO2(g)+2H2O(l) ΔH<0
B.HNO3(aq)+NaOH(aq) ==== NaNO3(aq)+H2O(l)
ΔH<0
C.2H2(g)+O2(g) ==== 2H2O(l) ΔH<0
D.2FeCl3(aq)+Fe(s) ==== 3FeCl2(aq) ΔH<0
【解析】选B。理论上,能设计成原电池的均为能自发进行的氧化还原反应,而B是非氧化还原反应,故不可以。
5.利用反应:Zn+2FeCl3 ==== ZnCl2+2FeCl2组成一个化学电池。
(1)画出装置图,并指出正极为_____,电极反应式为:__________;负极为_____,电极反应式为:____
______。
(2)若电池内溶液为100 mL 0.5 mol/L的FeCl3溶液,当溶液中FeCl3全部被还原成FeCl2时,溶液中ZnCl2的物质的量浓度是_____,导线上通过的电子是_____mol。
【解析】(1)据氧化还原反应方程式知还原剂Zn为负
极,电极反应为:Zn-2e-====Zn2+,正极可为Cu、Fe、
Ag或石墨,电极反应为:2Fe3++2e- ==== 2Fe2+。
(2)n(Fe3+)=0.5 mol/L×0.1 L=0.05 mol,则转
移电子为0.05 mol,c(ZnCl2)= =0.25 mol/L。
答案:(1)装置图如图所示
石墨 2Fe3++2e- ==== 2Fe2+
Zn Zn-2e- ==== Zn2+
(2)0.25 mol/L 0.05
知识点三:原电池的应用
6.将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加少量的CuSO4溶液,下列各图中产生H2的体积V(L)与时间t(min)的关系,正确的是( )
【解析】选A。a中锌先与Cu2+反应,生成的Cu与Zn形成原电池,加快了反应速率,但锌粉被消耗了一部分,造成产生H2的量变少。
一、选择题(本题包括5小题,每小题4分,共20分)
1.某原电池反应的离子方程式为:Fe+2H+====Fe2+
+H2↑,则下列说法正确的是( )
A.HNO3为电解质溶液 B.锌为原电池正极
C.铁极质量不变 D.铜为原电池正极
【解析】选D。由电池反应的离子方程式知,电池的负极为铁,则正极应是比铁活泼性差的金属(B被否定)。在反应中负极不断被消耗(C错)。由于反应中放出了氢气并生成了Fe2+,故知电解质溶液不能是HNO3。由以上分析可知正确选项为D。
2.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e- ==== Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
【解析】选C。该原电池中Cu作负极,Ag作正极,负极反应式为Cu-2e- ==== Cu2+,正极反应式为Ag++e- ==== Ag,因此②对;在外电路中,电子由Cu电极流向Ag电极,而电流方向与电子流向相反,所以①错;没有盐桥,原电池不能继续工作,所以③错;无论是否为原电池,反应实质相同,均为氧化还原反应,所以④对。
3.如图所示,两电极一为碳棒,一
为铁片,若电流表的指针发生偏转,
且a极上有大量气泡生成,则以下叙
述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
【解析】选C。根据原电池原理,负极发生氧化反应,金属溶解,故铁为负极;正极发生还原反应,若烧杯中的溶液为硫酸铜溶液,则析出铜,若烧杯中的溶液为硫酸,则析出H2,故a是正极,b是负极,电解质为硫酸。
4.如图所示的装置中,M为活动性顺序
位于氢之前的金属,N为石墨棒,关于
此装置的下列叙述中,不正确的是
( )
A.N极上有气体放出
B.M为负极,N为正极
C.是化学能转变为电能的装置
D.导线中有电流通过,电流方向是由M到N
【解析】选D。原电池中活泼金属为负极,失去电子,即M为负极,溶液中的氢离子在正极得到电子被还原为H2,则N为正极。电流方向与电子流向相反,应由正极(N)流向负极(M)。
5.如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
【解析】选C。M棒变粗,N棒变细可知N为负极,金属原子失电子,因此N极的金属比M极要活泼。M棒变粗,说明有金属离子得电子,且得电子能力比H+强。
二、非选择题(本题包括1小题,共10分)
6.利用反应方程式:Fe+CuSO4 ====
Cu+FeSO4设计一个原电池。在方
框内画出实验装置简图,并指出:
电解质为_____溶液;
正极为_____,电极反应:__________;
负极为_____,电极反应:__________。
【解析】根据反应方程式:Fe+CuSO4 ==== Cu+FeSO4可知,Fe失去电子,发生氧化反应,Fe为负极;Cu2+得到电子,发生还原反应,为正极,故CuSO4为电解质溶液。
答案:
CuSO4
C或Cu Cu2++2e- ==== Cu
Fe Fe-2e- ==== Fe2+
1.(5分)控制适合的条件,将反应2Fe3++2I- ==== 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是 ( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
【解析】选D。乙中I-失去电子放电,发生氧化反应,A正确;由总反应方程式知,Fe3+被还原成Fe2+,B正确;当电流计读数为零时,说明正逆反应转移的电子数量相等,反应达到平衡,C正确。加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,D错误。
2.(15分)某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极是否相同?______。
(2)写出实验3中的电极反应式:
负极:__________________;
正极:__________________。
(3)实验4中的铝作正极还是负极?______。写出电池总反应方程式:__________________。
(4)解释实验5中电流计指针偏向铝的原因。
【解析】在稀盐酸中Mg比Al活泼,Mg作原电池的负极,Al作原电池的正极,电流计指针偏向Al;在稀盐酸中Al比Cu活泼,Al作原电池的负极,Cu作原电池的正极,电流计指针偏向Cu。由此可知,在这里的原电池中电流计指针是偏向正极。在实验3中电流计指针偏向石墨,由上述规律可知,在该原电池中铝作负极,石墨作正极。化学反应是铝失去电子被氧化为铝离子,盐酸中的氢离子得到电子被还原为氢气。在氢氧化钠溶液中Al能与NaOH发生氧化还原反应而Mg不能与
NaOH反应,所以Al作原电池的负极,Mg作原电池的正极。铝在浓硝酸中钝化,锌在浓硝酸中被氧化,即在浓硝酸中Zn比Al活泼,Zn作原电池的负极,Al作原电池的正极,所以在实验5中电流计指针偏向铝。
答案:(1)不相同
(2)2Al-6e- ==== 2Al3+ 6H++6e- ==== 3H2↑
(3)负极 2Al+2NaOH+2H2O ==== 2NaAlO2+3H2↑
(4)铝在浓硝酸中钝化,锌在浓硝酸中可以被氧化,即在浓硝酸中Zn比Al活泼,Zn作原电池的负极,Al作原电池的正极,所以电流计指针偏向铝。
1.在必修2曾经学习过的将锌片和铜片直接置于CuSO4溶液的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?
提示:由于锌片与CuSO4溶液直接接触,反应一段时间后,难以避免溶液中有Cu2+在锌片表面被直接还原,一旦有少量铜在锌片表面析出,指示向外输出的电流强度减弱,当锌片表面完全被铜覆盖后,反应就终止了,也就无电流再产生。
2.从原电池装置中取出盐桥,为什么就不会产生电流了?
提示:盐桥中的盐溶液是电解质溶液,能使两个烧杯中的溶液连成一个通路。取出盐桥不再形成闭合回路,同时由于Zn原子失去电子成为Zn2+进入溶液,使ZnSO4溶液因Zn2+增加而带正电;同时Cu2+获得电子成为金属铜沉淀在铜片上,使CuSO4溶液因SO42-相对增加而带负电。这两种因素均会阻止电子从锌片流向铜片,造成不产生电流的现象。
3.有盐桥装置的原电池为什么能够持续、稳定的产生电流?
提示:当有盐桥存在时,随着反应的进行,盐桥中的Cl-会移向ZnSO4溶液,K+移向CuSO4溶液,使ZnSO4溶液和CuSO4溶液均保持电中性,氧化还原反应得以继续进行,从而使原电池不断地产生电流。
【典例1】(双选)(2010·广东高考)铜锌原电池(如图)工作时,下列叙述正确的是
A.正极反应为:Zn-2e- ==== Zn2+
B.电池反应为:Zn+Cu2+ ==== Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
【思路点拨】先由图示条件判断原电池的正负极→再结合原电池原理及原电池的有关性质进行判断。
【自主解答】选B、C。Zn是原电池的负极,故A错;原电池总反应与没有形成原电池时的氧化还原反应相同,故B正确;根据闭合回路的电流方向,在外电路中,电流由正极流向负极,因电子流向与电流的方向相反,即电子由负极流向正极,故C正确;在溶液中,阳离子向正极移动,故D错。
1.请依据原电池原理,将反应2FeCl3+Cu2 ==== FeCl2+
CuCl2设计成一个原电池。写出电极反应,确定电极材料和电解质溶液。
提示:(1)电极反应:将氧化还原反应拆成氧化反应和还原反应两个半反应,分别作原电池的负极和正极的电极反应式。
负极:Cu-2e- ==== Cu2+
正极:2Fe3++2e- ==== 2Fe2+。
(2)电极材料
如发生氧化反应的物质为金属单质,可用该金属直接作负极;如生成气体(如H2)或溶液中的还原性离子发生氧化反应,可用惰性电极(如Pt、碳棒)作负极。
发生还原反应的电极材料必须比负极材料活泼性差。
本例中可用铜棒作负极,用铂丝或碳棒作正极。
(3)电解质溶液
一般选用含反应物的电解质溶液即可。如本例中可用FeCl3溶液作电解质溶液。
2.为什么原电池反应可以加快化学反应速率?
提示:以铜-锌-稀硫酸原电池为例:如果直接将锌放入稀硫酸中,氢离子要在锌板表面得电子,生成氢气逸出,同时锌被氧化成锌离子从锌板上脱落聚集在锌板附近;因氢离子和锌离子都带正电,相互排斥,所以氢离子不易直接连续从锌板上得电子。而构成原电池后,氢离子在铜板上得电子,就解决了这一矛盾,因而加快了反应速率。还有:锌铜两极的电势差还有助于电子的转移,也对加快反应速率起作用。
【典例2】依据氧化还原反应:
2Ag+(aq)+Cu(s)====
Cu2+(aq)+2Ag(s)设计的原
电池如图所示。
请回答下列问题:
(1)电极X的材料是_____;电解质溶液Y是_____。
(2)银电极为电池的_____极,发生的电极反应为__________,X电极上发生的电极反应为__________。
(3)外电路中的电子是从_____电极流向_____电极。
【思路点拨】电极X的材料应是发生氧化反应的物质,电解质溶液Y应是含有发生还原反应的阳离子的电解质溶液,此题中Y应是含有Ag+的可溶性的电解质溶液。
【自主解答】根据所给氧化还原反应方程式,结合原电池反应原理以及所给原电池装置,Cu作负极,AgNO3溶液为电解质溶液,从而推知:(1)X的材料为铜,Y是AgNO3溶液(或其他Ag+的可溶性溶液)。(2)银为原电池的正极,发生的电极反应为Ag++e- ==== Ag;X电极上发生的电极反应为Cu-2e- === Cu2+。(3)外电路中的电子从铜电极流向银电极。
答案:(1)铜 AgNO3溶液(或其他Ag+的可溶性溶液)
(2)正 Ag++e- ==== Ag Cu-2e- ==== Cu2+
(3)铜 银
知识点一:原电池的工作原理
1.如图所示的装置能构成原电池产生电流的是( )
A.①③④⑤⑥ B.①②③④⑤
C.①②③④ D.①②③
【解析】选D。依据构成原电池的条件分析:④中没有构成闭合回路;⑤中两电极相同;⑥中酒精是非电解质;只有①②③符合条件,故选D。
2.某单质能和盐酸反应生成氢气,该单质与锌组成原电池时,锌为负极,该金属可能为( )
A.铝 B.铜 C.锡 D.石墨
【解析】选C。铜、石墨和盐酸不反应,铝、锡能和盐酸反应生成氢气;与锌组成原电池时,锌为负极,说明该金属不如锌活泼,故只有锡符合题意。
3.在盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO42-浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
【解析】选D。本题符合铜锌原电池的形成条件,原电池工作时,电子由负极(锌)经外电路(导线)流向正极(铜)。负极锌片:Zn-2e- ==== Zn2+;正极铜片:2H++2e- ==== H2↑,总反应为:Zn+2H+ ==== Zn2++ H2↑,原电池中没有产生O2。没有参与反应的SO42-浓度不会逐渐增大。
知识点二:原电池的设计
4.理论上不能设计为原电池的化学反应是( )
A.CH4(g)+2O2(g) ==== CO2(g)+2H2O(l) ΔH<0
B.HNO3(aq)+NaOH(aq) ==== NaNO3(aq)+H2O(l)
ΔH<0
C.2H2(g)+O2(g) ==== 2H2O(l) ΔH<0
D.2FeCl3(aq)+Fe(s) ==== 3FeCl2(aq) ΔH<0
【解析】选B。理论上,能设计成原电池的均为能自发进行的氧化还原反应,而B是非氧化还原反应,故不可以。
5.利用反应:Zn+2FeCl3 ==== ZnCl2+2FeCl2组成一个化学电池。
(1)画出装置图,并指出正极为_____,电极反应式为:__________;负极为_____,电极反应式为:____
______。
(2)若电池内溶液为100 mL 0.5 mol/L的FeCl3溶液,当溶液中FeCl3全部被还原成FeCl2时,溶液中ZnCl2的物质的量浓度是_____,导线上通过的电子是_____mol。
【解析】(1)据氧化还原反应方程式知还原剂Zn为负
极,电极反应为:Zn-2e-====Zn2+,正极可为Cu、Fe、
Ag或石墨,电极反应为:2Fe3++2e- ==== 2Fe2+。
(2)n(Fe3+)=0.5 mol/L×0.1 L=0.05 mol,则转
移电子为0.05 mol,c(ZnCl2)= =0.25 mol/L。
答案:(1)装置图如图所示
石墨 2Fe3++2e- ==== 2Fe2+
Zn Zn-2e- ==== Zn2+
(2)0.25 mol/L 0.05
知识点三:原电池的应用
6.将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加少量的CuSO4溶液,下列各图中产生H2的体积V(L)与时间t(min)的关系,正确的是( )
【解析】选A。a中锌先与Cu2+反应,生成的Cu与Zn形成原电池,加快了反应速率,但锌粉被消耗了一部分,造成产生H2的量变少。
一、选择题(本题包括5小题,每小题4分,共20分)
1.某原电池反应的离子方程式为:Fe+2H+====Fe2+
+H2↑,则下列说法正确的是( )
A.HNO3为电解质溶液 B.锌为原电池正极
C.铁极质量不变 D.铜为原电池正极
【解析】选D。由电池反应的离子方程式知,电池的负极为铁,则正极应是比铁活泼性差的金属(B被否定)。在反应中负极不断被消耗(C错)。由于反应中放出了氢气并生成了Fe2+,故知电解质溶液不能是HNO3。由以上分析可知正确选项为D。
2.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e- ==== Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
【解析】选C。该原电池中Cu作负极,Ag作正极,负极反应式为Cu-2e- ==== Cu2+,正极反应式为Ag++e- ==== Ag,因此②对;在外电路中,电子由Cu电极流向Ag电极,而电流方向与电子流向相反,所以①错;没有盐桥,原电池不能继续工作,所以③错;无论是否为原电池,反应实质相同,均为氧化还原反应,所以④对。
3.如图所示,两电极一为碳棒,一
为铁片,若电流表的指针发生偏转,
且a极上有大量气泡生成,则以下叙
述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
【解析】选C。根据原电池原理,负极发生氧化反应,金属溶解,故铁为负极;正极发生还原反应,若烧杯中的溶液为硫酸铜溶液,则析出铜,若烧杯中的溶液为硫酸,则析出H2,故a是正极,b是负极,电解质为硫酸。
4.如图所示的装置中,M为活动性顺序
位于氢之前的金属,N为石墨棒,关于
此装置的下列叙述中,不正确的是
( )
A.N极上有气体放出
B.M为负极,N为正极
C.是化学能转变为电能的装置
D.导线中有电流通过,电流方向是由M到N
【解析】选D。原电池中活泼金属为负极,失去电子,即M为负极,溶液中的氢离子在正极得到电子被还原为H2,则N为正极。电流方向与电子流向相反,应由正极(N)流向负极(M)。
5.如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
【解析】选C。M棒变粗,N棒变细可知N为负极,金属原子失电子,因此N极的金属比M极要活泼。M棒变粗,说明有金属离子得电子,且得电子能力比H+强。
二、非选择题(本题包括1小题,共10分)
6.利用反应方程式:Fe+CuSO4 ====
Cu+FeSO4设计一个原电池。在方
框内画出实验装置简图,并指出:
电解质为_____溶液;
正极为_____,电极反应:__________;
负极为_____,电极反应:__________。
【解析】根据反应方程式:Fe+CuSO4 ==== Cu+FeSO4可知,Fe失去电子,发生氧化反应,Fe为负极;Cu2+得到电子,发生还原反应,为正极,故CuSO4为电解质溶液。
答案:
CuSO4
C或Cu Cu2++2e- ==== Cu
Fe Fe-2e- ==== Fe2+
1.(5分)控制适合的条件,将反应2Fe3++2I- ==== 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是 ( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
【解析】选D。乙中I-失去电子放电,发生氧化反应,A正确;由总反应方程式知,Fe3+被还原成Fe2+,B正确;当电流计读数为零时,说明正逆反应转移的电子数量相等,反应达到平衡,C正确。加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,D错误。
2.(15分)某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极是否相同?______。
(2)写出实验3中的电极反应式:
负极:__________________;
正极:__________________。
(3)实验4中的铝作正极还是负极?______。写出电池总反应方程式:__________________。
(4)解释实验5中电流计指针偏向铝的原因。
【解析】在稀盐酸中Mg比Al活泼,Mg作原电池的负极,Al作原电池的正极,电流计指针偏向Al;在稀盐酸中Al比Cu活泼,Al作原电池的负极,Cu作原电池的正极,电流计指针偏向Cu。由此可知,在这里的原电池中电流计指针是偏向正极。在实验3中电流计指针偏向石墨,由上述规律可知,在该原电池中铝作负极,石墨作正极。化学反应是铝失去电子被氧化为铝离子,盐酸中的氢离子得到电子被还原为氢气。在氢氧化钠溶液中Al能与NaOH发生氧化还原反应而Mg不能与
NaOH反应,所以Al作原电池的负极,Mg作原电池的正极。铝在浓硝酸中钝化,锌在浓硝酸中被氧化,即在浓硝酸中Zn比Al活泼,Zn作原电池的负极,Al作原电池的正极,所以在实验5中电流计指针偏向铝。
答案:(1)不相同
(2)2Al-6e- ==== 2Al3+ 6H++6e- ==== 3H2↑
(3)负极 2Al+2NaOH+2H2O ==== 2NaAlO2+3H2↑
(4)铝在浓硝酸中钝化,锌在浓硝酸中可以被氧化,即在浓硝酸中Zn比Al活泼,Zn作原电池的负极,Al作原电池的正极,所以电流计指针偏向铝。
