【开学大礼包】2012高二化学课件:4.2化学电源(人教版选修4)
文档属性
| 名称 | 【开学大礼包】2012高二化学课件:4.2化学电源(人教版选修4) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 00:00:00 | ||
图片预览











文档简介
(共69张PPT)
1.如果你拥有一个笔记本电脑,你希望电脑中的电池有哪些优点?
提示:电容量大,工作寿命长,充电时间短,体积小,质量轻,性价比高等。
2.如果你是一个研制电池的工程师,在开发新产品时将主要考虑哪些问题?
提示:需要了解新产品的技术指标和生产成本是最基本的要求。例如:
①电池功率的大小(涉及活性物质及相关电解质溶液等填充物的选择);
②电池的使用环境(涉及电池使用的安全性以及对电池的外形、质量大小和外包装等方面的要求);
③电池的连续工作时间或使用寿命(涉及活性物质用量、电池的记忆效应以及电池自身放电率的大小等因素);
④电池废弃后,其内容物可能对环境的影响等。
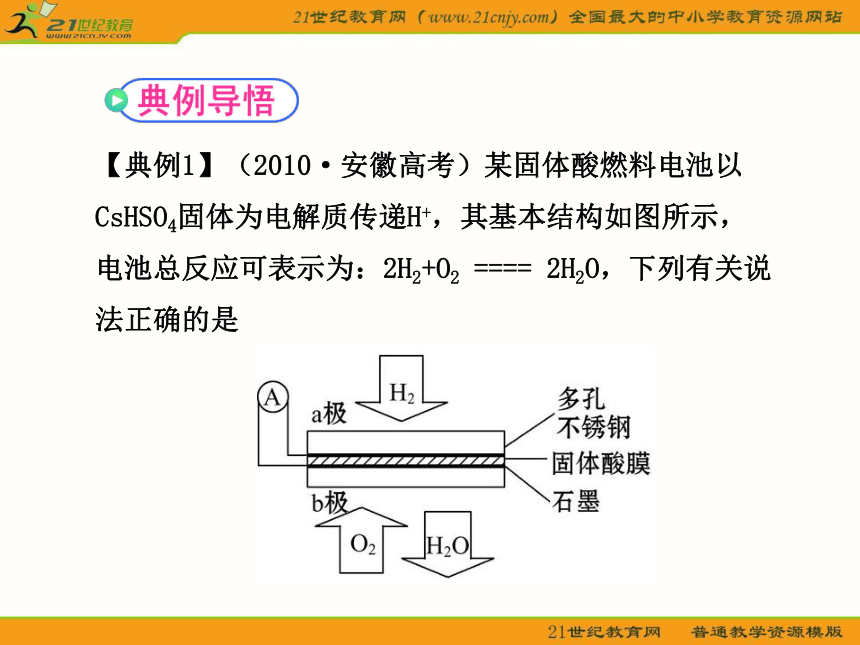
【典例1】(2010·安徽高考)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2 ==== 2H2O,下列有关说法正确的是
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e- ==== 4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
【思路点拨】(1)在外电路中电子由负极流向正极,在内电路中阳离子由负极移向正极;
(2)分析气体体积时应注意标准状况。
【自主解答】选D。本题考查了原电池的工作原理,包括电子的流向、电极反应式的书写、离子移动方向及电极产物“量”的计算。由电极反应式可知,氢气通入的一极为负极,氧气通入的一极为正极,故a为负极、b为正极,电子应该是通过外电路由a极流向b极,A错;B项,b极上的电极反应式为O2+4e-+4H+ ==== 2H2O,B错 ;C项,没有注明此时是否处于标准状况下,故无法计算气体的体积,C错。
请根据原电池原理,探讨以下几种电池的电极反应式及电池的总反应式。
(1)铝-空气-海水电池
提示:负极:Al-3e- ==== Al3+;
正极:2H2O+O2+4e- ==== 4OH-
电池总反应式为:4Al+3O2+6H2O ==== 4Al(OH)3
(2)甲烷燃料电池(KOH溶液)
提示:负极:CH4+10OH--8e- ==== CO32-+7H2O;
正极:2O2+4H2O+8e- ==== 8OH-
总反应方程式为:CH4+2O2+2OH- ==== CO32-+3H2O
(3)CH3OH燃料电池(KOH溶液)
提示:负极:2CH3OH+16OH--12e-====2CO32-+12H2O;
正极:3O2+6H2O+12e- ==== 12OH-
总反应方程式为:2CH3OH+3O2+4OH- ==== 2CO32-+6H2O
(4)熔融盐燃料电池:
该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650℃下工作的燃料电池。
提示:负极:2CO+2CO32--4e- ==== 4CO2
正极:O2+2CO2+4e- ==== 2CO32-
总反应式为:2CO+O2 2CO2
点燃
====
【典例2】(2010·福建高考)铅蓄电池的工作原理为:
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+
2H2O(l),阅读图,下列判断不正确的是
放电
充电
A.K 闭合时,d电极反应式:PbSO4+2H2O-2e- ==== PbO2+4H++SO42-
B.当电路中转移0.2 mol电子时,I中消耗的H2SO4 为0.2 mol
C.K闭合时,Ⅱ中SO42-向c电极迁移
D.K闭合一段时间后,II可单独作为原电池,d电极为正极
【思路点拨】(1)书写电极反应式时应看清充放电的方向,同时注意元素价态的变化。
(2)结合装置图,正确判断电极情况。
(3)熟练掌握铅蓄电池的工作原理。
【自主解答】选C。选项A :K闭合时Ⅱ中发生充电反应,d电极为阳极,发生氧化反应,其反应式为PbSO4
+2H2O-2e- ==== PbO2+4H++SO42-,所以A正确。选项B:
在上述总反应式中,得失电子总数为2e-,当电路中转移0.2 mol电子时,可以计算出Ⅰ中消耗的硫酸的量为
0.2 mol,所以B项正确。选项C:K闭合时d是阳极,阴离子向阳极移动,所以C项错误。选项D:K闭合一段时间,也就是充电一段时间后Ⅱ可以作为原电池,由于c表面生成Pb,放电时作电源的负极,d表面生成PbO2,作电源的正极,所以D项正确。
知识点一:一次电池
1.下列说法中正确的是( )
A.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铅蓄电池放电的时候正极是Pb负极是PbO2
【解析】选C。A项中碱性锌锰干电池都是一次电池,A项错误;燃料电池是一种高效不会污染环境的新型电池,B项错误;铅蓄电池放电的时候正极是PbO2,负极是Pb,D项错误。
2.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌?锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l) ==== Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e- === Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
【解析】选C 。该电池的电解液为KOH溶液,结合总反应式可写出负极反应式:Zn(s)+2OH-(aq)-2e- ==== Zn(OH)2(s),用总反应式减去负极反应式,可得到正极反应式:2MnO2(s)+H2O(l)+2e- ==== Mn2O3(s)+
2OH-(aq)。Zn为负极,失去电子,电子由负极通过外电路流向正极。1 mol Zn失去2 mol电子,外电路中每通过0.2 mol电子,有0.1 mol Zn溶解,Zn的质量理论上减少6.5 g。
3. 我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O ==== 4Al(OH)3,下列说法不正确的是( )
A.正极反应式为:O2+2H2O+4e- ==== 4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
【解析】选B。由电池总反应知,Al为负极,Al-3e- ==== Al3+,铂网为正极:O2+4e-+2H2O ==== 4OH-,电子由铝电极沿导线流向铂电极,故A对。电子由负极沿导线流向正极,电流方向恰好相反,故B错。
知识点二:二次电池
4.LiFePO4电池具有稳定性高、安全、对环境友好等优
点,可用于电动汽车。电池反应为:FePO4+Li
LiFePO4,电池的正极材料是LiFePO4,负极材料是石
墨,含Li+导电固体为电解质。下列有关LiFePO4电池
说法不正确的是( )
A.可加入硫酸以提高电解质的导电性
B. 放电时电池内部Li+向正极移动
C.充电过程中,电池正极材料的质量减少
放电
充电
D.放电时电池正极反应为:FePO4+Li++e- ==== LiFePO4
【解析】选A。放电时,负极:Li-e- ==== Li+,正极:FePO4+Li++e- ==== LiFePO4;充电时,阳极:LiFePO4-e- ==== FePO4+ Li+,阴极:Li++e- ==== Li,所以易知C、D正确。若加入硫酸,与Li单质(固体)发生反应,故A不正确;放电时,Li+(正电荷)应在电池内部(电解质中)向正极移动,故B正确。
5.镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应
用。已知某镍镉电池的电解质溶液为KOH溶液,其充、
放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2 +
2Ni(OH)2,有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2-e-+OH- ==== NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
放电
充电
【解析】选A。由充电时方程式中的Cd和Ni的化合价的变化可知,Ni(OH)2作阳极,电解质溶液为KOH,所以电极反应式为:Ni(OH)2-e-+OH- ==== NiOOH+H2O;Cd(OH)2作阴极:Cd(OH)2+2e- ==== Cd+2OH-;充电的过程是将电能转化为化学能;放电时,Cd作负极:
Cd-2e-+2OH- ==== Cd(OH)2,Cd周围的c(OH-)下降,OH-向负极移动。
知识点三:燃料电池
6.如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
A.a电极是负极
B.b电极的电极反应为:4OH--4e- ==== 2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
【解析】选B。分析氢氧燃料电池原理示意图,可知a极为负极,其电极反应为:2H2-4e- ==== 4H+,b极为正极,其电极反应为:O2+2H2O+4e- ==== 4OH-,电池总反应式为:2H2+O2 ==== 2H2O。H2为还原剂,O2为氧化剂,H2、O2不需全部储藏在电池内。
7. 以葡萄糖为燃料的微生物燃料
电池结构示意图如图所示。关于
该电池的叙述正确的是( )
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+
6H2O-24e- 6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成
标准状况下CO2气体
【解析】选B。A项,高温条件下微生物会变性,所以A错;B项,负极是葡萄糖失电子生成二氧化碳,所以B对;C项,原电池内部阳离子应向正极移动,所以C错;D项,消耗1 mol氧气生成1 mol二氧化碳,标准状况下体积是22.4 L,D错。
一、选择题(本题包括4小题,每小题5分,共20分)
1.一个原电池总反应的离子方程式是:Zn+Cu2+ ==== Zn2++Cu,该原电池组成正确的是( )
【解析】选C。由离子方程式Zn+Cu2+ ==== Zn2++Cu可知,Zn失去电子,是原电池的负极,Cu2+得到电子,故电解质溶液中含有Cu2+,正极材料应不如Zn活泼,只有C项符合要求。
2.用Pt电极放置于KOH溶液中,然后分别向两极通入CO和O2,即可产生电流,下列叙述中正确的是( )
①通入CO的电极为阴极
②通入CO的电极反应式为:2CO+O2+4e- ==== 2CO2
③正极反应式为:O2+2H2O+4e- ==== 4OH-
④负极反应式为:CO+4OH--2e- ==== CO32- +2H2O
⑤电池工作时溶液中的阳离子向原电池的负极移动
⑥放电时溶液中的阴离子向负极移动
A.①④⑥ B.③④⑥
C.④⑤⑥ D.①②③
【解析】选B 。CO燃料电池总反应为2CO+O2+4KOH ==== 2K2CO3+2H2O,故③④正确。在负极消耗OH-,故阴离子向负极移动,⑥正确。
3.某课外活动小组使用下列用品设计原电池。用品:铜片、铁片、导线、金属夹、发光二极管、果汁(橙汁、苹果汁)、500 mL烧杯。下列说法正确的是( )
A.该装置能将电能转化为化学能
B.实验过程中铜片逐渐溶解
C.电子由铁片通过导线流向铜片
D.铁片上会析出红色的铜
【解析】选C。原电池是把化学能转化为电能的装置,A错;活泼性Fe>Cu,Fe作负极溶解,B错;电子由负极流向正极,C正确;果汁呈酸性,H+得电子变成H2,不会析出Cu,D项错。
4.将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是( )
A.上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用
C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e- ==== 2CO2↑+3H2O
D.甲烷燃料电池的正极反应为O2+2H2O+4e- ==== 4OH-
【解析】选C。燃料电池中O2作正极发生还原反应,燃料作负极发生氧化反应;在碱性介质中CO2和OH-反应生成CO32-,C不正确。
二、非选择题(本题包括2小题,共10分)
5.(3分)燃料在电池中直接氧化而产生电能的装置叫燃料电池,它是一种高效低污染的新型电池。燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等。肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水,利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池反应的电极反应式和总反应式:______。
并指出电解质溶液中,OH-向哪极移动:______。
【解析】肼燃料电池总反应为N2H4+O2 ==== N2+2H2O,负极反应为:N2H4-4e-+4OH- ==== N2+4H2O,正极反应为:O2+4e-+2H2O ==== 4OH-。负极上消耗OH-,正极上产生OH-,故OH-向负极移动。
答案:负极:N2H4-4e-+4OH- ==== N2+4H2O;
正极:O2+4e-+2H2O ==== 4OH-;
总反应式:N2H4+O2 ==== N2+2H2O
OH-向负极移动
6.(7分)二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如图:
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为__________。
(2)滤渣A的主要成分是_____。
(3)加入MnS的目的是除去_____杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为__________。
(5)从废旧碱性锌锰电池中可以回收利用的物质有__________(写出两种)。
【解析】由反应流程可知:在酸性条件下二氧化锰将Fe2+氧化为Fe3+,将Cu氧化成Cu2+,此外溶液中还有Zn2+和Al3+,当调pH至5.4时,只有Al(OH)3 和Fe(OH)3会完全沉淀,故滤渣A的主要成分是Fe(OH)3和Al(OH)3。加入MnS后因为酸性条件下CuS 、ZnS更难溶,所以会转化为CuS、ZnS沉淀而除去Cu2+、Zn2+。
答案:(1)MnO2+2FeSO4+2H2SO4 ====
MnSO4+Fe2(SO4)3+2H2O
(2)Fe(OH)3、Al(OH)3 (3)Cu2+、Zn2+
(4)MnO2+H2O+e- ==== MnOOH+OH-(或2MnO2+H2O+2e- ==== Mn2O3+2OH-)
(5)锌、二氧化锰
1.(5分)(双选)锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时电极反应式为负极反应:C6Li-xe- ==== C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)正极反应:
Li1-xMO2+xLi++xe- ==== LiMO2(LiMO2表示含锂的过渡金属氧化物),下列有关说法正确的是( )
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2 ==== LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1 mol电子,金属锂所消耗的质量最小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++
x e- ==== C6Li
【解析】选B、D 。由负极反应:C6Li-xe- ==== C6Li1-x+xLi+和正极反应:Li1-xMO2+xLi++xe- ==== LiMO2得原电池总反应为C6Li+ Li1-xMO2 ==== C6Li1-x+LiMO2,而充电时电池反应与此相反,故A错D对,又因原电池内电路中电流方向是由负极流向正极,阳离子应向正极移动,故C错误。锂摩尔质量很小,故锂失去1 mol电子,锂所消耗的质量最小。
2.(5分)(双选)镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应为:Mg+2H++H2O2 ==== 2Mg2+
+H2O。关于该电池说法正确的是( )
A.镁合金为电池负极,发生还原反应
B.放电时H2O2在正极得电子,被还原
C.负极反应式为:Mg-2e- ==== Mg2+
D.放电时正极附近溶液酸性增强
【解析】选B、C。由原电池总反应:Mg+2H++H2O2 ==== Mg2++2H2O可知,Mg失去电子,为电池负极,发生氧化反应,电极反应式为:Mg-2e- ==== Mg2+,A错误,C正确;H2O2得到电子,是电池正极,被还原,电极反应式为:2H++H2O2+2e- ==== 2H2O,因H+被消耗,故正极附近溶液酸性减弱,B正确,D错误。
3.(10分)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次。假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO32-。
(1)该电池反应的离子方程式为_______________。
(2)甲醇在_____(填“正”或“负”)极发生反应,电池放电过程中溶液pH将_____(填“下降”、“上升”或“不变”);若有16克甲醇蒸气被完全氧化电池提供的电子数为_____。
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-(其中氧化反应发生完全)。以丁烷代表汽油,该电池的正极反应式为_________
______;放电时固体电解质里的O2-的移动方向是向_____极(填“正”或“负”)移动。
【解析】(1)该电池的总反应式可由下列两式合并得到:
2CH3OH+3O2 ==== 2CO2+4H2O,CO2+2OH- ==== CO32-
+H2O,合并得:2CH3OH+3O2+4OH- ==== 2CO32-+6H2O。
(2)燃料电池中可燃物被氧化作负极,根据电池总反应
2CH3OH+3O2+4OH- ==== 2CO32-+6H2O可知,放电过程中
OH-被消耗,溶液pH下降;每有2 mol CH3OH被氧化,
电池提供的电子数为12NA,故16 g CH3OH提供的电子
数为 =3NA。
(3)根据原电池原理,O2-移向负极,正极为空气中的O2,电极反应为O2+4e- ==== 2O2-。
答案:(1)2CH3OH+3O2+4OH- ==== 2CO32-+6H2O
(2)负 下降 3NA (3)O2+4e- ==== 2O2- 负
1.如果你拥有一个笔记本电脑,你希望电脑中的电池有哪些优点?
提示:电容量大,工作寿命长,充电时间短,体积小,质量轻,性价比高等。
2.如果你是一个研制电池的工程师,在开发新产品时将主要考虑哪些问题?
提示:需要了解新产品的技术指标和生产成本是最基本的要求。例如:
①电池功率的大小(涉及活性物质及相关电解质溶液等填充物的选择);
②电池的使用环境(涉及电池使用的安全性以及对电池的外形、质量大小和外包装等方面的要求);
③电池的连续工作时间或使用寿命(涉及活性物质用量、电池的记忆效应以及电池自身放电率的大小等因素);
④电池废弃后,其内容物可能对环境的影响等。
【典例1】(2010·安徽高考)某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2 ==== 2H2O,下列有关说法正确的是
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e- ==== 4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
【思路点拨】(1)在外电路中电子由负极流向正极,在内电路中阳离子由负极移向正极;
(2)分析气体体积时应注意标准状况。
【自主解答】选D。本题考查了原电池的工作原理,包括电子的流向、电极反应式的书写、离子移动方向及电极产物“量”的计算。由电极反应式可知,氢气通入的一极为负极,氧气通入的一极为正极,故a为负极、b为正极,电子应该是通过外电路由a极流向b极,A错;B项,b极上的电极反应式为O2+4e-+4H+ ==== 2H2O,B错 ;C项,没有注明此时是否处于标准状况下,故无法计算气体的体积,C错。
请根据原电池原理,探讨以下几种电池的电极反应式及电池的总反应式。
(1)铝-空气-海水电池
提示:负极:Al-3e- ==== Al3+;
正极:2H2O+O2+4e- ==== 4OH-
电池总反应式为:4Al+3O2+6H2O ==== 4Al(OH)3
(2)甲烷燃料电池(KOH溶液)
提示:负极:CH4+10OH--8e- ==== CO32-+7H2O;
正极:2O2+4H2O+8e- ==== 8OH-
总反应方程式为:CH4+2O2+2OH- ==== CO32-+3H2O
(3)CH3OH燃料电池(KOH溶液)
提示:负极:2CH3OH+16OH--12e-====2CO32-+12H2O;
正极:3O2+6H2O+12e- ==== 12OH-
总反应方程式为:2CH3OH+3O2+4OH- ==== 2CO32-+6H2O
(4)熔融盐燃料电池:
该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650℃下工作的燃料电池。
提示:负极:2CO+2CO32--4e- ==== 4CO2
正极:O2+2CO2+4e- ==== 2CO32-
总反应式为:2CO+O2 2CO2
点燃
====
【典例2】(2010·福建高考)铅蓄电池的工作原理为:
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+
2H2O(l),阅读图,下列判断不正确的是
放电
充电
A.K 闭合时,d电极反应式:PbSO4+2H2O-2e- ==== PbO2+4H++SO42-
B.当电路中转移0.2 mol电子时,I中消耗的H2SO4 为0.2 mol
C.K闭合时,Ⅱ中SO42-向c电极迁移
D.K闭合一段时间后,II可单独作为原电池,d电极为正极
【思路点拨】(1)书写电极反应式时应看清充放电的方向,同时注意元素价态的变化。
(2)结合装置图,正确判断电极情况。
(3)熟练掌握铅蓄电池的工作原理。
【自主解答】选C。选项A :K闭合时Ⅱ中发生充电反应,d电极为阳极,发生氧化反应,其反应式为PbSO4
+2H2O-2e- ==== PbO2+4H++SO42-,所以A正确。选项B:
在上述总反应式中,得失电子总数为2e-,当电路中转移0.2 mol电子时,可以计算出Ⅰ中消耗的硫酸的量为
0.2 mol,所以B项正确。选项C:K闭合时d是阳极,阴离子向阳极移动,所以C项错误。选项D:K闭合一段时间,也就是充电一段时间后Ⅱ可以作为原电池,由于c表面生成Pb,放电时作电源的负极,d表面生成PbO2,作电源的正极,所以D项正确。
知识点一:一次电池
1.下列说法中正确的是( )
A.镍氢电池、锂离子电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.铅蓄电池放电的时候正极是Pb负极是PbO2
【解析】选C。A项中碱性锌锰干电池都是一次电池,A项错误;燃料电池是一种高效不会污染环境的新型电池,B项错误;铅蓄电池放电的时候正极是PbO2,负极是Pb,D项错误。
2.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌?锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l) ==== Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e- === Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
【解析】选C 。该电池的电解液为KOH溶液,结合总反应式可写出负极反应式:Zn(s)+2OH-(aq)-2e- ==== Zn(OH)2(s),用总反应式减去负极反应式,可得到正极反应式:2MnO2(s)+H2O(l)+2e- ==== Mn2O3(s)+
2OH-(aq)。Zn为负极,失去电子,电子由负极通过外电路流向正极。1 mol Zn失去2 mol电子,外电路中每通过0.2 mol电子,有0.1 mol Zn溶解,Zn的质量理论上减少6.5 g。
3. 我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O ==== 4Al(OH)3,下列说法不正确的是( )
A.正极反应式为:O2+2H2O+4e- ==== 4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
【解析】选B。由电池总反应知,Al为负极,Al-3e- ==== Al3+,铂网为正极:O2+4e-+2H2O ==== 4OH-,电子由铝电极沿导线流向铂电极,故A对。电子由负极沿导线流向正极,电流方向恰好相反,故B错。
知识点二:二次电池
4.LiFePO4电池具有稳定性高、安全、对环境友好等优
点,可用于电动汽车。电池反应为:FePO4+Li
LiFePO4,电池的正极材料是LiFePO4,负极材料是石
墨,含Li+导电固体为电解质。下列有关LiFePO4电池
说法不正确的是( )
A.可加入硫酸以提高电解质的导电性
B. 放电时电池内部Li+向正极移动
C.充电过程中,电池正极材料的质量减少
放电
充电
D.放电时电池正极反应为:FePO4+Li++e- ==== LiFePO4
【解析】选A。放电时,负极:Li-e- ==== Li+,正极:FePO4+Li++e- ==== LiFePO4;充电时,阳极:LiFePO4-e- ==== FePO4+ Li+,阴极:Li++e- ==== Li,所以易知C、D正确。若加入硫酸,与Li单质(固体)发生反应,故A不正确;放电时,Li+(正电荷)应在电池内部(电解质中)向正极移动,故B正确。
5.镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应
用。已知某镍镉电池的电解质溶液为KOH溶液,其充、
放电按下式进行:Cd+2NiOOH+2H2O Cd(OH)2 +
2Ni(OH)2,有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2-e-+OH- ==== NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
放电
充电
【解析】选A。由充电时方程式中的Cd和Ni的化合价的变化可知,Ni(OH)2作阳极,电解质溶液为KOH,所以电极反应式为:Ni(OH)2-e-+OH- ==== NiOOH+H2O;Cd(OH)2作阴极:Cd(OH)2+2e- ==== Cd+2OH-;充电的过程是将电能转化为化学能;放电时,Cd作负极:
Cd-2e-+2OH- ==== Cd(OH)2,Cd周围的c(OH-)下降,OH-向负极移动。
知识点三:燃料电池
6.如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
A.a电极是负极
B.b电极的电极反应为:4OH--4e- ==== 2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
【解析】选B。分析氢氧燃料电池原理示意图,可知a极为负极,其电极反应为:2H2-4e- ==== 4H+,b极为正极,其电极反应为:O2+2H2O+4e- ==== 4OH-,电池总反应式为:2H2+O2 ==== 2H2O。H2为还原剂,O2为氧化剂,H2、O2不需全部储藏在电池内。
7. 以葡萄糖为燃料的微生物燃料
电池结构示意图如图所示。关于
该电池的叙述正确的是( )
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+
6H2O-24e- 6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成
标准状况下CO2气体
【解析】选B。A项,高温条件下微生物会变性,所以A错;B项,负极是葡萄糖失电子生成二氧化碳,所以B对;C项,原电池内部阳离子应向正极移动,所以C错;D项,消耗1 mol氧气生成1 mol二氧化碳,标准状况下体积是22.4 L,D错。
一、选择题(本题包括4小题,每小题5分,共20分)
1.一个原电池总反应的离子方程式是:Zn+Cu2+ ==== Zn2++Cu,该原电池组成正确的是( )
【解析】选C。由离子方程式Zn+Cu2+ ==== Zn2++Cu可知,Zn失去电子,是原电池的负极,Cu2+得到电子,故电解质溶液中含有Cu2+,正极材料应不如Zn活泼,只有C项符合要求。
2.用Pt电极放置于KOH溶液中,然后分别向两极通入CO和O2,即可产生电流,下列叙述中正确的是( )
①通入CO的电极为阴极
②通入CO的电极反应式为:2CO+O2+4e- ==== 2CO2
③正极反应式为:O2+2H2O+4e- ==== 4OH-
④负极反应式为:CO+4OH--2e- ==== CO32- +2H2O
⑤电池工作时溶液中的阳离子向原电池的负极移动
⑥放电时溶液中的阴离子向负极移动
A.①④⑥ B.③④⑥
C.④⑤⑥ D.①②③
【解析】选B 。CO燃料电池总反应为2CO+O2+4KOH ==== 2K2CO3+2H2O,故③④正确。在负极消耗OH-,故阴离子向负极移动,⑥正确。
3.某课外活动小组使用下列用品设计原电池。用品:铜片、铁片、导线、金属夹、发光二极管、果汁(橙汁、苹果汁)、500 mL烧杯。下列说法正确的是( )
A.该装置能将电能转化为化学能
B.实验过程中铜片逐渐溶解
C.电子由铁片通过导线流向铜片
D.铁片上会析出红色的铜
【解析】选C。原电池是把化学能转化为电能的装置,A错;活泼性Fe>Cu,Fe作负极溶解,B错;电子由负极流向正极,C正确;果汁呈酸性,H+得电子变成H2,不会析出Cu,D项错。
4.将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是( )
A.上述燃料电池的负极反应材料是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经过处理之后可供宇航员使用
C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e- ==== 2CO2↑+3H2O
D.甲烷燃料电池的正极反应为O2+2H2O+4e- ==== 4OH-
【解析】选C。燃料电池中O2作正极发生还原反应,燃料作负极发生氧化反应;在碱性介质中CO2和OH-反应生成CO32-,C不正确。
二、非选择题(本题包括2小题,共10分)
5.(3分)燃料在电池中直接氧化而产生电能的装置叫燃料电池,它是一种高效低污染的新型电池。燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等。肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水,利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池反应的电极反应式和总反应式:______。
并指出电解质溶液中,OH-向哪极移动:______。
【解析】肼燃料电池总反应为N2H4+O2 ==== N2+2H2O,负极反应为:N2H4-4e-+4OH- ==== N2+4H2O,正极反应为:O2+4e-+2H2O ==== 4OH-。负极上消耗OH-,正极上产生OH-,故OH-向负极移动。
答案:负极:N2H4-4e-+4OH- ==== N2+4H2O;
正极:O2+4e-+2H2O ==== 4OH-;
总反应式:N2H4+O2 ==== N2+2H2O
OH-向负极移动
6.(7分)二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如图:
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为__________。
(2)滤渣A的主要成分是_____。
(3)加入MnS的目的是除去_____杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为__________。
(5)从废旧碱性锌锰电池中可以回收利用的物质有__________(写出两种)。
【解析】由反应流程可知:在酸性条件下二氧化锰将Fe2+氧化为Fe3+,将Cu氧化成Cu2+,此外溶液中还有Zn2+和Al3+,当调pH至5.4时,只有Al(OH)3 和Fe(OH)3会完全沉淀,故滤渣A的主要成分是Fe(OH)3和Al(OH)3。加入MnS后因为酸性条件下CuS 、ZnS更难溶,所以会转化为CuS、ZnS沉淀而除去Cu2+、Zn2+。
答案:(1)MnO2+2FeSO4+2H2SO4 ====
MnSO4+Fe2(SO4)3+2H2O
(2)Fe(OH)3、Al(OH)3 (3)Cu2+、Zn2+
(4)MnO2+H2O+e- ==== MnOOH+OH-(或2MnO2+H2O+2e- ==== Mn2O3+2OH-)
(5)锌、二氧化锰
1.(5分)(双选)锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时电极反应式为负极反应:C6Li-xe- ==== C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)正极反应:
Li1-xMO2+xLi++xe- ==== LiMO2(LiMO2表示含锂的过渡金属氧化物),下列有关说法正确的是( )
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2 ==== LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1 mol电子,金属锂所消耗的质量最小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++
x e- ==== C6Li
【解析】选B、D 。由负极反应:C6Li-xe- ==== C6Li1-x+xLi+和正极反应:Li1-xMO2+xLi++xe- ==== LiMO2得原电池总反应为C6Li+ Li1-xMO2 ==== C6Li1-x+LiMO2,而充电时电池反应与此相反,故A错D对,又因原电池内电路中电流方向是由负极流向正极,阳离子应向正极移动,故C错误。锂摩尔质量很小,故锂失去1 mol电子,锂所消耗的质量最小。
2.(5分)(双选)镁燃料电池以镁合金作为电池的一极,另一极充入过氧化氢,电解质溶液是酸化的氯化钠溶液,放电时总反应为:Mg+2H++H2O2 ==== 2Mg2+
+H2O。关于该电池说法正确的是( )
A.镁合金为电池负极,发生还原反应
B.放电时H2O2在正极得电子,被还原
C.负极反应式为:Mg-2e- ==== Mg2+
D.放电时正极附近溶液酸性增强
【解析】选B、C。由原电池总反应:Mg+2H++H2O2 ==== Mg2++2H2O可知,Mg失去电子,为电池负极,发生氧化反应,电极反应式为:Mg-2e- ==== Mg2+,A错误,C正确;H2O2得到电子,是电池正极,被还原,电极反应式为:2H++H2O2+2e- ==== 2H2O,因H+被消耗,故正极附近溶液酸性减弱,B正确,D错误。
3.(10分)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用一个月才充电一次。假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO32-。
(1)该电池反应的离子方程式为_______________。
(2)甲醇在_____(填“正”或“负”)极发生反应,电池放电过程中溶液pH将_____(填“下降”、“上升”或“不变”);若有16克甲醇蒸气被完全氧化电池提供的电子数为_____。
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-(其中氧化反应发生完全)。以丁烷代表汽油,该电池的正极反应式为_________
______;放电时固体电解质里的O2-的移动方向是向_____极(填“正”或“负”)移动。
【解析】(1)该电池的总反应式可由下列两式合并得到:
2CH3OH+3O2 ==== 2CO2+4H2O,CO2+2OH- ==== CO32-
+H2O,合并得:2CH3OH+3O2+4OH- ==== 2CO32-+6H2O。
(2)燃料电池中可燃物被氧化作负极,根据电池总反应
2CH3OH+3O2+4OH- ==== 2CO32-+6H2O可知,放电过程中
OH-被消耗,溶液pH下降;每有2 mol CH3OH被氧化,
电池提供的电子数为12NA,故16 g CH3OH提供的电子
数为 =3NA。
(3)根据原电池原理,O2-移向负极,正极为空气中的O2,电极反应为O2+4e- ==== 2O2-。
答案:(1)2CH3OH+3O2+4OH- ==== 2CO32-+6H2O
(2)负 下降 3NA (3)O2+4e- ==== 2O2- 负
