【开学大礼包】2012高二化学课件:4.3电解池(人教版选修4)
文档属性
| 名称 | 【开学大礼包】2012高二化学课件:4.3电解池(人教版选修4) |  | |
| 格式 | zip | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 13:18:13 | ||
图片预览











文档简介
(共73张PPT)
1.请分析比较电离与电解
2.在CuCl2溶液中存在哪些离子?在电解CuCl2溶液时,为何发生氧化还原反应的是Cu2+、Cl-?
提示:在CuCl2溶液中存在Cu2+、Cl-、H+、OH-四种离子;其中Cu2+、H+在电场的作用下定向移向阴极,Cl-、OH-在电场的作用下定向移向阳极,但Cu2+得电子的能力比H+强,Cl-失电子的能力比OH-强,故在电解CuCl2溶液时,发生氧化还原反应的是Cu2+、Cl-。
3.用惰性电极进行电解的规律
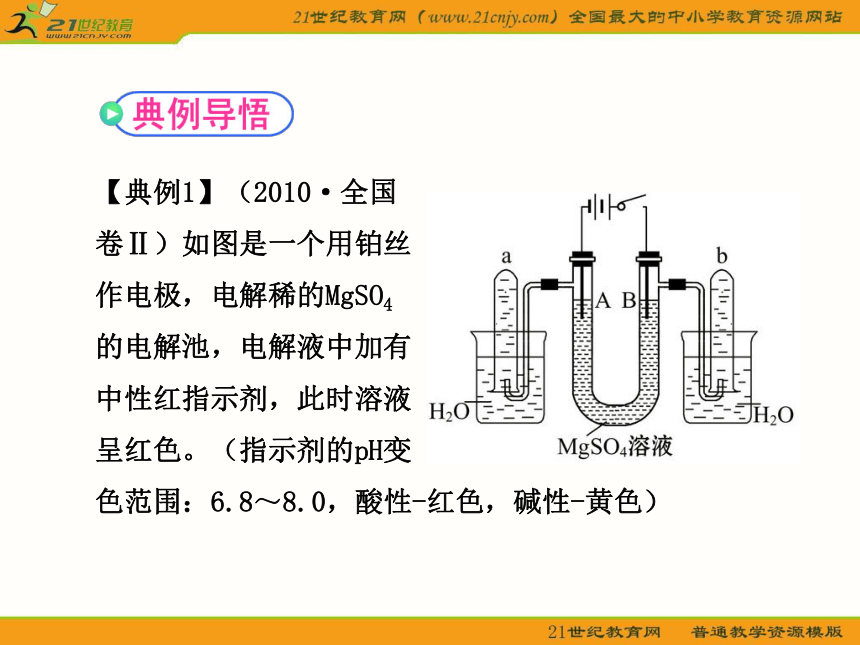
【典例1】(2010·全国
卷Ⅱ)如图是一个用铂丝
作电极,电解稀的MgSO4
的电解池,电解液中加有
中性红指示剂,此时溶液
呈红色。(指示剂的pH变
色范围:6.8~8.0,酸性-红色,碱性-黄色)
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是(填编号)_____;
①A管溶液由红变黄;②B管溶液由红变黄;③A管溶液不变色;④B管溶液不变色
(2)写出A管中发生反应的反应式:__________。
(3)写出B管中发生反应的反应式:__________。
(4)检验a管中气体的方法是__________。
(5)检验b管中气体的方法是__________。
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是__________。
【思路点拨】(1)根据阴、阳离子的放电顺序,判断A、B两极分别为H+和OH-放电,进一步确定溶液的酸碱性。
(2)掌握气体的检验方法。
【自主解答】①由装置图可知A为电解池的阴极,电极反应为:4H++4e- ==== 2H2↑;B为电解池的阳极,电极反应为:4OH--4e- ==== 2H2O+O2↑。根据放电情况可知A极由于H+放电附近显碱性,指示剂应显黄色,同时还会发生反应:Mg2++2OH- ==== Mg(OH)2↓;B极由于OH-放电附近显酸性,指示剂仍显本身的颜色红色。
②在检验H2时利用其可燃性,检验O2时用能否使带火星的木条复燃进行检验。③由于该电解池实质是电解水,所以将电解液倒入烧杯后,整个溶液呈中性,故指示剂变红,Mg(OH)2沉淀会消失(或大部分溶解)。
答案:(1)①④
(2)2H++2e- ==== H2↑,Mg2++2OH- ==== Mg(OH)2↓
(3)4OH--4e- ==== 2H2O+O2↑
(4)用拇指按住管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有蓝色火焰
(5)用拇指按住管口,取出试管,放开拇指,将带火星的木条伸入试管内会复燃
(6)溶液呈红色,白色沉淀溶解(或大部分溶解)
1.设计一套电解饱和食盐水的装置?电极表面有什么现象?若在饱和食盐水中事先滴加无色酚酞试剂,两极附近溶液会如何变化?如何判断两极气体产物?写出两电极反应式。
提示:(1)装置
(2)现象:两极表面均有气泡产生,阴极产生无色气体,且该电极附近溶液显红色,阳极产生黄绿色气体。
(3)H2检验:气体验纯后点燃,若产生淡蓝色火焰,证明为氢气。
Cl2检验:把湿润的KI淀粉试纸伸入试管口,若试纸变蓝,证明为氯气。
(4)阳极反应:2Cl--2e- ==== Cl2↑
阴极反应:2H++2e- ==== H2↑
2.粗铜中所含的杂质(如:Zn、Fe、Ni、Ag、Au等)是如何除去的呢?
提示:比铜活泼的金属杂质,在铜溶解的同时也会失去电子形成金属阳离子而被溶解掉。如:
Zn-2e- ==== Zn2+;Ni-2e- ==== Ni2+;由于这些离子比Cu2+难以还原,故它们不能在阴极上得电子析出而存留在溶液中。比铜不活泼的金属杂质,在铜失电子溶解时,不能失电子而溶解,故它们以单质形式沉积于电解槽底部,形成阳极泥。
3.请分析比较原电池、电解池与电镀池
【典例2】(2009·全国卷Ⅰ)如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为_____极;
②电极b上发生的电极反应为__________;
③列式计算电极b上生成的气体在标准状况下的体积为_____;
④电极c的质量变化是_____ g;
⑤电解前后各溶液的pH是否发生变化:
甲溶液:_____;乙溶液:_____;丙溶液:_____。
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
【思路点拨】(1)根据c极现象确定各电极名称。
(2)根据电解质溶液确定各电极反应。
(3)根据电子守恒进行计算,并分析溶液中离子的变化和pH的变化。
【自主解答】(1)①乙中c电极质量增加,则c处发生
的反应为:Cu2++2e- ==== Cu,即c处为阴极,由此可
推出b为阳极,a为阴极,M为负极,N为正极。丙中为
K2SO4溶液,相当于电解水,设电解的水的质量为x。
由电解前后溶质质量相等,有100 g×10.00%=(100 g
-x)×10.47%,得x=4.5 g,故为0.25 mol。由方程式
2H2O 2H2↑+O2↑可知,电解2 mol H2O,转移
4 mol电子,所以整个反应中转移0.5 mol电子,而整
个电路是串联的,故每个烧杯中的电极上转移电子数
电解
====
是相等的。②甲中为NaOH溶液,相当于电解H2O,阳极
b处为阴离子OH-放电,即4OH--4e- ==== 2H2O+O2↑。
③转移0.5 mol电子,则生成O2为 =0.125 mol,标准状况下的体积为0.125 mol×22.4 L/mol=2.8 L。④Cu2++2e- ==== Cu,转移0.5 mol电子,则生成的m(Cu)=0.5/2×64=16(g)。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极
为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
答案:(1)①正 ②4OH--4e- ==== 2H2O+O2↑
③2.8 L ④16
⑤pH增大 pH减小 pH几乎不变
(2)可以,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
知识点一:电解原理
1.下列有关电解的叙述正确的是( )
①电解是把电能转化为化学能
②电解是把化学能转化为电能
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理可以实现
⑤任何溶液被电解时,必然导致氧化还原反应的发生
A.①②③④ B.②③⑤
C.③④ D.①③④⑤
【解析】选D。从能量角度看,电解是把电能转变为化学能的过程,故①对②错。电解质溶液的导电过程,必将伴随着两个电极上氧化、还原反应的发生,同时生成新物质,故③、⑤对。某些不能自发进行的氧化还原反应,通过电解的原理也可以实现,故④对。所以D选项符合题意。
2.(2010·鹤壁高二检测)实验室用惰性电极电解氢氧化钠溶液,下列有关描述中正确的是( )
A.电解时,与电源正极相连的电极上产生H2
B.电解时,阳极反应是:4OH--4e- ==== O2↑+2H2O
C.在两极上放电的阴、阳离子的物质的量之比是2∶1
D.电解过程中,溶液的pH不变
【解析】选B。电解氢氧化钠溶液,实际是电解水。阴极与电源负极相连,电极反应是:4H++4e- ==== 2H2↑,A错误;阳极与电源正极相连,电极反应是:4OH--4e- ==== O2↑+2H2O,B正确;在两极上放电的阴、阳离子的物质的量之比是4∶4=1∶1,C错误;电解过程中,H2O不断被消耗,氢氧化钠溶液的浓度不断增大,故pH增大,D错误。
知识点二:电解原理的应用
3.下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是负极
B.用电解法精炼铜时粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
【解析】选C。在铜锌原电池中,与铜相比,锌易失去电子,因而锌极是负极,则铜极是正极,选项A错误;精炼铜时,需将其中的铜变成铜离子,再在阴极还原成铜。因而在电解池中粗铜应作为阳极,选项B错误;
在镀件上镀铜时,需要将溶液中的铜离子还原成铜而沉积在镀件上。用作向溶液中供给铜离子的金属铜必须作为阳极,选项C正确;电解硫酸时,金属铜如果作为阳极,它将以铜离子的形式被溶解而进入电解液,当电解液内有H+、Cu2+两种离子共存时,后者将在阴极放电。这样阴极的生成物将是铜而不是氢气,达不到制氢气和氧气的目的。选项D不对。
4.观察下列几个装置示意图,有关叙述正确的是( )
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
【解析】选C。本题所涉及的四个装置图全部来源于高中教材,装置①,电解氯化铜的装置图中没有标电极材料的名称,但根据溶液的组成及所给提示“电解CuCl2溶液实验装置示意图”,不难判断,铜应该在阴
极上析出。电镀实验中,待镀金属作为阴(负)极,故在装置②电镀铜实验中,待镀铁制品应与电源负极相连。装置③,根据氢气的入口,故很容易判断出原电池的左边为负极,氢气在左边电极上失电子,故外电路电子由a极流向b极。装置④的离子交换膜是阳离子交换膜,只允许阳离子、水分子自由通过,不允许阴离子通过。
知识点三:电解池的有关计算
5.用两支惰性电极插入500 mL的AgNO3溶液中,通电电解。当电解质溶液的pH由6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),则电极上析出银的质量是( )
A.27 mg B.54 mg
C.108 mg D.216 mg
【解析】选B。根据离子放电顺序,先写出两极的电极反应式:
阳极:4OH--4e- ==== O2↑+2H2O ①
阴极:4Ag++4e- ==== 4Ag ②
其中OH-来自水,所以总的电解反应式:
4Ag++2H2O 4Ag↓+O2↑+4H+或
4AgNO3+2H2O 4Ag↓+O2↑+4HNO3
因为有HNO3生成,所以pH要变小。生成HNO3的物质的量为(10-3-10-6)×0.5≈0.5×10-3(mol),所以析出银的质量为0.5×10-3mol×108 g/mol=54 mg
电解
====
电解
====
6.有三个烧杯,分别盛有氯化铜,氯化钾和硝酸银三种溶液;均以Pt作电极,将它们串联在一起电解一段时间,测得电极增重总和2.8克,这时产生的有色气体与无色气体的物质的量之比为( )
A.4∶1 B.1∶1 C.4∶3 D.3∶4
【解析】选C。串联电路中,相同时间内各电极得或失的电子的物质的量相同,各电极上放出气体的物质的量之比为定值。不必注意电极增重是多少。只要判断出生成何种气体及生成该气体一定物质的量所得失电
子的物质的量,就可以通过电子守恒,判断气体体积之比,第一个烧杯中放出Cl2,第二烧杯中放出Cl2和H2,第三烧杯中放出O2。在有1 mol电子转移的情况下,分别是0.5 mol,0.5 mol,0.5 mol和0.25 mol。所以共放出有色气体0.5+0.5=1(mol)(Cl2),无色气体0.5+
0.25=0.75(mol)(O2和H2)。
一、选择题(本题包括4小题,每小题5分,共20分)
1.用惰性电极实现电解,下列说法正确的是( )
A.电解稀硫酸溶液,实质上是电解水,故溶液的pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液的pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
【解析】选D。以稀硫酸、氢氧化钠、硫酸钠为电解液时,电解的实质是水被电解。由于水的消耗,电解液的pH会发生改变;以硫酸为电解液时,溶液的pH减小;以氢氧化钠为电解液时,溶液的pH增大。电解硫酸钠溶液时,阴、阳两极上产生的气体分别是氢气、氧气,所以其物质的量之比为2∶1。电解氯化铜溶液,在阴极上析出铜,阳极上析出氯气。根据电子守
恒原理,铜离子所得到的电子数目应等于氯离子所失去的电子数目,每一个铜离子得到的2个电子等于2个Cl-失去的2个电子,所以析出的铜与氯气的物质的量之比为1∶1。
2.用惰性电极电解下列溶液一段时间以后再加入一定量的某种纯物质(括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
A.AgNO3(AgNO3) B.NaOH(H2O)
C.KCl(KCl) D.CuSO4[Cu(OH)2]
【解析】选B。分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,就加入什么物质即可使溶液复原。A选项中AgNO3溶液电解析出单质银和氧气,同时生成硝酸,因此复
原时加入的物质为氧化银(Ag2O);B选项中NaOH溶液电解时实际电解的是水,在电极上析出氧气和氢气,因此复原时加入的物质为H2O;C选项中KCl溶液电解时析出氯气和氢气,同时生成KOH溶液,因此复原时加入的物质为HCl;D选项中CuSO4溶液电解时析出单质铜和氧气,同时生成了硫酸溶液,因此复原时加入的物质为CuO。
3.(双选)(2010·海南高考)利用电解法可将含有
Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的
是( )
A.电解时以精铜作阳极
B.电解时阴极发生还原反应
C.粗铜连接电源负极,其电极反应是Cu-2e-====Cu2+
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的
阳极泥
【解析】选B、D。电解法精炼金属铜时,粗铜作阳极,失去电子,逐渐溶解,Cu2+得到电子后析出,附着在阴极上,故精铜作阴极;在电解池中,阴极接电源的负极,发生还原反应,阳极接电源的正极,发生氧化反应,A、C错误,B正确;越活泼的金属越易失去电子,故比铜活泼的Fe、Zn先失去电子,变成Fe2+、Zn2+进入溶液,然后是铜失去电子,变成Cu2+进入溶液,因Ag、Pt等金属不如铜活泼,故在铜溶解后便沉淀在阳极底部成为阳极泥,D正确。
4.如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是( )
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶2
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷
【解析】选B。据F极显红色,推出F为阴极,电极反应:
2H++2e- ==== H2↑,从而确定A为电源正极,B为负极,C、E、G、X为阳极,D、F、H、Y为阴极。故A错误,C、D、E、F分别生成单质为O2、Cu、Cl2、H2,转移电子的量相同,故其物质的量之比为1∶2∶2∶2,B正确;因G为阳极,故G应为Ag,H为铜,C错误;据Y极附近红褐色加深,说明Fe(OH)3胶体微粒带有正电荷向阴极移动,D不正确。
二、非选择题(本题包括2小题,共10分)
5.(3分)甲、乙两个容器中,分别加入0.1 mol/L NaCl溶液与0.1 mol/L AgNO3溶液后,以Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为:_____。
【解析】此装置相当于两个电解槽串联到一起,在整个电路中电子转移总数相等,首先判断各极是阳极还是阴极,即电极名称,再分析各极发生的反应.A极(阴极)反应:2H++2e- ==== H2↑,B极(阳极)反应:2Cl--2e- ==== Cl2↑;C极(阴极)反应:Ag++e- ==== Ag;D极(阳极)反应:4OH--4e- ==== 2H2O+O2↑,根据电子守恒法可知,若
整个电路中有4 mol 电子转移,生成H2、Cl2、Ag、O2的物质的量分别为:2 mol、2 mol、4 mol、1 mol,因此各电极上生成物的物质的量之比为:2∶2∶4∶1。
答案:2∶2∶4∶1
6.(7分)(2010·北京四中模拟)请按要求回答下列问题。
(1)根据图1回答①②:
①打开K2,合并K1。
A电极可观察到的现象是____;
B极的电极反应为__________。
②打开 K1,合并K2。
A电极可观察到的现象是_____;
B极的电极反应为__________;
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示
的装置中进行电解,石墨电极上的电
极反应式为_______________,
电解反应的离子方程式为__________;
④实验完成后,铜电极增重a g,石墨
电极产生标准状况下的气体体积_____L。
【解析】(1)①此时为原电池,锌为负极,不断溶解,
B极为正极,反应为Cu2++2e- ==== Cu。
②此时为电解池,A极为阴极,反应为Cu2++2e- ====
Cu,故A极上镀上一层红色的铜,B极为阳极,反应为
Cu-2e- ==== Cu2+。
(2)此时为惰性电极电解CuSO4,石墨极上反应为:
4OH--4e- ==== 2H2O+O2↑,总反应的离子方程式为
2Cu2++2H2O 2Cu+O2↑+4H+,
V(O2)= 。
电解
====
答案:(1)①锌不断溶解 Cu2++2e- ==== Cu
②A镀上一层红色的铜 Cu-2e- ==== Cu2+
(2)③4OH--4e- ==== 2H2O+O2↑
2Cu2++2H2O 2Cu+O2↑+4H+ ④
电解
====
1.(5分)如图为直流电源电解稀
Na2SO4水溶液的装置。通电后在石
墨电极a和b附近分别滴加一滴石蕊
溶液。下列实验现象中正确的是
( )
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
【解析】选D。Na2SO4 ==== 2Na++SO42-,H2O ==== H+
+OH-,SO42-和OH-移向b电极,Na+和H+移向a电极,在b电极上:4OH--4e- ==== 2H2O+O2↑,在a电极上:2H++
2e- ==== H2↑,所以产生的气体体积a电极的大于b电极的;两种气体均为无色无味的气体;由于a电极上H+放电,所以a电极附近的c(OH-)>c(H+),滴加石蕊溶液,a电极附近呈蓝色,同理,b电极附近呈红色。
2.(5分)(2010·蚌埠高二检测)用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后( )
A.溶液的pH变大
B.c(Na+)与c(CO32-)的比值变大
C.溶液浓度变大,有晶体析出
D.溶液浓度不变,有晶体析出
【解析】选D。用惰性电极电解饱和Na2CO3溶液,实际是电解水,故Na2CO3会结晶析出,若保持温度不变,则仍为原温度下的饱和溶液,故溶液浓度不变,pH不变,c(Na+)∶c(CO32-)不变,故选D。
3.(10分)(2009·宁夏高考)请回答氯碱的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=______
(要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是______。(填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中X、Y分别是_____、_____(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小____;
②分别写出燃料电池B中正极、负极上发生的电极反应
正极:__________________;
负极:__________________;
③这样设计的主要节(电)能之处在于(写出2处)
__________________、__________________。
【解析】(1)只要了解电解饱和食盐水的化学方程式
2NaCl+2H2O 2NaOH+H2↑+Cl2↑,即可得到,
k=M(Cl2)/2 M(NaOH)=71/80=1∶1.13或0.89;(2)只
要抓住除钡离子要放在除碳酸根离子前即可得到顺序
关系:③①②;(3)本题突破口在于B燃料电池这
边,通空气一边为正极(还原反应),那么左边必然
通H2,这样Y即为H2;再转到左边依据电解饱和食盐水
的化学方程式可知惟一未知的就是X,必然为Cl2了;A
中的NaOH进入燃料电池正极再出来,依据O2+4e-+2H2O
==== 4OH-可知NaOH浓度增大。
电解
====
答案:(1)M(Cl2)/2 M(NaOH)=71/80=1∶1.13或0.89(2)③①② (3)①Cl2 H2 a%小于b%
②O2+4e-+2H2O ==== 4OH- H2-2e-+2OH- ==== 2H2O ③燃料电池可以补充电解池消耗的电能 提高产出碱液的浓度 降低能耗(任写2条,其他合理答案也可)
1.请分析比较电离与电解
2.在CuCl2溶液中存在哪些离子?在电解CuCl2溶液时,为何发生氧化还原反应的是Cu2+、Cl-?
提示:在CuCl2溶液中存在Cu2+、Cl-、H+、OH-四种离子;其中Cu2+、H+在电场的作用下定向移向阴极,Cl-、OH-在电场的作用下定向移向阳极,但Cu2+得电子的能力比H+强,Cl-失电子的能力比OH-强,故在电解CuCl2溶液时,发生氧化还原反应的是Cu2+、Cl-。
3.用惰性电极进行电解的规律
【典例1】(2010·全国
卷Ⅱ)如图是一个用铂丝
作电极,电解稀的MgSO4
的电解池,电解液中加有
中性红指示剂,此时溶液
呈红色。(指示剂的pH变
色范围:6.8~8.0,酸性-红色,碱性-黄色)
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是(填编号)_____;
①A管溶液由红变黄;②B管溶液由红变黄;③A管溶液不变色;④B管溶液不变色
(2)写出A管中发生反应的反应式:__________。
(3)写出B管中发生反应的反应式:__________。
(4)检验a管中气体的方法是__________。
(5)检验b管中气体的方法是__________。
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是__________。
【思路点拨】(1)根据阴、阳离子的放电顺序,判断A、B两极分别为H+和OH-放电,进一步确定溶液的酸碱性。
(2)掌握气体的检验方法。
【自主解答】①由装置图可知A为电解池的阴极,电极反应为:4H++4e- ==== 2H2↑;B为电解池的阳极,电极反应为:4OH--4e- ==== 2H2O+O2↑。根据放电情况可知A极由于H+放电附近显碱性,指示剂应显黄色,同时还会发生反应:Mg2++2OH- ==== Mg(OH)2↓;B极由于OH-放电附近显酸性,指示剂仍显本身的颜色红色。
②在检验H2时利用其可燃性,检验O2时用能否使带火星的木条复燃进行检验。③由于该电解池实质是电解水,所以将电解液倒入烧杯后,整个溶液呈中性,故指示剂变红,Mg(OH)2沉淀会消失(或大部分溶解)。
答案:(1)①④
(2)2H++2e- ==== H2↑,Mg2++2OH- ==== Mg(OH)2↓
(3)4OH--4e- ==== 2H2O+O2↑
(4)用拇指按住管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有蓝色火焰
(5)用拇指按住管口,取出试管,放开拇指,将带火星的木条伸入试管内会复燃
(6)溶液呈红色,白色沉淀溶解(或大部分溶解)
1.设计一套电解饱和食盐水的装置?电极表面有什么现象?若在饱和食盐水中事先滴加无色酚酞试剂,两极附近溶液会如何变化?如何判断两极气体产物?写出两电极反应式。
提示:(1)装置
(2)现象:两极表面均有气泡产生,阴极产生无色气体,且该电极附近溶液显红色,阳极产生黄绿色气体。
(3)H2检验:气体验纯后点燃,若产生淡蓝色火焰,证明为氢气。
Cl2检验:把湿润的KI淀粉试纸伸入试管口,若试纸变蓝,证明为氯气。
(4)阳极反应:2Cl--2e- ==== Cl2↑
阴极反应:2H++2e- ==== H2↑
2.粗铜中所含的杂质(如:Zn、Fe、Ni、Ag、Au等)是如何除去的呢?
提示:比铜活泼的金属杂质,在铜溶解的同时也会失去电子形成金属阳离子而被溶解掉。如:
Zn-2e- ==== Zn2+;Ni-2e- ==== Ni2+;由于这些离子比Cu2+难以还原,故它们不能在阴极上得电子析出而存留在溶液中。比铜不活泼的金属杂质,在铜失电子溶解时,不能失电子而溶解,故它们以单质形式沉积于电解槽底部,形成阳极泥。
3.请分析比较原电池、电解池与电镀池
【典例2】(2009·全国卷Ⅰ)如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为_____极;
②电极b上发生的电极反应为__________;
③列式计算电极b上生成的气体在标准状况下的体积为_____;
④电极c的质量变化是_____ g;
⑤电解前后各溶液的pH是否发生变化:
甲溶液:_____;乙溶液:_____;丙溶液:_____。
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
【思路点拨】(1)根据c极现象确定各电极名称。
(2)根据电解质溶液确定各电极反应。
(3)根据电子守恒进行计算,并分析溶液中离子的变化和pH的变化。
【自主解答】(1)①乙中c电极质量增加,则c处发生
的反应为:Cu2++2e- ==== Cu,即c处为阴极,由此可
推出b为阳极,a为阴极,M为负极,N为正极。丙中为
K2SO4溶液,相当于电解水,设电解的水的质量为x。
由电解前后溶质质量相等,有100 g×10.00%=(100 g
-x)×10.47%,得x=4.5 g,故为0.25 mol。由方程式
2H2O 2H2↑+O2↑可知,电解2 mol H2O,转移
4 mol电子,所以整个反应中转移0.5 mol电子,而整
个电路是串联的,故每个烧杯中的电极上转移电子数
电解
====
是相等的。②甲中为NaOH溶液,相当于电解H2O,阳极
b处为阴离子OH-放电,即4OH--4e- ==== 2H2O+O2↑。
③转移0.5 mol电子,则生成O2为 =0.125 mol,标准状况下的体积为0.125 mol×22.4 L/mol=2.8 L。④Cu2++2e- ==== Cu,转移0.5 mol电子,则生成的m(Cu)=0.5/2×64=16(g)。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极
为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。
答案:(1)①正 ②4OH--4e- ==== 2H2O+O2↑
③2.8 L ④16
⑤pH增大 pH减小 pH几乎不变
(2)可以,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
知识点一:电解原理
1.下列有关电解的叙述正确的是( )
①电解是把电能转化为化学能
②电解是把化学能转化为电能
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理可以实现
⑤任何溶液被电解时,必然导致氧化还原反应的发生
A.①②③④ B.②③⑤
C.③④ D.①③④⑤
【解析】选D。从能量角度看,电解是把电能转变为化学能的过程,故①对②错。电解质溶液的导电过程,必将伴随着两个电极上氧化、还原反应的发生,同时生成新物质,故③、⑤对。某些不能自发进行的氧化还原反应,通过电解的原理也可以实现,故④对。所以D选项符合题意。
2.(2010·鹤壁高二检测)实验室用惰性电极电解氢氧化钠溶液,下列有关描述中正确的是( )
A.电解时,与电源正极相连的电极上产生H2
B.电解时,阳极反应是:4OH--4e- ==== O2↑+2H2O
C.在两极上放电的阴、阳离子的物质的量之比是2∶1
D.电解过程中,溶液的pH不变
【解析】选B。电解氢氧化钠溶液,实际是电解水。阴极与电源负极相连,电极反应是:4H++4e- ==== 2H2↑,A错误;阳极与电源正极相连,电极反应是:4OH--4e- ==== O2↑+2H2O,B正确;在两极上放电的阴、阳离子的物质的量之比是4∶4=1∶1,C错误;电解过程中,H2O不断被消耗,氢氧化钠溶液的浓度不断增大,故pH增大,D错误。
知识点二:电解原理的应用
3.下列关于铜电极的叙述正确的是( )
A.铜锌原电池中铜是负极
B.用电解法精炼铜时粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
【解析】选C。在铜锌原电池中,与铜相比,锌易失去电子,因而锌极是负极,则铜极是正极,选项A错误;精炼铜时,需将其中的铜变成铜离子,再在阴极还原成铜。因而在电解池中粗铜应作为阳极,选项B错误;
在镀件上镀铜时,需要将溶液中的铜离子还原成铜而沉积在镀件上。用作向溶液中供给铜离子的金属铜必须作为阳极,选项C正确;电解硫酸时,金属铜如果作为阳极,它将以铜离子的形式被溶解而进入电解液,当电解液内有H+、Cu2+两种离子共存时,后者将在阴极放电。这样阴极的生成物将是铜而不是氢气,达不到制氢气和氧气的目的。选项D不对。
4.观察下列几个装置示意图,有关叙述正确的是( )
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
【解析】选C。本题所涉及的四个装置图全部来源于高中教材,装置①,电解氯化铜的装置图中没有标电极材料的名称,但根据溶液的组成及所给提示“电解CuCl2溶液实验装置示意图”,不难判断,铜应该在阴
极上析出。电镀实验中,待镀金属作为阴(负)极,故在装置②电镀铜实验中,待镀铁制品应与电源负极相连。装置③,根据氢气的入口,故很容易判断出原电池的左边为负极,氢气在左边电极上失电子,故外电路电子由a极流向b极。装置④的离子交换膜是阳离子交换膜,只允许阳离子、水分子自由通过,不允许阴离子通过。
知识点三:电解池的有关计算
5.用两支惰性电极插入500 mL的AgNO3溶液中,通电电解。当电解质溶液的pH由6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),则电极上析出银的质量是( )
A.27 mg B.54 mg
C.108 mg D.216 mg
【解析】选B。根据离子放电顺序,先写出两极的电极反应式:
阳极:4OH--4e- ==== O2↑+2H2O ①
阴极:4Ag++4e- ==== 4Ag ②
其中OH-来自水,所以总的电解反应式:
4Ag++2H2O 4Ag↓+O2↑+4H+或
4AgNO3+2H2O 4Ag↓+O2↑+4HNO3
因为有HNO3生成,所以pH要变小。生成HNO3的物质的量为(10-3-10-6)×0.5≈0.5×10-3(mol),所以析出银的质量为0.5×10-3mol×108 g/mol=54 mg
电解
====
电解
====
6.有三个烧杯,分别盛有氯化铜,氯化钾和硝酸银三种溶液;均以Pt作电极,将它们串联在一起电解一段时间,测得电极增重总和2.8克,这时产生的有色气体与无色气体的物质的量之比为( )
A.4∶1 B.1∶1 C.4∶3 D.3∶4
【解析】选C。串联电路中,相同时间内各电极得或失的电子的物质的量相同,各电极上放出气体的物质的量之比为定值。不必注意电极增重是多少。只要判断出生成何种气体及生成该气体一定物质的量所得失电
子的物质的量,就可以通过电子守恒,判断气体体积之比,第一个烧杯中放出Cl2,第二烧杯中放出Cl2和H2,第三烧杯中放出O2。在有1 mol电子转移的情况下,分别是0.5 mol,0.5 mol,0.5 mol和0.25 mol。所以共放出有色气体0.5+0.5=1(mol)(Cl2),无色气体0.5+
0.25=0.75(mol)(O2和H2)。
一、选择题(本题包括4小题,每小题5分,共20分)
1.用惰性电极实现电解,下列说法正确的是( )
A.电解稀硫酸溶液,实质上是电解水,故溶液的pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液的pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
【解析】选D。以稀硫酸、氢氧化钠、硫酸钠为电解液时,电解的实质是水被电解。由于水的消耗,电解液的pH会发生改变;以硫酸为电解液时,溶液的pH减小;以氢氧化钠为电解液时,溶液的pH增大。电解硫酸钠溶液时,阴、阳两极上产生的气体分别是氢气、氧气,所以其物质的量之比为2∶1。电解氯化铜溶液,在阴极上析出铜,阳极上析出氯气。根据电子守
恒原理,铜离子所得到的电子数目应等于氯离子所失去的电子数目,每一个铜离子得到的2个电子等于2个Cl-失去的2个电子,所以析出的铜与氯气的物质的量之比为1∶1。
2.用惰性电极电解下列溶液一段时间以后再加入一定量的某种纯物质(括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
A.AgNO3(AgNO3) B.NaOH(H2O)
C.KCl(KCl) D.CuSO4[Cu(OH)2]
【解析】选B。分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,就加入什么物质即可使溶液复原。A选项中AgNO3溶液电解析出单质银和氧气,同时生成硝酸,因此复
原时加入的物质为氧化银(Ag2O);B选项中NaOH溶液电解时实际电解的是水,在电极上析出氧气和氢气,因此复原时加入的物质为H2O;C选项中KCl溶液电解时析出氯气和氢气,同时生成KOH溶液,因此复原时加入的物质为HCl;D选项中CuSO4溶液电解时析出单质铜和氧气,同时生成了硫酸溶液,因此复原时加入的物质为CuO。
3.(双选)(2010·海南高考)利用电解法可将含有
Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的
是( )
A.电解时以精铜作阳极
B.电解时阴极发生还原反应
C.粗铜连接电源负极,其电极反应是Cu-2e-====Cu2+
D.电解后,电解槽底部会形成含少量Ag、Pt等金属的
阳极泥
【解析】选B、D。电解法精炼金属铜时,粗铜作阳极,失去电子,逐渐溶解,Cu2+得到电子后析出,附着在阴极上,故精铜作阴极;在电解池中,阴极接电源的负极,发生还原反应,阳极接电源的正极,发生氧化反应,A、C错误,B正确;越活泼的金属越易失去电子,故比铜活泼的Fe、Zn先失去电子,变成Fe2+、Zn2+进入溶液,然后是铜失去电子,变成Cu2+进入溶液,因Ag、Pt等金属不如铜活泼,故在铜溶解后便沉淀在阳极底部成为阳极泥,D正确。
4.如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是( )
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶2
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷
【解析】选B。据F极显红色,推出F为阴极,电极反应:
2H++2e- ==== H2↑,从而确定A为电源正极,B为负极,C、E、G、X为阳极,D、F、H、Y为阴极。故A错误,C、D、E、F分别生成单质为O2、Cu、Cl2、H2,转移电子的量相同,故其物质的量之比为1∶2∶2∶2,B正确;因G为阳极,故G应为Ag,H为铜,C错误;据Y极附近红褐色加深,说明Fe(OH)3胶体微粒带有正电荷向阴极移动,D不正确。
二、非选择题(本题包括2小题,共10分)
5.(3分)甲、乙两个容器中,分别加入0.1 mol/L NaCl溶液与0.1 mol/L AgNO3溶液后,以Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为:_____。
【解析】此装置相当于两个电解槽串联到一起,在整个电路中电子转移总数相等,首先判断各极是阳极还是阴极,即电极名称,再分析各极发生的反应.A极(阴极)反应:2H++2e- ==== H2↑,B极(阳极)反应:2Cl--2e- ==== Cl2↑;C极(阴极)反应:Ag++e- ==== Ag;D极(阳极)反应:4OH--4e- ==== 2H2O+O2↑,根据电子守恒法可知,若
整个电路中有4 mol 电子转移,生成H2、Cl2、Ag、O2的物质的量分别为:2 mol、2 mol、4 mol、1 mol,因此各电极上生成物的物质的量之比为:2∶2∶4∶1。
答案:2∶2∶4∶1
6.(7分)(2010·北京四中模拟)请按要求回答下列问题。
(1)根据图1回答①②:
①打开K2,合并K1。
A电极可观察到的现象是____;
B极的电极反应为__________。
②打开 K1,合并K2。
A电极可观察到的现象是_____;
B极的电极反应为__________;
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示
的装置中进行电解,石墨电极上的电
极反应式为_______________,
电解反应的离子方程式为__________;
④实验完成后,铜电极增重a g,石墨
电极产生标准状况下的气体体积_____L。
【解析】(1)①此时为原电池,锌为负极,不断溶解,
B极为正极,反应为Cu2++2e- ==== Cu。
②此时为电解池,A极为阴极,反应为Cu2++2e- ====
Cu,故A极上镀上一层红色的铜,B极为阳极,反应为
Cu-2e- ==== Cu2+。
(2)此时为惰性电极电解CuSO4,石墨极上反应为:
4OH--4e- ==== 2H2O+O2↑,总反应的离子方程式为
2Cu2++2H2O 2Cu+O2↑+4H+,
V(O2)= 。
电解
====
答案:(1)①锌不断溶解 Cu2++2e- ==== Cu
②A镀上一层红色的铜 Cu-2e- ==== Cu2+
(2)③4OH--4e- ==== 2H2O+O2↑
2Cu2++2H2O 2Cu+O2↑+4H+ ④
电解
====
1.(5分)如图为直流电源电解稀
Na2SO4水溶液的装置。通电后在石
墨电极a和b附近分别滴加一滴石蕊
溶液。下列实验现象中正确的是
( )
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
【解析】选D。Na2SO4 ==== 2Na++SO42-,H2O ==== H+
+OH-,SO42-和OH-移向b电极,Na+和H+移向a电极,在b电极上:4OH--4e- ==== 2H2O+O2↑,在a电极上:2H++
2e- ==== H2↑,所以产生的气体体积a电极的大于b电极的;两种气体均为无色无味的气体;由于a电极上H+放电,所以a电极附近的c(OH-)>c(H+),滴加石蕊溶液,a电极附近呈蓝色,同理,b电极附近呈红色。
2.(5分)(2010·蚌埠高二检测)用惰性电极电解饱和Na2CO3溶液,若保持温度不变,则一段时间后( )
A.溶液的pH变大
B.c(Na+)与c(CO32-)的比值变大
C.溶液浓度变大,有晶体析出
D.溶液浓度不变,有晶体析出
【解析】选D。用惰性电极电解饱和Na2CO3溶液,实际是电解水,故Na2CO3会结晶析出,若保持温度不变,则仍为原温度下的饱和溶液,故溶液浓度不变,pH不变,c(Na+)∶c(CO32-)不变,故选D。
3.(10分)(2009·宁夏高考)请回答氯碱的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=______
(要求写出计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是______。(填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中X、Y分别是_____、_____(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小____;
②分别写出燃料电池B中正极、负极上发生的电极反应
正极:__________________;
负极:__________________;
③这样设计的主要节(电)能之处在于(写出2处)
__________________、__________________。
【解析】(1)只要了解电解饱和食盐水的化学方程式
2NaCl+2H2O 2NaOH+H2↑+Cl2↑,即可得到,
k=M(Cl2)/2 M(NaOH)=71/80=1∶1.13或0.89;(2)只
要抓住除钡离子要放在除碳酸根离子前即可得到顺序
关系:③①②;(3)本题突破口在于B燃料电池这
边,通空气一边为正极(还原反应),那么左边必然
通H2,这样Y即为H2;再转到左边依据电解饱和食盐水
的化学方程式可知惟一未知的就是X,必然为Cl2了;A
中的NaOH进入燃料电池正极再出来,依据O2+4e-+2H2O
==== 4OH-可知NaOH浓度增大。
电解
====
答案:(1)M(Cl2)/2 M(NaOH)=71/80=1∶1.13或0.89(2)③①② (3)①Cl2 H2 a%小于b%
②O2+4e-+2H2O ==== 4OH- H2-2e-+2OH- ==== 2H2O ③燃料电池可以补充电解池消耗的电能 提高产出碱液的浓度 降低能耗(任写2条,其他合理答案也可)
