【开学大礼包】2012高二化学课件:3.1弱电解质的电离(人教版选修4)
文档属性
| 名称 | 【开学大礼包】2012高二化学课件:3.1弱电解质的电离(人教版选修4) |  | |
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 13:29:56 | ||
图片预览











文档简介
(共53张PPT)
1.NaCl晶体、液态HCl、BaSO4水溶液均不导电,则NaCl、HCl、BaSO4均是非电解质吗?你能总结出电解质导电的条件是什么吗?
提示:NaCl晶体不导电是因为Na+、Cl-不能自由移动,但NaCl溶于水或熔融状态下能导电;液态HCl不能电离,无离子,但溶于水时在水分子作用下能电离出自由移动的离子而导电;BaSO4水溶液不导电是因为BaSO4难溶于水,水溶液中离子浓度很小,但溶于水的BaSO4全部电离,所以,NaCl、HCl、BaSO4均是电解质。因此,电解质导电的条件为水溶液或熔融状态下能导电,两个条件满足其一即可。
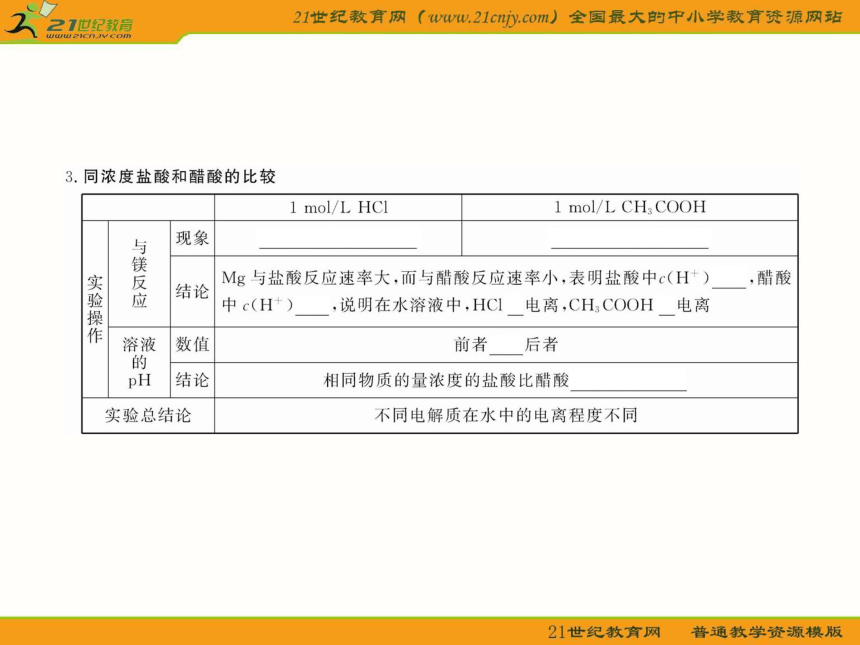
2.试仅从溶质的角度分析1 mol/L HCl溶液和1 mol/L CH3COOH溶液中,哪个里面所含的微粒种类多?
提示:HCl溶液中溶质HCl完全电离,形成H+和Cl-两种微粒;而CH3COOH溶液中溶质CH3COOH部分电离成H+和CH3COO-两种微粒,除此之外还有没电离的CH3COOH分子,所以该溶液中溶质形成了三种微粒,比HCl溶液中多一种溶质分子。
3.强电解质溶液的导电能力一定强,弱电解质溶液的导电能力一定弱吗?溶液的导电能力取决于什么?
提示:不一定,溶液的导电能力取决于溶液中离子所带电荷的浓度,离子浓度越大,所带电荷越多,则导电能力越强。而电解质的强弱则是指电解质在水溶液中的电离情况,因此二者无必然关系,即强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力不一定弱。但是,若条件相同,即相同浓度,相同温度下,相同化学组成的强电解质因完全电离而使溶液中离子浓度大,导电能力强。
【典例1】关于强、弱电解质叙述正确的是
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子
D.强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱
【思路点拨】(1)判断强、弱电解质的关键是化合物在水中是否全部电离。
(2)强、弱电解质与其溶解性、导电性无必然关系。
【自主解答】选C。判断强、弱电解质的关键是看化合物自身是否能在水中全部电离成离子,强电解质在水中完全电离,无溶质分子,弱电解质在水中部分电离,有离子也有溶质分子,从电解质的结构来看,强电解质包括离子化合物和含强极性键的共价化合物,故A错误,C正确;电解质的强弱与电解质的溶解性、导电能力强弱之间没有必然联系,如CaCO3难溶于水,但其溶于水的部分全部电离,故CaCO3为强电解质,B、D错误。
1.请与同学一起结合化学平衡的特征,分析电离平衡的特征。
提示:电离平衡是化学平衡的一种,故弱电解质的电离平衡特征可概括为五个字:
2.已知弱电解质的电离是吸热过程,醋酸的电离过程
如下:CH3COOH CH3COO-+H+,试结合勒夏特列原理
分析温度、浓度、其他物质对该电离平衡的影响。
提示:(1)温度:因为电离是吸热过程,所以升高温度,可促进弱电解质的电离。
(2)浓度:加水稀释时,离子浓度减小,溶液中各离子互相碰撞机会减少,离子相互结合生成弱电解质分子的速率减小,因此,加水稀释,可促进弱电解质的电离。
(3)同离子效应(向CH3COOH中加入CH3COONa晶体):加入CH3COONa晶体时,溶液中CH3COO-浓度增大,电离平衡向左移动,CH3COOH电离程度减小,因此当加入与弱电解质组成具有相同的离子的电解质时,抑制弱电解质的电离。
(4)消耗弱电解质的离子(向CH3COOH中加入Na2CO3粉末):因为加入的Na2CO3电离出的CO32-消耗CH3COOH电离出的H+而使c(H+)减小,所以电离平衡向右移动,因此,当加入能消耗弱电解质离子的电解质时,可促进弱电解质的电离。
(5)溶液酸碱性:如果通入HCl气体,会使H+浓度增大,抑制醋酸电离,平衡左移。如果加入NaOH固体,消耗了H+使其浓度降低,促进醋酸电离,平衡右移。
3.在25 ℃时,0.1 mol/L的HNO2、HCOOH、HCN的电离常数分别为4.6×10-4、1.8×10-4、4.9×10-10,则这三种酸的酸性大小顺序是怎样的?有何规律?
提示:根据这三种酸的电离常数大小可判断出这三种酸的酸性强弱顺序为:HNO2>HCOOH>HCN。
规律:相同条件下,弱酸的电离常数越大,酸性越强。
【典例2】在0.1 mol/L的NH3·H2O溶液中存在如下电
离平衡:NH3·H2O NH4++ OH-。下列叙述正确的是
A.加入少量浓盐酸,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol·L-1 NH4Cl溶液,溶液中c(OH-)减
小
D.加入少量MgSO4固体,溶液pH增大
【思路点拨】(1)加入不同物质后引起溶液中原有离子的变化趋势。
(2)受离子浓度变化影响,平衡体系的移动方向。
【自主解答】选C。本题主要考查电离平衡的影响因
素,对于平衡体系NH3·H2O NH4++ OH-加入少量浓
盐酸,发生H++OH- ==== H2O使OH-浓度降低,平衡正向
移动;加入少量NaOH固体,使OH-浓度升高,平衡逆向
移动;加入少量0.1 mol·L-1 NH4Cl溶液,使NH4+浓度
升高,平衡逆向移动,溶液中c(OH-)减小;加入少量
MgSO4固体,发生Mg2++2OH- ==== Mg(OH)2↓,溶液中
c(OH-)减小,pH减小。
知识点一:强弱电解质
1.下列叙述正确的是( )
A.溶液中的NaCl在电流的作用下电离成Na+和Cl-
B.溶于水后能电离出H+的化合物都是酸
C.CO2溶于水能导电,故CO2属于电解质
D.BaSO4难溶于水,但BaSO4属于强电解质
【解析】选D。A中NaCl的电离不需要通电,故A不正确;有些盐溶于水也能电离出H+,如NaHSO4,故B不正确;CO2溶于水生成的H2CO3可以电离出自由移动的离子,但CO2属于非电解质,故C也不正确。
2.同物质的量浓度、同体积的HCl和醋酸溶液,分别与过量相同情况的Na2CO3固体反应时,下列叙述正确的是
( )
A.反应速率HCl> CH3COOH
B.气泡逸出速率 CH3COOH>HCl
C.在相同条件下两酸产生的CO2的体积不相同
D.如果两酸的c(H+)相同时,两酸的物质的量浓度HCl>CH3COOH
【解析】选A。同物质的量浓度、同体积的HCl和醋酸溶液中,c(H+)是 HCl>CH3COOH,所以与Na2CO3固体的反应速率HCl>CH3COOH,A项对,B项错;两种酸的物质的量相等,提供的H+一样多,产生的CO2的体积也相同,C项错误;如果两酸的c(H+)相同时,两酸的物质的量浓度应为CH3COOH>HCl,D项错误。
知识点二:弱电解质的电离
3.下列电离方程式错误的是( )
A.(NH4)2SO4溶于水:(NH4)2SO4 ==== 2NH4++SO42-
B.H3PO4溶于水:H3PO4 3H++PO43-
C.HF溶于水:HF H++F-
D.NaHS溶于水:NaHS ==== Na++HS-,HS- H++S2-
【解析】选B。(NH4)2SO4属于强电解质,完全电离,A正确;H3PO4属于弱电解质,不能完全电离,应分步书写,且主要写出第一步,B错误;HF为一元弱酸,部分电离,C正确;NaHS属弱酸的酸式盐,两个电离方程式正确。
4.使某弱酸HX的电离程度增大,溶液中的c(H+)减小的措施有( )
A.加水稀释 B.加NaX
C.加热 D.加铜粉
【解析】选A。加水稀释能促进弱电解质电离,但离子浓度会减小,A项正确;加NaX会抑制HX的电离,B项错误;加热能促进电离,同时使c(H+)增大,C项错误;加铜粉不反应,对原溶液没影响,D项错误。
5.(1)甲、乙两瓶氨水的浓度分别为1 mol/L和
0.1 mol/L,则甲、乙两瓶氨水中c(OH-)之比_____
10(填“大于”、“等于”或“小于”)
(2)某一元弱酸A和二元强酸B的c(H+)相等,若将两溶液稀释相同的倍数,其溶液的c(H+):A_____B(填“大于”、“等于”或“小于”),其原因是_______________。
【解析】(1)若两瓶氨水电离程度相同,则OH-浓度之比为10∶1,但浓度越大电离程度越小,所以c(OH-)之比小于10∶1。
(2)在某一元弱酸A中,稀释时还会再电离出氢离子,而强酸B在稀释过程中c(H+)会成倍的下降,所以稀释后c(H+):A大于B。
答案:(1)小于 (2)大于 在稀释时A中还会再电离出氢离子
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列化合物中,只有在溶液中才能导电的电解质是
( )
A.NaCl B.SO2 C.H2SO4 D.Fe
【解析】选C。NaCl溶于水或熔融状态下均可导电;SO2为非电解质;H2SO4属于共价化合物,液态时不导电,只有溶于水时才导电;Fe既不是电解质,也不是非电解质。
2.(2010·佳木斯高二检测)下列关于强弱电解质的叙述错误的是( )
A.强电解质在溶液中完全电离,不存在电离平衡
B.在溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同
D.纯净的强电解质在液态时,有的导电,有的不导电
【解析】选B。本题考查强、弱电解质的概念。强电解质在溶液中完全电离,无电离平衡,A正确;强电解质和弱电解质是依据电离程度划分的,电解质的强弱和溶液导电能力的强弱没有必然的对应关系,所以B项错误;因为温度、浓度不同时,弱电解质的电离程度不同,故C正确;D项如熔融的氯化钠导电,而液态纯硫酸不导电,D正确。
3.下列关于电离平衡常数(K)的说法正确的是( )
A.电离平衡常数(K)只与弱电解质本身和温度有关
B.电离平衡常数(K)随浓度的变化而变化
C.电离平衡常数(K)越大标志着该电解质电离程度越小
D.电离平衡常数(K)只与弱电解质本身有关,与其他外部因素无关
【解析】选A。电离平衡常数(K)与弱电解质本身和温度有关而与浓度无关,故A正确,B、D错误;电离平衡常数(K)越大标志着该电解质电离程度越大,故C项错误。
4.醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,
下列叙述不正确的是( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)
+c(CH3COO-)
B.0.10 mol/L的CH3COOH溶液中加水稀释,溶液中
c(OH-)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等
体积混合后,溶液的pH<7
【解析】选B。根据电荷守恒,选项A中的等量关系成立;选项B中加水稀释,溶液酸性减弱,H+浓度降低,OH-浓度增大;选项C中加入少量的固体CH3COONa,实际上相当于增大了c(CH3COO-),使平衡逆向移动;选项D中pH=2的CH3COOH溶液中的c(H+)和pH=12的NaOH溶液中的c(OH-)相等,但由于CH3COOH为弱酸,CH3COOH只有部分电离,所以反应后溶液呈酸性。
5.(双选)已知0.1 mol/L的醋酸溶液中存在电离平衡:
CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A.加少量烧碱溶液
B.升高温度
C.加少量冰醋酸
D.加水
【解析】选B、D。加少量烧碱,将减小溶液中氢离子浓度,虽然平衡右移,但由勒夏特列原理可知,醋酸浓度降低程度小于溶液中氢离子浓度降低程度;C项加入少量冰醋酸,平衡右移但比值减小;升高温度,平衡右移,氢离子浓度增大,醋酸浓度减小,B正确;加水氢离子浓度和醋酸浓度都降低,若平衡不移动,则比值不变,但事实上平衡右移,故D正确;此题的C、D两项若从结果来看,可以看成是不同浓度的醋酸中c(H+)/c(CH3COOH)值,这样可更快选出正确答案。
二、非选择题(本题包括1小题,共10分)
6.下列物质中:(1)能导电的是_____;
(2)属于电解质的是_____;
(3)属于非电解质的是_____;
(4)属于强电解质的是_____;
(5)属于弱电解质的是_____。
A.NaOH溶液 B.Cu C.液态HCl D.液态CH3COOH
E.蔗糖溶液 F.液氨 G.氨水 H.CuSO4晶体
I.石墨 J.无水乙醇
【解析】(1)离子化合物在水溶液里或熔融状态下能导电,共价化合物中的电解质在水溶液里能导电,金属单质和部分非金属单质能导电。第(2)问~第(5)问根据电解质、非电解质、强电解质、弱电解质的概念进行判断。
答案:(1)A、B、G、I (2)C、D、H
(3)F、J (4)C、H (5)D
1.(5分)化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(溶液) H+(溶液)+ In-(溶液)
红色 黄色
浓度为0.02 mol/L的下列各溶液:①盐酸 ②石灰水
③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,其中能使指示剂显红色的有( )
A.①④⑤ B.②⑤⑥ C.①④ D.②③⑥
【解析】选C。化合物HIn在水溶液中存在着以上的电离平衡,可以看出它在酸性时才显红色,而所给物质中只有①④才能使溶液显酸性,⑤虽然是酸式盐,但它的溶液不显酸性,所以只选①④。
2.(15分)(1)将25 mL 0.2 mol/L的盐酸和25 mL 0.2 mol/L的CH3COONa溶液进行混合;
(2)50 mL 0.1 mol/L的CH3COOH溶液
则:两溶液中的氢离子浓度之比为:_____;
两溶液中的CH3COOH的物质的量浓度之比为:_____;
比较两溶液的导电能力:_____(填“前者强”、“后者强”或“相同”)。
【解析】(1)发生反应:HCl+CH3COONa ==== CH3COOH
+NaCl,故(1)中为50 mL 0.1 mol/L的CH3COOH与
0.1 mol/L的NaCl的混合溶液。因此,(1)、(2)两溶液中CH3COOH与CH3COO-和H+的电离平衡是完全相同的。故两溶液中CH3COOH、CH3COO-、H+的浓度对应相同。只是前者的溶质还有NaCl,故其导电能力要比后者强。
答案:1∶1 1∶1 前者强
1.NaCl晶体、液态HCl、BaSO4水溶液均不导电,则NaCl、HCl、BaSO4均是非电解质吗?你能总结出电解质导电的条件是什么吗?
提示:NaCl晶体不导电是因为Na+、Cl-不能自由移动,但NaCl溶于水或熔融状态下能导电;液态HCl不能电离,无离子,但溶于水时在水分子作用下能电离出自由移动的离子而导电;BaSO4水溶液不导电是因为BaSO4难溶于水,水溶液中离子浓度很小,但溶于水的BaSO4全部电离,所以,NaCl、HCl、BaSO4均是电解质。因此,电解质导电的条件为水溶液或熔融状态下能导电,两个条件满足其一即可。
2.试仅从溶质的角度分析1 mol/L HCl溶液和1 mol/L CH3COOH溶液中,哪个里面所含的微粒种类多?
提示:HCl溶液中溶质HCl完全电离,形成H+和Cl-两种微粒;而CH3COOH溶液中溶质CH3COOH部分电离成H+和CH3COO-两种微粒,除此之外还有没电离的CH3COOH分子,所以该溶液中溶质形成了三种微粒,比HCl溶液中多一种溶质分子。
3.强电解质溶液的导电能力一定强,弱电解质溶液的导电能力一定弱吗?溶液的导电能力取决于什么?
提示:不一定,溶液的导电能力取决于溶液中离子所带电荷的浓度,离子浓度越大,所带电荷越多,则导电能力越强。而电解质的强弱则是指电解质在水溶液中的电离情况,因此二者无必然关系,即强电解质溶液的导电能力不一定强,弱电解质溶液的导电能力不一定弱。但是,若条件相同,即相同浓度,相同温度下,相同化学组成的强电解质因完全电离而使溶液中离子浓度大,导电能力强。
【典例1】关于强、弱电解质叙述正确的是
A.强电解质都是离子化合物,弱电解质都是共价化合物
B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子
D.强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱
【思路点拨】(1)判断强、弱电解质的关键是化合物在水中是否全部电离。
(2)强、弱电解质与其溶解性、导电性无必然关系。
【自主解答】选C。判断强、弱电解质的关键是看化合物自身是否能在水中全部电离成离子,强电解质在水中完全电离,无溶质分子,弱电解质在水中部分电离,有离子也有溶质分子,从电解质的结构来看,强电解质包括离子化合物和含强极性键的共价化合物,故A错误,C正确;电解质的强弱与电解质的溶解性、导电能力强弱之间没有必然联系,如CaCO3难溶于水,但其溶于水的部分全部电离,故CaCO3为强电解质,B、D错误。
1.请与同学一起结合化学平衡的特征,分析电离平衡的特征。
提示:电离平衡是化学平衡的一种,故弱电解质的电离平衡特征可概括为五个字:
2.已知弱电解质的电离是吸热过程,醋酸的电离过程
如下:CH3COOH CH3COO-+H+,试结合勒夏特列原理
分析温度、浓度、其他物质对该电离平衡的影响。
提示:(1)温度:因为电离是吸热过程,所以升高温度,可促进弱电解质的电离。
(2)浓度:加水稀释时,离子浓度减小,溶液中各离子互相碰撞机会减少,离子相互结合生成弱电解质分子的速率减小,因此,加水稀释,可促进弱电解质的电离。
(3)同离子效应(向CH3COOH中加入CH3COONa晶体):加入CH3COONa晶体时,溶液中CH3COO-浓度增大,电离平衡向左移动,CH3COOH电离程度减小,因此当加入与弱电解质组成具有相同的离子的电解质时,抑制弱电解质的电离。
(4)消耗弱电解质的离子(向CH3COOH中加入Na2CO3粉末):因为加入的Na2CO3电离出的CO32-消耗CH3COOH电离出的H+而使c(H+)减小,所以电离平衡向右移动,因此,当加入能消耗弱电解质离子的电解质时,可促进弱电解质的电离。
(5)溶液酸碱性:如果通入HCl气体,会使H+浓度增大,抑制醋酸电离,平衡左移。如果加入NaOH固体,消耗了H+使其浓度降低,促进醋酸电离,平衡右移。
3.在25 ℃时,0.1 mol/L的HNO2、HCOOH、HCN的电离常数分别为4.6×10-4、1.8×10-4、4.9×10-10,则这三种酸的酸性大小顺序是怎样的?有何规律?
提示:根据这三种酸的电离常数大小可判断出这三种酸的酸性强弱顺序为:HNO2>HCOOH>HCN。
规律:相同条件下,弱酸的电离常数越大,酸性越强。
【典例2】在0.1 mol/L的NH3·H2O溶液中存在如下电
离平衡:NH3·H2O NH4++ OH-。下列叙述正确的是
A.加入少量浓盐酸,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol·L-1 NH4Cl溶液,溶液中c(OH-)减
小
D.加入少量MgSO4固体,溶液pH增大
【思路点拨】(1)加入不同物质后引起溶液中原有离子的变化趋势。
(2)受离子浓度变化影响,平衡体系的移动方向。
【自主解答】选C。本题主要考查电离平衡的影响因
素,对于平衡体系NH3·H2O NH4++ OH-加入少量浓
盐酸,发生H++OH- ==== H2O使OH-浓度降低,平衡正向
移动;加入少量NaOH固体,使OH-浓度升高,平衡逆向
移动;加入少量0.1 mol·L-1 NH4Cl溶液,使NH4+浓度
升高,平衡逆向移动,溶液中c(OH-)减小;加入少量
MgSO4固体,发生Mg2++2OH- ==== Mg(OH)2↓,溶液中
c(OH-)减小,pH减小。
知识点一:强弱电解质
1.下列叙述正确的是( )
A.溶液中的NaCl在电流的作用下电离成Na+和Cl-
B.溶于水后能电离出H+的化合物都是酸
C.CO2溶于水能导电,故CO2属于电解质
D.BaSO4难溶于水,但BaSO4属于强电解质
【解析】选D。A中NaCl的电离不需要通电,故A不正确;有些盐溶于水也能电离出H+,如NaHSO4,故B不正确;CO2溶于水生成的H2CO3可以电离出自由移动的离子,但CO2属于非电解质,故C也不正确。
2.同物质的量浓度、同体积的HCl和醋酸溶液,分别与过量相同情况的Na2CO3固体反应时,下列叙述正确的是
( )
A.反应速率HCl> CH3COOH
B.气泡逸出速率 CH3COOH>HCl
C.在相同条件下两酸产生的CO2的体积不相同
D.如果两酸的c(H+)相同时,两酸的物质的量浓度HCl>CH3COOH
【解析】选A。同物质的量浓度、同体积的HCl和醋酸溶液中,c(H+)是 HCl>CH3COOH,所以与Na2CO3固体的反应速率HCl>CH3COOH,A项对,B项错;两种酸的物质的量相等,提供的H+一样多,产生的CO2的体积也相同,C项错误;如果两酸的c(H+)相同时,两酸的物质的量浓度应为CH3COOH>HCl,D项错误。
知识点二:弱电解质的电离
3.下列电离方程式错误的是( )
A.(NH4)2SO4溶于水:(NH4)2SO4 ==== 2NH4++SO42-
B.H3PO4溶于水:H3PO4 3H++PO43-
C.HF溶于水:HF H++F-
D.NaHS溶于水:NaHS ==== Na++HS-,HS- H++S2-
【解析】选B。(NH4)2SO4属于强电解质,完全电离,A正确;H3PO4属于弱电解质,不能完全电离,应分步书写,且主要写出第一步,B错误;HF为一元弱酸,部分电离,C正确;NaHS属弱酸的酸式盐,两个电离方程式正确。
4.使某弱酸HX的电离程度增大,溶液中的c(H+)减小的措施有( )
A.加水稀释 B.加NaX
C.加热 D.加铜粉
【解析】选A。加水稀释能促进弱电解质电离,但离子浓度会减小,A项正确;加NaX会抑制HX的电离,B项错误;加热能促进电离,同时使c(H+)增大,C项错误;加铜粉不反应,对原溶液没影响,D项错误。
5.(1)甲、乙两瓶氨水的浓度分别为1 mol/L和
0.1 mol/L,则甲、乙两瓶氨水中c(OH-)之比_____
10(填“大于”、“等于”或“小于”)
(2)某一元弱酸A和二元强酸B的c(H+)相等,若将两溶液稀释相同的倍数,其溶液的c(H+):A_____B(填“大于”、“等于”或“小于”),其原因是_______________。
【解析】(1)若两瓶氨水电离程度相同,则OH-浓度之比为10∶1,但浓度越大电离程度越小,所以c(OH-)之比小于10∶1。
(2)在某一元弱酸A中,稀释时还会再电离出氢离子,而强酸B在稀释过程中c(H+)会成倍的下降,所以稀释后c(H+):A大于B。
答案:(1)小于 (2)大于 在稀释时A中还会再电离出氢离子
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列化合物中,只有在溶液中才能导电的电解质是
( )
A.NaCl B.SO2 C.H2SO4 D.Fe
【解析】选C。NaCl溶于水或熔融状态下均可导电;SO2为非电解质;H2SO4属于共价化合物,液态时不导电,只有溶于水时才导电;Fe既不是电解质,也不是非电解质。
2.(2010·佳木斯高二检测)下列关于强弱电解质的叙述错误的是( )
A.强电解质在溶液中完全电离,不存在电离平衡
B.在溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
C.同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不相同
D.纯净的强电解质在液态时,有的导电,有的不导电
【解析】选B。本题考查强、弱电解质的概念。强电解质在溶液中完全电离,无电离平衡,A正确;强电解质和弱电解质是依据电离程度划分的,电解质的强弱和溶液导电能力的强弱没有必然的对应关系,所以B项错误;因为温度、浓度不同时,弱电解质的电离程度不同,故C正确;D项如熔融的氯化钠导电,而液态纯硫酸不导电,D正确。
3.下列关于电离平衡常数(K)的说法正确的是( )
A.电离平衡常数(K)只与弱电解质本身和温度有关
B.电离平衡常数(K)随浓度的变化而变化
C.电离平衡常数(K)越大标志着该电解质电离程度越小
D.电离平衡常数(K)只与弱电解质本身有关,与其他外部因素无关
【解析】选A。电离平衡常数(K)与弱电解质本身和温度有关而与浓度无关,故A正确,B、D错误;电离平衡常数(K)越大标志着该电解质电离程度越大,故C项错误。
4.醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,
下列叙述不正确的是( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)
+c(CH3COO-)
B.0.10 mol/L的CH3COOH溶液中加水稀释,溶液中
c(OH-)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等
体积混合后,溶液的pH<7
【解析】选B。根据电荷守恒,选项A中的等量关系成立;选项B中加水稀释,溶液酸性减弱,H+浓度降低,OH-浓度增大;选项C中加入少量的固体CH3COONa,实际上相当于增大了c(CH3COO-),使平衡逆向移动;选项D中pH=2的CH3COOH溶液中的c(H+)和pH=12的NaOH溶液中的c(OH-)相等,但由于CH3COOH为弱酸,CH3COOH只有部分电离,所以反应后溶液呈酸性。
5.(双选)已知0.1 mol/L的醋酸溶液中存在电离平衡:
CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A.加少量烧碱溶液
B.升高温度
C.加少量冰醋酸
D.加水
【解析】选B、D。加少量烧碱,将减小溶液中氢离子浓度,虽然平衡右移,但由勒夏特列原理可知,醋酸浓度降低程度小于溶液中氢离子浓度降低程度;C项加入少量冰醋酸,平衡右移但比值减小;升高温度,平衡右移,氢离子浓度增大,醋酸浓度减小,B正确;加水氢离子浓度和醋酸浓度都降低,若平衡不移动,则比值不变,但事实上平衡右移,故D正确;此题的C、D两项若从结果来看,可以看成是不同浓度的醋酸中c(H+)/c(CH3COOH)值,这样可更快选出正确答案。
二、非选择题(本题包括1小题,共10分)
6.下列物质中:(1)能导电的是_____;
(2)属于电解质的是_____;
(3)属于非电解质的是_____;
(4)属于强电解质的是_____;
(5)属于弱电解质的是_____。
A.NaOH溶液 B.Cu C.液态HCl D.液态CH3COOH
E.蔗糖溶液 F.液氨 G.氨水 H.CuSO4晶体
I.石墨 J.无水乙醇
【解析】(1)离子化合物在水溶液里或熔融状态下能导电,共价化合物中的电解质在水溶液里能导电,金属单质和部分非金属单质能导电。第(2)问~第(5)问根据电解质、非电解质、强电解质、弱电解质的概念进行判断。
答案:(1)A、B、G、I (2)C、D、H
(3)F、J (4)C、H (5)D
1.(5分)化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(溶液) H+(溶液)+ In-(溶液)
红色 黄色
浓度为0.02 mol/L的下列各溶液:①盐酸 ②石灰水
③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,其中能使指示剂显红色的有( )
A.①④⑤ B.②⑤⑥ C.①④ D.②③⑥
【解析】选C。化合物HIn在水溶液中存在着以上的电离平衡,可以看出它在酸性时才显红色,而所给物质中只有①④才能使溶液显酸性,⑤虽然是酸式盐,但它的溶液不显酸性,所以只选①④。
2.(15分)(1)将25 mL 0.2 mol/L的盐酸和25 mL 0.2 mol/L的CH3COONa溶液进行混合;
(2)50 mL 0.1 mol/L的CH3COOH溶液
则:两溶液中的氢离子浓度之比为:_____;
两溶液中的CH3COOH的物质的量浓度之比为:_____;
比较两溶液的导电能力:_____(填“前者强”、“后者强”或“相同”)。
【解析】(1)发生反应:HCl+CH3COONa ==== CH3COOH
+NaCl,故(1)中为50 mL 0.1 mol/L的CH3COOH与
0.1 mol/L的NaCl的混合溶液。因此,(1)、(2)两溶液中CH3COOH与CH3COO-和H+的电离平衡是完全相同的。故两溶液中CH3COOH、CH3COO-、H+的浓度对应相同。只是前者的溶质还有NaCl,故其导电能力要比后者强。
答案:1∶1 1∶1 前者强
