化学高中鲁科版选修四3.3沉淀溶解平衡的应用
文档属性
| 名称 | 化学高中鲁科版选修四3.3沉淀溶解平衡的应用 |

|
|
| 格式 | zip | ||
| 文件大小 | 824.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 16:38:34 | ||
图片预览








文档简介
(共23张PPT)
1、误食可溶性钡盐,造成钡中毒,应尽快用5%的Na2SO4溶液给患者洗胃
2、精制食盐时,可加入适量的NaOH溶液除去氯化钠中的Mg2+
请运用沉淀溶解平衡的原理解释下列事实
为什么不用Na2CO3
除去Mg2+
BaSO4(s) Ba2++SO4 2-
KSP=1.07×10-10
Mg(OH)2(s) Mg2++2OH-
KSP=5.61×10-12
KSP与沉淀的溶解和生成关系
MgCO3 (s) Mg2++CO32-
KSP=6.82×10-6
1.难溶电解质在水中会建立沉淀溶解平衡:
Qc>Ksp时,平衡向生成沉淀的方向移动。
Qc=Ksp,平衡状态,既无沉淀生成,也不能 溶解沉淀
Qc < Ksp , 沉淀溶解
2.用Ksp定量描述难溶电解质的溶解能力。
归纳小结
沉淀溶解平衡的应用
1、原则:生成沉淀的反应能发生,且进行得越完全越好。
2、意义:在物质的检验、提纯及工厂废水的处理等方面有重要意义。
3、方法(1)加沉淀剂
(2) 调PH
一、沉淀的生成
Qc>Ksp,生成沉淀
问题组:
1、为什么向溶液中加入Cu(OH)2和Cu2(OH)2CO3?
2、还可以用什么物质代替?
废铜(主要杂质为Fe)制备胆矾的流程
氧化剂
H2SO4
含铁废铜
CuSO4 aq) (含Fe3+)
Cu(OH)2
Cu2(OH)2CO3
调节溶液
PH=3-4
Fe(OH)3↓
(除去Fe3+)
Cu2+
学生讨论结果:
学生列举CuO、CuCO3、NH3·H2O、NaOH等物质,讨论哪些物质可行?为什么?
BaCO3 Ba2+ + CO32-
+
2H+
H2O + CO2
1、 医院中进行钡餐透视时,用BaSO4做内服造影剂,为什么不用BaCO3做内服造影剂?
请你利用沉淀溶解平衡的知识、Qc与Ksp的关系及所提供的信息解释下列现象:
1.Ksp(BaSO4)=1.1×10-10mol2·L-2;Ksp(BaCO3)=5.1×10-9mol2·L-2
2.Ba2+有剧毒,;
3.胃酸的酸性很强,pH约为0.9~1.5
H+和SO42-不反应,不影响BaSO4的沉淀溶解平衡,Ba2+浓度保持在安全浓度标准下,所以用BaSO4 作“钡餐”
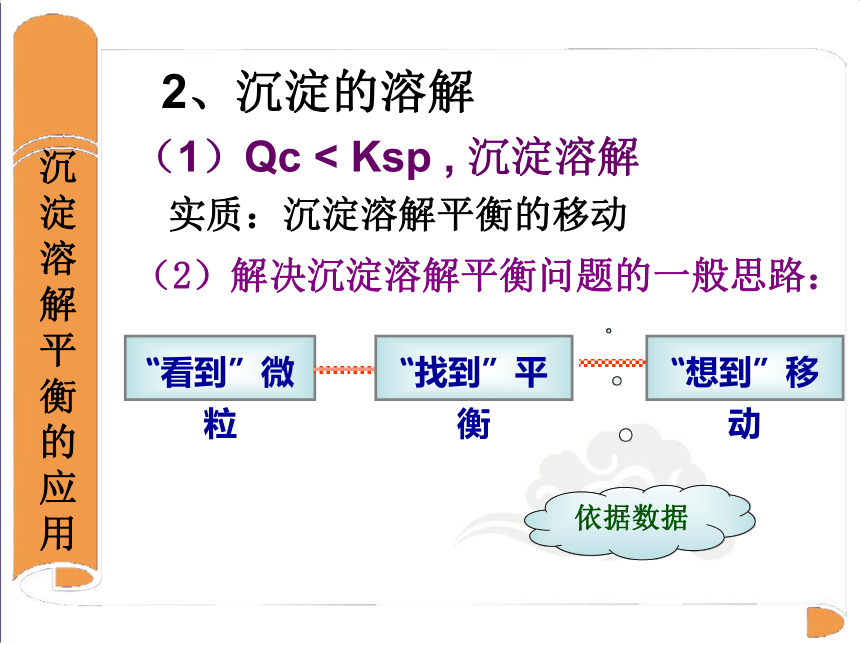
2、沉淀的溶解
实质:沉淀溶解平衡的移动
(1)Qc < Ksp , 沉淀溶解
(2)解决沉淀溶解平衡问题的一般思路:
“看到”微粒
“找到”平衡
“想到”移动
依据数据
龋齿的形成
(1) 牙齿表面由一层硬的组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH 5Ca2+(aq) +3PO43- (aq) +OH-(aq) KSP=2.5×10-59mol9 L-9
(2)进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是:
生成的有机酸能中和OH-,使平衡向脱矿方向移动,羟基磷灰石溶解,加速腐蚀牙齿
牙齿的保护
3、根据羟基磷灰石的平衡体系,你能想到用什么方法保护牙齿?
Ca5(PO4)3OH 5Ca2+(aq) +3PO43- (aq) +OH-(aq) KSP=2.5×10-59mol9 L-9
4、已知Ca5(PO4)3F的KSP=2.8×10-61mol9 L-9,比Ca5(PO4)3OH质地___。请用离子方程式表示使用含氟牙膏防止龋齿的原因 .
更坚固
5Ca2+ + 3PO43- + F-= Ca5(PO4)3F
含钾、钠、钙、镁等矿物质较多的食物,在体内的最终代谢产物呈碱性。 包括:豆腐、牛奶、芹菜、土豆、竹笋、香菇、胡萝卜、海带、绿豆、香蕉、西瓜、草莓以及大部分的蔬菜和水果
1.取一支试管,向其中滴加2mL硝酸银溶液,然后向其中逐滴加入氯化钠溶液。
2.向上述试管中滴加碘化钾溶液。
3.向实验2的试管中滴加硫化钠溶液。
实验卡
3、沉淀的转化
实验现象 离子方程式
1
2
3
生成白色沉淀
生成黄色沉淀
生成黑色沉淀
Ag++Cl- = AgCl↓
Ag++I- = AgI ↓
2Ag++S2- = Ag2S ↓
已知AgCl、 AgI和Ag2S的KSP为 1.8×10-10mol2 L-2、
8.3×10-17mol2 L-2 、
1.6×10-49mol3 L-3 ,
分析沉淀转化的方向。
规律探究
AgCl Ag+ + Cl-
+
KI == I- + K+
AgI
2AgI 2Ag+ + 2I-
Na2S == S2- + 2Na+
+
Ag2S
(1)实质:沉淀溶解平衡的移动
(2)一般规律:沉淀溶解平衡是溶解能力相对较强的物质转化为溶解能力相对较强的物质
3、沉淀的转化
重晶石(主要成分是BaSO4)是制备钡化合物的重要原料 :BaSO4不溶于酸,但可以用饱和Na2CO3溶液处理转化为易溶于酸的BaCO3
BaSO4 Ba2+ + SO42-
+
BaCO3(s)
BaSO4 + CO32- BaCO3 +SO42-
①饱和Na2CO3溶液
②移走上层溶液
H+
(重复①②操作)
BaSO4 、BaCO3
Ba2+
BaSO4
……
BaCO3
Na2CO3 CO32- + 2Na+
1、 BaSO4的ksp比 BaCO3小,为什么可以转化?
2、饱和Na2CO3溶液的作用是什么?
3、如何操作才能保证绝大多数BaSO4 转化为BaCO3?
(1)实质:沉淀溶解平衡的移动
(2)一般规律:溶解能力相对较强的物质易转化为溶解能力相对较弱的物质
3、沉淀的转化
(3)控制条件,将难溶强酸盐转化为难溶弱酸盐(使溶解能力相对较弱的物质转化为溶解能力相对较强的物质)
锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使 之转化为疏松、易溶于酸的CaCO3。
CaSO4 SO42- + Ca2+
+
CO32-
CaCO3
我们学到了什么?
沉淀溶解平衡的应用
1.沉淀的生成
2、沉淀的溶解
3.沉淀的转化;
KSP和沉
淀
溶
解
平
衡
的
移
动
解决沉淀溶解平衡问题的一般思路
1、龋齿的形成和防治
2、工业处理重晶石
3、锅炉除水垢
沉淀溶解平衡
生活
自然界
生产
溶液中的化学反应
溶洞中美丽的石笋、钟乳石和石柱是大自然创造的奇迹。石灰岩里不溶性的碳酸钙与水及二氧化碳反应能转化为微溶性的碳酸氢钙。
溶有碳酸氢钙的水从溶洞顶向溶洞底滴落时,水分蒸发,二氧化碳压强减小以及温度的变化都会使二氧化碳溶解度减小而析出碳酸钙沉淀。这些沉淀经过千百万年的积聚,渐渐形成了钟乳石、石笋等。
CaCO3 Ca2+ + CO32-
2HCO3-
+
H2O+CO2
溶洞的形成:
珊瑚虫是海洋中的一种腔肠动物,可从周围的海水中获取Ca2+和HCO3-,经反应形成石灰石外壳。珊瑚周围的藻类植物的生长会促进碳酸的产生,对珊瑚的形成贡献巨大。人口增长、人类大规模砍伐森林、燃烧煤和其他化学燃料等因素导致空气中二氧化碳增多,使海水中二氧化碳浓度增大,干扰珊瑚的生长,甚至造成珊瑚虫的死亡。
美丽的珊瑚礁
1、误食可溶性钡盐,造成钡中毒,应尽快用5%的Na2SO4溶液给患者洗胃
2、精制食盐时,可加入适量的NaOH溶液除去氯化钠中的Mg2+
请运用沉淀溶解平衡的原理解释下列事实
为什么不用Na2CO3
除去Mg2+
BaSO4(s) Ba2++SO4 2-
KSP=1.07×10-10
Mg(OH)2(s) Mg2++2OH-
KSP=5.61×10-12
KSP与沉淀的溶解和生成关系
MgCO3 (s) Mg2++CO32-
KSP=6.82×10-6
1.难溶电解质在水中会建立沉淀溶解平衡:
Qc>Ksp时,平衡向生成沉淀的方向移动。
Qc=Ksp,平衡状态,既无沉淀生成,也不能 溶解沉淀
Qc < Ksp , 沉淀溶解
2.用Ksp定量描述难溶电解质的溶解能力。
归纳小结
沉淀溶解平衡的应用
1、原则:生成沉淀的反应能发生,且进行得越完全越好。
2、意义:在物质的检验、提纯及工厂废水的处理等方面有重要意义。
3、方法(1)加沉淀剂
(2) 调PH
一、沉淀的生成
Qc>Ksp,生成沉淀
问题组:
1、为什么向溶液中加入Cu(OH)2和Cu2(OH)2CO3?
2、还可以用什么物质代替?
废铜(主要杂质为Fe)制备胆矾的流程
氧化剂
H2SO4
含铁废铜
CuSO4 aq) (含Fe3+)
Cu(OH)2
Cu2(OH)2CO3
调节溶液
PH=3-4
Fe(OH)3↓
(除去Fe3+)
Cu2+
学生讨论结果:
学生列举CuO、CuCO3、NH3·H2O、NaOH等物质,讨论哪些物质可行?为什么?
BaCO3 Ba2+ + CO32-
+
2H+
H2O + CO2
1、 医院中进行钡餐透视时,用BaSO4做内服造影剂,为什么不用BaCO3做内服造影剂?
请你利用沉淀溶解平衡的知识、Qc与Ksp的关系及所提供的信息解释下列现象:
1.Ksp(BaSO4)=1.1×10-10mol2·L-2;Ksp(BaCO3)=5.1×10-9mol2·L-2
2.Ba2+有剧毒,;
3.胃酸的酸性很强,pH约为0.9~1.5
H+和SO42-不反应,不影响BaSO4的沉淀溶解平衡,Ba2+浓度保持在安全浓度标准下,所以用BaSO4 作“钡餐”
2、沉淀的溶解
实质:沉淀溶解平衡的移动
(1)Qc < Ksp , 沉淀溶解
(2)解决沉淀溶解平衡问题的一般思路:
“看到”微粒
“找到”平衡
“想到”移动
依据数据
龋齿的形成
(1) 牙齿表面由一层硬的组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡:
Ca5(PO4)3OH 5Ca2+(aq) +3PO43- (aq) +OH-(aq) KSP=2.5×10-59mol9 L-9
(2)进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是:
生成的有机酸能中和OH-,使平衡向脱矿方向移动,羟基磷灰石溶解,加速腐蚀牙齿
牙齿的保护
3、根据羟基磷灰石的平衡体系,你能想到用什么方法保护牙齿?
Ca5(PO4)3OH 5Ca2+(aq) +3PO43- (aq) +OH-(aq) KSP=2.5×10-59mol9 L-9
4、已知Ca5(PO4)3F的KSP=2.8×10-61mol9 L-9,比Ca5(PO4)3OH质地___。请用离子方程式表示使用含氟牙膏防止龋齿的原因 .
更坚固
5Ca2+ + 3PO43- + F-= Ca5(PO4)3F
含钾、钠、钙、镁等矿物质较多的食物,在体内的最终代谢产物呈碱性。 包括:豆腐、牛奶、芹菜、土豆、竹笋、香菇、胡萝卜、海带、绿豆、香蕉、西瓜、草莓以及大部分的蔬菜和水果
1.取一支试管,向其中滴加2mL硝酸银溶液,然后向其中逐滴加入氯化钠溶液。
2.向上述试管中滴加碘化钾溶液。
3.向实验2的试管中滴加硫化钠溶液。
实验卡
3、沉淀的转化
实验现象 离子方程式
1
2
3
生成白色沉淀
生成黄色沉淀
生成黑色沉淀
Ag++Cl- = AgCl↓
Ag++I- = AgI ↓
2Ag++S2- = Ag2S ↓
已知AgCl、 AgI和Ag2S的KSP为 1.8×10-10mol2 L-2、
8.3×10-17mol2 L-2 、
1.6×10-49mol3 L-3 ,
分析沉淀转化的方向。
规律探究
AgCl Ag+ + Cl-
+
KI == I- + K+
AgI
2AgI 2Ag+ + 2I-
Na2S == S2- + 2Na+
+
Ag2S
(1)实质:沉淀溶解平衡的移动
(2)一般规律:沉淀溶解平衡是溶解能力相对较强的物质转化为溶解能力相对较强的物质
3、沉淀的转化
重晶石(主要成分是BaSO4)是制备钡化合物的重要原料 :BaSO4不溶于酸,但可以用饱和Na2CO3溶液处理转化为易溶于酸的BaCO3
BaSO4 Ba2+ + SO42-
+
BaCO3(s)
BaSO4 + CO32- BaCO3 +SO42-
①饱和Na2CO3溶液
②移走上层溶液
H+
(重复①②操作)
BaSO4 、BaCO3
Ba2+
BaSO4
……
BaCO3
Na2CO3 CO32- + 2Na+
1、 BaSO4的ksp比 BaCO3小,为什么可以转化?
2、饱和Na2CO3溶液的作用是什么?
3、如何操作才能保证绝大多数BaSO4 转化为BaCO3?
(1)实质:沉淀溶解平衡的移动
(2)一般规律:溶解能力相对较强的物质易转化为溶解能力相对较弱的物质
3、沉淀的转化
(3)控制条件,将难溶强酸盐转化为难溶弱酸盐(使溶解能力相对较弱的物质转化为溶解能力相对较强的物质)
锅炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使 之转化为疏松、易溶于酸的CaCO3。
CaSO4 SO42- + Ca2+
+
CO32-
CaCO3
我们学到了什么?
沉淀溶解平衡的应用
1.沉淀的生成
2、沉淀的溶解
3.沉淀的转化;
KSP和沉
淀
溶
解
平
衡
的
移
动
解决沉淀溶解平衡问题的一般思路
1、龋齿的形成和防治
2、工业处理重晶石
3、锅炉除水垢
沉淀溶解平衡
生活
自然界
生产
溶液中的化学反应
溶洞中美丽的石笋、钟乳石和石柱是大自然创造的奇迹。石灰岩里不溶性的碳酸钙与水及二氧化碳反应能转化为微溶性的碳酸氢钙。
溶有碳酸氢钙的水从溶洞顶向溶洞底滴落时,水分蒸发,二氧化碳压强减小以及温度的变化都会使二氧化碳溶解度减小而析出碳酸钙沉淀。这些沉淀经过千百万年的积聚,渐渐形成了钟乳石、石笋等。
CaCO3 Ca2+ + CO32-
2HCO3-
+
H2O+CO2
溶洞的形成:
珊瑚虫是海洋中的一种腔肠动物,可从周围的海水中获取Ca2+和HCO3-,经反应形成石灰石外壳。珊瑚周围的藻类植物的生长会促进碳酸的产生,对珊瑚的形成贡献巨大。人口增长、人类大规模砍伐森林、燃烧煤和其他化学燃料等因素导致空气中二氧化碳增多,使海水中二氧化碳浓度增大,干扰珊瑚的生长,甚至造成珊瑚虫的死亡。
美丽的珊瑚礁
