11-12版高中化学全程学习方略配套课件:1.3人类对原子结构的认识(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:1.3人类对原子结构的认识(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 20:44:18 | ||
图片预览









文档简介
(共82张PPT)
【典例1】导弹的巨大威力离不开制导弹合金材料中的稀土元素钕(14060Nd)。则下列说法中正确的是
A.钕原子的摩尔质量等于其相对原子质量
B.一个14060Nd原子的质量为140/NA克(NA为阿伏加德罗常数)
C.14060Nd原子的中子数与质子数之差为80
D.14 g钕元素含有6 mol电子
【思路点拨】解答本题要注意如下几点:
【自主解答】选B。摩尔质量在以g/mol为单位时,在数值上等于其相对原子质量,A选项错误;根据
所以 所以一个14060Nd原子的质量为
B选项正确; 14060Nd原子的质子数Z=60,中子数N=A-Z=140-60=80,所以中子数与质子数之差为N-Z=80-60=20,C选项错误;元素的相对原子质量是其所有同位素相
对原子质量的平均值,因为不知道有无其他同位素,所以无法确定其相对原子质量,无法计算14 g钕元素的物质的量及所含有的电子数,D选项错误。
【互动探究】若将D选项改为“14 g 14060Nd原子中含有
6 mol 电子”,则该说法是否正确?
提示:正确。14060Nd原子的核外电子数为N(e-)=Z=60,
14 g 14060Nd原子的物质的量为n(Nd)=
所含电子的物质的量为n(e-)=0.1 mol×60=6 mol。
【规律方法】微粒中质子、中子和电子的个数的判断及计算方法
(1)因为在化学反应中,任何微粒中的质子数和中子数都不变,所以其质子数和中子数就是微粒中所有原子质子数和中子数的和。
(2)因为在化学反应中,原子的核外电子会发生变化,所以在阳离子中,电子数等于质子数之和减去所带的正电荷数,在阴离子中,电子数等于质子数之和加上所带的负电荷数,在原子或中性分子中电子数等于质子数之和。
(3)计算思路:先根据题给条件,计算出所
求微粒的物质的量,再求算该微粒的个数。
【变式训练】已知An-阴离子的原子核内有x个中子,A元素原子的质量数为m,w克An-阴离子中含有电子的物质的量为( )
A. B.
C. D.
【解析】选B。An-阴离子中含有的电子数为(m―x+n),w克An-的物质的量为n(An-)= mol,所以含有电子的物质
的量为 ×(m―x+n)mol。
【典例2】已知金属钠和水反应的化学方程式为:2Na+2H2O====2NaOH+H2↑。将9.2 g金属钠投入到足量的重水中,则产生的气体中含有
A.0.2 mol中子 B.0.4 mol电子
C.0.2 mol质子 D.0.4 mol分子
【思路点拨】解答本题要注意以下三点:
【自主解答】选B。钠和重水反应的化学方程式为:2Na+2D2O====2NaOD+D2↑,所以产生的气体全部是D2(21H2),1个分子中含有2个质子,2个电子和2个中子。9.2 g金属钠的物质的量是0.4 mol,由反应方程式知,0.4 mol钠可生成0.2 mol D2,所以0.2 mol D2中含有的中子数、电子数、质子数均为0.4 mol。
【互动探究】你能够写出重氢形成的盐酸和碳酸钙反应的化学方程式吗?
提示:类比CaCO3+2HCl====CaCl2+CO2↑+H2O,可写出该反应的化学方程式为CaCO3+2DCl====CaCl2+CO2↑+D2O。
【变式训练】“神舟”七号所用动力燃料之一的氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,下列有关叙述中正确的是( )
A.物质的量相等的三种化合物质子数之比为1∶2∶3
B.物质的量相等的三种化合物中子数之比为1∶1∶1
C.三种化合物的摩尔质量之比为8∶9∶10
D.三种化合物的化学性质不相同
【解析】选C。H、D、T的质子数相同、中子数不同,所以LiH、LiD、LiT的质子数相同、中子数不同,所以A、B两项均错误;三种化合物的摩尔质量之比等于(7+1)∶(7+2)∶
(7+3)=8∶9∶10,C项正确;同位素的化学性质相同,所以LiH、LiD、LiT的化学性质也相同,D项错误。
【典例】现将资料上记载的氯元素有关的数据摘录如下表:
试回答下列问题:
(1)34.969是表示_________________________。
(2)35.453是表示_________________________。
(3)35是表示_____________________________。
(4)35.485是表示_________________________。
(5)24.23%是表示_________________________。
【思路点拨】解答本题要注意以下两点:
【自主解答】从表中可以看出,氯元素有两种核素3517Cl和3717Cl,其相对原子质量分别是34.969和36.966,质量数分别是35和37,在自然界中所占的原子个数百分比分别是75.77%和24.23%,氯元素的平均相对原子质量是35.453,其近似平均相对原子质量是35.485。
答案:(1)核素3717Cl的相对原子质量
(2)氯元素的平均相对原子质量
(3)核素3517Cl的质量数
(4)氯元素的近似平均相对原子质量
(5)核素3717Cl在自然界中所占的原子个数百分比
【互动探究】若假设氯元素的近似相对原子质量为35.5,则3517Cl所占的原子百分比为多少?
提示:设3517Cl所占的原子百分比为x,则3717Cl所占的原子百分比为(1-x),所以有:35.5=35x+37×(1-x),解得: x=0.75。
【变式训练】已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,这两种同位素的原子个数比应为( )
A.39∶61 B.61∶39
C.1∶1 D.39∶11
【解析】选A。设铱的两种同位素19177Ir、19377Ir的原子数分别为x,y,解得
【规律方法】可以运用十字交叉法巧妙地将元素同位素的质量数、元素的相对原子质量及同位素所占原子的百分含量三者之间联系起来。如上题还可以用该方法进行巧解:
【典例】下列说法正确的是
A.只含一种元素的物质一定是纯净物
B.质子数和电子数相同的微粒,一定是同位素
C.质量数相同的两种原子一定属于同种元素
D.质量数不同的两种微粒的化学性质可能相同
【易错选项】A
【易错剖析】
(1)易错选项分析
本题易错选A的原因在于忽略了同种元素可组成不同性质的单质,它们能组成混合物,如金刚石和石墨组成的混合物中只含有碳元素,不属于纯净物。
(2)其他错误选项分析:
【标准答案】D
1.铋(Bi)被称为“绿色”金属,在医药方面有重要应用。下列关于20983Bi和21083Bi的说法正确的是( )
A.20983Bi和21083Bi是同一种核素
B.20983Bi和21083Bi都含有83个中子
C.20983Bi和21083Bi的核外电子数相同,中子数不同
D.20983Bi和21083Bi分别含有126和127个质子
【解析】选C。20983Bi和21083Bi是铋元素的两种不同的核素,它们的质子数和核外电子数都是83,中子数分别为126和127,互为同位素。
2.某粒子含有6个电子,7个中子,显电中性,则它的化学符号可能是( )
A.13Al B.13Al
C.13C D.13C
【解析】选D。该粒子显电中性,所以质子数和电子数相等,都为6,为碳元素;质量数=质子数+中子数=6+7=13,所以该原子为136C。
3.11H、21H、31H、H+、H2是( )
A.氢的五种同位素
B.五种氢元素
C.氢的五种同素异形体
D.氢元素的五种不同粒子
【解析】选D。质子数相同,质量数不同的同种元素的不同原子互为同位素,即同位素的研究对象为原子,H+表示氢离子,H2表示氢分子,所以不属于氢元素的同位素。元素泛指含有相同质子数构成的原子、离子等一类微粒的总称,所以这五种微粒都属于氢元素。
4.与OH-具有相同质子数和相同电子数的微粒是( )
A.O2- B.Cl-
C.NH3 D.NH2-
【解析】选D。各微粒的质子数和电子数如下表:
5.根据下列几种微粒的结构示意图,回答下列问题(填编号):
(1)其中属于阴离子的是____________。
(2)具有相似化学性质的是______________。
(3)A、D两元素的单质相互反应生成化合物,A元素的原子________(填“得到”或“失去”)______个电子,在形成的化合物中显_________价,D元素的原子_______(填“得到”或“失去”)___________个电子,在形成的化合物中显______________价。
【解析】阴离子的核外电子总数大于质子数,所以B是阴离子;最外层电子数相同,化学性质相似,所以A、C的化学性质相似;在形成化合物的过程中,金属元素的原子通常失去电子而显正化合价,非金属元素的原子通常得到电子而显负化合价,且得失电子的数目与最外层电子数有关。
答案:(1)B (2)A、C
(3)得到 2 负(或-2) 失去 2 正(或+2)
一、选择题(本题包括5小题,每小题4分,共20分)
1.原子结构模型的演变图中:①为道尔顿实心球式原子模型;②为卢瑟福行星运转式原子模型;③为汤姆生葡萄干面包式原子模型;④为近代量子力学原子模型;⑤为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是
( )
A.①③②⑤④ B.①②③④⑤
C.①⑤③②④ D.①③⑤④②
【解析】选A。原子结构模型的演变过程为:道尔顿实心球式模型→汤姆生葡萄干面包式模型→卢瑟福行星运转式模型→玻尔轨道式模型→近代量子力学模型。
2.146C在考古学和医学上有着广泛用途,下列有关146C的说法中正确的是( )
A.质子数为14 B.中子数为6
C.质量数为8 D.电子数为6
【解析】选D。在146C中,6表示质子数,14表示质量数,所以中子数为14-6=8,核外电子数=质子数=6。
3.(2011·长沙高一检测)“稀土”是我国宝贵的战略资源,国家已经控制其出口。14462Sm与15062Sm是稀土元素,下列有关说法正确的是( )
A.14462Sm与15062Sm互为同位素
B.14462Sm与15062Sm的质量数相同
C.14462Sm与15062Sm是同一种核素
D.14462Sm与15062Sm的核外电子数和中子数均为62
【解析】选A。本题考查同位素、核素的概念及质量数、质子数、中子数、电子数之间的关系。由稀土元素14462Sm、15062Sm可知,该元素是含有相同质子数不同中子数的同种元素,互为同位素;其中14462Sm的质量数为144,中子数为82;15062Sm的质量数为150,中子数为88;故B、D项错;根据核素的定义“含有一定数目的质子和一定数目的中子”可知14462Sm、15062Sm为两种核素,故C错。
4.据《科学》杂志报道:科学家们已大量制造出反物质中的反氢原子,认为反物质研究领域的前景“正前所未有的光明”。反原子原子核和核外电子电性与原子的电性刚好相反,假若发现反氯离子,请运用核外电子排布规律大胆设想反氯离子的结构示意图( )
【解析】选D。由题中所给的信息知,反氯离子含有17个带负电荷的质子和18个带正电荷的核外电子。
5.(2011·石家庄高一检测)20 g AO32-中核外电子数比质子数多0.5NA(NA代表阿伏加德罗常数)个,则元素A的相对原子质量为( )
A.12 B.32 C.60 D.80
【解析】选B。1个AO32-中核外电子数比质子数多2个,假设20 g AO32-的物质的量为x,则x∶0.5 mol=1∶2,解得:x=0.25 mol,所以M(AO32-)= =80 g/mol,即Ar(A)+16×3=80,所以Ar(A)=32。
二、非选择题(本题包括3小题,共30分)
6.(10分)元素、原子、核素、同位素都是重要的基本概念。根据下列8种化学符号:11H2、 21H2、146C、 63Li、2311Na、147N、73Li、2412Mg回答问题:
(1)表示核素的符号共_______种。
(2)互为同位素的是______和______。
(3)质量数相等,但不能互称为同位素的是______和______。
(4)中子数相等,但质子数不相等的是_____和______。
【解析】(1)核素是具有一定质子数和一定中子数的某种元素的原子,一种原子即为一种核素,11H2和21H2都是分子,不属于核素,其余6种全部表示核素。(2)同位素是具有相同质子数和不同中子数的同种元素的原子,所以63Li和73Li互称为同位素。(3)146C和147N的质量数都是14,但质子数分别为6和7,属于不同元素的原子,不能互称为同位素。(4)2311Na和2412Mg的中子数都是12,但质子数分别为11和12。
答案:(1)6 (2)63Li 73Li
(3)146C 147N (4)2311Na 2412Mg
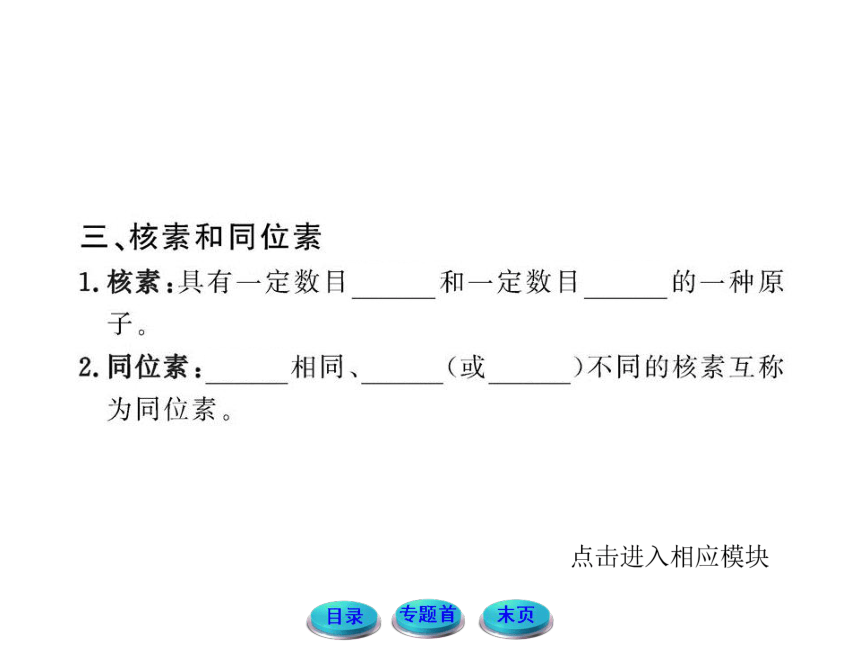
【方法技巧】同位素的“六同二不同”
属于同位素的各核素间的差异,可概括为“六同二不同”
(1)六同:①属于同种元素,②核电荷数相同,③核内质子数相同,④核外电子数相同,⑤在周期表中的位置相同,⑥化学性质相同。
(2)二不同:①核内中子数不同,②质量数不同。
7.(10分)元素M的原子核内中子数比质子数多1,0.9 g
元素M的单质和足量的稀盐酸反应时生成M3+,同时置换出
1.12 L H2(标准状况)。
(1)M元素的名称是______,其相应的离子结构示意图为
_________。
(2)M元素的单质和稀盐酸反应的化学方程式为____,反
应中转移的电子数约为_______个。
【解析】设M的相对原子质量为x
2M+6HCl====2MCl3+3H2↑
2x g 67.2 L
0.9 g 1.12 L
1.12 L×2x g=67.2 L×0.9 g
x=27
根据M原子核内中子数比质子数多1,可知M原子的质子数为13,为铝元素。
答案:(1)铝
(2)2Al+6HCl====2AlCl3+3H2↑ 6.02×1022
8.(10分)(挑战能力)有相同状况下的两种气体12C18O和14N2。
(1)若两种气体的质量相等,则两种气体所含的质子数之比为________。
(2)若两种气体的原子数相等,则两种气体所含的中子数之比为________。
(3)若两种气体的分子数相同,则两种气体的体积之比为__________。
(4)若两种气体的体积相同,则两种气体的密度之比为__________。
【解析】两种气体,相对分子质量分别为30和28。12C18O的质子数为14,中子数为16,而14N2的质子数为14,中子数为14。(1)中两气体质量相同,设均为1 g,则物质的量分别为 mol和 mol,所含质子数分别为 mol和 mol;(2)中两气体的原子数相等,则物质的量也相等,所以中子数之比为16∶14;(3)中两气体的分子数相等,物质的量也相同,则体积比等于物质的量之比;(4)中在相同状况下,两气体的体积相同,则气体的密度之比等于其相对分子质量之比。
答案:(1)14∶15 (2)8∶7 (3)1∶1 (4)15∶14
有几种微粒的最外电子层结构如图所示:
其中:
(1)某电中性微粒X一般不与其他元素的原子反应,X的化学符号是_______________。
(2)某微粒Y的盐溶液,加入AgNO3溶液时会出现白色浑浊,则这种微粒的化学符号是____________。
(3)某微粒Z得到电子后得到一种原子,且这种原子有一个单电子,这种微粒的化学符号是__________,从它的某种盐溶液中鉴别该元素的方法是(简述实验步骤、实验现象和实验结论)____________________。
(4)某微粒M失去2个电子即变为原子,这种微粒的化学符号是__________________。
【解析】(1)电中性微粒中质子数和核外电子数相同,所以x=2+8+8=18,为氩原子;(2)Cl-能够和Ag+反应生成白色的AgCl沉淀;(3)Z得到1个电子后变成原子,说明该微粒为阳离子,且这种原子有一个单电子,所以Z的原子序数为19,为K原子,该微粒为K+;鉴别钾元素可以用焰色反应,钾元素的焰色为紫色,观察钾的焰色反应时,必须透过蓝色的钴玻璃;(4)M失去2个电子即变为原子,说明该微粒为阴离子,则其原子序数为18-2=16,为S原子,该微粒为S2-。
答案:(1)Ar
(2) Cl-
(3)K+ 用铂丝蘸取少量盐溶液在酒精灯火焰上灼烧,若透过蓝色钴玻璃观察到紫色火焰,则说明该溶液中含有钾元素
(4)S2-
【典例1】导弹的巨大威力离不开制导弹合金材料中的稀土元素钕(14060Nd)。则下列说法中正确的是
A.钕原子的摩尔质量等于其相对原子质量
B.一个14060Nd原子的质量为140/NA克(NA为阿伏加德罗常数)
C.14060Nd原子的中子数与质子数之差为80
D.14 g钕元素含有6 mol电子
【思路点拨】解答本题要注意如下几点:
【自主解答】选B。摩尔质量在以g/mol为单位时,在数值上等于其相对原子质量,A选项错误;根据
所以 所以一个14060Nd原子的质量为
B选项正确; 14060Nd原子的质子数Z=60,中子数N=A-Z=140-60=80,所以中子数与质子数之差为N-Z=80-60=20,C选项错误;元素的相对原子质量是其所有同位素相
对原子质量的平均值,因为不知道有无其他同位素,所以无法确定其相对原子质量,无法计算14 g钕元素的物质的量及所含有的电子数,D选项错误。
【互动探究】若将D选项改为“14 g 14060Nd原子中含有
6 mol 电子”,则该说法是否正确?
提示:正确。14060Nd原子的核外电子数为N(e-)=Z=60,
14 g 14060Nd原子的物质的量为n(Nd)=
所含电子的物质的量为n(e-)=0.1 mol×60=6 mol。
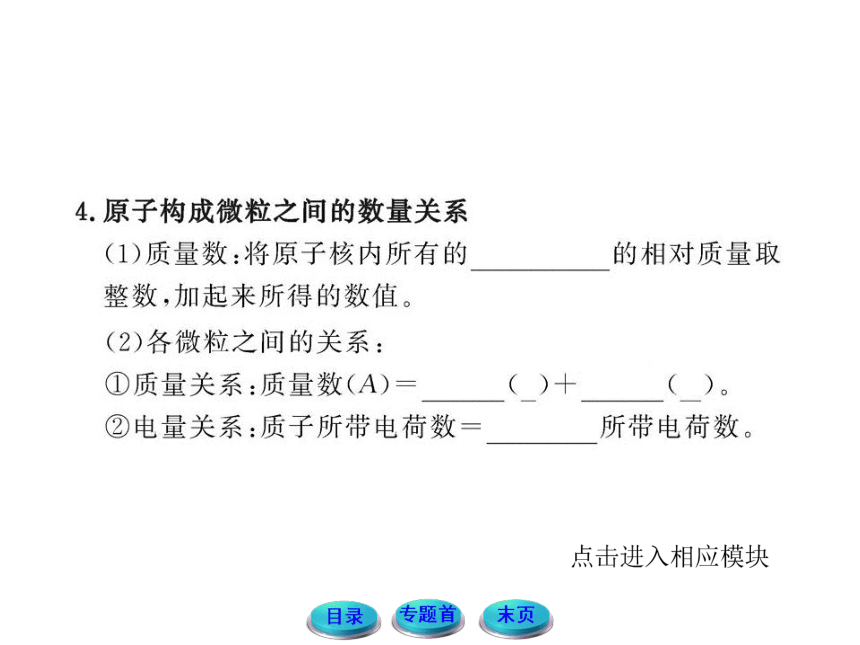
【规律方法】微粒中质子、中子和电子的个数的判断及计算方法
(1)因为在化学反应中,任何微粒中的质子数和中子数都不变,所以其质子数和中子数就是微粒中所有原子质子数和中子数的和。
(2)因为在化学反应中,原子的核外电子会发生变化,所以在阳离子中,电子数等于质子数之和减去所带的正电荷数,在阴离子中,电子数等于质子数之和加上所带的负电荷数,在原子或中性分子中电子数等于质子数之和。
(3)计算思路:先根据题给条件,计算出所
求微粒的物质的量,再求算该微粒的个数。
【变式训练】已知An-阴离子的原子核内有x个中子,A元素原子的质量数为m,w克An-阴离子中含有电子的物质的量为( )
A. B.
C. D.
【解析】选B。An-阴离子中含有的电子数为(m―x+n),w克An-的物质的量为n(An-)= mol,所以含有电子的物质
的量为 ×(m―x+n)mol。
【典例2】已知金属钠和水反应的化学方程式为:2Na+2H2O====2NaOH+H2↑。将9.2 g金属钠投入到足量的重水中,则产生的气体中含有
A.0.2 mol中子 B.0.4 mol电子
C.0.2 mol质子 D.0.4 mol分子
【思路点拨】解答本题要注意以下三点:
【自主解答】选B。钠和重水反应的化学方程式为:2Na+2D2O====2NaOD+D2↑,所以产生的气体全部是D2(21H2),1个分子中含有2个质子,2个电子和2个中子。9.2 g金属钠的物质的量是0.4 mol,由反应方程式知,0.4 mol钠可生成0.2 mol D2,所以0.2 mol D2中含有的中子数、电子数、质子数均为0.4 mol。
【互动探究】你能够写出重氢形成的盐酸和碳酸钙反应的化学方程式吗?
提示:类比CaCO3+2HCl====CaCl2+CO2↑+H2O,可写出该反应的化学方程式为CaCO3+2DCl====CaCl2+CO2↑+D2O。
【变式训练】“神舟”七号所用动力燃料之一的氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,下列有关叙述中正确的是( )
A.物质的量相等的三种化合物质子数之比为1∶2∶3
B.物质的量相等的三种化合物中子数之比为1∶1∶1
C.三种化合物的摩尔质量之比为8∶9∶10
D.三种化合物的化学性质不相同
【解析】选C。H、D、T的质子数相同、中子数不同,所以LiH、LiD、LiT的质子数相同、中子数不同,所以A、B两项均错误;三种化合物的摩尔质量之比等于(7+1)∶(7+2)∶
(7+3)=8∶9∶10,C项正确;同位素的化学性质相同,所以LiH、LiD、LiT的化学性质也相同,D项错误。
【典例】现将资料上记载的氯元素有关的数据摘录如下表:
试回答下列问题:
(1)34.969是表示_________________________。
(2)35.453是表示_________________________。
(3)35是表示_____________________________。
(4)35.485是表示_________________________。
(5)24.23%是表示_________________________。
【思路点拨】解答本题要注意以下两点:
【自主解答】从表中可以看出,氯元素有两种核素3517Cl和3717Cl,其相对原子质量分别是34.969和36.966,质量数分别是35和37,在自然界中所占的原子个数百分比分别是75.77%和24.23%,氯元素的平均相对原子质量是35.453,其近似平均相对原子质量是35.485。
答案:(1)核素3717Cl的相对原子质量
(2)氯元素的平均相对原子质量
(3)核素3517Cl的质量数
(4)氯元素的近似平均相对原子质量
(5)核素3717Cl在自然界中所占的原子个数百分比
【互动探究】若假设氯元素的近似相对原子质量为35.5,则3517Cl所占的原子百分比为多少?
提示:设3517Cl所占的原子百分比为x,则3717Cl所占的原子百分比为(1-x),所以有:35.5=35x+37×(1-x),解得: x=0.75。
【变式训练】已知自然界中铱有两种质量数分别为191和193的同位素,而铱的平均相对原子质量为192.22,这两种同位素的原子个数比应为( )
A.39∶61 B.61∶39
C.1∶1 D.39∶11
【解析】选A。设铱的两种同位素19177Ir、19377Ir的原子数分别为x,y,解得
【规律方法】可以运用十字交叉法巧妙地将元素同位素的质量数、元素的相对原子质量及同位素所占原子的百分含量三者之间联系起来。如上题还可以用该方法进行巧解:
【典例】下列说法正确的是
A.只含一种元素的物质一定是纯净物
B.质子数和电子数相同的微粒,一定是同位素
C.质量数相同的两种原子一定属于同种元素
D.质量数不同的两种微粒的化学性质可能相同
【易错选项】A
【易错剖析】
(1)易错选项分析
本题易错选A的原因在于忽略了同种元素可组成不同性质的单质,它们能组成混合物,如金刚石和石墨组成的混合物中只含有碳元素,不属于纯净物。
(2)其他错误选项分析:
【标准答案】D
1.铋(Bi)被称为“绿色”金属,在医药方面有重要应用。下列关于20983Bi和21083Bi的说法正确的是( )
A.20983Bi和21083Bi是同一种核素
B.20983Bi和21083Bi都含有83个中子
C.20983Bi和21083Bi的核外电子数相同,中子数不同
D.20983Bi和21083Bi分别含有126和127个质子
【解析】选C。20983Bi和21083Bi是铋元素的两种不同的核素,它们的质子数和核外电子数都是83,中子数分别为126和127,互为同位素。
2.某粒子含有6个电子,7个中子,显电中性,则它的化学符号可能是( )
A.13Al B.13Al
C.13C D.13C
【解析】选D。该粒子显电中性,所以质子数和电子数相等,都为6,为碳元素;质量数=质子数+中子数=6+7=13,所以该原子为136C。
3.11H、21H、31H、H+、H2是( )
A.氢的五种同位素
B.五种氢元素
C.氢的五种同素异形体
D.氢元素的五种不同粒子
【解析】选D。质子数相同,质量数不同的同种元素的不同原子互为同位素,即同位素的研究对象为原子,H+表示氢离子,H2表示氢分子,所以不属于氢元素的同位素。元素泛指含有相同质子数构成的原子、离子等一类微粒的总称,所以这五种微粒都属于氢元素。
4.与OH-具有相同质子数和相同电子数的微粒是( )
A.O2- B.Cl-
C.NH3 D.NH2-
【解析】选D。各微粒的质子数和电子数如下表:
5.根据下列几种微粒的结构示意图,回答下列问题(填编号):
(1)其中属于阴离子的是____________。
(2)具有相似化学性质的是______________。
(3)A、D两元素的单质相互反应生成化合物,A元素的原子________(填“得到”或“失去”)______个电子,在形成的化合物中显_________价,D元素的原子_______(填“得到”或“失去”)___________个电子,在形成的化合物中显______________价。
【解析】阴离子的核外电子总数大于质子数,所以B是阴离子;最外层电子数相同,化学性质相似,所以A、C的化学性质相似;在形成化合物的过程中,金属元素的原子通常失去电子而显正化合价,非金属元素的原子通常得到电子而显负化合价,且得失电子的数目与最外层电子数有关。
答案:(1)B (2)A、C
(3)得到 2 负(或-2) 失去 2 正(或+2)
一、选择题(本题包括5小题,每小题4分,共20分)
1.原子结构模型的演变图中:①为道尔顿实心球式原子模型;②为卢瑟福行星运转式原子模型;③为汤姆生葡萄干面包式原子模型;④为近代量子力学原子模型;⑤为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是
( )
A.①③②⑤④ B.①②③④⑤
C.①⑤③②④ D.①③⑤④②
【解析】选A。原子结构模型的演变过程为:道尔顿实心球式模型→汤姆生葡萄干面包式模型→卢瑟福行星运转式模型→玻尔轨道式模型→近代量子力学模型。
2.146C在考古学和医学上有着广泛用途,下列有关146C的说法中正确的是( )
A.质子数为14 B.中子数为6
C.质量数为8 D.电子数为6
【解析】选D。在146C中,6表示质子数,14表示质量数,所以中子数为14-6=8,核外电子数=质子数=6。
3.(2011·长沙高一检测)“稀土”是我国宝贵的战略资源,国家已经控制其出口。14462Sm与15062Sm是稀土元素,下列有关说法正确的是( )
A.14462Sm与15062Sm互为同位素
B.14462Sm与15062Sm的质量数相同
C.14462Sm与15062Sm是同一种核素
D.14462Sm与15062Sm的核外电子数和中子数均为62
【解析】选A。本题考查同位素、核素的概念及质量数、质子数、中子数、电子数之间的关系。由稀土元素14462Sm、15062Sm可知,该元素是含有相同质子数不同中子数的同种元素,互为同位素;其中14462Sm的质量数为144,中子数为82;15062Sm的质量数为150,中子数为88;故B、D项错;根据核素的定义“含有一定数目的质子和一定数目的中子”可知14462Sm、15062Sm为两种核素,故C错。
4.据《科学》杂志报道:科学家们已大量制造出反物质中的反氢原子,认为反物质研究领域的前景“正前所未有的光明”。反原子原子核和核外电子电性与原子的电性刚好相反,假若发现反氯离子,请运用核外电子排布规律大胆设想反氯离子的结构示意图( )
【解析】选D。由题中所给的信息知,反氯离子含有17个带负电荷的质子和18个带正电荷的核外电子。
5.(2011·石家庄高一检测)20 g AO32-中核外电子数比质子数多0.5NA(NA代表阿伏加德罗常数)个,则元素A的相对原子质量为( )
A.12 B.32 C.60 D.80
【解析】选B。1个AO32-中核外电子数比质子数多2个,假设20 g AO32-的物质的量为x,则x∶0.5 mol=1∶2,解得:x=0.25 mol,所以M(AO32-)= =80 g/mol,即Ar(A)+16×3=80,所以Ar(A)=32。
二、非选择题(本题包括3小题,共30分)
6.(10分)元素、原子、核素、同位素都是重要的基本概念。根据下列8种化学符号:11H2、 21H2、146C、 63Li、2311Na、147N、73Li、2412Mg回答问题:
(1)表示核素的符号共_______种。
(2)互为同位素的是______和______。
(3)质量数相等,但不能互称为同位素的是______和______。
(4)中子数相等,但质子数不相等的是_____和______。
【解析】(1)核素是具有一定质子数和一定中子数的某种元素的原子,一种原子即为一种核素,11H2和21H2都是分子,不属于核素,其余6种全部表示核素。(2)同位素是具有相同质子数和不同中子数的同种元素的原子,所以63Li和73Li互称为同位素。(3)146C和147N的质量数都是14,但质子数分别为6和7,属于不同元素的原子,不能互称为同位素。(4)2311Na和2412Mg的中子数都是12,但质子数分别为11和12。
答案:(1)6 (2)63Li 73Li
(3)146C 147N (4)2311Na 2412Mg
【方法技巧】同位素的“六同二不同”
属于同位素的各核素间的差异,可概括为“六同二不同”
(1)六同:①属于同种元素,②核电荷数相同,③核内质子数相同,④核外电子数相同,⑤在周期表中的位置相同,⑥化学性质相同。
(2)二不同:①核内中子数不同,②质量数不同。
7.(10分)元素M的原子核内中子数比质子数多1,0.9 g
元素M的单质和足量的稀盐酸反应时生成M3+,同时置换出
1.12 L H2(标准状况)。
(1)M元素的名称是______,其相应的离子结构示意图为
_________。
(2)M元素的单质和稀盐酸反应的化学方程式为____,反
应中转移的电子数约为_______个。
【解析】设M的相对原子质量为x
2M+6HCl====2MCl3+3H2↑
2x g 67.2 L
0.9 g 1.12 L
1.12 L×2x g=67.2 L×0.9 g
x=27
根据M原子核内中子数比质子数多1,可知M原子的质子数为13,为铝元素。
答案:(1)铝
(2)2Al+6HCl====2AlCl3+3H2↑ 6.02×1022
8.(10分)(挑战能力)有相同状况下的两种气体12C18O和14N2。
(1)若两种气体的质量相等,则两种气体所含的质子数之比为________。
(2)若两种气体的原子数相等,则两种气体所含的中子数之比为________。
(3)若两种气体的分子数相同,则两种气体的体积之比为__________。
(4)若两种气体的体积相同,则两种气体的密度之比为__________。
【解析】两种气体,相对分子质量分别为30和28。12C18O的质子数为14,中子数为16,而14N2的质子数为14,中子数为14。(1)中两气体质量相同,设均为1 g,则物质的量分别为 mol和 mol,所含质子数分别为 mol和 mol;(2)中两气体的原子数相等,则物质的量也相等,所以中子数之比为16∶14;(3)中两气体的分子数相等,物质的量也相同,则体积比等于物质的量之比;(4)中在相同状况下,两气体的体积相同,则气体的密度之比等于其相对分子质量之比。
答案:(1)14∶15 (2)8∶7 (3)1∶1 (4)15∶14
有几种微粒的最外电子层结构如图所示:
其中:
(1)某电中性微粒X一般不与其他元素的原子反应,X的化学符号是_______________。
(2)某微粒Y的盐溶液,加入AgNO3溶液时会出现白色浑浊,则这种微粒的化学符号是____________。
(3)某微粒Z得到电子后得到一种原子,且这种原子有一个单电子,这种微粒的化学符号是__________,从它的某种盐溶液中鉴别该元素的方法是(简述实验步骤、实验现象和实验结论)____________________。
(4)某微粒M失去2个电子即变为原子,这种微粒的化学符号是__________________。
【解析】(1)电中性微粒中质子数和核外电子数相同,所以x=2+8+8=18,为氩原子;(2)Cl-能够和Ag+反应生成白色的AgCl沉淀;(3)Z得到1个电子后变成原子,说明该微粒为阳离子,且这种原子有一个单电子,所以Z的原子序数为19,为K原子,该微粒为K+;鉴别钾元素可以用焰色反应,钾元素的焰色为紫色,观察钾的焰色反应时,必须透过蓝色的钴玻璃;(4)M失去2个电子即变为原子,说明该微粒为阴离子,则其原子序数为18-2=16,为S原子,该微粒为S2-。
答案:(1)Ar
(2) Cl-
(3)K+ 用铂丝蘸取少量盐溶液在酒精灯火焰上灼烧,若透过蓝色钴玻璃观察到紫色火焰,则说明该溶液中含有钾元素
(4)S2-
