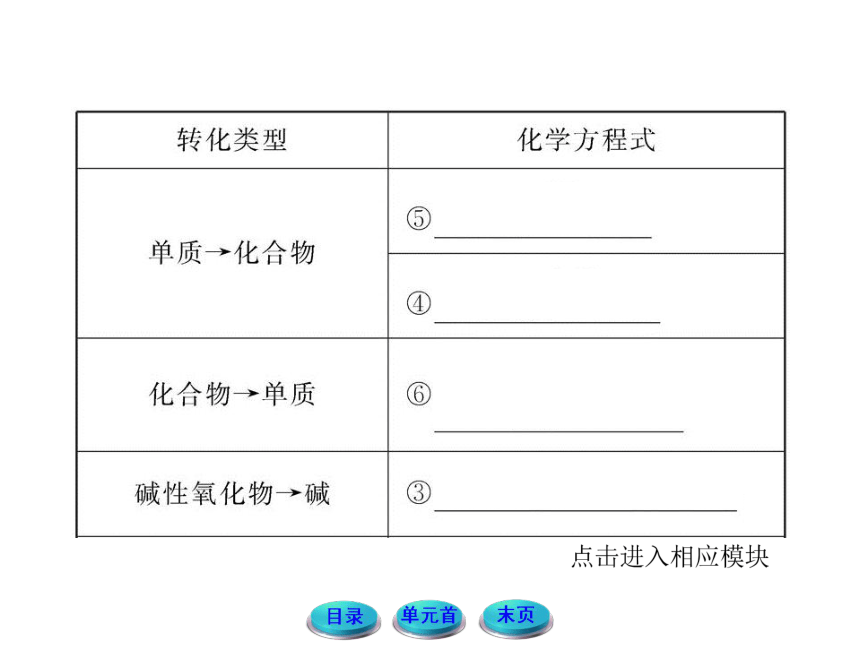
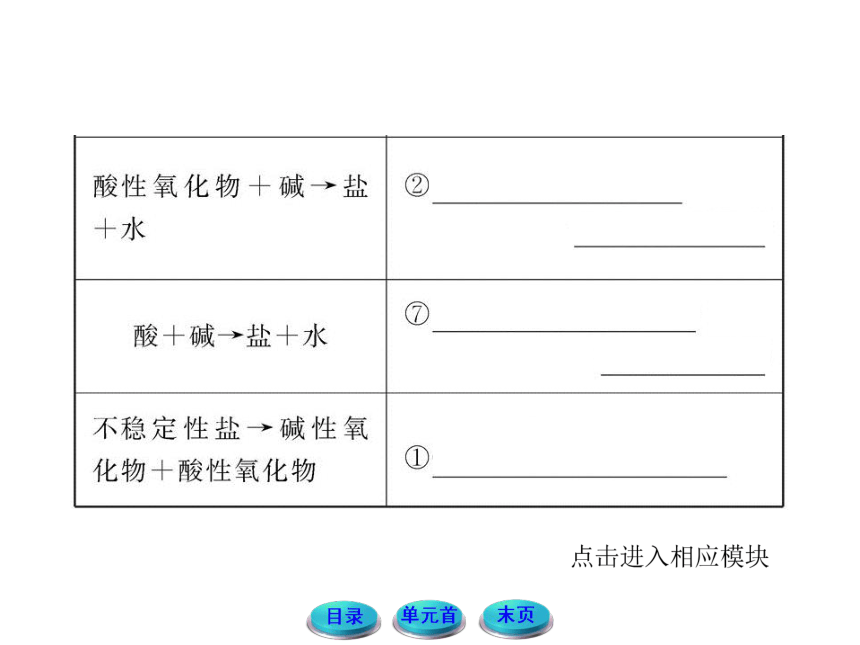
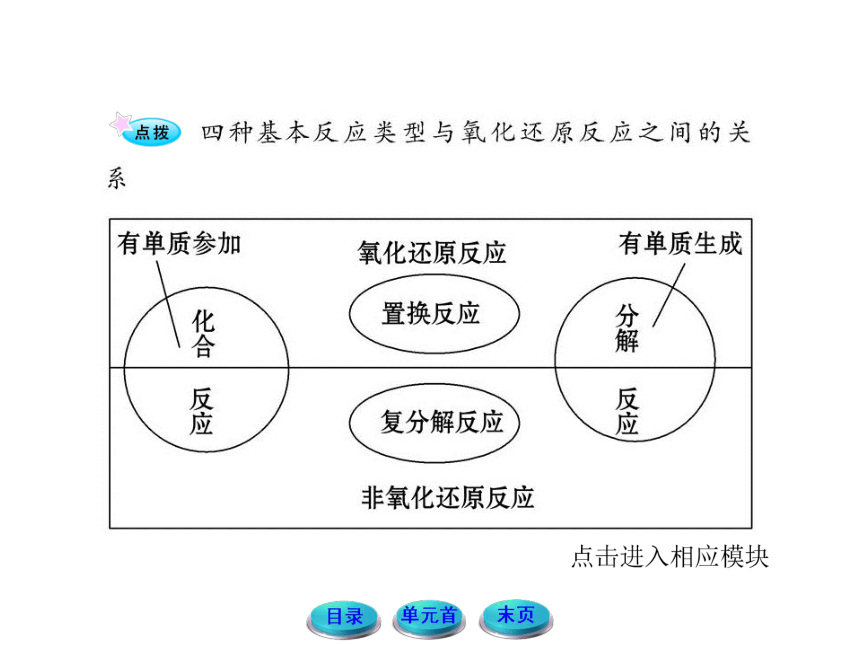
11-12版高中化学全程学习方略配套课件:1.1.1物质的分类与转化(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:1.1.1物质的分类与转化(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 20:45:37 | ||
图片预览






文档简介
(共97张PPT)
【典例1】下列4组物质均有一种物质的类别与其他3种不同:
A.CaO、Na2O、CO2、CuO
B.H2、C、P、Cu
C.O2、Fe、Cu、Zn
D.HCl、H2O、H2SO4、HNO3
(1)以上四组物质中分类与其他物质不同的物质依次是(填化学式):
A________;B________;C________;D________。
(2)这四种物质相互作用可生成一种新物质[碱式碳酸铜,化学式Cu2(OH)2CO3],该反应________氧化还原反应(填“是”或“否”)。
(3)碱式碳酸铜可以看作是Cu(OH)2和CuCO3按照1∶1组成的混合型化合物,写出它与足量盐酸反应的化学方程式:________。
【思路点拨】解答此题要注意以下三点:
【自主解答】(1)A组物质中,CO2为酸性氧化物,其余的都是碱性氧化物;B组物质中,Cu为金属单质,其余的都是非金属单质;C组物质中,O2为非金属单质(气态),其余的都是金属单质(固态);D组物质中,H2O为氧化物,其余的都是酸类物质。(2)这四种物质反应的化学方程式为2Cu+CO2+H2O+O2====Cu2(OH)2CO3,反应前后铜和氧元素的化合价发生了变化,属于氧化还原反应。(3)Cu(OH)2和盐酸反应生成CuCl2和H2O,CuCO3和盐酸反应生成CuCl2、H2O和CO2,由此可以写出碱式碳酸铜与足量盐酸反应的化学方程式。
答案:(1)CO2 Cu O2 H2O (2)是
(3)Cu2(OH)2CO3+4HCl====2CuCl2+3H2O+CO2↑
【互动探究】(1)根据不同的分类标准,B中哪种物质还与其他物质类别不同。
提示:H2。H2为气态物质,C、P、Cu为固态物质。
(2)碱式碳酸铜受热能够分解,你能写出该反应的化学方程式吗?
提示:Cu(OH)2受热分解生成CuO和H2O,CuCO3受热分解生成CuO和CO2,所以碱式碳酸铜受热分解生成CuO、CO2和H2O。其反应的化学方程式为:
Cu2(OH)2CO3 2CuO+H2O+CO2↑。
△
====
【规律方法】常见的分类方法
(1)交叉分类法:对同一物质按照不同的标准分类。如硫酸钠,从其组成的阳离子来看,属于钠盐;从其组成的阴离子来看,属于硫酸盐。
(2)树状分类法:对同类事物按照某种标准进行分类。如化合物可以分为酸、碱、盐和氧化物等。
【变式训练】符合下图中阴影部分的物质是( )
A.Na2CO3 B.Cu2(OH)2CO3
C.NaCl D.NaHCO3
【解析】选A。图中阴影部分的物质既属于钠盐、又属于碳酸盐、还属于正盐。Cu2(OH)2CO3属于碳酸盐的碱式盐,是一种铜盐;NaCl属于盐酸盐的钠盐,是一种正盐。NaHCO3属于碳酸盐的酸式盐,是一种钠盐。
【典例2】甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色无味气体。则甲、乙、丙、丁四种溶液依次是
A.BaCl2、Na2CO3、AgNO3、盐酸
B.BaCl2、Na2CO3、盐酸、AgNO3
C.Na2CO3、盐酸、AgNO3、BaCl2
D.AgNO3、盐酸、BaCl2、Na2CO3
【思路点拨】解答此题要注意以下两点:
【自主解答】选A。四种物质中只有Na2CO3和盐酸反应能够生成无色无味气体(CO2),所以乙和丁中,一种是Na2CO3,另一种是盐酸。而Na2CO3能够和剩余两种物质反应生成沉淀,盐酸只能和AgNO3反应生成沉淀,由此可以确定乙是Na2CO3,丁是盐酸。既能和Na2CO3反应又能和盐酸反应生成沉淀的物质只有AgNO3,所以丙是AgNO3,甲是BaCl2。
【互动探究】这四种物质中有一种与其他三种物质所属的类别不同,试分别写出该物质发生复分解反应和置换反应的一个化学方程式。
提示:盐酸属于酸类物质,其余三种都属于盐类物质。其发生的复分解反应为Ca(OH)2+2HCl====CaCl2+2H2O,置换反应为Zn+2HCl====ZnCl2+H2↑。(所写反应合理即可)
【变式训练】(2011·成都高一检测)如图五角星上排列的
A、B、C、D、E五种物质均为中学化学中常见的化合物,相互之间的连线表示两种物质能发生化学反应。
A、C、E均为氧化物,A是人体呼出的气体之一;在实验室中B可以用来制取A,而D可以用来检验A;C和E反应能生成D。
(1)写出下列物质的化学式:A______,D_____;
(2)B除了制取A之外的另一种用途是_______;
(3)C和E反应的化学方程式为_______;
(4)这五种物质之间两两发生反应,其中没有涉及到的基本反应类型是_______。
【解析】人体呼出的气体中含有水蒸气和CO2,所以A最有可能是CO2,实验室可以用大理石(或石灰石)和稀盐酸反应制取CO2,用澄清石灰水检验CO2,CaO和H2O反应能够生成Ca(OH)2。再结合“相互之间的连线表示两种物质能发生化学反应”这一条件,可以判断出各物质是什么,如下图所示:
这五种物质之间两两发生反应时,H2O与CaO、CO2的反应
都是化合反应,CO2与Ca(OH)2反应其本质是复分解反应,HCl和CaO、Ca(OH)2的反应都是复分解反应,没有涉及到分解反应和置换反应。
答案:(1)CO2 Ca(OH)2
(2)用于金属表面除锈(制造药物、可帮助消化等)
(3)CaO+H2O====Ca(OH)2
(4)分解反应和置换反应
【典例】根据下面列出的氯的含氧酸及它们对应的氧化物(酸酐)的关系:
判断硝酸(HNO3)的酸酐是
A.NO B.N2O3 C.NO2 D.N2O5
【思路点拨】根据表中信息,可以得出如下结论:
【自主解答】选D。HNO3的脱水过程可以表示为:HNO3→H2N2O6→N2O5,所以硝酸的酸酐是N2O5。
【互动探究】根据酸酐和相应含氧酸的对应关系,你能写出SO3和SO2对应的含氧酸吗?
提示:H2SO4和H2SO3。
【变式训练】氧化钠是碱性氧化物,下列关于氧化钠性质的叙述不正确的是( )
A.氧化钠可以与水反应生成碱
B.氧化钠可以与盐酸反应
C.氧化钠可以与CaO反应
D.氧化钠可以与CO2反应
【解析】选C。氧化钠具有碱性氧化物的通性:能够与水反应生成碱;能够与酸反应生成盐和水;能够和酸性氧化物反应生成盐;不能和碱性氧化物反应。
【典例】有关氧化物的叙述正确的是
A.碱性氧化物一定是金属氧化物
B.金属氧化物一定是碱性氧化物
C.酸性氧化物一定是非金属氧化物
D.酸性氧化物、碱性氧化物一定都能与水反应生成相应的酸、碱
【易错选项】C
【易错剖析】
(1)易错选项分析
本题易错选C的原因在于混淆了非金属氧化物与酸性氧化物的概念,酸性氧化物不一定是非金属氧化物(如Mn2O7属于酸性氧化物,但其是金属氧化物);非金属氧化物也不一定是酸性氧化物(如CO、NO属于不成盐氧化物)。
(2)其他错误选项分析:
【标准答案】A
1.根据物质的组成对物质进行分类,NaHCO3属于( )
A.盐 B.有机物 C.碱 D.氧化物
【解析】选A。从该物质组成上看,含有金属阳离子Na+和酸式酸根离子HCO3-,故该物质属于盐。
2.对于下列反应类型的判断,不正确的是( )
A.2FeCl2+Cl2====2FeCl3(化合反应)
B.3CO+Fe2O3 2Fe+3CO2(置换反应)
C.2KClO3 2KCl+3O2↑(氧化还原反应)
D.H2CO3 CO2↑+H2O(分解反应)
【解析】选B。B选项的反应只有单质生成而没有单质参加反应,不属于置换反应,属于氧化还原反应。
高温
====
MnO2
△
====
△
====
3.在:①化合反应;②分解反应;③置换反应;④复分解反应四种基本反应类型中,可以生成水的是( )
A.只有②③ B.只有①④
C.只有①②④ D.①②③④
【解析】选D。可以用方程式举例法来判断。①2H2+O2
2H2O;②Cu(OH)2 CuO+H2O;③CuO+H2 Cu+H2O;
④CaCO3+2HCl====CaCl2+CO2↑+H2O。所以这四种基本反应类型都可以生成水。
点燃
====
△
====
△
====
4.下列说法正确的是( )
A.无氧酸是指分子组成中不含氧元素的酸,如HCl、CH4等
B.根据溶解性的不同,可将碱分为难溶性碱和可溶性碱
C.和酸反应生成盐和水的物质一定是碱性氧化物
D.所有的酸性氧化物都可以与水化合得到相应的酸
【解析】选B。A项CH4不是酸。C项与酸反应生成盐和水的物质还有碱、盐等。常见的酸性氧化物中SiO2与水不反应。
5.根据四种基本反应类型各写出一个有二氧化碳生成的化学方程式:
①化合反应______________________________;
②置换反应______________________________;
③分解反应______________________________;
④复分解反应____________________________。
【解析】生成二氧化碳的反应通常考虑含碳的某些物质的燃烧。只生成二氧化碳的反应则为碳或一氧化碳的燃烧。生成二氧化碳的置换反应通常考虑碳参与的置换反应,如碳与氧化铜或氧化铁反应。生成二氧化碳的分解反应则考虑某些碳酸盐的分解反应,如碳酸钙、碳酸铵或碳酸氢铵的分解。而生成二氧化碳的复分解反应则为碳酸盐和稀盐酸或稀硫酸、稀硝酸的反应。
答案:①C+O2 CO2或2CO+O2 2CO2
②C+2CuO CO2↑+2Cu
③CaCO3 CaO+CO2↑
④CaCO3+2HCl====CaCl2+H2O+CO2↑
(合理即可)
点燃
====
点燃
====
高温
====
高温
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列物质的分类合理的是( )
A.酸性氧化物:CO2、H2O
B.碱性氧化物:Na2O、CaO
C.碱:NaOH、Na2CO3
D.铵盐:NH4Cl、CO(NH2)2
【解析】选B。A选项中,H2O不是酸性氧化物;C选项中,Na2CO3不是碱而是盐;D选项中,CO(NH2)2中不含NH4+,不属于铵盐。
2.(2011·郑州高一检测)某食品袋中有一个写着“干燥剂”的小纸袋,里面的主要成分是生石灰,对此“干燥剂”的说法正确的是( )
A.此干燥剂为混合物
B.小纸袋中的物质可长期持续地作干燥剂
C.生石灰属于强碱
D.此干燥剂可以食用
【解析】选A。生石灰是CaO的俗名,是氧化物,不是碱,它能够和水剧烈的反应并且放出大量的热,不可以食用,当它完全吸收空气中的水蒸气变成Ca(OH)2时,其干燥效果将消失。
3.化学概念在逻辑上存在如下关系:
对下列概念的说法正确的是( )
A.纯净物与混合物属于包含关系
B.化合物与碱性氧化物属于包含关系
C.单质与化合物属于交叉关系
D.氧化还原反应与分解反应属于并列关系
【解析】选B。
4.(2011·哈尔滨高一检测)
小美在五连环中填入了5种物
质,相连环物质间能发生反
应,不相连环物质间不能发
生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数有( )
A.复分解反应、1个
B.分解反应、2个
C.化合反应、3个
D.置换反应、2个
【解析】选B。五连环中的5种物质发生反应的方程式如下:
①Fe+2HCl====FeCl2+H2↑,②HCl+NaOH====NaCl+H2O,
③2NaOH+CO2====Na2CO3+H2O(或NaOH+CO2====NaHCO3),
④C+CO2 2CO,其中①为置换反应,②为复分解反应,
④为化合反应,③可为复分解反应,也可为化合反应,①和
④反应前后有元素价态的改变,属于氧化还原反应,故选B。
高温
====
5.某化学兴趣小组欲研究H2SO4、NaCl、KCl、Na2CO3、NaOH的性质,对于如何研究,他们设计了两种研究方案:
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。
下列说法正确的是( )
A.常温时将少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的只有稀硫酸溶液
B.设计方案②的同学取某种溶液,在其中加入上述的钾盐溶液,有白色沉淀生成,再加入稀硝酸,沉淀不消失,则该溶液中含有Ag+
C.按照方案①的分类,属于碱的有Na2CO3、NaOH
D.这两组同学在研究物质时只使用了实验法、观察法
【解析】选B。铜粉不能溶于稀硫酸,A选项错误;钾盐只有KCl,不溶于稀硝酸的白色沉淀有AgCl和BaSO4,向溶液中加入KCl溶液和稀硝酸,产生的白色沉淀为AgCl,所以溶液中含有Ag+,B选项正确;Na2CO3俗名纯碱,属于盐类物质,C选项错误;这两组同学在研究物质时除了使用了实验法、观察法外,还使用了分类法,D选项错误。
【方法技巧】常用的物质分类标准
(1)根据物质的组成(纯净物和混合物)
(2)根据物质的导电性(导体、半导体和绝缘体)
(3)根据物质的存在方式(单质、化合物)
(4)根据物质在水中的溶解性(可溶、微溶、难溶)
(5)根据物质在化学反应中的作用(酸、碱、盐)
(6)根据物质的存在状态(气体、液体、固体)
二、非选择题(本题包括3小题,共30分)
6.(12分)运载火箭前两级加注的常用推进剂是偏二甲肼(C2H8N2)和四氧化二氮(N2O4),第三级注入液氢。
(1)从元素组成角度考虑,三种火箭推进剂有一种与其他两种不同,这种物质是(填化学式)____________。
(2)写出以三种火箭推进剂所含的四种元素C、N、H、O组成的一种盐类物质的化学式__________。
(3)气体N2O4和水反应的化学方程式为:3N2O4+2H2O===4HNO3
+2NO,据此判断该反应_____氧化还原反应(填“是”或“不是”,下同),N2O4_______酸性氧化物。
【解析】(1)C2H8N2和N2O4都含有多种元素,属于化合物,而液氢只含H一种元素,是一种单质;(2)盐是由金属阳离子或铵根离子与酸根离子形成的化合物,因为这四种元素全部是非金属元素,要想组成盐类物质,则一定含有铵根离子,即该盐为(NH4)2CO3或NH4HCO3;(3)在该反应中氮元素的化合价由+4价变为+5价和+2价,属于氧化还原反应;能够和水反应的酸性氧化物,与水反应会生成相应的酸,N2O4与水反应除了生成HNO3外,还生成NO,所以不属于酸性氧化物。
答案:(1)H2 (2)(NH4)2CO3或NH4HCO3
(3)是 不是
7.(8分)已知碘元素及其化合物的性质与氯元素的相似。下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。请根据此表,结合中学学过的化学知识,回答下列问题:
(1)据物质分类的有关知识,在:①HIO3;②碘酸钠;③KOH;④I2O5;⑤HI五种______(填“混合物”或“化合物”或“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的有_______(填序号)。
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)_____溶于水(填“能”或“不能”),化学性质:碘酸钾(KIO3)在受热时________。
【解析】(1)HIO3、碘酸钠、KOH、I2O5、HI五种化合物依次属于含氧酸、含氧酸盐、碱、非金属氧化物和无氧酸,KIO3属于含氧酸盐;(2)KIO3属于含钾盐,钾盐都能溶于水;KIO3的性质与KClO3的相似,受热时易分解。
答案:(1)化合物 ② (2)能 易分解
8.(10分)(挑战能力)我国古代炼丹中用的红丹又名铅丹,在一定条件下,铅丹(本题中用X表示)与硝酸能够发生如下反应:X+4HNO3====PbO2+2Pb(NO3)2+2H2O。
(1)铅丹的化学式为________。
(2)已知铅丹中铅元素的化合价为+2价和+4价,Fe3O4可以看作“混合氧化物”,用氧化物的形式可以表示为FeO·Fe2O3,
则铅丹用氧化物的形式可以表示为________。
(3)由此反应可以推断:PbO是_______氧化物(填“酸性”或“碱性”,下同),PbO2是_______氧化物。
(4)铅元素和碳元素的化学性质相似,请写出PbO2和NaOH溶液反应的化学方程式________________________。
【解析】(1)根据质量守恒定律:反应前后元素种类不变,原子数目不变,可以确定铅丹的化学式为Pb3O4。(2)铅丹中铅元素的化合价为+2价和+4价,其相应的氧化物分别为PbO和PbO2,所以铅丹用氧化物的形式可以表示为2PbO·PbO2。(3)从方程式可以看出,PbO2和HNO3不反应,所以PbO2不属于碱性氧化物,而属于酸性氧化物。而PbO能够和HNO3反应,所以属于碱性氧化物。(4)类比CO2和NaOH溶液反应:CO2+2NaOH====
Na2CO3+H2O可以写出:PbO2+2NaOH====Na2PbO3+H2O。
答案:(1)Pb3O4 (2)2PbO·PbO2 (3)碱性 酸性
(4)PbO2+2NaOH===Na2PbO3+H2O
松花蛋于明朝初年问世。其腌制配方有多种,但主要配料为生石灰(CaO)、纯碱(Na2CO3)和食盐(NaCl)。将一定比例的配料用水和黏土调制成糊状,敷于蛋上,密封保存,数日后即可食用。
(1)下表列出了松花蛋腌制配方的三种主要配料,请在表中填写它们所属的物质类别:
(2)腌制松花蛋的配料用水调制时,主要发生的化学反应的方程式有(不考虑黏土中的物质可能参与的反应)
_________________,________________。
(3)松花蛋外的糊状物经水溶解、过滤后,滤液中肯定大量含有的溶质为_________和_________,可能含有的物质为Ca(OH)2或Na2CO3(不考虑黏土中的物质)。
(4)某同学设计如下表所示的实验方案,探究(3)所得滤液中可能含有的物质是否存在,请你帮他完善实验方案。
【解析】(1)CaO是一种碱性氧化物;Na2CO3虽然称为“纯碱”,但它不属于碱,而属于盐类物质,是一种含氧酸盐;NaCl是一种无氧酸盐。
(2)配料用水调制时可能发生如下变化过程:
(3)在配料和反应产物中,NaCl、Na2CO3、Ca(OH)2、NaOH等都能够溶于水,因为NaCl不与其他物质反应,NaOH是反应的最终产物,所以滤液中一定含有它们;若配料中的Na2CO3是过量的,则滤液中还含有Na2CO3;若配料中的CaO是过量的,则滤液中还含有Ca(OH)2。
(4)检验溶液中是否含有Na2CO3,可以加入适量盐酸,看有无气泡产生;也可以加入含有Ca2+或Ba2+的溶液,看有无白色沉淀产生。题目中加入的是稀盐酸,按要求写出实验现象即可。
答案:(1)氧化物 盐 盐
(2)CaO+H2O====Ca(OH)2
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
(3)NaOH NaCl
(4)气泡 气泡
【典例1】下列4组物质均有一种物质的类别与其他3种不同:
A.CaO、Na2O、CO2、CuO
B.H2、C、P、Cu
C.O2、Fe、Cu、Zn
D.HCl、H2O、H2SO4、HNO3
(1)以上四组物质中分类与其他物质不同的物质依次是(填化学式):
A________;B________;C________;D________。
(2)这四种物质相互作用可生成一种新物质[碱式碳酸铜,化学式Cu2(OH)2CO3],该反应________氧化还原反应(填“是”或“否”)。
(3)碱式碳酸铜可以看作是Cu(OH)2和CuCO3按照1∶1组成的混合型化合物,写出它与足量盐酸反应的化学方程式:________。
【思路点拨】解答此题要注意以下三点:
【自主解答】(1)A组物质中,CO2为酸性氧化物,其余的都是碱性氧化物;B组物质中,Cu为金属单质,其余的都是非金属单质;C组物质中,O2为非金属单质(气态),其余的都是金属单质(固态);D组物质中,H2O为氧化物,其余的都是酸类物质。(2)这四种物质反应的化学方程式为2Cu+CO2+H2O+O2====Cu2(OH)2CO3,反应前后铜和氧元素的化合价发生了变化,属于氧化还原反应。(3)Cu(OH)2和盐酸反应生成CuCl2和H2O,CuCO3和盐酸反应生成CuCl2、H2O和CO2,由此可以写出碱式碳酸铜与足量盐酸反应的化学方程式。
答案:(1)CO2 Cu O2 H2O (2)是
(3)Cu2(OH)2CO3+4HCl====2CuCl2+3H2O+CO2↑
【互动探究】(1)根据不同的分类标准,B中哪种物质还与其他物质类别不同。
提示:H2。H2为气态物质,C、P、Cu为固态物质。
(2)碱式碳酸铜受热能够分解,你能写出该反应的化学方程式吗?
提示:Cu(OH)2受热分解生成CuO和H2O,CuCO3受热分解生成CuO和CO2,所以碱式碳酸铜受热分解生成CuO、CO2和H2O。其反应的化学方程式为:
Cu2(OH)2CO3 2CuO+H2O+CO2↑。
△
====
【规律方法】常见的分类方法
(1)交叉分类法:对同一物质按照不同的标准分类。如硫酸钠,从其组成的阳离子来看,属于钠盐;从其组成的阴离子来看,属于硫酸盐。
(2)树状分类法:对同类事物按照某种标准进行分类。如化合物可以分为酸、碱、盐和氧化物等。
【变式训练】符合下图中阴影部分的物质是( )
A.Na2CO3 B.Cu2(OH)2CO3
C.NaCl D.NaHCO3
【解析】选A。图中阴影部分的物质既属于钠盐、又属于碳酸盐、还属于正盐。Cu2(OH)2CO3属于碳酸盐的碱式盐,是一种铜盐;NaCl属于盐酸盐的钠盐,是一种正盐。NaHCO3属于碳酸盐的酸式盐,是一种钠盐。
【典例2】甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色无味气体。则甲、乙、丙、丁四种溶液依次是
A.BaCl2、Na2CO3、AgNO3、盐酸
B.BaCl2、Na2CO3、盐酸、AgNO3
C.Na2CO3、盐酸、AgNO3、BaCl2
D.AgNO3、盐酸、BaCl2、Na2CO3
【思路点拨】解答此题要注意以下两点:
【自主解答】选A。四种物质中只有Na2CO3和盐酸反应能够生成无色无味气体(CO2),所以乙和丁中,一种是Na2CO3,另一种是盐酸。而Na2CO3能够和剩余两种物质反应生成沉淀,盐酸只能和AgNO3反应生成沉淀,由此可以确定乙是Na2CO3,丁是盐酸。既能和Na2CO3反应又能和盐酸反应生成沉淀的物质只有AgNO3,所以丙是AgNO3,甲是BaCl2。
【互动探究】这四种物质中有一种与其他三种物质所属的类别不同,试分别写出该物质发生复分解反应和置换反应的一个化学方程式。
提示:盐酸属于酸类物质,其余三种都属于盐类物质。其发生的复分解反应为Ca(OH)2+2HCl====CaCl2+2H2O,置换反应为Zn+2HCl====ZnCl2+H2↑。(所写反应合理即可)
【变式训练】(2011·成都高一检测)如图五角星上排列的
A、B、C、D、E五种物质均为中学化学中常见的化合物,相互之间的连线表示两种物质能发生化学反应。
A、C、E均为氧化物,A是人体呼出的气体之一;在实验室中B可以用来制取A,而D可以用来检验A;C和E反应能生成D。
(1)写出下列物质的化学式:A______,D_____;
(2)B除了制取A之外的另一种用途是_______;
(3)C和E反应的化学方程式为_______;
(4)这五种物质之间两两发生反应,其中没有涉及到的基本反应类型是_______。
【解析】人体呼出的气体中含有水蒸气和CO2,所以A最有可能是CO2,实验室可以用大理石(或石灰石)和稀盐酸反应制取CO2,用澄清石灰水检验CO2,CaO和H2O反应能够生成Ca(OH)2。再结合“相互之间的连线表示两种物质能发生化学反应”这一条件,可以判断出各物质是什么,如下图所示:
这五种物质之间两两发生反应时,H2O与CaO、CO2的反应
都是化合反应,CO2与Ca(OH)2反应其本质是复分解反应,HCl和CaO、Ca(OH)2的反应都是复分解反应,没有涉及到分解反应和置换反应。
答案:(1)CO2 Ca(OH)2
(2)用于金属表面除锈(制造药物、可帮助消化等)
(3)CaO+H2O====Ca(OH)2
(4)分解反应和置换反应
【典例】根据下面列出的氯的含氧酸及它们对应的氧化物(酸酐)的关系:
判断硝酸(HNO3)的酸酐是
A.NO B.N2O3 C.NO2 D.N2O5
【思路点拨】根据表中信息,可以得出如下结论:
【自主解答】选D。HNO3的脱水过程可以表示为:HNO3→H2N2O6→N2O5,所以硝酸的酸酐是N2O5。
【互动探究】根据酸酐和相应含氧酸的对应关系,你能写出SO3和SO2对应的含氧酸吗?
提示:H2SO4和H2SO3。
【变式训练】氧化钠是碱性氧化物,下列关于氧化钠性质的叙述不正确的是( )
A.氧化钠可以与水反应生成碱
B.氧化钠可以与盐酸反应
C.氧化钠可以与CaO反应
D.氧化钠可以与CO2反应
【解析】选C。氧化钠具有碱性氧化物的通性:能够与水反应生成碱;能够与酸反应生成盐和水;能够和酸性氧化物反应生成盐;不能和碱性氧化物反应。
【典例】有关氧化物的叙述正确的是
A.碱性氧化物一定是金属氧化物
B.金属氧化物一定是碱性氧化物
C.酸性氧化物一定是非金属氧化物
D.酸性氧化物、碱性氧化物一定都能与水反应生成相应的酸、碱
【易错选项】C
【易错剖析】
(1)易错选项分析
本题易错选C的原因在于混淆了非金属氧化物与酸性氧化物的概念,酸性氧化物不一定是非金属氧化物(如Mn2O7属于酸性氧化物,但其是金属氧化物);非金属氧化物也不一定是酸性氧化物(如CO、NO属于不成盐氧化物)。
(2)其他错误选项分析:
【标准答案】A
1.根据物质的组成对物质进行分类,NaHCO3属于( )
A.盐 B.有机物 C.碱 D.氧化物
【解析】选A。从该物质组成上看,含有金属阳离子Na+和酸式酸根离子HCO3-,故该物质属于盐。
2.对于下列反应类型的判断,不正确的是( )
A.2FeCl2+Cl2====2FeCl3(化合反应)
B.3CO+Fe2O3 2Fe+3CO2(置换反应)
C.2KClO3 2KCl+3O2↑(氧化还原反应)
D.H2CO3 CO2↑+H2O(分解反应)
【解析】选B。B选项的反应只有单质生成而没有单质参加反应,不属于置换反应,属于氧化还原反应。
高温
====
MnO2
△
====
△
====
3.在:①化合反应;②分解反应;③置换反应;④复分解反应四种基本反应类型中,可以生成水的是( )
A.只有②③ B.只有①④
C.只有①②④ D.①②③④
【解析】选D。可以用方程式举例法来判断。①2H2+O2
2H2O;②Cu(OH)2 CuO+H2O;③CuO+H2 Cu+H2O;
④CaCO3+2HCl====CaCl2+CO2↑+H2O。所以这四种基本反应类型都可以生成水。
点燃
====
△
====
△
====
4.下列说法正确的是( )
A.无氧酸是指分子组成中不含氧元素的酸,如HCl、CH4等
B.根据溶解性的不同,可将碱分为难溶性碱和可溶性碱
C.和酸反应生成盐和水的物质一定是碱性氧化物
D.所有的酸性氧化物都可以与水化合得到相应的酸
【解析】选B。A项CH4不是酸。C项与酸反应生成盐和水的物质还有碱、盐等。常见的酸性氧化物中SiO2与水不反应。
5.根据四种基本反应类型各写出一个有二氧化碳生成的化学方程式:
①化合反应______________________________;
②置换反应______________________________;
③分解反应______________________________;
④复分解反应____________________________。
【解析】生成二氧化碳的反应通常考虑含碳的某些物质的燃烧。只生成二氧化碳的反应则为碳或一氧化碳的燃烧。生成二氧化碳的置换反应通常考虑碳参与的置换反应,如碳与氧化铜或氧化铁反应。生成二氧化碳的分解反应则考虑某些碳酸盐的分解反应,如碳酸钙、碳酸铵或碳酸氢铵的分解。而生成二氧化碳的复分解反应则为碳酸盐和稀盐酸或稀硫酸、稀硝酸的反应。
答案:①C+O2 CO2或2CO+O2 2CO2
②C+2CuO CO2↑+2Cu
③CaCO3 CaO+CO2↑
④CaCO3+2HCl====CaCl2+H2O+CO2↑
(合理即可)
点燃
====
点燃
====
高温
====
高温
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.下列物质的分类合理的是( )
A.酸性氧化物:CO2、H2O
B.碱性氧化物:Na2O、CaO
C.碱:NaOH、Na2CO3
D.铵盐:NH4Cl、CO(NH2)2
【解析】选B。A选项中,H2O不是酸性氧化物;C选项中,Na2CO3不是碱而是盐;D选项中,CO(NH2)2中不含NH4+,不属于铵盐。
2.(2011·郑州高一检测)某食品袋中有一个写着“干燥剂”的小纸袋,里面的主要成分是生石灰,对此“干燥剂”的说法正确的是( )
A.此干燥剂为混合物
B.小纸袋中的物质可长期持续地作干燥剂
C.生石灰属于强碱
D.此干燥剂可以食用
【解析】选A。生石灰是CaO的俗名,是氧化物,不是碱,它能够和水剧烈的反应并且放出大量的热,不可以食用,当它完全吸收空气中的水蒸气变成Ca(OH)2时,其干燥效果将消失。
3.化学概念在逻辑上存在如下关系:
对下列概念的说法正确的是( )
A.纯净物与混合物属于包含关系
B.化合物与碱性氧化物属于包含关系
C.单质与化合物属于交叉关系
D.氧化还原反应与分解反应属于并列关系
【解析】选B。
4.(2011·哈尔滨高一检测)
小美在五连环中填入了5种物
质,相连环物质间能发生反
应,不相连环物质间不能发
生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数有( )
A.复分解反应、1个
B.分解反应、2个
C.化合反应、3个
D.置换反应、2个
【解析】选B。五连环中的5种物质发生反应的方程式如下:
①Fe+2HCl====FeCl2+H2↑,②HCl+NaOH====NaCl+H2O,
③2NaOH+CO2====Na2CO3+H2O(或NaOH+CO2====NaHCO3),
④C+CO2 2CO,其中①为置换反应,②为复分解反应,
④为化合反应,③可为复分解反应,也可为化合反应,①和
④反应前后有元素价态的改变,属于氧化还原反应,故选B。
高温
====
5.某化学兴趣小组欲研究H2SO4、NaCl、KCl、Na2CO3、NaOH的性质,对于如何研究,他们设计了两种研究方案:
方案①:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验;
方案②:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。
下列说法正确的是( )
A.常温时将少量铜粉分别投入上述溶液中,按照方案①的分类,能够完全溶解铜粉的只有稀硫酸溶液
B.设计方案②的同学取某种溶液,在其中加入上述的钾盐溶液,有白色沉淀生成,再加入稀硝酸,沉淀不消失,则该溶液中含有Ag+
C.按照方案①的分类,属于碱的有Na2CO3、NaOH
D.这两组同学在研究物质时只使用了实验法、观察法
【解析】选B。铜粉不能溶于稀硫酸,A选项错误;钾盐只有KCl,不溶于稀硝酸的白色沉淀有AgCl和BaSO4,向溶液中加入KCl溶液和稀硝酸,产生的白色沉淀为AgCl,所以溶液中含有Ag+,B选项正确;Na2CO3俗名纯碱,属于盐类物质,C选项错误;这两组同学在研究物质时除了使用了实验法、观察法外,还使用了分类法,D选项错误。
【方法技巧】常用的物质分类标准
(1)根据物质的组成(纯净物和混合物)
(2)根据物质的导电性(导体、半导体和绝缘体)
(3)根据物质的存在方式(单质、化合物)
(4)根据物质在水中的溶解性(可溶、微溶、难溶)
(5)根据物质在化学反应中的作用(酸、碱、盐)
(6)根据物质的存在状态(气体、液体、固体)
二、非选择题(本题包括3小题,共30分)
6.(12分)运载火箭前两级加注的常用推进剂是偏二甲肼(C2H8N2)和四氧化二氮(N2O4),第三级注入液氢。
(1)从元素组成角度考虑,三种火箭推进剂有一种与其他两种不同,这种物质是(填化学式)____________。
(2)写出以三种火箭推进剂所含的四种元素C、N、H、O组成的一种盐类物质的化学式__________。
(3)气体N2O4和水反应的化学方程式为:3N2O4+2H2O===4HNO3
+2NO,据此判断该反应_____氧化还原反应(填“是”或“不是”,下同),N2O4_______酸性氧化物。
【解析】(1)C2H8N2和N2O4都含有多种元素,属于化合物,而液氢只含H一种元素,是一种单质;(2)盐是由金属阳离子或铵根离子与酸根离子形成的化合物,因为这四种元素全部是非金属元素,要想组成盐类物质,则一定含有铵根离子,即该盐为(NH4)2CO3或NH4HCO3;(3)在该反应中氮元素的化合价由+4价变为+5价和+2价,属于氧化还原反应;能够和水反应的酸性氧化物,与水反应会生成相应的酸,N2O4与水反应除了生成HNO3外,还生成NO,所以不属于酸性氧化物。
答案:(1)H2 (2)(NH4)2CO3或NH4HCO3
(3)是 不是
7.(8分)已知碘元素及其化合物的性质与氯元素的相似。下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。请根据此表,结合中学学过的化学知识,回答下列问题:
(1)据物质分类的有关知识,在:①HIO3;②碘酸钠;③KOH;④I2O5;⑤HI五种______(填“混合物”或“化合物”或“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的有_______(填序号)。
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)_____溶于水(填“能”或“不能”),化学性质:碘酸钾(KIO3)在受热时________。
【解析】(1)HIO3、碘酸钠、KOH、I2O5、HI五种化合物依次属于含氧酸、含氧酸盐、碱、非金属氧化物和无氧酸,KIO3属于含氧酸盐;(2)KIO3属于含钾盐,钾盐都能溶于水;KIO3的性质与KClO3的相似,受热时易分解。
答案:(1)化合物 ② (2)能 易分解
8.(10分)(挑战能力)我国古代炼丹中用的红丹又名铅丹,在一定条件下,铅丹(本题中用X表示)与硝酸能够发生如下反应:X+4HNO3====PbO2+2Pb(NO3)2+2H2O。
(1)铅丹的化学式为________。
(2)已知铅丹中铅元素的化合价为+2价和+4价,Fe3O4可以看作“混合氧化物”,用氧化物的形式可以表示为FeO·Fe2O3,
则铅丹用氧化物的形式可以表示为________。
(3)由此反应可以推断:PbO是_______氧化物(填“酸性”或“碱性”,下同),PbO2是_______氧化物。
(4)铅元素和碳元素的化学性质相似,请写出PbO2和NaOH溶液反应的化学方程式________________________。
【解析】(1)根据质量守恒定律:反应前后元素种类不变,原子数目不变,可以确定铅丹的化学式为Pb3O4。(2)铅丹中铅元素的化合价为+2价和+4价,其相应的氧化物分别为PbO和PbO2,所以铅丹用氧化物的形式可以表示为2PbO·PbO2。(3)从方程式可以看出,PbO2和HNO3不反应,所以PbO2不属于碱性氧化物,而属于酸性氧化物。而PbO能够和HNO3反应,所以属于碱性氧化物。(4)类比CO2和NaOH溶液反应:CO2+2NaOH====
Na2CO3+H2O可以写出:PbO2+2NaOH====Na2PbO3+H2O。
答案:(1)Pb3O4 (2)2PbO·PbO2 (3)碱性 酸性
(4)PbO2+2NaOH===Na2PbO3+H2O
松花蛋于明朝初年问世。其腌制配方有多种,但主要配料为生石灰(CaO)、纯碱(Na2CO3)和食盐(NaCl)。将一定比例的配料用水和黏土调制成糊状,敷于蛋上,密封保存,数日后即可食用。
(1)下表列出了松花蛋腌制配方的三种主要配料,请在表中填写它们所属的物质类别:
(2)腌制松花蛋的配料用水调制时,主要发生的化学反应的方程式有(不考虑黏土中的物质可能参与的反应)
_________________,________________。
(3)松花蛋外的糊状物经水溶解、过滤后,滤液中肯定大量含有的溶质为_________和_________,可能含有的物质为Ca(OH)2或Na2CO3(不考虑黏土中的物质)。
(4)某同学设计如下表所示的实验方案,探究(3)所得滤液中可能含有的物质是否存在,请你帮他完善实验方案。
【解析】(1)CaO是一种碱性氧化物;Na2CO3虽然称为“纯碱”,但它不属于碱,而属于盐类物质,是一种含氧酸盐;NaCl是一种无氧酸盐。
(2)配料用水调制时可能发生如下变化过程:
(3)在配料和反应产物中,NaCl、Na2CO3、Ca(OH)2、NaOH等都能够溶于水,因为NaCl不与其他物质反应,NaOH是反应的最终产物,所以滤液中一定含有它们;若配料中的Na2CO3是过量的,则滤液中还含有Na2CO3;若配料中的CaO是过量的,则滤液中还含有Ca(OH)2。
(4)检验溶液中是否含有Na2CO3,可以加入适量盐酸,看有无气泡产生;也可以加入含有Ca2+或Ba2+的溶液,看有无白色沉淀产生。题目中加入的是稀盐酸,按要求写出实验现象即可。
答案:(1)氧化物 盐 盐
(2)CaO+H2O====Ca(OH)2
Ca(OH)2+Na2CO3====CaCO3↓+2NaOH
(3)NaOH NaCl
(4)气泡 气泡
