11-12版高中化学全程学习方略配套课件:1.1.3物质的聚集状态(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:1.1.3物质的聚集状态(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 20:47:58 | ||
图片预览










文档简介
(共79张PPT)
【典例1】在标准状况下,等质量的CH4和
CO2比较,下列说法中不正确的是
A.密度比为4∶11 B.分子数之比为4∶11
C.体积比为11∶4 D.物质的量之比为11∶4
【思路点拨】
【自主解答】选B。设CH4与CO2的质量均为1 g,则n(CH4)=
n(CO2)= 则
n(CH4)∶n(CO2)=11∶4,D正确;同温同压下
B错误;同温同压下
【互动探究】若将“标准状况”改为“同温同体积”,则说法正确的选项是什么?
提示:据ρ=m/V,同体积、等质量的CH4和CO2的密度相同,密度比为1∶1,A错;分子数之比等于物质的量之比,为11∶4,B错;体积比为1∶1,C错;物质的量之比为11∶4,D正确。故选D。
【变式训练】在同温同压下,有等质量的气体X和Y。已知此时Y的体积大于X的体积,则它们的相对分子质量关系是( )
A.M(X)>M(Y) B.M(X)<M(Y)
C.M(X)=M(Y) D.无法确定
【解析】选A。同温同压下,体积之比等于物质的量之比,故
因m(X)=m(Y),n(Y)>n(X),故M(X)>M(Y)。
【典例2】今有铁和锌的混合物12.1 g,其中铁的质量分数为46.28%,与足量的盐酸反应后生成标准状况下的氢气多少升?
【思路点拨】解答本题的思路为:
【自主解答】m(Fe)=12.1 g×46.28%=5.6 g
则m(Zn)=12.1 g-5.6 g=6.5 g
n(Fe)=
n(Zn)=
答案:4.48 L
【互动探究】反应中消耗HCl的物质的量为多少?
提示:根据关系式:Fe~2HCl和Zn~2HCl,所以n(HCl)=2n(Fe)+2n(Zn)=2×0.1 mol+2×0.1 mol=0.4 mol。
【规律方法】(1)物质的量应用于化学方程式计算时,一定要根据题给条件,结合反应的方程式,找到已知量和未知量的对应关系,然后列式进行计算。
(2)对于有气体参与的反应而言,可以将体积直接用于方程式的计算而无需转化为物质的量。
【变式训练】在一定体积的密闭容器中放入3 mol气体R和5 mol气体Q,在一定的条件下发生反应2R(g)+5Q(g)====4X(g)+nY(g)。反应完全后,容器的温度不变,混合气体的压强是原来的87.5%,则化学方程式中n的值是( )
A.2 B.3 C.4 D.5
【解析】选A。根据阿伏加德罗定律,同温同体积条件下压强之比等于物质的量之比。反应完全后压强变为原来的87.5%,即物质的量变为原来的87.5%,反应后气体的物质的量减少,即2+5>4+n,则n<3,故选A。
【典例1】有一真空瓶质量为m1 g,该瓶充入空气后质量
为m2 g。在相同状况下,若改为充入某气体A时,总质量为m3 g。则A的相对分子质量是
A. B.
C. D.
【思路点拨】同温同压下,同容积的容器中所盛气体的体积和物质的量均相等。
【自主解答】选C。设A的相对分子质量是Mr,则根据
n=
【互动探究】若所有的数据都是在标准状况下测定的,则该真空瓶的体积为多少?
提示:V=n·Vm=
【变式训练】同温同压下,已知O2的密度为ρ g·L-1,则Cl2的密度为( )
A. B.
C. D.
【解析】选A。同温同压下,气体的密度之比等于摩尔质量之比,所以 得:
【规律方法】掌握气体摩尔体积这个概念应注意的事项
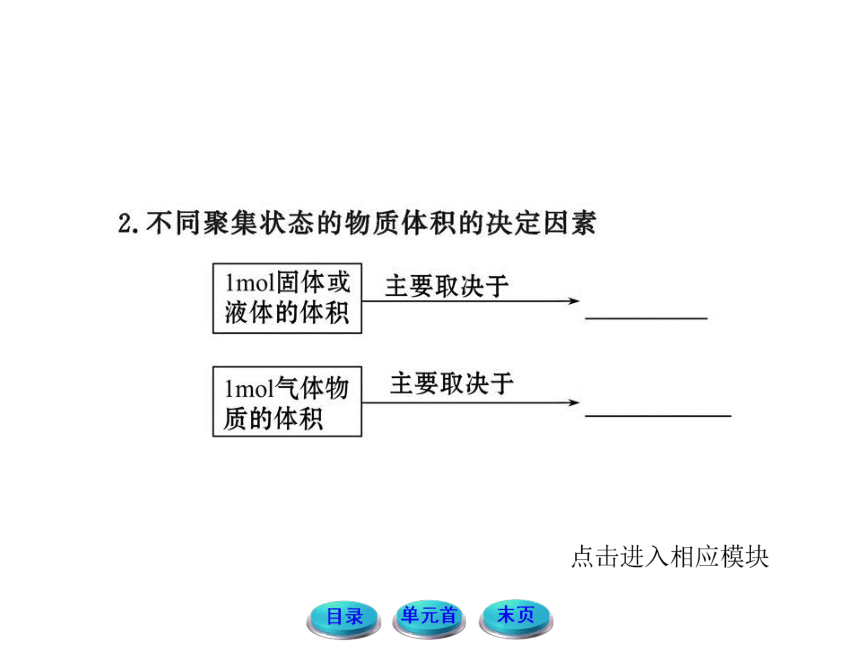
(1)气体的体积,在一定温度、压强下只与气体的微粒数目有关,而与气体分子的种类无关。所以,讨论气体的摩尔体积时必需在一定条件下讨论才有意义。
(2)气体在不同状况下,气体摩尔体积不同,气体摩尔体积与温度和压强有关。
(3)在温度为0 ℃,压强为101 kPa下,气体的摩尔体积约为22.4 L/mol,也就是标准状况下的气体摩尔体积。
(4)气体摩尔体积仅仅是针对气体(包括单一气体和混合气体)而言。
【典例2】某混合气体各组分的质量分数分别为:O2占32%、N2占28%、CO2占22%、CH4占16%、H2占2%,则此混合气体对氢气的相对密度为
A.60.76 B.30.36 C.22.22 D.11.11
【思路点拨】解答本题可以按如下程序进行:
【自主解答】选D。假设混合气体的质量为100 g,则m(O2)=32 g,m(N2)=28 g,m(CO2)=22 g,m(CH4)=16 g,
m(H2)=2 g,然后求出各气体的物质的量:n(O2)=1 mol,n(N2)=1 mol,n(CO2)=0.5 mol,n(CH4)=1 mol,n(H2)=1 mol,n(总)=4.5 mol,所以
【互动探究】若将题中的“质量分数”改为“物质的量分数”则混合气体对H2的相对密度为多少?
提示: =32×32%+28×28%+44×22%+16×16%+2×2%=
30.36
【规律方法】做有关求平均摩尔质量的选择型计算题时,可以先根据平均值的特点判断平均摩尔质量的范围
若只有1个选项在此范围内,则必为正确答
案,不必再计算;若有多个选项在此范围内,则必须选择适当的公式进行计算。本题中, 1<D<22,只有
D选项符合。
【变式训练】CH4和CO的混合气体对H2的相对密度为10,则该混合气体中CH4和CO的分子数之比为( )
A.1∶2 B.2∶1
C.1∶1 D.3∶2
【解析】选B。混合气体的平均摩尔质量为:
=20 g/mol,设混合气体中CH4的物质的量分数为x,则CO的物质的量分数为(1-x),即16x+28(1-x)=20,解得:
所以CH4和CO的分子数之比为:
【典例】NA代表阿伏加德罗常数。下列有关叙述正确的是
A.标准状况下,22.4 L H2O含有的分子数为NA
B.常温常压下,1.06 g Na2CO3含有的Na+数为0.02NA
C.通常状况下,NA个CO2分子占有的体积为22.4 L
D.常温下16 g O2和14 g N2组成的混合气中,所含分子数大于NA
【易错选项】A
【易错剖析】
(1)易错选项分析
本题易错选A的原因在于忽略了气体摩尔体积的研究对象是气体,而在标准状况下水为液态,此时22.4 L H2O含有的分子数远远大于NA。
(2)其他错误选项分析:
【标准答案】B
1.在下列条件下,两种气体的密度一定相等的是( )
A.同质量不同体积的C2H4和CO
B.不同温度同体积的C2H6和NO
C.同体积、同压强的N2和C2H4
D.同温同压下的CO和N2
【解析】选D。选项A,根据 质量相同体积不同的气
体,密度不同;选项B,在压强不确定的情况下,体积相同的气体,其质量不一定相同,根据 气体的密度不一
定相同;选项C,温度不确定,气体的密度无法确定。根据阿伏加德罗定律,选项D正确。
2.下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气体物质体积的大小,由构成气体的分子的大小决定
B.一定温度和压强下,各种气体物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L
【解析】选B。当温度和压强确定后,气体分子间的距离就确定了,气体体积由分子间距离和分子个数决定,故在一定温度、压强下,气体体积由分子数决定,A选项错误;比较气体的体积,一定要指明状态,在相同状态下(即温度、压强相同的情况下),才可以比较气体体积,这里没有指明相同状态,故无法根据体积来判断所含分子数的多少,C选项错误;气体摩尔体积是单位物质的量的气体所具有的体积,只有在标准状况下,1 mol气体所占体积才约为22.4 L,D选项错误。
3.下列说法正确的是( )
A.标准状况下,1 mol水的体积约是22.4 L
B.1 mol H2所占的体积约是22.4 L
C.标准状况下,6.02×1023个分子所占的体积约是22.4 L
D.标准状况下,28 g氮气和CO的混合气体的体积约是22.4 L
【解析】选D。水在标准状况下为液体,不能用气体摩尔体积计算水的体积,A选项错误;B选项没有指明H2是否处于标准状况下,不能确定其准确的体积;C选项没有指明该分子是否是气体分子,错误。
4.相同状况下,下列气体所占体积最大的是( )
A.64 g SO2 B.16 g O2
C.34 g H2S D.3 g H2
【解析】选D。在相同状况下,气体的体积和物质的量成正比,
所以H2所占体积最大。
5.在标准状况下:①6.72 L CH4气体;②3.01×1023个HCl气体分子;③13.6 g H2S气体;④0.2 mol NH3,下列对这四种气体的关系从大到小的排列是(用上述数字序号表示):
(1)标准状况下四种气体的体积______________。
(2)四种气体的质量_____________。
【解析】n(CH4)= =0.3 mol,m(CH4)=0.3 mol
×16 g/mol=4.8 g,n(HCl)=
m(HCl)=0.5 mol×36.5 g/mol=18.25 g,n(H2S)=
=0.4 mol,m(NH3)=0.2 mol×17 g/mol=3.4 g。
(1)n(HCl)>n(H2S)>n(CH4)>n(NH3),因为在同温同压下,气体的体积比等于物质的量之比,所以V(HCl)>V(H2S)>V(CH4)>V(NH3)。
(2)m(HCl)>m(H2S)>m(CH4)>m(NH3)。
答案:(1)②>③>①>④
(2)②>③>①>④
一、选择题(本题包括5小题,每小题4分,共20分)
1.(双选)下列有关气体摩尔体积的描述中正确的是
( )
A.单位物质的量的气体所占的体积就是气体摩尔体积
B.通常状况(室温、101 kPa)下,气体摩尔体积约为22.4 L/mol
C.标准状况(0 ℃、101 kPa)下,气体摩尔体积约为22.4 L/mol
D.标准状况(0 ℃、101 kPa)下,1 mol H2O的体积是22.4 L
【解析】选A、C。标准状况(0 ℃、101 kPa)下,气体摩尔体积约为22.4 L/mol,通常状况(室温、101 kPa)下,气体摩尔体积大于22.4 L/mol,B错误,标准状况(0 ℃、101 kPa)下,H2O不是气体,不能应用22.4 L/mol来计算体积。
2.(2011·海淀高一检测)在标准状况下,0.5 mol H2的体积是( )
A.0.5 L B.2.0 L C.11.2 L D.22.4 L
【解析】选C。V(H2)=0.5 mol×22.4 L/mol=11.2 L。
3.2 mol O2和2 mol CO2相比较,下列叙述中正确的是
( )
A.分子数相等 B.原子数相等
C.体积相等 D.质量相等
【解析】选A。物质的量相同,分子数相等,均为NA,A正确;原子数分别为4NA和6NA,不相等,B错误;同温同压下,体积相等,C项未指明“同温同压下”,错误;质量分别为64 g和88 g,不相等,D错误。
4.质量为16 g的下列气体,在标准状况下体积约为11.2 L的是( )
A.H2 B.O2
C.CO2 D.CH4
【解析】选B。标准状况下气体的物质的量为11.2 L÷
22.4 L/mol=0.5 mol,则该气体的摩尔质量为16 g÷0.5mol
=32 g/mol,即为氧气。
5.(2011·温州高一检测)某温度下,在体积一定的密闭容器中,通入适量的NH3和Cl2,使其恰好完全反应,反应方程式为:3Cl2+8NH3====N2+6NH4Cl(固体),则反应前后容器中压强比应接近( )
A.11∶1 B.1∶11 C.7∶11 D.11∶7
【解析】选A。在相同的温度和体积下,气体的压强之比等于其物质的量之比,所以p1∶p2=n1∶n2=(8+3)∶1=11∶1。
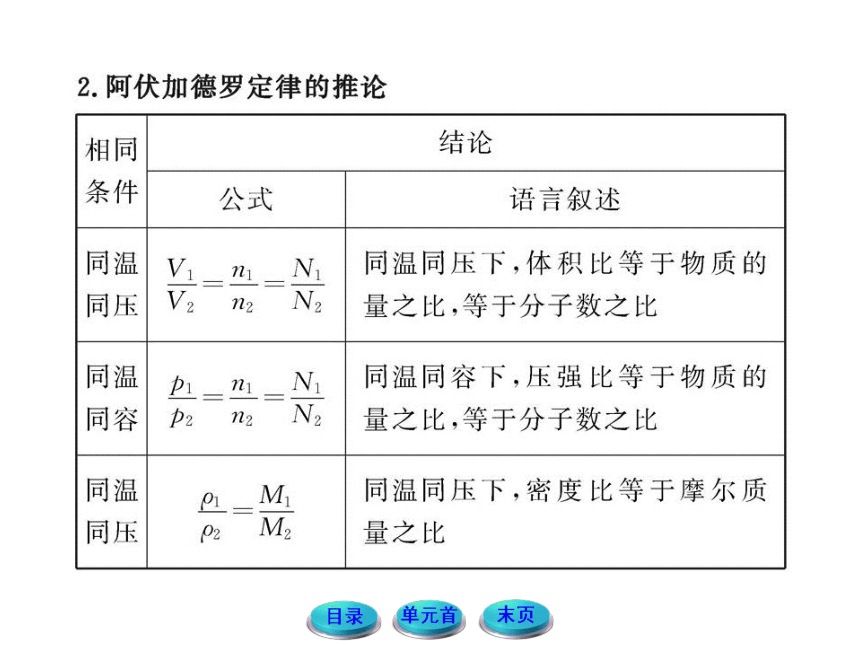
【方法技巧】阿伏加德罗定律及其推论的应用
(1)定律中的同温同压下,不一定必须在标准状况下,标准状况只是其中的一种特殊情况。
(2)定律只适用于气体,对固体、液体物质不适用。所以在解题时一定要看清物质的状态。
(3)定律中的任何气体,既可以是单一气体,也可以是混合气体。
(4)含有相同数目的分子,即分子的物质的量相同。但原子的数目不一定相同,是否相同具体要看组成分子的原子个数。
二、非选择题(本题包括3小题,共30分)
6.(11分)(1)在标准状况下,有物质①4 g H2,②33.6 L CH4, ③1 mol H2O,④3.01×1023个O2,含分子数最多的是(填序号,下同)________,含原子数最少的是_______,质量最大的是_____,体积最小的是_____;密度由大到小的顺序为:________________。
(2)含有相同氧原子数的CO和CO2 ,其质量比为______;物质的量比为______;碳原子数比为______;原子数比为___。
(3)含有电子数相等的CO和CO2气体在同温同压下的体积比为_________;密度比为_________。
【解析】(1)分子数与物质的量成正比,以上四种物质的物质的量分别为2 mol、1.5 mol、1 mol、0.5 mol,故分子
数最多的为H2;进一步可得所含原子的物质的量分别是:
4 mol、7.5 mol、3 mol、1 mol;同理可得其他答案。
(2)若CO和CO2所含氧原子数相同,则其物质的量之比为
2∶1。(3)若CO和CO2所含电子数相同,则其物质的量之比
为11∶7。
答案:(1)① ④ ② ③ ③④②①
(2)14∶11 2∶1 2∶1 4∶3 (3)11∶7 7∶11
7.(9分)已知实验室在加热条件下制取Cl2的化学方程式
为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将8.7 g
MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加
热,充分反应后,求:
(1)标准状况下生成Cl2的体积为______。
(2)反应的HCl的分子数为___________。
(3)向反应后的溶液中加入足量的AgNO3溶液,可生成白色
沉淀的质量为__________。
△
====
【解析】n(MnO2)= =0.1 mol
n总(HCl)= =2 mol
MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O
1 mol 4 mol 22.4 L
0.1 mol n(HCl) V(Cl2)
1 mol∶0.1 mol=4 mol∶n(HCl),所以n(HCl)=0.4 mol
1 mol∶0.1 mol=22.4 L∶V(Cl2),所以V(Cl2)=2.24 L,
N(HCl)=0.4 mol×6.02×1023mol-1=2.408×1023个。
△
====
氯元素除了变成氯气外,其余的全部以Cl-形式存在于溶液中,加入足量的AgNO3溶液后全部转化成AgCl沉淀,而且有n(AgCl)=n(Cl-)=n总(HCl)-2n(Cl2)=2 mol-0.1 mol
×2=1.8 mol,m(AgCl)=1.8 mol×143.5 g·mol-1=258.3 g。
答案:(1)2.24 L (2)2.408×1023 (3)258.3 g
8.(10分)(挑战能力)一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,生成XO2和YO2气体。冷却后,在标准状况下,测得生成物的体积是672 mL,则:
(1)反应前O2的体积是__________;
(2)化合物XY2物质的量是_______;
(3)若XY2分子中X、Y两元素的质量比为3∶16,则X元素与Y元素的相对原子质量比为________。
【解析】(1)由反应的化学方程式:XY2(l)+3O2 XO2+
2YO2可知,该反应前后气体体积不变,所以反应前O2的体
积也是672 mL。n(O2)= =0.03 mol。
(2)n(XY2)= n(O2)= ×0.03 mol=0.01 mol。
(3)假设X、Y两元素的相对原子质量分别为x和y,
则: =1∶2
。
答案:(1)672 mL (2)0.01 mol (3)3∶8
点燃
====
【实验设计】已知化学反应:S(s)+O2(g) SO2(g),
加热使硫粉与O2反应,冷却至室温时观察水银柱变化,通过水银柱是否变化确定大试管中气体体积与分子数之间的关系。
【实验用品】大试管、带弯曲玻璃管的橡皮塞、铁架台、酒精灯、研细的硫粉、氧气、水银、红笔。
点燃
====
【实验装置及步骤】
(1)将如图装置装好后固定到铁架台上。待内外气体压强不再变化时,用红笔在玻璃管上标出水银柱液面刻度。
(2)用酒精灯加热试管底部,可以看到研细的硫粉在试管中燃烧,当瓶中氧气消耗完时火焰熄灭。已知该反应是放热反应。
(3)反应结束后,让其自然冷却。
【思考探究】
(1)保证本实验成功的关键是什么?
提示:应保证装置气密性良好。
(2)硫粉在大试管中充分燃烧后,水银柱液面如何变化?
提示:水银柱左管液面上升,右管液面下降。
(3)大试管自然冷却到室温,水银柱液面如何变化?
提示:水银柱液面又回到原来标出的刻度。
(4)硫粉燃烧后,再恢复到室温时,水银柱液面和硫粉燃烧前相同。据此,你能得出什么样的结论?
提示:相同温度和压强下,相同体积的任何气体都具有相同的粒子数。(合理即可)
【典例1】在标准状况下,等质量的CH4和
CO2比较,下列说法中不正确的是
A.密度比为4∶11 B.分子数之比为4∶11
C.体积比为11∶4 D.物质的量之比为11∶4
【思路点拨】
【自主解答】选B。设CH4与CO2的质量均为1 g,则n(CH4)=
n(CO2)= 则
n(CH4)∶n(CO2)=11∶4,D正确;同温同压下
B错误;同温同压下
【互动探究】若将“标准状况”改为“同温同体积”,则说法正确的选项是什么?
提示:据ρ=m/V,同体积、等质量的CH4和CO2的密度相同,密度比为1∶1,A错;分子数之比等于物质的量之比,为11∶4,B错;体积比为1∶1,C错;物质的量之比为11∶4,D正确。故选D。
【变式训练】在同温同压下,有等质量的气体X和Y。已知此时Y的体积大于X的体积,则它们的相对分子质量关系是( )
A.M(X)>M(Y) B.M(X)<M(Y)
C.M(X)=M(Y) D.无法确定
【解析】选A。同温同压下,体积之比等于物质的量之比,故
因m(X)=m(Y),n(Y)>n(X),故M(X)>M(Y)。
【典例2】今有铁和锌的混合物12.1 g,其中铁的质量分数为46.28%,与足量的盐酸反应后生成标准状况下的氢气多少升?
【思路点拨】解答本题的思路为:
【自主解答】m(Fe)=12.1 g×46.28%=5.6 g
则m(Zn)=12.1 g-5.6 g=6.5 g
n(Fe)=
n(Zn)=
答案:4.48 L
【互动探究】反应中消耗HCl的物质的量为多少?
提示:根据关系式:Fe~2HCl和Zn~2HCl,所以n(HCl)=2n(Fe)+2n(Zn)=2×0.1 mol+2×0.1 mol=0.4 mol。
【规律方法】(1)物质的量应用于化学方程式计算时,一定要根据题给条件,结合反应的方程式,找到已知量和未知量的对应关系,然后列式进行计算。
(2)对于有气体参与的反应而言,可以将体积直接用于方程式的计算而无需转化为物质的量。
【变式训练】在一定体积的密闭容器中放入3 mol气体R和5 mol气体Q,在一定的条件下发生反应2R(g)+5Q(g)====4X(g)+nY(g)。反应完全后,容器的温度不变,混合气体的压强是原来的87.5%,则化学方程式中n的值是( )
A.2 B.3 C.4 D.5
【解析】选A。根据阿伏加德罗定律,同温同体积条件下压强之比等于物质的量之比。反应完全后压强变为原来的87.5%,即物质的量变为原来的87.5%,反应后气体的物质的量减少,即2+5>4+n,则n<3,故选A。
【典例1】有一真空瓶质量为m1 g,该瓶充入空气后质量
为m2 g。在相同状况下,若改为充入某气体A时,总质量为m3 g。则A的相对分子质量是
A. B.
C. D.
【思路点拨】同温同压下,同容积的容器中所盛气体的体积和物质的量均相等。
【自主解答】选C。设A的相对分子质量是Mr,则根据
n=
【互动探究】若所有的数据都是在标准状况下测定的,则该真空瓶的体积为多少?
提示:V=n·Vm=
【变式训练】同温同压下,已知O2的密度为ρ g·L-1,则Cl2的密度为( )
A. B.
C. D.
【解析】选A。同温同压下,气体的密度之比等于摩尔质量之比,所以 得:
【规律方法】掌握气体摩尔体积这个概念应注意的事项
(1)气体的体积,在一定温度、压强下只与气体的微粒数目有关,而与气体分子的种类无关。所以,讨论气体的摩尔体积时必需在一定条件下讨论才有意义。
(2)气体在不同状况下,气体摩尔体积不同,气体摩尔体积与温度和压强有关。
(3)在温度为0 ℃,压强为101 kPa下,气体的摩尔体积约为22.4 L/mol,也就是标准状况下的气体摩尔体积。
(4)气体摩尔体积仅仅是针对气体(包括单一气体和混合气体)而言。
【典例2】某混合气体各组分的质量分数分别为:O2占32%、N2占28%、CO2占22%、CH4占16%、H2占2%,则此混合气体对氢气的相对密度为
A.60.76 B.30.36 C.22.22 D.11.11
【思路点拨】解答本题可以按如下程序进行:
【自主解答】选D。假设混合气体的质量为100 g,则m(O2)=32 g,m(N2)=28 g,m(CO2)=22 g,m(CH4)=16 g,
m(H2)=2 g,然后求出各气体的物质的量:n(O2)=1 mol,n(N2)=1 mol,n(CO2)=0.5 mol,n(CH4)=1 mol,n(H2)=1 mol,n(总)=4.5 mol,所以
【互动探究】若将题中的“质量分数”改为“物质的量分数”则混合气体对H2的相对密度为多少?
提示: =32×32%+28×28%+44×22%+16×16%+2×2%=
30.36
【规律方法】做有关求平均摩尔质量的选择型计算题时,可以先根据平均值的特点判断平均摩尔质量的范围
若只有1个选项在此范围内,则必为正确答
案,不必再计算;若有多个选项在此范围内,则必须选择适当的公式进行计算。本题中, 1<D<22,只有
D选项符合。
【变式训练】CH4和CO的混合气体对H2的相对密度为10,则该混合气体中CH4和CO的分子数之比为( )
A.1∶2 B.2∶1
C.1∶1 D.3∶2
【解析】选B。混合气体的平均摩尔质量为:
=20 g/mol,设混合气体中CH4的物质的量分数为x,则CO的物质的量分数为(1-x),即16x+28(1-x)=20,解得:
所以CH4和CO的分子数之比为:
【典例】NA代表阿伏加德罗常数。下列有关叙述正确的是
A.标准状况下,22.4 L H2O含有的分子数为NA
B.常温常压下,1.06 g Na2CO3含有的Na+数为0.02NA
C.通常状况下,NA个CO2分子占有的体积为22.4 L
D.常温下16 g O2和14 g N2组成的混合气中,所含分子数大于NA
【易错选项】A
【易错剖析】
(1)易错选项分析
本题易错选A的原因在于忽略了气体摩尔体积的研究对象是气体,而在标准状况下水为液态,此时22.4 L H2O含有的分子数远远大于NA。
(2)其他错误选项分析:
【标准答案】B
1.在下列条件下,两种气体的密度一定相等的是( )
A.同质量不同体积的C2H4和CO
B.不同温度同体积的C2H6和NO
C.同体积、同压强的N2和C2H4
D.同温同压下的CO和N2
【解析】选D。选项A,根据 质量相同体积不同的气
体,密度不同;选项B,在压强不确定的情况下,体积相同的气体,其质量不一定相同,根据 气体的密度不一
定相同;选项C,温度不确定,气体的密度无法确定。根据阿伏加德罗定律,选项D正确。
2.下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气体物质体积的大小,由构成气体的分子的大小决定
B.一定温度和压强下,各种气体物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L
【解析】选B。当温度和压强确定后,气体分子间的距离就确定了,气体体积由分子间距离和分子个数决定,故在一定温度、压强下,气体体积由分子数决定,A选项错误;比较气体的体积,一定要指明状态,在相同状态下(即温度、压强相同的情况下),才可以比较气体体积,这里没有指明相同状态,故无法根据体积来判断所含分子数的多少,C选项错误;气体摩尔体积是单位物质的量的气体所具有的体积,只有在标准状况下,1 mol气体所占体积才约为22.4 L,D选项错误。
3.下列说法正确的是( )
A.标准状况下,1 mol水的体积约是22.4 L
B.1 mol H2所占的体积约是22.4 L
C.标准状况下,6.02×1023个分子所占的体积约是22.4 L
D.标准状况下,28 g氮气和CO的混合气体的体积约是22.4 L
【解析】选D。水在标准状况下为液体,不能用气体摩尔体积计算水的体积,A选项错误;B选项没有指明H2是否处于标准状况下,不能确定其准确的体积;C选项没有指明该分子是否是气体分子,错误。
4.相同状况下,下列气体所占体积最大的是( )
A.64 g SO2 B.16 g O2
C.34 g H2S D.3 g H2
【解析】选D。在相同状况下,气体的体积和物质的量成正比,
所以H2所占体积最大。
5.在标准状况下:①6.72 L CH4气体;②3.01×1023个HCl气体分子;③13.6 g H2S气体;④0.2 mol NH3,下列对这四种气体的关系从大到小的排列是(用上述数字序号表示):
(1)标准状况下四种气体的体积______________。
(2)四种气体的质量_____________。
【解析】n(CH4)= =0.3 mol,m(CH4)=0.3 mol
×16 g/mol=4.8 g,n(HCl)=
m(HCl)=0.5 mol×36.5 g/mol=18.25 g,n(H2S)=
=0.4 mol,m(NH3)=0.2 mol×17 g/mol=3.4 g。
(1)n(HCl)>n(H2S)>n(CH4)>n(NH3),因为在同温同压下,气体的体积比等于物质的量之比,所以V(HCl)>V(H2S)>V(CH4)>V(NH3)。
(2)m(HCl)>m(H2S)>m(CH4)>m(NH3)。
答案:(1)②>③>①>④
(2)②>③>①>④
一、选择题(本题包括5小题,每小题4分,共20分)
1.(双选)下列有关气体摩尔体积的描述中正确的是
( )
A.单位物质的量的气体所占的体积就是气体摩尔体积
B.通常状况(室温、101 kPa)下,气体摩尔体积约为22.4 L/mol
C.标准状况(0 ℃、101 kPa)下,气体摩尔体积约为22.4 L/mol
D.标准状况(0 ℃、101 kPa)下,1 mol H2O的体积是22.4 L
【解析】选A、C。标准状况(0 ℃、101 kPa)下,气体摩尔体积约为22.4 L/mol,通常状况(室温、101 kPa)下,气体摩尔体积大于22.4 L/mol,B错误,标准状况(0 ℃、101 kPa)下,H2O不是气体,不能应用22.4 L/mol来计算体积。
2.(2011·海淀高一检测)在标准状况下,0.5 mol H2的体积是( )
A.0.5 L B.2.0 L C.11.2 L D.22.4 L
【解析】选C。V(H2)=0.5 mol×22.4 L/mol=11.2 L。
3.2 mol O2和2 mol CO2相比较,下列叙述中正确的是
( )
A.分子数相等 B.原子数相等
C.体积相等 D.质量相等
【解析】选A。物质的量相同,分子数相等,均为NA,A正确;原子数分别为4NA和6NA,不相等,B错误;同温同压下,体积相等,C项未指明“同温同压下”,错误;质量分别为64 g和88 g,不相等,D错误。
4.质量为16 g的下列气体,在标准状况下体积约为11.2 L的是( )
A.H2 B.O2
C.CO2 D.CH4
【解析】选B。标准状况下气体的物质的量为11.2 L÷
22.4 L/mol=0.5 mol,则该气体的摩尔质量为16 g÷0.5mol
=32 g/mol,即为氧气。
5.(2011·温州高一检测)某温度下,在体积一定的密闭容器中,通入适量的NH3和Cl2,使其恰好完全反应,反应方程式为:3Cl2+8NH3====N2+6NH4Cl(固体),则反应前后容器中压强比应接近( )
A.11∶1 B.1∶11 C.7∶11 D.11∶7
【解析】选A。在相同的温度和体积下,气体的压强之比等于其物质的量之比,所以p1∶p2=n1∶n2=(8+3)∶1=11∶1。
【方法技巧】阿伏加德罗定律及其推论的应用
(1)定律中的同温同压下,不一定必须在标准状况下,标准状况只是其中的一种特殊情况。
(2)定律只适用于气体,对固体、液体物质不适用。所以在解题时一定要看清物质的状态。
(3)定律中的任何气体,既可以是单一气体,也可以是混合气体。
(4)含有相同数目的分子,即分子的物质的量相同。但原子的数目不一定相同,是否相同具体要看组成分子的原子个数。
二、非选择题(本题包括3小题,共30分)
6.(11分)(1)在标准状况下,有物质①4 g H2,②33.6 L CH4, ③1 mol H2O,④3.01×1023个O2,含分子数最多的是(填序号,下同)________,含原子数最少的是_______,质量最大的是_____,体积最小的是_____;密度由大到小的顺序为:________________。
(2)含有相同氧原子数的CO和CO2 ,其质量比为______;物质的量比为______;碳原子数比为______;原子数比为___。
(3)含有电子数相等的CO和CO2气体在同温同压下的体积比为_________;密度比为_________。
【解析】(1)分子数与物质的量成正比,以上四种物质的物质的量分别为2 mol、1.5 mol、1 mol、0.5 mol,故分子
数最多的为H2;进一步可得所含原子的物质的量分别是:
4 mol、7.5 mol、3 mol、1 mol;同理可得其他答案。
(2)若CO和CO2所含氧原子数相同,则其物质的量之比为
2∶1。(3)若CO和CO2所含电子数相同,则其物质的量之比
为11∶7。
答案:(1)① ④ ② ③ ③④②①
(2)14∶11 2∶1 2∶1 4∶3 (3)11∶7 7∶11
7.(9分)已知实验室在加热条件下制取Cl2的化学方程式
为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将8.7 g
MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加
热,充分反应后,求:
(1)标准状况下生成Cl2的体积为______。
(2)反应的HCl的分子数为___________。
(3)向反应后的溶液中加入足量的AgNO3溶液,可生成白色
沉淀的质量为__________。
△
====
【解析】n(MnO2)= =0.1 mol
n总(HCl)= =2 mol
MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2O
1 mol 4 mol 22.4 L
0.1 mol n(HCl) V(Cl2)
1 mol∶0.1 mol=4 mol∶n(HCl),所以n(HCl)=0.4 mol
1 mol∶0.1 mol=22.4 L∶V(Cl2),所以V(Cl2)=2.24 L,
N(HCl)=0.4 mol×6.02×1023mol-1=2.408×1023个。
△
====
氯元素除了变成氯气外,其余的全部以Cl-形式存在于溶液中,加入足量的AgNO3溶液后全部转化成AgCl沉淀,而且有n(AgCl)=n(Cl-)=n总(HCl)-2n(Cl2)=2 mol-0.1 mol
×2=1.8 mol,m(AgCl)=1.8 mol×143.5 g·mol-1=258.3 g。
答案:(1)2.24 L (2)2.408×1023 (3)258.3 g
8.(10分)(挑战能力)一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,生成XO2和YO2气体。冷却后,在标准状况下,测得生成物的体积是672 mL,则:
(1)反应前O2的体积是__________;
(2)化合物XY2物质的量是_______;
(3)若XY2分子中X、Y两元素的质量比为3∶16,则X元素与Y元素的相对原子质量比为________。
【解析】(1)由反应的化学方程式:XY2(l)+3O2 XO2+
2YO2可知,该反应前后气体体积不变,所以反应前O2的体
积也是672 mL。n(O2)= =0.03 mol。
(2)n(XY2)= n(O2)= ×0.03 mol=0.01 mol。
(3)假设X、Y两元素的相对原子质量分别为x和y,
则: =1∶2
。
答案:(1)672 mL (2)0.01 mol (3)3∶8
点燃
====
【实验设计】已知化学反应:S(s)+O2(g) SO2(g),
加热使硫粉与O2反应,冷却至室温时观察水银柱变化,通过水银柱是否变化确定大试管中气体体积与分子数之间的关系。
【实验用品】大试管、带弯曲玻璃管的橡皮塞、铁架台、酒精灯、研细的硫粉、氧气、水银、红笔。
点燃
====
【实验装置及步骤】
(1)将如图装置装好后固定到铁架台上。待内外气体压强不再变化时,用红笔在玻璃管上标出水银柱液面刻度。
(2)用酒精灯加热试管底部,可以看到研细的硫粉在试管中燃烧,当瓶中氧气消耗完时火焰熄灭。已知该反应是放热反应。
(3)反应结束后,让其自然冷却。
【思考探究】
(1)保证本实验成功的关键是什么?
提示:应保证装置气密性良好。
(2)硫粉在大试管中充分燃烧后,水银柱液面如何变化?
提示:水银柱左管液面上升,右管液面下降。
(3)大试管自然冷却到室温,水银柱液面如何变化?
提示:水银柱液面又回到原来标出的刻度。
(4)硫粉燃烧后,再恢复到室温时,水银柱液面和硫粉燃烧前相同。据此,你能得出什么样的结论?
提示:相同温度和压强下,相同体积的任何气体都具有相同的粒子数。(合理即可)
