11-12版高中化学全程学习方略配套课件:1.2.2常见物质的检验(苏教版必修1)
文档属性
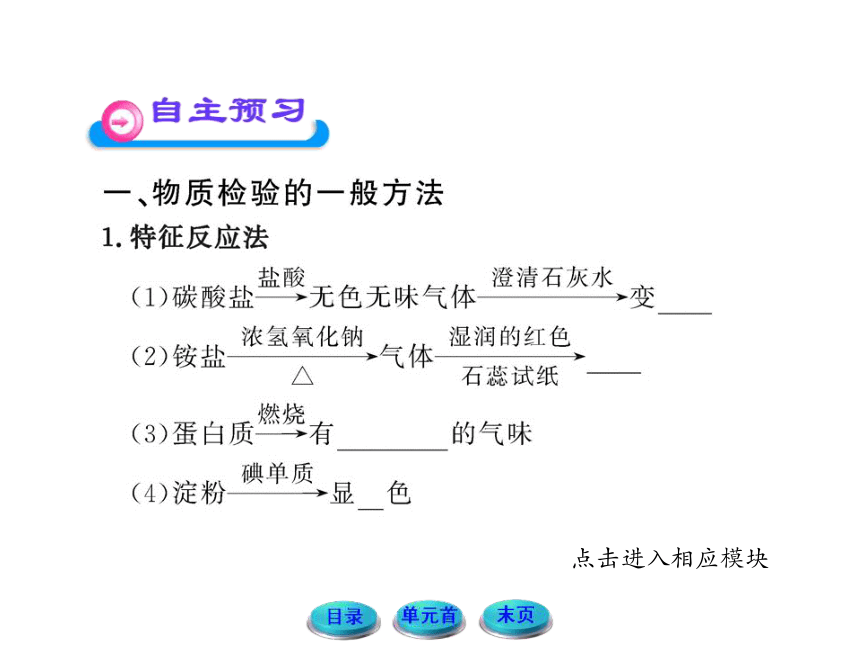
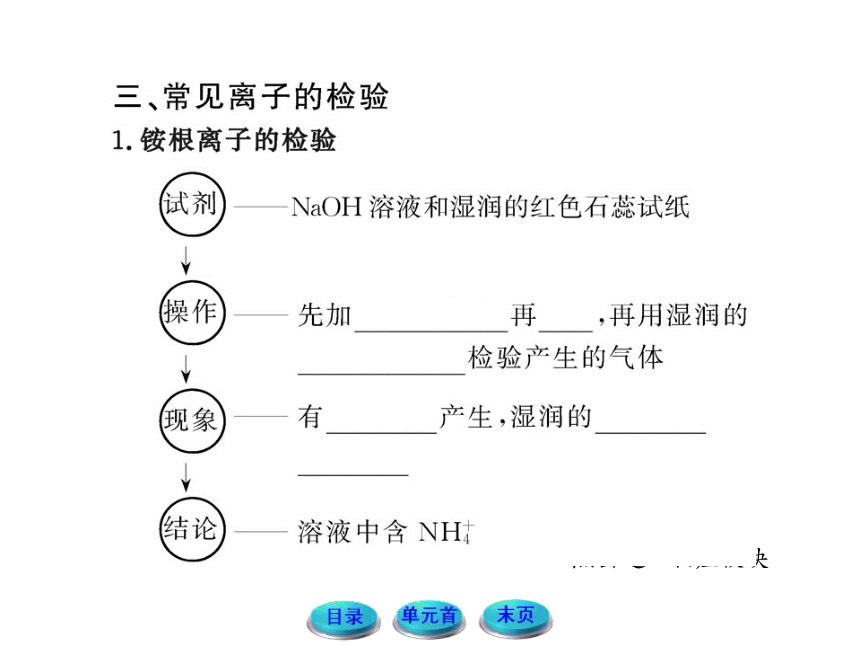
| 名称 | 11-12版高中化学全程学习方略配套课件:1.2.2常见物质的检验(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-10 20:53:44 | ||
图片预览




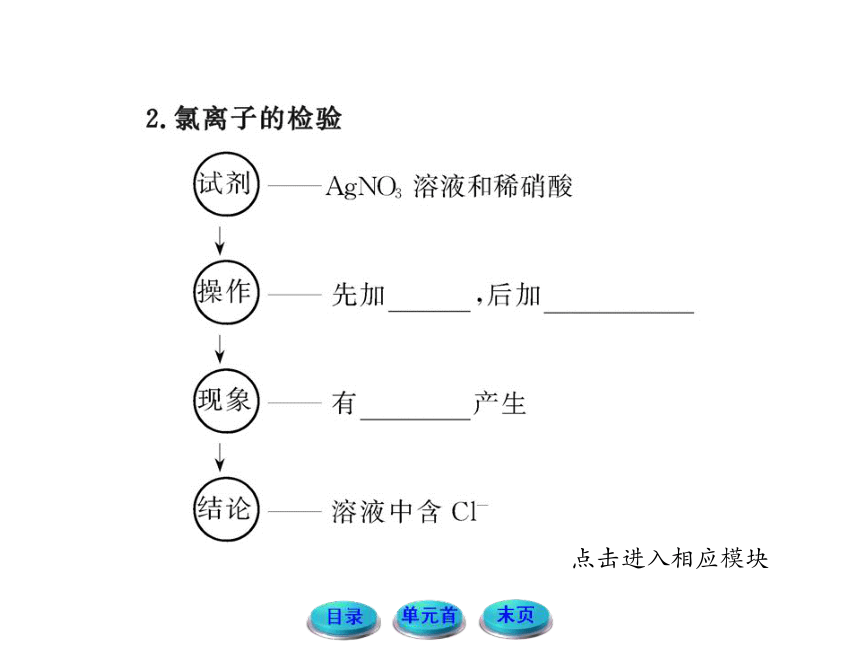
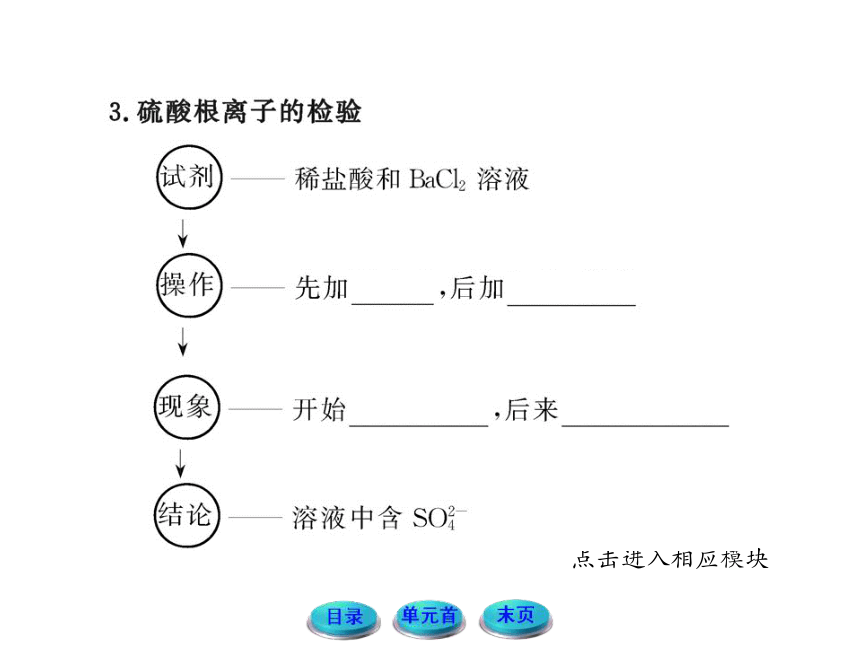


文档简介
(共81张PPT)
【典例】水污染问题是当前全世界关注的焦点问题。我们每一个人都应该自觉地保护水资源,防止污水的随意排放。比如,实验过程中产生的废水不能随意倒入下水道。已知某次化学实验后,回收的废液中可能含有K+、Cu2+、Ag+等离子。
(1)为检验废水中是否含有Ag+,可以选用的试剂是_____。如果溶液中确实存在Ag+,加入试剂后,将观察到的现象是__________。
(2)实验证明,废液中确实存在上述三种离子。为回收Cu、Ag两种金属,实验时可以分别加入过量的_____和____(填物质名称),充分反应后,经过______(填实验操作名称),可得到Cu和Ag。经过上述处理后的废水,进一步处理后即可以排放。
【思路点拨】解答本题要明确以下三点:
【自主解答】(1)利用Ag+和Cl-反应生成不溶于硝酸或盐酸的AgCl白色沉淀来检验Ag+。
(2)回收Cu、Ag两种金属的流程如下:
答案:(1)HCl(或盐酸盐) 有白色沉淀析出
(2)铁粉(或比铜活泼的金属) 稀盐酸 过滤
【互动探究】(1)如何证明废液中含有K+?
提示:用洁净的铂丝蘸取废液,在酒精灯火焰上灼烧,若透过蓝色钴玻璃观察到紫色火焰,则证明废液中含有K+。
(2)若将溶液中的Cu2+和Ag+逐一用沉淀法除去,而且不带入其他阳离子,所加的试剂及其顺序是什么?
提示:沉淀Cu2+可以用OH-,沉淀Ag+可以用Cl-,但是若先加入OH-则会产生AgOH(或Ag2O)和Cu(OH)2两种沉淀,所以应该先加入Cl-再加入OH-,又不能带入其他阳离子,所以应该选择KCl和KOH溶液。
【规律方法】不用任何试剂鉴别多种物质的方法和思路
(1)先依据外观特征,鉴别出其中的一种或几种,然后再利用它去鉴别其余物质。
(2)若均无明显外观特征时,可考虑能否用加热或焰色反应区别开来。
(3)若以上两种方法都不能鉴别时,可考虑用两两混合法来鉴别,记录混合后的反应现象,分析确定。
(4)若被鉴别物质为两种时,可考虑因试剂加入的顺序不同而造成的现象不同来进行鉴别。
【变式训练】(双选)下列各组溶液,不用任何试剂就可以鉴别出来的是(可以加热)( )
A.HCl、AgNO3、Na2CO3、NaOH
B.NH4Cl、AgNO3、CaCl2、HNO3
C.(NH4)2SO4、Na2SO4、NaCl、NH4Cl
D.MgCl2、Na2SO4、NaOH、NH4Cl
【解析】选A、D。对各组溶液,分别采用两两混合法进行区分。A组中HCl遇AgNO3产生白色沉淀,遇Na2CO3则产生气体,与NaOH相遇反应但无现象。D组中NaOH遇MgCl2产生白色沉淀,遇NH4Cl加热则产生有刺激性气味的气体,遇Na2SO4无明显现象。
【典例】用光洁的铂丝蘸取无色溶液,在无色灯焰上灼烧时观察到黄色火焰,则下列有关叙述正确的是
A.该溶液只含有Na+
B.该溶液一定含有Na+,也可能含K+
C.该溶液既含Na+,也含K+
D.该溶液可能含Na+或K+中的一种
【思路点拨】解答本题,要明确以下两点:
【自主解答】选B。因为钾盐中常混有钠离子,在灼烧时产生的黄色火焰能够遮盖钾的紫色火焰,使用蓝色钴玻璃可以将黄光过滤掉,避免钠元素的干扰。
【互动探究】在上题中,若观察到紫色火焰,则答案应是什么?
提示:观察到紫色火焰,则说明一定含钾元素;若含有钠元素,则黄色火焰能够遮盖紫色火焰,不能观察到紫色火焰,所以一定不含钠元素。
【变式训练】北京奥运会开幕式上的焰火“脚印”、“笑脸”、“五环”让奥运更加辉煌、浪漫,这与高中化学中的“焰色反应”知识相关。下列说法中正确的是( )
A.非金属单质燃烧时火焰均为无色
B.NaCl与Na2CO3灼烧时火焰颜色相同
C.焰色反应均应透过蓝色钴玻璃观察
D.所有金属及其化合物灼烧时火焰均有颜色
【解析】选B。某些金属或金属的化合物在火焰上灼烧时会产生焰色反应,某些非金属单质燃烧时也会产生火焰,如氢气燃烧产生淡蓝色火焰,A选项错误;钠元素焰色反应呈黄色,B选项正确;观察钾元素的焰色反应时必须透过蓝色钴玻璃才能观察到紫色火焰,而钠的火焰用肉眼直接观察即可,C选项错误;并不是所有金属及其化合物灼烧时火焰均有颜色,如Pt、Fe、Ni等金属无焰色反应,D选项错误。
【典例】某固体混合物可能含有MgCO3、K2SO4、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”):
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
【错因剖析】
【标准答案】(1)
1.用最简便的方法鉴别硫酸铜、碳酸钠、氧化镁三种白色粉末,应选用的试剂是( )
A.稀盐酸 B.紫色石蕊试液
C.水 D.氢氧化钠溶液
【解析】选C。白色硫酸铜固体遇水会生成蓝色溶液,碳酸钠溶解生成无色溶液,氧化镁不溶于水。
2.珍珠的主要成分是一种钙盐。将其加入稀盐酸中,有气泡产生,生成的气体无气味,而且能使澄清石灰水变浑浊,则珍珠的主要成分是( )
A.CaSO4 B.CaCl2 C.CaCO3 D.Ca(OH)2
【解析】选C。能使澄清石灰水变浑浊的无味气体一定是CO2,所以珍珠的主要成分是一种碳酸盐。
3.某物质灼烧时,焰色反应为黄色,下列判断中正确的是
( )
A.该物质一定是钠的化合物
B.该物质一定含钠元素
C.该物质中不含钾元素
D.该物质一定是金属钠
【解析】选B。焰色反应是元素的性质,不是单质和化合物的性质。
4.某溶液中可能含有SO42-、CO32-、Cl-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是( )
A.H2SO4 B.HCl C.NaOH D.NaNO3
【解析】选B。加入BaCl2溶液,可能产生BaSO4和BaCO3两种白色沉淀,但BaCO3溶于稀盐酸,所以再加入稀盐酸,若仍然有白色沉淀,说明该沉淀一定是BaSO4,原溶液中一定有SO42-存在。
5.已知鸡蛋清溶液是一种胶体,现有三瓶无色溶液:NaCl溶液、Na2SO4溶液、鸡蛋清溶液,请你根据已有的知识鉴别它们。
(1)用_________,若能看到_________,则该无色溶液为鸡蛋清溶液。
(2)取两支干净的试管分别盛余下的两种待测液,分别滴入几滴BaCl2试液,若有__________生成,则该试管盛的是_________溶液,则余下的那种便是__________溶液。
【解析】鉴别胶体可以通过丁达尔效应;BaCl2试液能够和Na2SO4溶液反应生成白色的BaSO4沉淀,而与NaCl溶液不能反应。
答案:(1)聚光手电筒照射在三种待测液上
一条光亮的通路
(2)白色沉淀 Na2SO4 NaCl
6.草木灰是农村常用的钾肥,其主要成分为碳酸钾。某同学要以草木灰为原料提取少量碳酸钾,他设计了如下一些步骤:①将草木灰用适量水浸泡;②加热蒸发结晶;③过滤。
(1)正确的操作顺序应是__________(填编号)。
(2)在步骤③中用到的主要玻璃仪器有_________。
(3)若需检验最后得到的晶体里含有CO32-,还应进行的实验是______________。
【解析】一种固体难溶,另一种固体易溶,从它们的混合物中提取某成分的一般步骤是:取样→溶解→过滤→蒸发结晶,所以:(1)正确的操作顺序应是:①③②;(2)过滤用到的主要玻璃仪器有烧杯、玻璃棒、漏斗;(3)检验最后得到的晶体里含有CO32-的方法是:取少量晶体置于试管中滴加适量稀盐酸,若产生能使澄清石灰水变浑浊的无色无味的气体,则证明晶体中含有CO32-。
答案:(1)①③②
(2)烧杯、玻璃棒、漏斗
(3)取少量晶体置于试管中滴加适量稀盐酸,若产生能使澄清石灰水变浑浊的无色无味的气体,则证明晶体中含有CO32-
一、选择题(本题包括5小题,每小题4分,共20分)
1.2010年11月12日第十六届亚洲运动会在广州开幕时五彩缤纷的焰火给世人留下深刻的印象,这些五彩缤纷的焰火与某些元素的焰色反应有关。下列说法错误的是( )
A.观察K2CO3的焰色应透过红色的玻璃
B.焰色反应实验中常用稀盐酸洗涤铂丝
C.可以用焰色反应来区别NaCl和KCl
D.Na与Na2SO4在灼烧时火焰颜色相同
【解析】选A。观察钾元素的焰色反应,必须透过蓝色的钴玻璃以滤去黄色光,否则不能看到紫色火焰。
2.对于某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,不一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入硝酸银溶液产生白色沉淀,溶液中一定含有Cl-
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
【解析】选A。加稀盐酸产生能使澄清石灰水变浑浊的无色气体的溶液中,不一定有CO32-,也可能有HCO3-;加BaCl2溶液产生白色沉淀,且不溶于盐酸,不一定是BaSO4,也可能是AgCl;加AgNO3溶液产生白色沉淀,不一定是AgCl,也可能是Ag2CO3,加Na2CO3产生能溶于盐酸的白色沉淀,不一定是BaCO3,也可能是CaCO3。B、C、D不正确。
3.(双选)某一无色晶体要鉴定它是否为硫酸铵,下列操作必要的是( )
A.加入NaOH溶液并加热,用红色石蕊试纸检验产生气体的性质
B.加热有无气体放出
C.晶体用蒸馏水溶解,用盐酸酸化,再加入BaCl2观察有无沉淀生成
D.晶体溶解,加入稀盐酸无现象,再加入BaCl2溶液看有无沉淀生成
【解析】选A、D。鉴定某种物质时,可以将其所含的各种元素、离子或原子团都一一检验出来。检验硫酸铵即检验NH4+和SO42-。检验NH4+,可以先将样品溶于水,再加入NaOH溶液加热,若产生能够使湿润的红色石蕊试纸变蓝的气体,则可以证明原样品中有NH4+存在。检验SO42-,可以先将样品溶于水,加入稀盐酸无现象,再加入BaCl2溶液,若产生白色沉淀,则可以证明原样品中有SO42-存在。
4.(2011·宁波高一检测)某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案。经检验装置气密性合格并加入试剂。下列说法中正确的是( )
①鸡蛋壳发生了分解反应
②Ⅰ中发生的现象为鸡蛋壳逐渐溶解,产生大量气泡
③Ⅱ中的澄清石灰水变浑浊
④Ⅲ中紫色石蕊试液变浅红
A.①②③ B.①②④
C.②③④ D.①③④
【解析】选C。鸡蛋壳的主要成分是碳酸钙,加入盐酸后,发生如下复分解反应:CaCO3+2HCl====CaCl2+CO2↑+H2O,现象是鸡蛋壳逐渐溶解,产生大量气泡。产生的CO2气体能够使澄清石灰水变浑浊,由于碳酸的酸性很弱,所以只能够使紫色石蕊试液变成浅红色。
5.限用一种试剂,经过一次性实验就能鉴别Na2CO3、(NH4)2SO4、NH4Cl、KNO3溶液,应选用( )
A.AgNO3溶液 B.NaOH溶液
C.Ba(OH)2溶液 D.盐酸
【解析】选C。此类试题一般要对题目所提供物质的阴、阳离子的鉴别分别分析,然后找出最佳试剂。阴离子检验:CO32-一般考虑使用H+或Ba+或Ca2+等;SO42-一般用Ba2+;Cl-用硝酸酸化的AgNO3溶液,一般不考虑NO3-的检验;阳离子中Na+、K+一般用焰色反应检验,在中学化学中不考虑用化学试剂;NH4+一般用与强碱加热的方法检验。综上所述,最佳试剂应为Ba(OH)2。本题也可以考虑用四个选项逐一试验的方法求解。
二、非选择题(本题包括3小题,共30分)
6.(10分)氢氧化钠溶液中大量存在的分子或离子有_____,其中能使酚酞试液变红的是_____,现欲通过实验证明使酚酞试液变红的的确是此微粒,某同学设计了如下方案:
(1)在第一支试管中加入2 mL蒸馏水,滴入几滴无色酚酞试液,现象是_______。可得出的结论是____________。
(2)在第二支试管中加入2 mL NaCl溶液(pH=7),滴入几滴无色酚酞试液,现象是____,能得出的结论是_________。
(3)在第三支试管中加入2 mL NaOH溶液,滴入几滴无色酚酞试液,现象是_______。可得出的结论是__________。
【解析】NaOH溶液中含有OH-、Na+和H2O分子,其中能使酚酞试液变红的是OH-。
(1)向水中加入酚酞试液,没有明显变化,说明H2O不能使酚酞试液变红;
(2)向NaCl溶液中加入酚酞试液,无明显变化,说明Na+不能使酚酞试液变红;
(3)向NaOH溶液中加入酚酞试液,溶液变红,而Na+不能使酚酞试液变红,只能是OH-使酚酞试液变红。
答案:Na+、OH-、H2O OH-
(1)无明显变化 H2O不能使酚酞试液变红
(2)无明显变化 Na+不能使酚酞试液变红
(3)溶液变红 OH-能使酚酞试液变红
7.(8分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可
溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是
用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做
过的该实验回答下列问题。
(1)如何运用最简方法检验溶液中有无SO42-?__________。
如果有,应该如何除去SO42-?_________________。
(2)在粗盐经过溶解、过滤后的溶液中滴加Na2CO3溶液,直至
不再产生沉淀为止。请问这步操作的目的是__________。
(3)将经过操作(2)后的溶液过滤。这一操作能除掉的杂质有
__________________。
【解析】(1)本题中检验SO42-是否存在,可取适量溶液于一试管中,向其中加入BaCl2溶液,若产生白色沉淀即证明含有SO42-,而除去SO42-可向原溶液中加入过量的BaCl2溶液即可。
(2)加入过量的Na2CO3溶液,目的是除去其中的Ca2+和过量的Ba2+及少量的Mg2+。
答案:(1)加BaCl2溶液,若有白色沉淀则有SO42- 加入过量BaCl2溶液,过滤
(2)除去其中的Ca2+和过量的Ba2+及少量的Mg2+
(3)BaSO4、CaCO3、BaCO3、MgCO3等杂质
【方法技巧】检验SO42-的注意事项
检验SO42-的正确方法是:未知液 无明显现象
产生白色沉淀。加入的试剂及试剂的先后顺序均不得互换,否则,将会有干扰因素,从而无法判断原溶液中是否有SO42- 。例如,未知液 产生白色沉淀 白色沉淀不溶解,此时不能说明原溶液中是否有SO42- ,因为Ag+能造成干扰。
过量盐酸
BaCl2溶液
过量BaCl2溶液
过量盐酸
8.(12分)(挑战能力)现有失去标签的6种无色溶液,分别为盐酸、氯化钡、硝酸银、硫酸钠、碳酸钠、硝酸钾溶液。将上述6种溶液两两反应,现象如下表所示(↓表示产生沉淀,↑表示产生气体),试推断A、B、C、D、E、F各是上述何种溶液(已知Ag2SO4是微溶物,看作沉淀)。
A______,B______,C______,
D______,E______,F______。
【解析】解答此类题目的突破口是分析这6种溶液间两两反应产生现象的多重性。如AgNO3能与除KNO3之外的另4种溶液反应都产生沉淀,产生气体的一定是盐酸和Na2CO3。KNO3与另5种溶液都不能反应生成沉淀。
答案:AgNO3 HCl Na2SO4 KNO3 Na2CO3 BaCl2
某校化学课外活动小组对实验室两瓶失去标签的无色溶液Na2SO4和HCl进行鉴别,经讨论可行的实验方案有多种。请你设计3种实验方案加以鉴别。简要写出操作过程、现象和结论。
【解析】本题具有开放性,可以利用Na2SO4和HCl的性质差异进行鉴别。Na2SO4中含有钠元素,其焰色反应为黄色;Na2SO4能够和BaCl2溶液反应生成不溶于稀硝酸的BaSO4的白色沉淀;盐酸能够使紫色石蕊试液变红,能够和活泼金属反应放出氢气,能够和碳酸盐反应放出二氧化碳气体……,这些性质差异都可以用来鉴别它们。
答案:
【典例】水污染问题是当前全世界关注的焦点问题。我们每一个人都应该自觉地保护水资源,防止污水的随意排放。比如,实验过程中产生的废水不能随意倒入下水道。已知某次化学实验后,回收的废液中可能含有K+、Cu2+、Ag+等离子。
(1)为检验废水中是否含有Ag+,可以选用的试剂是_____。如果溶液中确实存在Ag+,加入试剂后,将观察到的现象是__________。
(2)实验证明,废液中确实存在上述三种离子。为回收Cu、Ag两种金属,实验时可以分别加入过量的_____和____(填物质名称),充分反应后,经过______(填实验操作名称),可得到Cu和Ag。经过上述处理后的废水,进一步处理后即可以排放。
【思路点拨】解答本题要明确以下三点:
【自主解答】(1)利用Ag+和Cl-反应生成不溶于硝酸或盐酸的AgCl白色沉淀来检验Ag+。
(2)回收Cu、Ag两种金属的流程如下:
答案:(1)HCl(或盐酸盐) 有白色沉淀析出
(2)铁粉(或比铜活泼的金属) 稀盐酸 过滤
【互动探究】(1)如何证明废液中含有K+?
提示:用洁净的铂丝蘸取废液,在酒精灯火焰上灼烧,若透过蓝色钴玻璃观察到紫色火焰,则证明废液中含有K+。
(2)若将溶液中的Cu2+和Ag+逐一用沉淀法除去,而且不带入其他阳离子,所加的试剂及其顺序是什么?
提示:沉淀Cu2+可以用OH-,沉淀Ag+可以用Cl-,但是若先加入OH-则会产生AgOH(或Ag2O)和Cu(OH)2两种沉淀,所以应该先加入Cl-再加入OH-,又不能带入其他阳离子,所以应该选择KCl和KOH溶液。
【规律方法】不用任何试剂鉴别多种物质的方法和思路
(1)先依据外观特征,鉴别出其中的一种或几种,然后再利用它去鉴别其余物质。
(2)若均无明显外观特征时,可考虑能否用加热或焰色反应区别开来。
(3)若以上两种方法都不能鉴别时,可考虑用两两混合法来鉴别,记录混合后的反应现象,分析确定。
(4)若被鉴别物质为两种时,可考虑因试剂加入的顺序不同而造成的现象不同来进行鉴别。
【变式训练】(双选)下列各组溶液,不用任何试剂就可以鉴别出来的是(可以加热)( )
A.HCl、AgNO3、Na2CO3、NaOH
B.NH4Cl、AgNO3、CaCl2、HNO3
C.(NH4)2SO4、Na2SO4、NaCl、NH4Cl
D.MgCl2、Na2SO4、NaOH、NH4Cl
【解析】选A、D。对各组溶液,分别采用两两混合法进行区分。A组中HCl遇AgNO3产生白色沉淀,遇Na2CO3则产生气体,与NaOH相遇反应但无现象。D组中NaOH遇MgCl2产生白色沉淀,遇NH4Cl加热则产生有刺激性气味的气体,遇Na2SO4无明显现象。
【典例】用光洁的铂丝蘸取无色溶液,在无色灯焰上灼烧时观察到黄色火焰,则下列有关叙述正确的是
A.该溶液只含有Na+
B.该溶液一定含有Na+,也可能含K+
C.该溶液既含Na+,也含K+
D.该溶液可能含Na+或K+中的一种
【思路点拨】解答本题,要明确以下两点:
【自主解答】选B。因为钾盐中常混有钠离子,在灼烧时产生的黄色火焰能够遮盖钾的紫色火焰,使用蓝色钴玻璃可以将黄光过滤掉,避免钠元素的干扰。
【互动探究】在上题中,若观察到紫色火焰,则答案应是什么?
提示:观察到紫色火焰,则说明一定含钾元素;若含有钠元素,则黄色火焰能够遮盖紫色火焰,不能观察到紫色火焰,所以一定不含钠元素。
【变式训练】北京奥运会开幕式上的焰火“脚印”、“笑脸”、“五环”让奥运更加辉煌、浪漫,这与高中化学中的“焰色反应”知识相关。下列说法中正确的是( )
A.非金属单质燃烧时火焰均为无色
B.NaCl与Na2CO3灼烧时火焰颜色相同
C.焰色反应均应透过蓝色钴玻璃观察
D.所有金属及其化合物灼烧时火焰均有颜色
【解析】选B。某些金属或金属的化合物在火焰上灼烧时会产生焰色反应,某些非金属单质燃烧时也会产生火焰,如氢气燃烧产生淡蓝色火焰,A选项错误;钠元素焰色反应呈黄色,B选项正确;观察钾元素的焰色反应时必须透过蓝色钴玻璃才能观察到紫色火焰,而钠的火焰用肉眼直接观察即可,C选项错误;并不是所有金属及其化合物灼烧时火焰均有颜色,如Pt、Fe、Ni等金属无焰色反应,D选项错误。
【典例】某固体混合物可能含有MgCO3、K2SO4、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”):
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
【错因剖析】
【标准答案】(1)
1.用最简便的方法鉴别硫酸铜、碳酸钠、氧化镁三种白色粉末,应选用的试剂是( )
A.稀盐酸 B.紫色石蕊试液
C.水 D.氢氧化钠溶液
【解析】选C。白色硫酸铜固体遇水会生成蓝色溶液,碳酸钠溶解生成无色溶液,氧化镁不溶于水。
2.珍珠的主要成分是一种钙盐。将其加入稀盐酸中,有气泡产生,生成的气体无气味,而且能使澄清石灰水变浑浊,则珍珠的主要成分是( )
A.CaSO4 B.CaCl2 C.CaCO3 D.Ca(OH)2
【解析】选C。能使澄清石灰水变浑浊的无味气体一定是CO2,所以珍珠的主要成分是一种碳酸盐。
3.某物质灼烧时,焰色反应为黄色,下列判断中正确的是
( )
A.该物质一定是钠的化合物
B.该物质一定含钠元素
C.该物质中不含钾元素
D.该物质一定是金属钠
【解析】选B。焰色反应是元素的性质,不是单质和化合物的性质。
4.某溶液中可能含有SO42-、CO32-、Cl-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是( )
A.H2SO4 B.HCl C.NaOH D.NaNO3
【解析】选B。加入BaCl2溶液,可能产生BaSO4和BaCO3两种白色沉淀,但BaCO3溶于稀盐酸,所以再加入稀盐酸,若仍然有白色沉淀,说明该沉淀一定是BaSO4,原溶液中一定有SO42-存在。
5.已知鸡蛋清溶液是一种胶体,现有三瓶无色溶液:NaCl溶液、Na2SO4溶液、鸡蛋清溶液,请你根据已有的知识鉴别它们。
(1)用_________,若能看到_________,则该无色溶液为鸡蛋清溶液。
(2)取两支干净的试管分别盛余下的两种待测液,分别滴入几滴BaCl2试液,若有__________生成,则该试管盛的是_________溶液,则余下的那种便是__________溶液。
【解析】鉴别胶体可以通过丁达尔效应;BaCl2试液能够和Na2SO4溶液反应生成白色的BaSO4沉淀,而与NaCl溶液不能反应。
答案:(1)聚光手电筒照射在三种待测液上
一条光亮的通路
(2)白色沉淀 Na2SO4 NaCl
6.草木灰是农村常用的钾肥,其主要成分为碳酸钾。某同学要以草木灰为原料提取少量碳酸钾,他设计了如下一些步骤:①将草木灰用适量水浸泡;②加热蒸发结晶;③过滤。
(1)正确的操作顺序应是__________(填编号)。
(2)在步骤③中用到的主要玻璃仪器有_________。
(3)若需检验最后得到的晶体里含有CO32-,还应进行的实验是______________。
【解析】一种固体难溶,另一种固体易溶,从它们的混合物中提取某成分的一般步骤是:取样→溶解→过滤→蒸发结晶,所以:(1)正确的操作顺序应是:①③②;(2)过滤用到的主要玻璃仪器有烧杯、玻璃棒、漏斗;(3)检验最后得到的晶体里含有CO32-的方法是:取少量晶体置于试管中滴加适量稀盐酸,若产生能使澄清石灰水变浑浊的无色无味的气体,则证明晶体中含有CO32-。
答案:(1)①③②
(2)烧杯、玻璃棒、漏斗
(3)取少量晶体置于试管中滴加适量稀盐酸,若产生能使澄清石灰水变浑浊的无色无味的气体,则证明晶体中含有CO32-
一、选择题(本题包括5小题,每小题4分,共20分)
1.2010年11月12日第十六届亚洲运动会在广州开幕时五彩缤纷的焰火给世人留下深刻的印象,这些五彩缤纷的焰火与某些元素的焰色反应有关。下列说法错误的是( )
A.观察K2CO3的焰色应透过红色的玻璃
B.焰色反应实验中常用稀盐酸洗涤铂丝
C.可以用焰色反应来区别NaCl和KCl
D.Na与Na2SO4在灼烧时火焰颜色相同
【解析】选A。观察钾元素的焰色反应,必须透过蓝色的钴玻璃以滤去黄色光,否则不能看到紫色火焰。
2.对于某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,不一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入硝酸银溶液产生白色沉淀,溶液中一定含有Cl-
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
【解析】选A。加稀盐酸产生能使澄清石灰水变浑浊的无色气体的溶液中,不一定有CO32-,也可能有HCO3-;加BaCl2溶液产生白色沉淀,且不溶于盐酸,不一定是BaSO4,也可能是AgCl;加AgNO3溶液产生白色沉淀,不一定是AgCl,也可能是Ag2CO3,加Na2CO3产生能溶于盐酸的白色沉淀,不一定是BaCO3,也可能是CaCO3。B、C、D不正确。
3.(双选)某一无色晶体要鉴定它是否为硫酸铵,下列操作必要的是( )
A.加入NaOH溶液并加热,用红色石蕊试纸检验产生气体的性质
B.加热有无气体放出
C.晶体用蒸馏水溶解,用盐酸酸化,再加入BaCl2观察有无沉淀生成
D.晶体溶解,加入稀盐酸无现象,再加入BaCl2溶液看有无沉淀生成
【解析】选A、D。鉴定某种物质时,可以将其所含的各种元素、离子或原子团都一一检验出来。检验硫酸铵即检验NH4+和SO42-。检验NH4+,可以先将样品溶于水,再加入NaOH溶液加热,若产生能够使湿润的红色石蕊试纸变蓝的气体,则可以证明原样品中有NH4+存在。检验SO42-,可以先将样品溶于水,加入稀盐酸无现象,再加入BaCl2溶液,若产生白色沉淀,则可以证明原样品中有SO42-存在。
4.(2011·宁波高一检测)某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案。经检验装置气密性合格并加入试剂。下列说法中正确的是( )
①鸡蛋壳发生了分解反应
②Ⅰ中发生的现象为鸡蛋壳逐渐溶解,产生大量气泡
③Ⅱ中的澄清石灰水变浑浊
④Ⅲ中紫色石蕊试液变浅红
A.①②③ B.①②④
C.②③④ D.①③④
【解析】选C。鸡蛋壳的主要成分是碳酸钙,加入盐酸后,发生如下复分解反应:CaCO3+2HCl====CaCl2+CO2↑+H2O,现象是鸡蛋壳逐渐溶解,产生大量气泡。产生的CO2气体能够使澄清石灰水变浑浊,由于碳酸的酸性很弱,所以只能够使紫色石蕊试液变成浅红色。
5.限用一种试剂,经过一次性实验就能鉴别Na2CO3、(NH4)2SO4、NH4Cl、KNO3溶液,应选用( )
A.AgNO3溶液 B.NaOH溶液
C.Ba(OH)2溶液 D.盐酸
【解析】选C。此类试题一般要对题目所提供物质的阴、阳离子的鉴别分别分析,然后找出最佳试剂。阴离子检验:CO32-一般考虑使用H+或Ba+或Ca2+等;SO42-一般用Ba2+;Cl-用硝酸酸化的AgNO3溶液,一般不考虑NO3-的检验;阳离子中Na+、K+一般用焰色反应检验,在中学化学中不考虑用化学试剂;NH4+一般用与强碱加热的方法检验。综上所述,最佳试剂应为Ba(OH)2。本题也可以考虑用四个选项逐一试验的方法求解。
二、非选择题(本题包括3小题,共30分)
6.(10分)氢氧化钠溶液中大量存在的分子或离子有_____,其中能使酚酞试液变红的是_____,现欲通过实验证明使酚酞试液变红的的确是此微粒,某同学设计了如下方案:
(1)在第一支试管中加入2 mL蒸馏水,滴入几滴无色酚酞试液,现象是_______。可得出的结论是____________。
(2)在第二支试管中加入2 mL NaCl溶液(pH=7),滴入几滴无色酚酞试液,现象是____,能得出的结论是_________。
(3)在第三支试管中加入2 mL NaOH溶液,滴入几滴无色酚酞试液,现象是_______。可得出的结论是__________。
【解析】NaOH溶液中含有OH-、Na+和H2O分子,其中能使酚酞试液变红的是OH-。
(1)向水中加入酚酞试液,没有明显变化,说明H2O不能使酚酞试液变红;
(2)向NaCl溶液中加入酚酞试液,无明显变化,说明Na+不能使酚酞试液变红;
(3)向NaOH溶液中加入酚酞试液,溶液变红,而Na+不能使酚酞试液变红,只能是OH-使酚酞试液变红。
答案:Na+、OH-、H2O OH-
(1)无明显变化 H2O不能使酚酞试液变红
(2)无明显变化 Na+不能使酚酞试液变红
(3)溶液变红 OH-能使酚酞试液变红
7.(8分)粗食盐中除含有钙离子、镁离子、硫酸根离子等可
溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是
用粗食盐提纯而得到的。通过教材中“粗盐的提纯”及你做
过的该实验回答下列问题。
(1)如何运用最简方法检验溶液中有无SO42-?__________。
如果有,应该如何除去SO42-?_________________。
(2)在粗盐经过溶解、过滤后的溶液中滴加Na2CO3溶液,直至
不再产生沉淀为止。请问这步操作的目的是__________。
(3)将经过操作(2)后的溶液过滤。这一操作能除掉的杂质有
__________________。
【解析】(1)本题中检验SO42-是否存在,可取适量溶液于一试管中,向其中加入BaCl2溶液,若产生白色沉淀即证明含有SO42-,而除去SO42-可向原溶液中加入过量的BaCl2溶液即可。
(2)加入过量的Na2CO3溶液,目的是除去其中的Ca2+和过量的Ba2+及少量的Mg2+。
答案:(1)加BaCl2溶液,若有白色沉淀则有SO42- 加入过量BaCl2溶液,过滤
(2)除去其中的Ca2+和过量的Ba2+及少量的Mg2+
(3)BaSO4、CaCO3、BaCO3、MgCO3等杂质
【方法技巧】检验SO42-的注意事项
检验SO42-的正确方法是:未知液 无明显现象
产生白色沉淀。加入的试剂及试剂的先后顺序均不得互换,否则,将会有干扰因素,从而无法判断原溶液中是否有SO42- 。例如,未知液 产生白色沉淀 白色沉淀不溶解,此时不能说明原溶液中是否有SO42- ,因为Ag+能造成干扰。
过量盐酸
BaCl2溶液
过量BaCl2溶液
过量盐酸
8.(12分)(挑战能力)现有失去标签的6种无色溶液,分别为盐酸、氯化钡、硝酸银、硫酸钠、碳酸钠、硝酸钾溶液。将上述6种溶液两两反应,现象如下表所示(↓表示产生沉淀,↑表示产生气体),试推断A、B、C、D、E、F各是上述何种溶液(已知Ag2SO4是微溶物,看作沉淀)。
A______,B______,C______,
D______,E______,F______。
【解析】解答此类题目的突破口是分析这6种溶液间两两反应产生现象的多重性。如AgNO3能与除KNO3之外的另4种溶液反应都产生沉淀,产生气体的一定是盐酸和Na2CO3。KNO3与另5种溶液都不能反应生成沉淀。
答案:AgNO3 HCl Na2SO4 KNO3 Na2CO3 BaCl2
某校化学课外活动小组对实验室两瓶失去标签的无色溶液Na2SO4和HCl进行鉴别,经讨论可行的实验方案有多种。请你设计3种实验方案加以鉴别。简要写出操作过程、现象和结论。
【解析】本题具有开放性,可以利用Na2SO4和HCl的性质差异进行鉴别。Na2SO4中含有钠元素,其焰色反应为黄色;Na2SO4能够和BaCl2溶液反应生成不溶于稀硝酸的BaSO4的白色沉淀;盐酸能够使紫色石蕊试液变红,能够和活泼金属反应放出氢气,能够和碳酸盐反应放出二氧化碳气体……,这些性质差异都可以用来鉴别它们。
答案:
