11-12版高中化学全程学习方略配套课件:2.1.2氧化还原反应(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:2.1.2氧化还原反应(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-11 08:26:08 | ||
图片预览










文档简介
(共111张PPT)
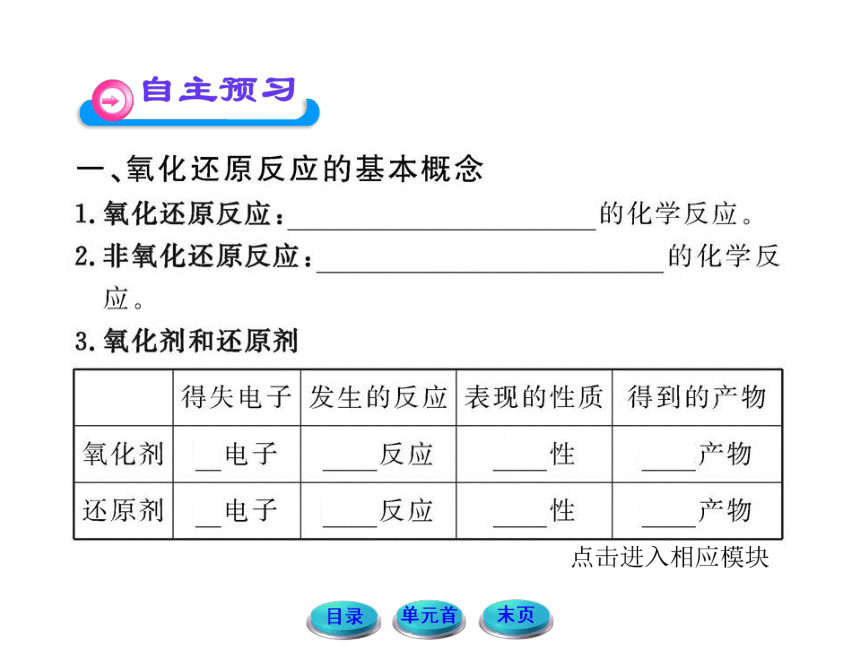
【典例1】金属铜和浓硝酸可发生如下反应:
Cu+4HNO3====Cu(NO3)2+2 +2H2O
(1)方框中的化学式是________。
(2)用双线桥标出电子转移的方向和数目。
【思路点拨】解答本题要注意以下三点:
【自主解答】根据“原子个数和种类不变”,判断出(1)中为NO2气体;反应中铜的化合价从0价升到+2价,氮元素从+5价降到+4价。
答案:(1)NO2
【互动探究】(1)用单线桥标出上述反应的电子转移方向和数目。
(2)反应中的HNO3表现了什么性质?
提示:(1)Cu+4HNO3=====Cu(NO3)2+2NO2↑+2H2O
(2)HNO3表现了酸性和氧化性两个性质。
【变式训练】火药是中国的“四大发明”之一。黑火药在发生爆炸时,可以发生如下反应:
2KNO3+3C+S=====K2S+N2↑+3CO2↑
(1)标出其电子转移的数目和方向________。
(2)被氧化的元素为______,氧化剂为_______,氧化产物为______。
【解析】解该题的关键是分析各元素的化合价及其变化。
根据化合价变化或得失电子情况判断各概念。
答案:(1)
(2)C KNO3、S CO2
【典例2】根据下列反应判断有关物质还原性由强到弱的顺序正确的是
①H2SO3+I2+H2O====2HI+H2SO4
②2FeCl3+2HI====2FeCl2+2HCl+I2
③3FeCl2+4HNO3=====2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO
B.I->H2SO3>Fe2+>NO
C.Fe2+>I->H2SO3>NO
D.NO>Fe2+>H2SO3>I-
【思路点拨】解答本题可以按照如下步骤进行:
【自主解答】选A。根据题中三个反应可依次得还原性强弱的如下结论:①H2SO3>HI,②HI>FeCl2,③FeCl2>NO,综合分析得答案为A。
【互动探究】利用题中得出的还原性强弱的结论,判断反应2FeCl2+H2SO4+2HCl====2FeCl3+H2SO3+H2O能否发生?
提示:不能。若该反应能够发生,则可得,还原性:Fe2+>H2SO3,与题中所给结论矛盾,所以该反应不能发生。
【规律方法】判断氧化还原反应能否发生的方法
判断氧化还原反应能否发生是比较氧化性和还原性强弱的一种变式题型,其处理的方法是假设该反应能够发生,分析出其中的氧化剂、还原剂、氧化产物、还原产物,依据“还原剂的还原性>还原产物的还原性,氧化剂的氧化性>氧化产物的氧化性”,比较其氧化性或还原性的强弱,然后再与实际的强弱顺序相比较,如果一致则能够发生,如果不一致则不能发生。
【变式训练】下列离子,哪种是最强的氧化剂( )
A.Ag+ B.Mg2+
C.H+ D.Cu2+
【解析】选A。金属单质的还原性越强,相应离子的氧化性就越弱,因为还原性:Mg>H2>Cu>Ag,所以氧化性:Ag+>Cu2+>H+>Mg2+。
【典例3】溶液中氧化剂XO3-的含量有1.5×10-2 mol,与300 mL 0.1 mol/L亚硫酸钠(Na2SO3)溶液恰好反应完全,已知Na2SO3被氧化为Na2SO4,则还原产物中元素X的价态是
A.+2 B.-2 C.+1 D.0
【思路点拨】解答本题注意两个方面:
【自主解答】选C。n(Na2SO3)=0.3 L×0.1 mol·L-1=
0.03 mol,Na2SO3被氧化为Na2SO4,S失电子总数为[+6-(+4)]×0.03 mol;设X被还原后的价态为y,则XO3-得电子总数为(+5-y)×1.5×10-2 mol,由得电子总数等于失电子总数得:(6-4)×0.03=(5-y)×1.5×10-2,y=+1。
【互动探究】将题中的“Na2SO3改为Na2S2O3(其中S元素的化合价为+2),XO3-的物质的量改为0.04 mol”,结果又如何?
提示:Na2S2O3失电子的物质的量是:2×0.03×(6-2)=
0.24 mol,XO4-得电子的物质的量是:0.04×(5-y),由得失电子守恒,解出y=-1。
【规律方法】 “守恒法”的应用
氧化还原反应中,氧化反应和还原反应同时发生,反应前后元素原子个数守恒,元素原子得失电子总数相等(或化合价升降总数相等)。利用得失电子守恒进行计算,可不写化学方程式,特别对于一些较难书写化学方程式的计算,能更方便解题。
【变式训练】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的物质的量之比为3∶1,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的原子个数之比为( )
A.1∶4 B.1∶2 C.4∶1 D.2∶1
【解析】选D。Cl2与NaOH反应时,Cl2被氧化为ClO-和ClO3-,被还原为Cl-,根据化合价升高总数等于降低总数,设ClO-、ClO3-、Cl-的物质的量分别为3 mol、1 mol、x,3 mol×1+
1 mol×5=x·1,x=8 mol,被还原的氯元素与被氧化的氯元素的原子个数比为2∶1。
【典例】(2010·全国卷Ⅱ)若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为
A.1∶4 B.1∶2 C.2∶1 D.4∶1
【思路点拨】解答本题要注意两个守恒:
【自主解答】选B。根据(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,可知发生化合价改变的元素为N和S,N元素从-3价到0价,生成一个N2,化合价总共升高6价;S元素从+6价到+4价,生成一个SO2化合价降低2价,根据化合价升降或电子转移守恒,生成一个N2的同时应生成3个SO2,由此可知需要3个(NH4)2SO4,故化合价发生变化和未发生变化的N原子数之比为2∶4=1∶2,即B正确。
【变式训练】根据S2O82-+2e- 2SO42-、Mn2++4H2O MnO4-+8H++5e-,推测氧化1.5 mol Mn2+需S2O82-的物质的量为( )
A.1.5 mol B.3.75 mol
C.3.25 mol D.3.125 mol
【解析】选B。根据氧化还原反应得失电子数相等,可以得如下关系式:5S2O82-~10e-~2Mn2+,所以n(S2O82-)=
n(Mn2+)= ×1.5 mol=3.75 mol。
【规律方法】氧化还原反应典型的计算有:
求氧化剂与还原剂的物质的量或质量之比;计算参加反应的氧化剂或还原剂的量;确定反应前后某一元素价态的变化;氧化还原反应方程式的配平等。计算的关键是依据氧化剂得电子数等于还原剂失电子数,列出守恒关系求解。
【典例1】下列有关氧化还原反应的叙述中正确的是
A.反应中当有一种元素被氧化时,一定有另一种元素被还原
B.反应中不一定所有元素的化合价都发生变化
C.某元素从游离态变为化合态,该元素一定被氧化
D.氧化还原反应中的反应物,不是氧化剂,就一定是还原剂
【易错选项】A
【易错剖析】
(1)易错选项分析
本题易错选A的原因在于不明确一个氧化还原反应中化合价升降的元素可能是同一种,也可能是两种或多种。
(2)其他错误选项分析:
【标准答案】B
【典例2】有关反应6HCl(浓)+KClO3====KCl+3Cl2↑+3H2O的叙述正确的是
A.KClO3作氧化剂,HCl作还原剂
B.当有6 mol HCl发生反应时,转移了6 mol电子
C.HCl只作还原剂
D.Cl2的氧化性大于KClO3
【易错选项】B
【易错剖析】
(1)易错选项分析
本题易错选B的原因在于不明确氧化还原反应的规律,误认为6 mol HCl全部被氧化成氯气,而事实只有5 mol HCl被氧化,转移了5 mol电子。
(2)其他错误选项分析:
【标准答案】A
1.如图为反应Fe+CuSO4====Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示( )
A.Fe、S B.Cu、S
C.Fe、O D.Fe、Cu
【解析】选D。在氧化还原反应中,还原剂失电子,化合价升高,氧化剂得电子,化合价降低,在反应Fe+CuSO4
=====Cu+FeSO4中,Fe是还原剂,CuSO4是氧化剂。
2.盐酸可能具有的化学性质是( )
A.只有还原性
B.只有酸性
C.只有氧化性
D.有酸性、氧化性、还原性
【解析】选D。盐酸是三大强酸之一,当然有酸性。物质的氧化性、还原性与分子中各元素原子的化合价有关。HCl中H元素处于最高价,只有氧化性,Cl元素处于最低价,只有还原性,所以HCl既有氧化性又有还原性。
3.下列反应中气体作氧化剂的是( )
A.SO3通入水中:SO3+H2O====H2SO4
B.Cl2通入FeCl2溶液中:Cl2+2FeCl2====2FeCl3
C.HCl通入NaOH溶液中:HCl+NaOH====NaCl+H2O
D.CO2通入NaOH溶液中:CO2+2NaOH====Na2CO3+H2O
【解析】选B。A、C、D三个选项的反应都不是氧化还原反应,B选项中氯元素的化合价由0价降低到-1价,被还原,所以Cl2作氧化剂。
4.月球尘埃中的FeTiO3可与H2发生如下反应:FeTiO3+H2
Fe+TiO2+H2O,该反应中一定被还原的元素是( )
A.Fe B.Ti C.H D.O
【解析】选A。被还原的元素化合价降低,在反应FeTiO3+
H2 Fe+TiO2+H2O中,铁元素的化合价由+2价变成0价,氢元素的化合价由0价变为+1价,Ti元素反应前后化合价都是+4价,没有发生变化。
△
====
△
====
5.检验市售食用碘盐是否含碘,可向食盐中加入稀硫酸,再加入碘化钾淀粉溶液,若出现蓝色,则说明该食盐中含有碘。检验时发生的反应如下:
5KI+KIO3+3H2SO4====3K2SO4+3I2+3H2O
(1)该反应中,氧化剂是(填化学式,下同)________,氧化产物是_____,还原产物是_________。
(2)在该反应中,H2SO4表现的性质是_________。
(3)试用单线桥法在上述方程式中标出电子转移的方向和数目。
【解析】(1)在该反应中KIO3中碘元素的化合价由+5价变成I2中的0价,化合价降低,做氧化剂,发生还原反应,得到还原产物,所以KIO3是氧化剂,I2是还原产物;KI中碘元素的化合价由-1价变成I2中的0价,化合价升高,做还原剂,发生氧化反应,得到氧化产物,所以KI是还原剂,I2是氧化产物。
(2)反应中H2SO4中各元素的化合价都没有发生变化,最终变成盐类物质K2SO4,所以只表现酸性。
(3)用单线桥法表示电子转移的方向和数目,箭头由失电子的元素指向得电子的元素,即由KI中的I指向KIO3中的I,转移电子数为5e-。
答案:(1)KIO3 I2 I2 (2)酸性
一、选择题(本题包括5小题,每小题4分,共20分)
1.氧化还原反应的实质是( )
A.氧元素的得失
B.化合价的升降
C.电子的转移
D.分子中原子的重新组合
【解析】选C。氧化还原反应的本质就是电子转移。
2.下列说法正确的是( )
A.在氧化还原反应中,氧化剂经化学变化变成还原剂
B.在氧化还原反应中,氧化剂被氧化,还原剂被还原
C.在化学反应中,能把其他物质氧化的物质是氧化剂
D.在氧化还原反应中,还原剂生成的氧化产物一定只具有氧化性
【解析】选C。氧化剂、还原剂都是反应物,氧化剂经化学变化变成还原产物,故A项错误;氧化剂得电子被还原,还原剂失电子被氧化,故B项错误;氧化剂能把其他物质氧化,还原剂能把其他物质还原,故C项正确;还原剂、还原产物都具有还原性,氧化剂、氧化产物都具有氧化性,但氧化产物也可能具有还原性,故D项错误。
3.(2011·常德高一检测)溴的氧化性介于氯和碘的氧化性之间,根据这一性质你认为:将下列哪种试剂加入到含有Br-的溶液中,可以将Br-氧化为Br2( )
A.I2 B.I- C.Cl2 D.Cl-
【解析】选C。根据题意可知,氧化性Cl2>Br2>I2,则还原性I->Br->Cl-,只有氯气能够将Br-氧化为Br2。
4.在下列反应过程中,有3 mol电子转移的是( )
A.1 mol钠与水反应
B.27 g铝与足量盐酸反应
C.22.4 L氧气(标准状况)与足量镁反应
D.1.5 mol CO2与足量水反应
【解析】选B。27 g铝和标准状况下22.4 L氧气的物质的量都是1 mol。先标出每个反应所转移电子数目,然后找出电子数和所给物质之间的关系,即可计算出给定量的物质所转移电子的物质的量。
5.(2011·连云港高一检测)关于2KMnO4+16HCl====2KCl
+2MnCl2+5Cl2↑+8 的反应,下列说法正确的是( )
A.氧化剂与还原剂物质的量之比为1∶8
B. 处对应的物质为H2O
C.Cl2是还原产物
D.若1 mol KMnO4参加反应,转移的电子的物质的量是7mol
【解析】选B。在该反应中KMnO4作氧化剂,16个HCl中有10个被氧化成Cl2,作还原剂,剩余8个起酸性作用,所以氧化剂与还原剂物质的量之比为1∶5。该反应共转移10 mol电子,所以若1 mol KMnO4参加反应,转移的电子的物质的量是5 mol。
二、非选择题(本题包括3小题,共30分)
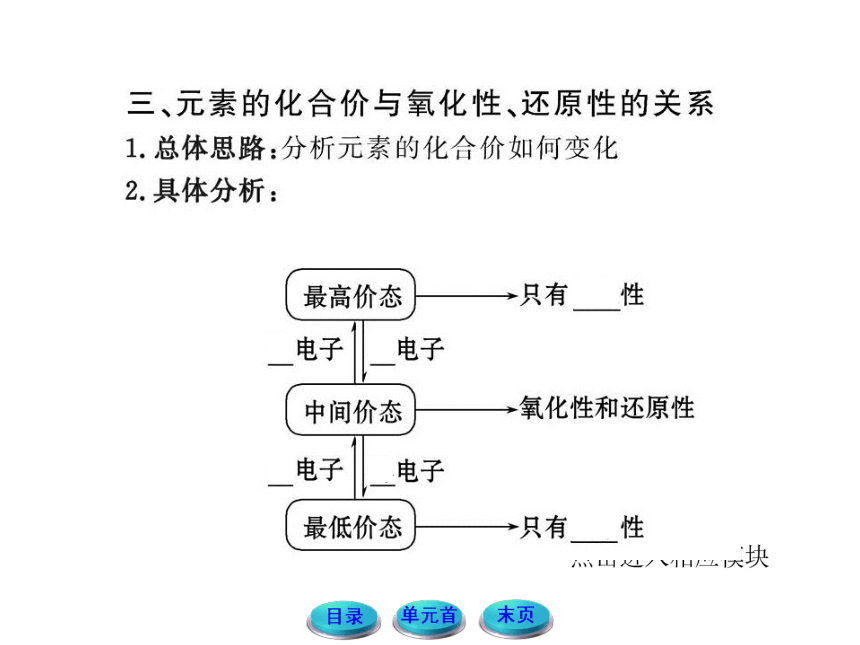
6.(8分)已知:氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,试据此判断下列四种化合物:
①NO ②N2O4 ③HNO3 ④NH3中:
(1)氮元素只能作还原剂的是_______(填序号,下同)。
(2)可能是HNO2还原产物的是________。
(3)不可能是N2的氧化产物的是________。
(4)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式________。
【解析】(1)NH3中氮元素的化合价为-3价,为氮元素的最低价态,只有还原性,只能作还原剂;(2)HNO2中氮元素的化合价为+3价,为氮元素的中间价态,既有氧化性,又有还原性。其发生还原反应时,化合价要降低,所以NO和NH3都可能是HNO2的还原产物;(3)N2中氮元素的化合价为0价,为氮元素的中间价态,既有氧化性,又有还原性。其发生氧化反应时,化合价要升高,所以氮元素化合价比0价低的NH3不可能是N2的氧化产物;(4)氧化铜具有氧化性,能够把氨气氧化成N2,自身被还原成Cu,同时H和O结合生成水,据此可以写出该反应的化学方程式。
答案:(1)④ (2)①④ (3)④
(4)2NH3+3CuO N2+3Cu+3H2O
△
====
7.(12分)(1)图A为“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO
Cu+H2O所属的区域。
△
====
(2)“四种基本反应类型与氧化还原反应的关系”也可用B图表达。其中Ⅰ为化合反应,则Ⅱ为______反应。写出有水生成的符合反应类型Ⅲ的一个化学方程式________。写出有水参加的符合反应类型Ⅳ的一个化学方程式_______,其中水为_______剂。
【解析】四种基本反应类型和氧化还原反应的关系如下:①有单质参加的化合反应一定是氧化还原反应;②有单质生成的分解反应一定是氧化还原反应;③置换反应一定是氧化还原反应;④复分解反应一定不是氧化还原反应。(1)H2+CuO Cu+H2O属于置换反应,一定是氧化还原反应,所以其应在A图中被大环完全包围的小环区域内。(2)B图中,Ⅰ和Ⅱ有一部分属于氧化还原反应,有一部分属于非氧化还原反应,若I为化合反应,则Ⅱ一定为分解反应。Ⅲ全部是非氧化还原反应,即复分解反应;Ⅳ全部是氧化还原反应,即置换反应。
△
====
答案:(1)
(2)分解NaOH+HCl====NaCl+H2O(合理即可)
C+H2O(g) CO+H2 氧化(其他合理答案也可)
高温
====
8.(10分)(挑战能力)在反应2KMnO4+16HCl(浓)====2MnCl2
+2KCl+5Cl2↑+8H2O中,
(1)氧化剂是_______,氧化产物是_______(填化学式)。
(2)若生成71 g Cl2,则消耗的HCl是________mol,
被氧化的HCl是_____mol,转移的电子的物质的量是_____。
【解析】根据反应中元素化合价的变化,判断氧化剂和还原剂及相应产物;化合价升高的反应物作还原剂,还原剂被氧化对应氧化产物,化合价降低的反应物作氧化剂,氧化剂被还原对应还原产物。
在反应中元素化合价升降情况为: ,
故氧化剂为KMnO4,氧化产物为Cl2,反应中生成71 g Cl2(即1 mol)时,消耗HCl为
1 mol· =3.2 mol,其中被氧化的HCl为1 mol×2=2 mol,转移电子为1 mol×2=2 mol。
答案:(1)KMnO4 Cl2
(2)3.2 2 2 mol
【方法技巧】氧化还原反应方程式的书写技巧
近几年高考试题中关于氧化还原反应方程式的书写主要以填空题的形式出现,具体形式有:
(1)根据列出的反应体系中所有物质,写出反应方程式,这种题型较简单;
(2)根据题给信息书写氧化还原反应方程式。题给信息一般包括氧化剂、还原剂、氧化产物、还原产物以及反应介质等。
书写步骤为:
①先列出氧化剂、还原剂、氧化产物、还原产物。如果氧化产物、还原产物不全给出,可通过化合价升降关系判断得出。
②根据介质种类添加其他反应物、生成物。
③用化合价升降法配平方程式。
可以通过实验探究有关物质氧化性和还原性的强弱。
Ⅰ.探究有关物质氧化性的强弱。
已知Bi +3价较稳定,NaBiO3溶液为无色,Bi3+无色;Mn2+无色,MnO4-呈紫红色;Pb +2价较稳定,PbSO4是一种白色沉淀。取一定量的Mn(NO3)2溶液依次进行实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体。
请回答下列问题:
(1)推测实验④中的现象为___________。
(2)分析上述现象,KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________。
Ⅱ.探究镁、铝、铜金属单质还原性的强弱。
现有镁条、铝片、铝粉、铜片、氧化镁、氧化铝、氧化铁、盐酸、硝酸银溶液、硫酸铜溶液及其他常用的实验用品和仪器,根据现有药品,请你设计简单实验验证镁、铝、铜金属单质的还原性强弱。
依据你设计的实验方案,回答下列问题:
(3)实验原理:用化学方程式表示实验中的反应:
①__________________________________;
②__________________________________;
③__________________________________。
(4)实验现象:能够充分说明镁、铝、铜金属单质还原性强弱的明显现象是_______________________。
【解析】Ⅰ.①向Mn(NO3)2溶液中滴加NaBiO3溶液时,溶液变为紫红色,说明有MnO4-生成,即Mn2+被氧化成MnO4-,NaBiO3被还原成Bi3+,所以氧化性NaBiO3>KMnO4;
②向所得到的KMnO4溶液中滴加H2O2,紫红色褪去,说明MnO4-被还原成Mn2+,H2O2被氧化成O2,所以氧化性KMnO4>H2O2;
③向含Mn2+的溶液中加入PbO2固体,固体溶解,溶液又变为紫红色,说明Mn2+又被氧化成MnO4-,PbO2被还原成Pb2+,所以氧化性PbO2>KMnO4;
④MnO4-可以将SO2氧化成SO42-,SO42-和Pb2+结合成白色的PbSO4沉淀。
Ⅱ.镁、铝是活泼金属,能够和盐酸反应放出氢气,但是更活泼的镁反应更为剧烈;铜是不活泼金属,不能和盐酸反应放出氢气,但是可以和硝酸银溶液发生置换反应生成更不活泼的单质银。
答案:(1)紫红色褪去,生成白色沉淀
(2)PbO2>KMnO4>H2O2
(3)Mg+2HCl=====MgCl2+H2↑
2Al+6HCl2====2AlCl3+3H2↑
Cu+2AgNO3=====Cu(NO3)2+2Ag
(4)镁条、铝片分别与盐酸反应时,镁条与盐酸反应剧烈;铜和硝酸银溶液反应时,铜片表面有银白色物质析出
【典例1】金属铜和浓硝酸可发生如下反应:
Cu+4HNO3====Cu(NO3)2+2 +2H2O
(1)方框中的化学式是________。
(2)用双线桥标出电子转移的方向和数目。
【思路点拨】解答本题要注意以下三点:
【自主解答】根据“原子个数和种类不变”,判断出(1)中为NO2气体;反应中铜的化合价从0价升到+2价,氮元素从+5价降到+4价。
答案:(1)NO2
【互动探究】(1)用单线桥标出上述反应的电子转移方向和数目。
(2)反应中的HNO3表现了什么性质?
提示:(1)Cu+4HNO3=====Cu(NO3)2+2NO2↑+2H2O
(2)HNO3表现了酸性和氧化性两个性质。
【变式训练】火药是中国的“四大发明”之一。黑火药在发生爆炸时,可以发生如下反应:
2KNO3+3C+S=====K2S+N2↑+3CO2↑
(1)标出其电子转移的数目和方向________。
(2)被氧化的元素为______,氧化剂为_______,氧化产物为______。
【解析】解该题的关键是分析各元素的化合价及其变化。
根据化合价变化或得失电子情况判断各概念。
答案:(1)
(2)C KNO3、S CO2
【典例2】根据下列反应判断有关物质还原性由强到弱的顺序正确的是
①H2SO3+I2+H2O====2HI+H2SO4
②2FeCl3+2HI====2FeCl2+2HCl+I2
③3FeCl2+4HNO3=====2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO
B.I->H2SO3>Fe2+>NO
C.Fe2+>I->H2SO3>NO
D.NO>Fe2+>H2SO3>I-
【思路点拨】解答本题可以按照如下步骤进行:
【自主解答】选A。根据题中三个反应可依次得还原性强弱的如下结论:①H2SO3>HI,②HI>FeCl2,③FeCl2>NO,综合分析得答案为A。
【互动探究】利用题中得出的还原性强弱的结论,判断反应2FeCl2+H2SO4+2HCl====2FeCl3+H2SO3+H2O能否发生?
提示:不能。若该反应能够发生,则可得,还原性:Fe2+>H2SO3,与题中所给结论矛盾,所以该反应不能发生。
【规律方法】判断氧化还原反应能否发生的方法
判断氧化还原反应能否发生是比较氧化性和还原性强弱的一种变式题型,其处理的方法是假设该反应能够发生,分析出其中的氧化剂、还原剂、氧化产物、还原产物,依据“还原剂的还原性>还原产物的还原性,氧化剂的氧化性>氧化产物的氧化性”,比较其氧化性或还原性的强弱,然后再与实际的强弱顺序相比较,如果一致则能够发生,如果不一致则不能发生。
【变式训练】下列离子,哪种是最强的氧化剂( )
A.Ag+ B.Mg2+
C.H+ D.Cu2+
【解析】选A。金属单质的还原性越强,相应离子的氧化性就越弱,因为还原性:Mg>H2>Cu>Ag,所以氧化性:Ag+>Cu2+>H+>Mg2+。
【典例3】溶液中氧化剂XO3-的含量有1.5×10-2 mol,与300 mL 0.1 mol/L亚硫酸钠(Na2SO3)溶液恰好反应完全,已知Na2SO3被氧化为Na2SO4,则还原产物中元素X的价态是
A.+2 B.-2 C.+1 D.0
【思路点拨】解答本题注意两个方面:
【自主解答】选C。n(Na2SO3)=0.3 L×0.1 mol·L-1=
0.03 mol,Na2SO3被氧化为Na2SO4,S失电子总数为[+6-(+4)]×0.03 mol;设X被还原后的价态为y,则XO3-得电子总数为(+5-y)×1.5×10-2 mol,由得电子总数等于失电子总数得:(6-4)×0.03=(5-y)×1.5×10-2,y=+1。
【互动探究】将题中的“Na2SO3改为Na2S2O3(其中S元素的化合价为+2),XO3-的物质的量改为0.04 mol”,结果又如何?
提示:Na2S2O3失电子的物质的量是:2×0.03×(6-2)=
0.24 mol,XO4-得电子的物质的量是:0.04×(5-y),由得失电子守恒,解出y=-1。
【规律方法】 “守恒法”的应用
氧化还原反应中,氧化反应和还原反应同时发生,反应前后元素原子个数守恒,元素原子得失电子总数相等(或化合价升降总数相等)。利用得失电子守恒进行计算,可不写化学方程式,特别对于一些较难书写化学方程式的计算,能更方便解题。
【变式训练】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的物质的量之比为3∶1,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的原子个数之比为( )
A.1∶4 B.1∶2 C.4∶1 D.2∶1
【解析】选D。Cl2与NaOH反应时,Cl2被氧化为ClO-和ClO3-,被还原为Cl-,根据化合价升高总数等于降低总数,设ClO-、ClO3-、Cl-的物质的量分别为3 mol、1 mol、x,3 mol×1+
1 mol×5=x·1,x=8 mol,被还原的氯元素与被氧化的氯元素的原子个数比为2∶1。
【典例】(2010·全国卷Ⅱ)若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为
A.1∶4 B.1∶2 C.2∶1 D.4∶1
【思路点拨】解答本题要注意两个守恒:
【自主解答】选B。根据(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,可知发生化合价改变的元素为N和S,N元素从-3价到0价,生成一个N2,化合价总共升高6价;S元素从+6价到+4价,生成一个SO2化合价降低2价,根据化合价升降或电子转移守恒,生成一个N2的同时应生成3个SO2,由此可知需要3个(NH4)2SO4,故化合价发生变化和未发生变化的N原子数之比为2∶4=1∶2,即B正确。
【变式训练】根据S2O82-+2e- 2SO42-、Mn2++4H2O MnO4-+8H++5e-,推测氧化1.5 mol Mn2+需S2O82-的物质的量为( )
A.1.5 mol B.3.75 mol
C.3.25 mol D.3.125 mol
【解析】选B。根据氧化还原反应得失电子数相等,可以得如下关系式:5S2O82-~10e-~2Mn2+,所以n(S2O82-)=
n(Mn2+)= ×1.5 mol=3.75 mol。
【规律方法】氧化还原反应典型的计算有:
求氧化剂与还原剂的物质的量或质量之比;计算参加反应的氧化剂或还原剂的量;确定反应前后某一元素价态的变化;氧化还原反应方程式的配平等。计算的关键是依据氧化剂得电子数等于还原剂失电子数,列出守恒关系求解。
【典例1】下列有关氧化还原反应的叙述中正确的是
A.反应中当有一种元素被氧化时,一定有另一种元素被还原
B.反应中不一定所有元素的化合价都发生变化
C.某元素从游离态变为化合态,该元素一定被氧化
D.氧化还原反应中的反应物,不是氧化剂,就一定是还原剂
【易错选项】A
【易错剖析】
(1)易错选项分析
本题易错选A的原因在于不明确一个氧化还原反应中化合价升降的元素可能是同一种,也可能是两种或多种。
(2)其他错误选项分析:
【标准答案】B
【典例2】有关反应6HCl(浓)+KClO3====KCl+3Cl2↑+3H2O的叙述正确的是
A.KClO3作氧化剂,HCl作还原剂
B.当有6 mol HCl发生反应时,转移了6 mol电子
C.HCl只作还原剂
D.Cl2的氧化性大于KClO3
【易错选项】B
【易错剖析】
(1)易错选项分析
本题易错选B的原因在于不明确氧化还原反应的规律,误认为6 mol HCl全部被氧化成氯气,而事实只有5 mol HCl被氧化,转移了5 mol电子。
(2)其他错误选项分析:
【标准答案】A
1.如图为反应Fe+CuSO4====Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示( )
A.Fe、S B.Cu、S
C.Fe、O D.Fe、Cu
【解析】选D。在氧化还原反应中,还原剂失电子,化合价升高,氧化剂得电子,化合价降低,在反应Fe+CuSO4
=====Cu+FeSO4中,Fe是还原剂,CuSO4是氧化剂。
2.盐酸可能具有的化学性质是( )
A.只有还原性
B.只有酸性
C.只有氧化性
D.有酸性、氧化性、还原性
【解析】选D。盐酸是三大强酸之一,当然有酸性。物质的氧化性、还原性与分子中各元素原子的化合价有关。HCl中H元素处于最高价,只有氧化性,Cl元素处于最低价,只有还原性,所以HCl既有氧化性又有还原性。
3.下列反应中气体作氧化剂的是( )
A.SO3通入水中:SO3+H2O====H2SO4
B.Cl2通入FeCl2溶液中:Cl2+2FeCl2====2FeCl3
C.HCl通入NaOH溶液中:HCl+NaOH====NaCl+H2O
D.CO2通入NaOH溶液中:CO2+2NaOH====Na2CO3+H2O
【解析】选B。A、C、D三个选项的反应都不是氧化还原反应,B选项中氯元素的化合价由0价降低到-1价,被还原,所以Cl2作氧化剂。
4.月球尘埃中的FeTiO3可与H2发生如下反应:FeTiO3+H2
Fe+TiO2+H2O,该反应中一定被还原的元素是( )
A.Fe B.Ti C.H D.O
【解析】选A。被还原的元素化合价降低,在反应FeTiO3+
H2 Fe+TiO2+H2O中,铁元素的化合价由+2价变成0价,氢元素的化合价由0价变为+1价,Ti元素反应前后化合价都是+4价,没有发生变化。
△
====
△
====
5.检验市售食用碘盐是否含碘,可向食盐中加入稀硫酸,再加入碘化钾淀粉溶液,若出现蓝色,则说明该食盐中含有碘。检验时发生的反应如下:
5KI+KIO3+3H2SO4====3K2SO4+3I2+3H2O
(1)该反应中,氧化剂是(填化学式,下同)________,氧化产物是_____,还原产物是_________。
(2)在该反应中,H2SO4表现的性质是_________。
(3)试用单线桥法在上述方程式中标出电子转移的方向和数目。
【解析】(1)在该反应中KIO3中碘元素的化合价由+5价变成I2中的0价,化合价降低,做氧化剂,发生还原反应,得到还原产物,所以KIO3是氧化剂,I2是还原产物;KI中碘元素的化合价由-1价变成I2中的0价,化合价升高,做还原剂,发生氧化反应,得到氧化产物,所以KI是还原剂,I2是氧化产物。
(2)反应中H2SO4中各元素的化合价都没有发生变化,最终变成盐类物质K2SO4,所以只表现酸性。
(3)用单线桥法表示电子转移的方向和数目,箭头由失电子的元素指向得电子的元素,即由KI中的I指向KIO3中的I,转移电子数为5e-。
答案:(1)KIO3 I2 I2 (2)酸性
一、选择题(本题包括5小题,每小题4分,共20分)
1.氧化还原反应的实质是( )
A.氧元素的得失
B.化合价的升降
C.电子的转移
D.分子中原子的重新组合
【解析】选C。氧化还原反应的本质就是电子转移。
2.下列说法正确的是( )
A.在氧化还原反应中,氧化剂经化学变化变成还原剂
B.在氧化还原反应中,氧化剂被氧化,还原剂被还原
C.在化学反应中,能把其他物质氧化的物质是氧化剂
D.在氧化还原反应中,还原剂生成的氧化产物一定只具有氧化性
【解析】选C。氧化剂、还原剂都是反应物,氧化剂经化学变化变成还原产物,故A项错误;氧化剂得电子被还原,还原剂失电子被氧化,故B项错误;氧化剂能把其他物质氧化,还原剂能把其他物质还原,故C项正确;还原剂、还原产物都具有还原性,氧化剂、氧化产物都具有氧化性,但氧化产物也可能具有还原性,故D项错误。
3.(2011·常德高一检测)溴的氧化性介于氯和碘的氧化性之间,根据这一性质你认为:将下列哪种试剂加入到含有Br-的溶液中,可以将Br-氧化为Br2( )
A.I2 B.I- C.Cl2 D.Cl-
【解析】选C。根据题意可知,氧化性Cl2>Br2>I2,则还原性I->Br->Cl-,只有氯气能够将Br-氧化为Br2。
4.在下列反应过程中,有3 mol电子转移的是( )
A.1 mol钠与水反应
B.27 g铝与足量盐酸反应
C.22.4 L氧气(标准状况)与足量镁反应
D.1.5 mol CO2与足量水反应
【解析】选B。27 g铝和标准状况下22.4 L氧气的物质的量都是1 mol。先标出每个反应所转移电子数目,然后找出电子数和所给物质之间的关系,即可计算出给定量的物质所转移电子的物质的量。
5.(2011·连云港高一检测)关于2KMnO4+16HCl====2KCl
+2MnCl2+5Cl2↑+8 的反应,下列说法正确的是( )
A.氧化剂与还原剂物质的量之比为1∶8
B. 处对应的物质为H2O
C.Cl2是还原产物
D.若1 mol KMnO4参加反应,转移的电子的物质的量是7mol
【解析】选B。在该反应中KMnO4作氧化剂,16个HCl中有10个被氧化成Cl2,作还原剂,剩余8个起酸性作用,所以氧化剂与还原剂物质的量之比为1∶5。该反应共转移10 mol电子,所以若1 mol KMnO4参加反应,转移的电子的物质的量是5 mol。
二、非选择题(本题包括3小题,共30分)
6.(8分)已知:氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,试据此判断下列四种化合物:
①NO ②N2O4 ③HNO3 ④NH3中:
(1)氮元素只能作还原剂的是_______(填序号,下同)。
(2)可能是HNO2还原产物的是________。
(3)不可能是N2的氧化产物的是________。
(4)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式________。
【解析】(1)NH3中氮元素的化合价为-3价,为氮元素的最低价态,只有还原性,只能作还原剂;(2)HNO2中氮元素的化合价为+3价,为氮元素的中间价态,既有氧化性,又有还原性。其发生还原反应时,化合价要降低,所以NO和NH3都可能是HNO2的还原产物;(3)N2中氮元素的化合价为0价,为氮元素的中间价态,既有氧化性,又有还原性。其发生氧化反应时,化合价要升高,所以氮元素化合价比0价低的NH3不可能是N2的氧化产物;(4)氧化铜具有氧化性,能够把氨气氧化成N2,自身被还原成Cu,同时H和O结合生成水,据此可以写出该反应的化学方程式。
答案:(1)④ (2)①④ (3)④
(4)2NH3+3CuO N2+3Cu+3H2O
△
====
7.(12分)(1)图A为“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:H2+CuO
Cu+H2O所属的区域。
△
====
(2)“四种基本反应类型与氧化还原反应的关系”也可用B图表达。其中Ⅰ为化合反应,则Ⅱ为______反应。写出有水生成的符合反应类型Ⅲ的一个化学方程式________。写出有水参加的符合反应类型Ⅳ的一个化学方程式_______,其中水为_______剂。
【解析】四种基本反应类型和氧化还原反应的关系如下:①有单质参加的化合反应一定是氧化还原反应;②有单质生成的分解反应一定是氧化还原反应;③置换反应一定是氧化还原反应;④复分解反应一定不是氧化还原反应。(1)H2+CuO Cu+H2O属于置换反应,一定是氧化还原反应,所以其应在A图中被大环完全包围的小环区域内。(2)B图中,Ⅰ和Ⅱ有一部分属于氧化还原反应,有一部分属于非氧化还原反应,若I为化合反应,则Ⅱ一定为分解反应。Ⅲ全部是非氧化还原反应,即复分解反应;Ⅳ全部是氧化还原反应,即置换反应。
△
====
答案:(1)
(2)分解NaOH+HCl====NaCl+H2O(合理即可)
C+H2O(g) CO+H2 氧化(其他合理答案也可)
高温
====
8.(10分)(挑战能力)在反应2KMnO4+16HCl(浓)====2MnCl2
+2KCl+5Cl2↑+8H2O中,
(1)氧化剂是_______,氧化产物是_______(填化学式)。
(2)若生成71 g Cl2,则消耗的HCl是________mol,
被氧化的HCl是_____mol,转移的电子的物质的量是_____。
【解析】根据反应中元素化合价的变化,判断氧化剂和还原剂及相应产物;化合价升高的反应物作还原剂,还原剂被氧化对应氧化产物,化合价降低的反应物作氧化剂,氧化剂被还原对应还原产物。
在反应中元素化合价升降情况为: ,
故氧化剂为KMnO4,氧化产物为Cl2,反应中生成71 g Cl2(即1 mol)时,消耗HCl为
1 mol· =3.2 mol,其中被氧化的HCl为1 mol×2=2 mol,转移电子为1 mol×2=2 mol。
答案:(1)KMnO4 Cl2
(2)3.2 2 2 mol
【方法技巧】氧化还原反应方程式的书写技巧
近几年高考试题中关于氧化还原反应方程式的书写主要以填空题的形式出现,具体形式有:
(1)根据列出的反应体系中所有物质,写出反应方程式,这种题型较简单;
(2)根据题给信息书写氧化还原反应方程式。题给信息一般包括氧化剂、还原剂、氧化产物、还原产物以及反应介质等。
书写步骤为:
①先列出氧化剂、还原剂、氧化产物、还原产物。如果氧化产物、还原产物不全给出,可通过化合价升降关系判断得出。
②根据介质种类添加其他反应物、生成物。
③用化合价升降法配平方程式。
可以通过实验探究有关物质氧化性和还原性的强弱。
Ⅰ.探究有关物质氧化性的强弱。
已知Bi +3价较稳定,NaBiO3溶液为无色,Bi3+无色;Mn2+无色,MnO4-呈紫红色;Pb +2价较稳定,PbSO4是一种白色沉淀。取一定量的Mn(NO3)2溶液依次进行实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体。
请回答下列问题:
(1)推测实验④中的现象为___________。
(2)分析上述现象,KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________。
Ⅱ.探究镁、铝、铜金属单质还原性的强弱。
现有镁条、铝片、铝粉、铜片、氧化镁、氧化铝、氧化铁、盐酸、硝酸银溶液、硫酸铜溶液及其他常用的实验用品和仪器,根据现有药品,请你设计简单实验验证镁、铝、铜金属单质的还原性强弱。
依据你设计的实验方案,回答下列问题:
(3)实验原理:用化学方程式表示实验中的反应:
①__________________________________;
②__________________________________;
③__________________________________。
(4)实验现象:能够充分说明镁、铝、铜金属单质还原性强弱的明显现象是_______________________。
【解析】Ⅰ.①向Mn(NO3)2溶液中滴加NaBiO3溶液时,溶液变为紫红色,说明有MnO4-生成,即Mn2+被氧化成MnO4-,NaBiO3被还原成Bi3+,所以氧化性NaBiO3>KMnO4;
②向所得到的KMnO4溶液中滴加H2O2,紫红色褪去,说明MnO4-被还原成Mn2+,H2O2被氧化成O2,所以氧化性KMnO4>H2O2;
③向含Mn2+的溶液中加入PbO2固体,固体溶解,溶液又变为紫红色,说明Mn2+又被氧化成MnO4-,PbO2被还原成Pb2+,所以氧化性PbO2>KMnO4;
④MnO4-可以将SO2氧化成SO42-,SO42-和Pb2+结合成白色的PbSO4沉淀。
Ⅱ.镁、铝是活泼金属,能够和盐酸反应放出氢气,但是更活泼的镁反应更为剧烈;铜是不活泼金属,不能和盐酸反应放出氢气,但是可以和硝酸银溶液发生置换反应生成更不活泼的单质银。
答案:(1)紫红色褪去,生成白色沉淀
(2)PbO2>KMnO4>H2O2
(3)Mg+2HCl=====MgCl2+H2↑
2Al+6HCl2====2AlCl3+3H2↑
Cu+2AgNO3=====Cu(NO3)2+2Ag
(4)镁条、铝片分别与盐酸反应时,镁条与盐酸反应剧烈;铜和硝酸银溶液反应时,铜片表面有银白色物质析出
