11-12版高中化学全程学习方略配套课件:2.2.2碳酸钠的性质与应用(苏教版必修1)
文档属性
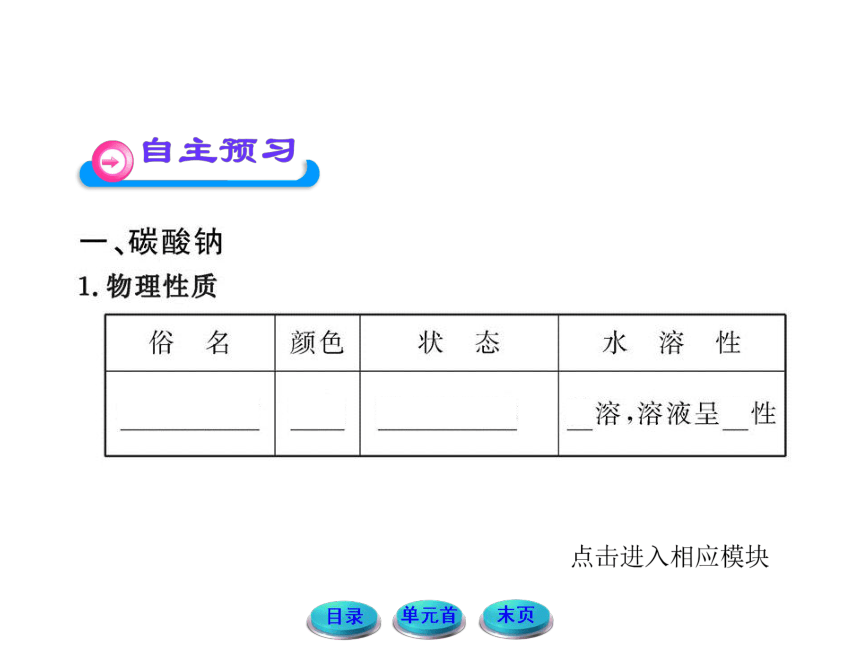
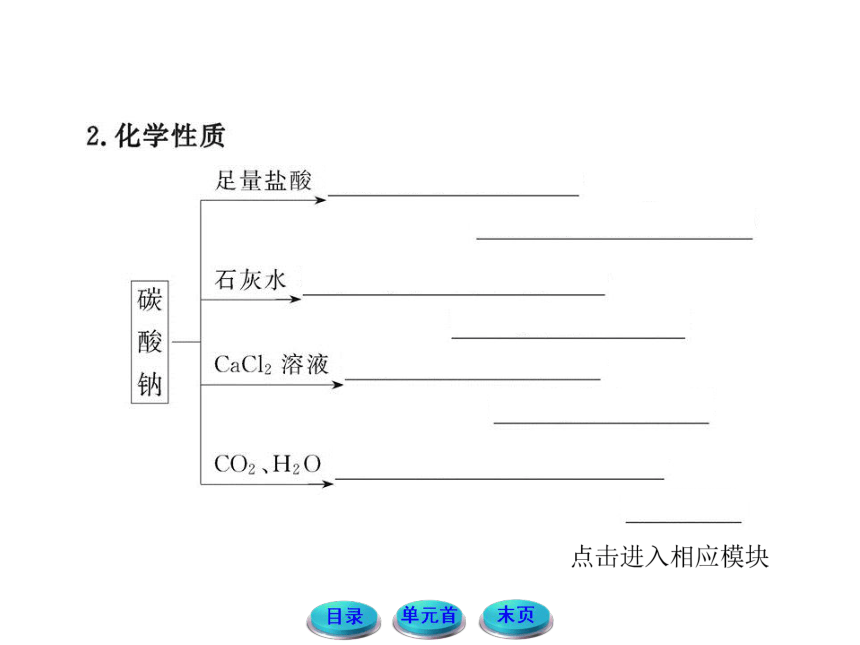
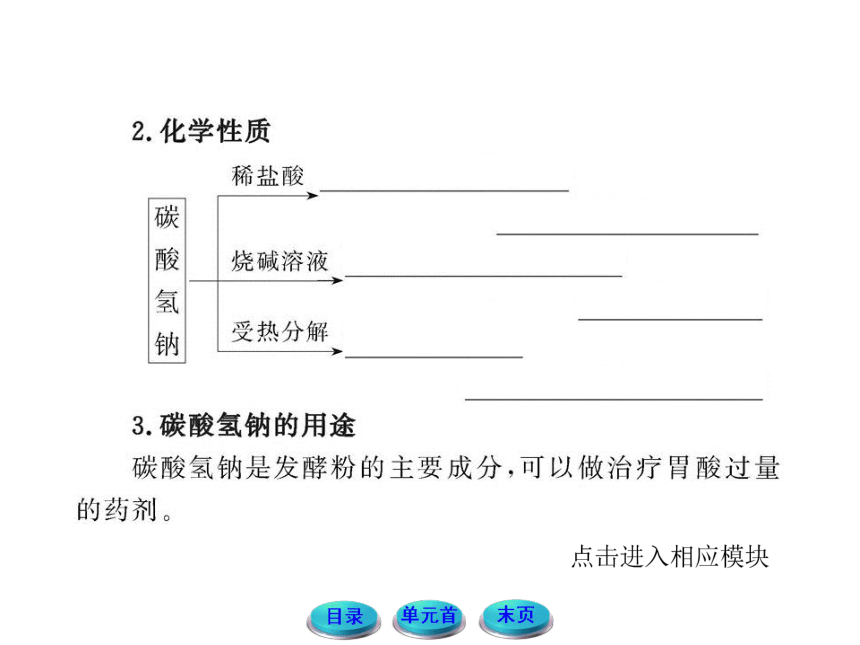
| 名称 | 11-12版高中化学全程学习方略配套课件:2.2.2碳酸钠的性质与应用(苏教版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-11 00:00:00 | ||
图片预览









文档简介
(共110张PPT)
【典例】为鉴别K2CO3和NaHCO3两种白色固
体,有4位同学分别设计了下列四种不同的
方法,其中可行的是__________。
(1)分别配成1 mol/L的溶液,各取1 mL滴加1滴酚酞试液,比较颜色深浅
(2)分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
(3)分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
(4)分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色(必要时可透过蓝色钴玻璃)
【思路点拨】解答此题时应注意以下两点:
【自主解答】
答案:(1)(2)(4)
【互动探究】(1)若将K2CO3改成Na2CO3,则答案是什么?
提示:(1)和(2)。因为此时阳离子相同,所以从阳离子角度无法鉴别,但是阴离子不同,可以用(1)、(2)鉴别。
(2)如何除去Na2CO3固体中的NaHCO3杂质
提示:利用NaHCO3受热易分解这一性质,即:2NaHCO3 Na2CO3+CO2↑+H2O,即可除去NaHCO3。
△
====
【规律方法】Na2CO3和NaHCO3的鉴别
【变式训练】某学生在A、B两个装置的气球中分别装入1.06 g Na2CO3和0.84 g NaHCO3,试管中是足量的浓度、体积相同的盐酸。将两气球中物质同时倒入试管中,有关现象描述正确的是(假设反应前后溶液体积不变)( )
A.起初A气球鼓胀快,最终B气球大
B.起初A气球鼓胀快,最终两气球一样大
C.最终两溶液中氯离子物质的量浓度不同
D.最终两溶液中钠离子物质的量浓度不同
【解析】选D。NaHCO3固体和同浓度的酸反应快,所以起初B气球鼓胀快。1.06 g Na2CO3和0.84 g NaHCO3的物质的量都是0.01 mol,根据反应方程式:Na2CO3+2HCl====2NaCl+
CO2↑+H2O和NaHCO3+HCl====NaCl+CO2↑+H2O,它们和足量
的盐酸反应生成的CO2都是0.01 mol,所以最终两气球一样大;溶液中氯离子全部来自盐酸,由于盐酸浓度、体积相同,所以其物质的量也相同,即溶液中Cl-的物质的量浓度相同,A、B、C选项错误;溶液中钠离子全部来自于Na2CO3和NaHCO3中,其所含的Na+的物质的量分别为0.02 mol和0.01 mol,所以溶液中Na+的物质的量浓度不同,D选项正确。
【典例】(2010·上海高考)将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
【思路点拨】反应情况为
【自主解答】选C。向NaOH和Na2CO3混合溶液中滴加盐酸时,HCl首先和NaOH反应生成水和氯化钠,当滴入0.1 L时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3====NaHCO3+NaCl,不放出气体,当再加入0.1 L时,此步反应进行完全;继续滴加时,发生反应NaHCO3+HCl====NaCl+H2O+CO2↑。此时开始放出气体,分析图像可知选C。
【互动探究】具有B选项图像特征的物质组成是什么?其物质的量为多少?
提示:因为向Na2CO3或NaOH或两者的混合物中加入盐酸,开始没有CO2产生,所以必定没有这两种物质,只能是NaHCO3,根据反应:NaHCO3+HCl====NaCl+H2O+CO2↑,n(NaHCO3)=n(HCl)=0.1 mol·L-1×0.1 L=0.01 mol
【变式训练】有1.5 mL 2 mol·L-1的H2SO4溶液与15 mL
3 mol·L-1的Na2CO3溶液,欲使其反应产生CO2的量最多,则正确的操作是( )
A.把两种溶液快速混合并不断搅拌
B.把两种溶液缓慢混合并不断搅拌
C.把H2SO4溶液滴加到Na2CO3溶液中
D.把Na2CO3溶液滴加到H2SO4溶液中
【解析】选D。把Na2CO3溶液滴加到H2SO4溶液中,开始时H2SO4过量,而把H2SO4溶液滴加到Na2CO3溶液中,H2SO4不足。把H2SO4溶液滴加到Na2CO3溶液中,生成NaHCO3,把Na2CO3溶液滴加到H2SO4溶液中,直接生成CO2,所以当H+的物质的量小于CO32-的物质的量的二倍时,把碳酸盐溶液滴加到酸中产生CO2的量最多。
【典例】关于Na2CO3和NaHCO3的说法中正确的是
A.向两者的溶液中加入BaCl2均生成白色沉淀
B.向两者的溶液中逐滴加入HCl,反应现象完全相同
C.Na2CO3和NaHCO3两物质之间可以相互转化
D.向饱和的Na2CO3溶液中通入足量的CO2气体,观察不到任何实验现象
【易错选项】D
【易错剖析】(1)易错选项分析
错选D原因在于对知识的分析不到位,对所学知识的综合运用能力不强。向饱和的Na2CO3溶液中通入足量的CO2气体,反应生成的NaHCO3会以沉淀的形式析出。原因有三:①生成的NaHCO3相对于Na2CO3来说溶解度更小;②反应后生成的NaHCO3质量大于Na2CO3的质量(溶质质量增加);③反应中要消耗一部分水(溶剂减少)。综合以上三点,饱和的Na2CO3溶液中通入足量的CO2气体的反应方程式是:Na2CO3+CO2+
H2O====2NaHCO3↓,因此反应时可观察到有晶体析出。
(2)其他错误选项分析
【标准答案】C
1.下列关于碳酸氢钠(NaHCO3)的叙述中,不正确的是( )
A.可溶于水 B.能与NaOH反应
C.受热不分解 D.能与盐酸反应
【解析】选C。碳酸氢钠受热可分解成Na2CO3、CO2和H2O。
2.下列物质中,有一种物质的颜色与其他三种物质的颜色不同,这种物质是( )
A.NaOH B.Na2O C.Na2O2 D.NaHCO3
【解析】选C。过氧化钠是淡黄色固体,其余的都是白色固体。
3.106 g Na2CO3和84 g NaHCO3分别与同浓度的过量的稀硫酸反应,下列叙述正确的是( )
A.两者放出的CO2一样多
B.Na2CO3放出的CO2多
C.NaHCO3消耗的硫酸多
D.Na2CO3反应快
【解析】选A。NaHCO3与同浓度的稀硫酸反应速率快;106 g Na2CO3和84 g NaHCO3的物质的量都为1 mol,由关系式:Na2CO~H2SO4~CO2,2NaHCO3 ~H2SO4 ~2CO2,所以与过量的稀硫酸反应时,生成的CO2一样多,NaHCO3消耗的硫酸少。
4.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是
( )
A.分别加热这两种固体物质,并将可能生成的气体通入澄清石灰水中
B.分别在这两种物质的溶液中,加入CaCl2溶液
C.分别在这两种固体中,加入同浓度的稀盐酸
D.分别在这两种物质的溶液中,加入少量澄清石灰水
【解析】选D。加热两种固体,产生能使澄清石灰水变浑浊的气体的是碳酸氢钠;加入氯化钙溶液,产生白色沉淀的是碳酸钠,无明显现象的是碳酸氢钠;加入同浓度的盐酸,产生气体速率快的是碳酸氢钠;加入澄清石灰水,两者均产生白色沉淀。
5.如图装置中:
加热试管内的白色固体A(A的焰色反应为黄色),生成白色固体B并放出气体C和D,这些气体通过甲瓶的浓硫酸后,C被吸收;D通过乙装置跟另一淡黄色固体E反应生成白色固体B和气体F;丙瓶中的NaOH溶液用来吸收剩余的气体D。
(1)写出各物质的化学式:
B_______;E_______;F_______。
(2)写出试管中及丙瓶中反应的化学方程式:
试管中_________________________,
丙瓶中_________________________。
【解析】A的焰色反应为黄色,说明A中含有钠元素,因为A
B+C↑+D↑,所以A为NaHCO3,B为Na2CO3。浓硫酸可以吸收水蒸气,所以C为H2O,D为CO2,CO2能够和淡黄色的Na2O2固体反应生成Na2CO3和O2,所以E为Na2O2,F为O2。
答案:(1)Na2CO3 Na2O2 O2
(2)2NaHCO3 Na2CO3+CO2↑+H2O↑
2NaOH+CO2=====Na2CO3+H2O
△
△
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.跟Na、Na2O、Na2O2、NaOH、Na2CO3、NaHCO3六种物质都能发生反应的是( )
A.H2O B.CO2 C.H2SO4 D.Ca(OH)2
【解析】选C。NaOH、Na2CO3、NaHCO3和水都不能反应,NaHCO3和CO2不能反应,NaOH和Ca(OH)2不能反应,H2SO4和这六种物质都能反应生成Na2SO4。
2.如图是某学生设计的加热碳酸氢钠的实验装置图,其中错误的地方共有( )
A.1处 B.2处 C.3处 D.4处
【解析】选C。加热固体时,酒精灯的外焰应该对准试管盛药品的部位先预热再集中加热;试管口应该向下倾斜,防止水蒸气冷凝后倒流入热的试管使试管炸裂;导气管不能深入试管内部,应该使其稍微漏出橡胶塞即可,使产生的气体能够顺利导出。
3.(2011·南通高一检测)某化合物加热时会放出一种气体并生成一种残渣,残渣能与稀盐酸反应放出相同的气体,化合物可能是( )
A.碳酸钠 B.碳酸氢钠
C.氯酸钾 D.硫酸钠
【解析】选B。碳酸钠和硫酸钠加热不分解。氯酸钾受热分解生成KCl和O2,KCl和盐酸不反应;NaHCO3受热分解为Na2CO3、H2O和CO2,Na2CO3和盐酸反应也生成CO2。
4.现有一工业纯碱样品(含少量氯化钠等不与酸反应的杂质),用如图装置测定样品中碳酸钠的质量分数,其中正确的是( )
【解析】选C。因为盐酸容易挥发,若选用盐酸,则所得的CO2中含有HCl气体,最好选用难挥发的硫酸,因为CO2溶于水不溶于饱和NaHCO3溶液,所以应用排饱和NaHCO3溶液法来测量CO2的体积,排液装置导气管口应是“短进长出”,以保证液体顺利排出。
5.将10 g Na2CO3和NaHCO3的混合物充分加热后,固体质量减少3.1 g,则原混合物中Na2CO3的质量分数是( )
A.84% B.16% C.10.6% D.无法计算
【解析】选B。设混合物中NaHCO3的物质的量为x。
2NaHCO3 Na2CO3+CO2↑+H2O 固体质量减少
2 mol (44+18) g
X 3.1 g
2 mol∶x=(44+18) g∶3.1 g
x=0.1 mol
所以Na2CO3的质量分数为 ×100%=16%。
△
====
二、非选择题(本题包括3小题,共30分)
6.(10分)(2011·枣庄高一检测)实验室中氢氧化钠溶液在空气中放置,因密封不好会变质,有关反应的离子方程式为__________;为了检测一瓶氢氧化钠溶液是否已变质,可取少量该溶液向其中加入__________,若有_________现象发生,则说明烧碱溶液已经变质。为了除去烧碱溶液中的杂质,应加入适量的___________,并进行过滤。
【解析】氢氧化钠溶液在空气中放置易与CO2反应生成杂质碳酸钠,可用氯化钙溶液或氢氧化钙溶液检测,除去碳酸钠应选适量氢氧化钙溶液。
答案:2OH-+CO2====CO32-+H2O
氯化钙溶液或氢氧化钙溶液(其他合理答案也可)
白色沉淀 氢氧化钙溶液
7.(10分)实验室利用如图所示装置进行NaHCO3的受热分解实验。
请回答:(1)加热一段时间后,烧杯中观察到的实验现象是
__________________。
(2)实验结束时的正确操作是_______(填字母);
A.先将导管从液体中移出,再熄灭酒精灯
B.先熄灭酒精灯,再将导管从液体中移出
否则会引起_______________________。
(3)NaHCO3受热分解的化学方程式为____________。
【解析】NaHCO3受热分解为Na2CO3、H2O和CO2,CO2能够使澄清石灰水变浑浊。实验结束时若先熄灭酒精灯,再将导管从液体中移出,则试管内压强迅速减小,在外界大气压的作用下烧杯中的水倒吸回试管,引起试管破裂,所以先将导管从液体中移出,再熄灭酒精灯。
答案:(1)澄清石灰水变浑浊 (2)A 倒吸
(3)2NaHCO3 Na2CO3+CO2↑+H2O
△
====
8.(10分)(挑战能力)
有A、B、C、D四种物
质的溶液,在进行焰
色反应实验时,火焰
都呈黄色,它们之间
可发生如图所示的转
化,则A、C两种物质的化学式分别为:
A__________、C____________。
写出有关反应的离子方程式:
②_____________________________________;
③_____________________________________;
⑤_____________________________________。
【解析】由信息“火焰都呈黄色”,可知它们均为钠的化合物。再由框图中A B C,可推出A、B、C分别为NaOH、Na2CO3和NaHCO3,则D为Na2SO4。
少量CO2
CO2、H2O
答案:NaOH NaHCO3
②CO32-+CO2+H2O====2HCO3-
③HCO3-+H+====H2O+CO2↑
⑤CO32-+2H+====H2O+CO2↑
(1)如图a、b所示,按装置进行实验准备,然后将气球内等质量的Na2CO3、NaHCO3粉末同时倒入足量等体积等浓度的盐酸中。
(2)①将50 mL 2 mol/L的Na2CO3溶液逐滴滴入80 mL 2mol/L
的稀盐酸中
②将80 mL 2 mol/L的稀盐酸逐滴滴入50 mL 2 mol/L的Na2CO3溶液中
(3)向饱和Na2CO3溶液中通入足量的CO2。
【思考探究】
(1)a、b会产生怎样的实验现象?有什么不同吗?
提示:两支试管中均生成无色气体,气球体积膨胀;装NaHCO3粉末的a气球膨胀得快且大。
(2)由(1)中的实验现象,你能得出什么样的结论?
提示:等质量的Na2CO3粉末、NaHCO3粉末与足量等体积等浓度的盐酸反应时,NaHCO3与盐酸反应快,且产生CO2气体多。
(3)实验(2)中两种操作现象是否相同?
提示:不相同。操作①中滴入Na2CO3溶液,即产生气泡,直到盐酸完全反应,再滴入时,无明显变化,操作②中开始滴入盐酸时不产生气泡,直到盐酸超过50 mL时才产生气泡。
(4)实验(2)的两个实验,最终溶液中的溶质是什么?
提示:①中是NaCl和Na2CO3,②中是NaCl和NaHCO3。
(5)向饱和Na2CO3溶液中通入足量的CO2会有什么现象?这一实验现象说明了什么?若Na2CO3溶液不饱和会出现这一现象吗?
提示:有晶体析出。
说明NaHCO3的溶解度比Na2CO3的溶解度小。
向不饱和的Na2CO3溶液中通入CO2不一定有晶体析出,因为Na2CO3与NaHCO3都属于易溶物。
【典例】为鉴别K2CO3和NaHCO3两种白色固
体,有4位同学分别设计了下列四种不同的
方法,其中可行的是__________。
(1)分别配成1 mol/L的溶液,各取1 mL滴加1滴酚酞试液,比较颜色深浅
(2)分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
(3)分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
(4)分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色(必要时可透过蓝色钴玻璃)
【思路点拨】解答此题时应注意以下两点:
【自主解答】
答案:(1)(2)(4)
【互动探究】(1)若将K2CO3改成Na2CO3,则答案是什么?
提示:(1)和(2)。因为此时阳离子相同,所以从阳离子角度无法鉴别,但是阴离子不同,可以用(1)、(2)鉴别。
(2)如何除去Na2CO3固体中的NaHCO3杂质
提示:利用NaHCO3受热易分解这一性质,即:2NaHCO3 Na2CO3+CO2↑+H2O,即可除去NaHCO3。
△
====
【规律方法】Na2CO3和NaHCO3的鉴别
【变式训练】某学生在A、B两个装置的气球中分别装入1.06 g Na2CO3和0.84 g NaHCO3,试管中是足量的浓度、体积相同的盐酸。将两气球中物质同时倒入试管中,有关现象描述正确的是(假设反应前后溶液体积不变)( )
A.起初A气球鼓胀快,最终B气球大
B.起初A气球鼓胀快,最终两气球一样大
C.最终两溶液中氯离子物质的量浓度不同
D.最终两溶液中钠离子物质的量浓度不同
【解析】选D。NaHCO3固体和同浓度的酸反应快,所以起初B气球鼓胀快。1.06 g Na2CO3和0.84 g NaHCO3的物质的量都是0.01 mol,根据反应方程式:Na2CO3+2HCl====2NaCl+
CO2↑+H2O和NaHCO3+HCl====NaCl+CO2↑+H2O,它们和足量
的盐酸反应生成的CO2都是0.01 mol,所以最终两气球一样大;溶液中氯离子全部来自盐酸,由于盐酸浓度、体积相同,所以其物质的量也相同,即溶液中Cl-的物质的量浓度相同,A、B、C选项错误;溶液中钠离子全部来自于Na2CO3和NaHCO3中,其所含的Na+的物质的量分别为0.02 mol和0.01 mol,所以溶液中Na+的物质的量浓度不同,D选项正确。
【典例】(2010·上海高考)将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
【思路点拨】反应情况为
【自主解答】选C。向NaOH和Na2CO3混合溶液中滴加盐酸时,HCl首先和NaOH反应生成水和氯化钠,当滴入0.1 L时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3====NaHCO3+NaCl,不放出气体,当再加入0.1 L时,此步反应进行完全;继续滴加时,发生反应NaHCO3+HCl====NaCl+H2O+CO2↑。此时开始放出气体,分析图像可知选C。
【互动探究】具有B选项图像特征的物质组成是什么?其物质的量为多少?
提示:因为向Na2CO3或NaOH或两者的混合物中加入盐酸,开始没有CO2产生,所以必定没有这两种物质,只能是NaHCO3,根据反应:NaHCO3+HCl====NaCl+H2O+CO2↑,n(NaHCO3)=n(HCl)=0.1 mol·L-1×0.1 L=0.01 mol
【变式训练】有1.5 mL 2 mol·L-1的H2SO4溶液与15 mL
3 mol·L-1的Na2CO3溶液,欲使其反应产生CO2的量最多,则正确的操作是( )
A.把两种溶液快速混合并不断搅拌
B.把两种溶液缓慢混合并不断搅拌
C.把H2SO4溶液滴加到Na2CO3溶液中
D.把Na2CO3溶液滴加到H2SO4溶液中
【解析】选D。把Na2CO3溶液滴加到H2SO4溶液中,开始时H2SO4过量,而把H2SO4溶液滴加到Na2CO3溶液中,H2SO4不足。把H2SO4溶液滴加到Na2CO3溶液中,生成NaHCO3,把Na2CO3溶液滴加到H2SO4溶液中,直接生成CO2,所以当H+的物质的量小于CO32-的物质的量的二倍时,把碳酸盐溶液滴加到酸中产生CO2的量最多。
【典例】关于Na2CO3和NaHCO3的说法中正确的是
A.向两者的溶液中加入BaCl2均生成白色沉淀
B.向两者的溶液中逐滴加入HCl,反应现象完全相同
C.Na2CO3和NaHCO3两物质之间可以相互转化
D.向饱和的Na2CO3溶液中通入足量的CO2气体,观察不到任何实验现象
【易错选项】D
【易错剖析】(1)易错选项分析
错选D原因在于对知识的分析不到位,对所学知识的综合运用能力不强。向饱和的Na2CO3溶液中通入足量的CO2气体,反应生成的NaHCO3会以沉淀的形式析出。原因有三:①生成的NaHCO3相对于Na2CO3来说溶解度更小;②反应后生成的NaHCO3质量大于Na2CO3的质量(溶质质量增加);③反应中要消耗一部分水(溶剂减少)。综合以上三点,饱和的Na2CO3溶液中通入足量的CO2气体的反应方程式是:Na2CO3+CO2+
H2O====2NaHCO3↓,因此反应时可观察到有晶体析出。
(2)其他错误选项分析
【标准答案】C
1.下列关于碳酸氢钠(NaHCO3)的叙述中,不正确的是( )
A.可溶于水 B.能与NaOH反应
C.受热不分解 D.能与盐酸反应
【解析】选C。碳酸氢钠受热可分解成Na2CO3、CO2和H2O。
2.下列物质中,有一种物质的颜色与其他三种物质的颜色不同,这种物质是( )
A.NaOH B.Na2O C.Na2O2 D.NaHCO3
【解析】选C。过氧化钠是淡黄色固体,其余的都是白色固体。
3.106 g Na2CO3和84 g NaHCO3分别与同浓度的过量的稀硫酸反应,下列叙述正确的是( )
A.两者放出的CO2一样多
B.Na2CO3放出的CO2多
C.NaHCO3消耗的硫酸多
D.Na2CO3反应快
【解析】选A。NaHCO3与同浓度的稀硫酸反应速率快;106 g Na2CO3和84 g NaHCO3的物质的量都为1 mol,由关系式:Na2CO~H2SO4~CO2,2NaHCO3 ~H2SO4 ~2CO2,所以与过量的稀硫酸反应时,生成的CO2一样多,NaHCO3消耗的硫酸少。
4.不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是
( )
A.分别加热这两种固体物质,并将可能生成的气体通入澄清石灰水中
B.分别在这两种物质的溶液中,加入CaCl2溶液
C.分别在这两种固体中,加入同浓度的稀盐酸
D.分别在这两种物质的溶液中,加入少量澄清石灰水
【解析】选D。加热两种固体,产生能使澄清石灰水变浑浊的气体的是碳酸氢钠;加入氯化钙溶液,产生白色沉淀的是碳酸钠,无明显现象的是碳酸氢钠;加入同浓度的盐酸,产生气体速率快的是碳酸氢钠;加入澄清石灰水,两者均产生白色沉淀。
5.如图装置中:
加热试管内的白色固体A(A的焰色反应为黄色),生成白色固体B并放出气体C和D,这些气体通过甲瓶的浓硫酸后,C被吸收;D通过乙装置跟另一淡黄色固体E反应生成白色固体B和气体F;丙瓶中的NaOH溶液用来吸收剩余的气体D。
(1)写出各物质的化学式:
B_______;E_______;F_______。
(2)写出试管中及丙瓶中反应的化学方程式:
试管中_________________________,
丙瓶中_________________________。
【解析】A的焰色反应为黄色,说明A中含有钠元素,因为A
B+C↑+D↑,所以A为NaHCO3,B为Na2CO3。浓硫酸可以吸收水蒸气,所以C为H2O,D为CO2,CO2能够和淡黄色的Na2O2固体反应生成Na2CO3和O2,所以E为Na2O2,F为O2。
答案:(1)Na2CO3 Na2O2 O2
(2)2NaHCO3 Na2CO3+CO2↑+H2O↑
2NaOH+CO2=====Na2CO3+H2O
△
△
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.跟Na、Na2O、Na2O2、NaOH、Na2CO3、NaHCO3六种物质都能发生反应的是( )
A.H2O B.CO2 C.H2SO4 D.Ca(OH)2
【解析】选C。NaOH、Na2CO3、NaHCO3和水都不能反应,NaHCO3和CO2不能反应,NaOH和Ca(OH)2不能反应,H2SO4和这六种物质都能反应生成Na2SO4。
2.如图是某学生设计的加热碳酸氢钠的实验装置图,其中错误的地方共有( )
A.1处 B.2处 C.3处 D.4处
【解析】选C。加热固体时,酒精灯的外焰应该对准试管盛药品的部位先预热再集中加热;试管口应该向下倾斜,防止水蒸气冷凝后倒流入热的试管使试管炸裂;导气管不能深入试管内部,应该使其稍微漏出橡胶塞即可,使产生的气体能够顺利导出。
3.(2011·南通高一检测)某化合物加热时会放出一种气体并生成一种残渣,残渣能与稀盐酸反应放出相同的气体,化合物可能是( )
A.碳酸钠 B.碳酸氢钠
C.氯酸钾 D.硫酸钠
【解析】选B。碳酸钠和硫酸钠加热不分解。氯酸钾受热分解生成KCl和O2,KCl和盐酸不反应;NaHCO3受热分解为Na2CO3、H2O和CO2,Na2CO3和盐酸反应也生成CO2。
4.现有一工业纯碱样品(含少量氯化钠等不与酸反应的杂质),用如图装置测定样品中碳酸钠的质量分数,其中正确的是( )
【解析】选C。因为盐酸容易挥发,若选用盐酸,则所得的CO2中含有HCl气体,最好选用难挥发的硫酸,因为CO2溶于水不溶于饱和NaHCO3溶液,所以应用排饱和NaHCO3溶液法来测量CO2的体积,排液装置导气管口应是“短进长出”,以保证液体顺利排出。
5.将10 g Na2CO3和NaHCO3的混合物充分加热后,固体质量减少3.1 g,则原混合物中Na2CO3的质量分数是( )
A.84% B.16% C.10.6% D.无法计算
【解析】选B。设混合物中NaHCO3的物质的量为x。
2NaHCO3 Na2CO3+CO2↑+H2O 固体质量减少
2 mol (44+18) g
X 3.1 g
2 mol∶x=(44+18) g∶3.1 g
x=0.1 mol
所以Na2CO3的质量分数为 ×100%=16%。
△
====
二、非选择题(本题包括3小题,共30分)
6.(10分)(2011·枣庄高一检测)实验室中氢氧化钠溶液在空气中放置,因密封不好会变质,有关反应的离子方程式为__________;为了检测一瓶氢氧化钠溶液是否已变质,可取少量该溶液向其中加入__________,若有_________现象发生,则说明烧碱溶液已经变质。为了除去烧碱溶液中的杂质,应加入适量的___________,并进行过滤。
【解析】氢氧化钠溶液在空气中放置易与CO2反应生成杂质碳酸钠,可用氯化钙溶液或氢氧化钙溶液检测,除去碳酸钠应选适量氢氧化钙溶液。
答案:2OH-+CO2====CO32-+H2O
氯化钙溶液或氢氧化钙溶液(其他合理答案也可)
白色沉淀 氢氧化钙溶液
7.(10分)实验室利用如图所示装置进行NaHCO3的受热分解实验。
请回答:(1)加热一段时间后,烧杯中观察到的实验现象是
__________________。
(2)实验结束时的正确操作是_______(填字母);
A.先将导管从液体中移出,再熄灭酒精灯
B.先熄灭酒精灯,再将导管从液体中移出
否则会引起_______________________。
(3)NaHCO3受热分解的化学方程式为____________。
【解析】NaHCO3受热分解为Na2CO3、H2O和CO2,CO2能够使澄清石灰水变浑浊。实验结束时若先熄灭酒精灯,再将导管从液体中移出,则试管内压强迅速减小,在外界大气压的作用下烧杯中的水倒吸回试管,引起试管破裂,所以先将导管从液体中移出,再熄灭酒精灯。
答案:(1)澄清石灰水变浑浊 (2)A 倒吸
(3)2NaHCO3 Na2CO3+CO2↑+H2O
△
====
8.(10分)(挑战能力)
有A、B、C、D四种物
质的溶液,在进行焰
色反应实验时,火焰
都呈黄色,它们之间
可发生如图所示的转
化,则A、C两种物质的化学式分别为:
A__________、C____________。
写出有关反应的离子方程式:
②_____________________________________;
③_____________________________________;
⑤_____________________________________。
【解析】由信息“火焰都呈黄色”,可知它们均为钠的化合物。再由框图中A B C,可推出A、B、C分别为NaOH、Na2CO3和NaHCO3,则D为Na2SO4。
少量CO2
CO2、H2O
答案:NaOH NaHCO3
②CO32-+CO2+H2O====2HCO3-
③HCO3-+H+====H2O+CO2↑
⑤CO32-+2H+====H2O+CO2↑
(1)如图a、b所示,按装置进行实验准备,然后将气球内等质量的Na2CO3、NaHCO3粉末同时倒入足量等体积等浓度的盐酸中。
(2)①将50 mL 2 mol/L的Na2CO3溶液逐滴滴入80 mL 2mol/L
的稀盐酸中
②将80 mL 2 mol/L的稀盐酸逐滴滴入50 mL 2 mol/L的Na2CO3溶液中
(3)向饱和Na2CO3溶液中通入足量的CO2。
【思考探究】
(1)a、b会产生怎样的实验现象?有什么不同吗?
提示:两支试管中均生成无色气体,气球体积膨胀;装NaHCO3粉末的a气球膨胀得快且大。
(2)由(1)中的实验现象,你能得出什么样的结论?
提示:等质量的Na2CO3粉末、NaHCO3粉末与足量等体积等浓度的盐酸反应时,NaHCO3与盐酸反应快,且产生CO2气体多。
(3)实验(2)中两种操作现象是否相同?
提示:不相同。操作①中滴入Na2CO3溶液,即产生气泡,直到盐酸完全反应,再滴入时,无明显变化,操作②中开始滴入盐酸时不产生气泡,直到盐酸超过50 mL时才产生气泡。
(4)实验(2)的两个实验,最终溶液中的溶质是什么?
提示:①中是NaCl和Na2CO3,②中是NaCl和NaHCO3。
(5)向饱和Na2CO3溶液中通入足量的CO2会有什么现象?这一实验现象说明了什么?若Na2CO3溶液不饱和会出现这一现象吗?
提示:有晶体析出。
说明NaHCO3的溶解度比Na2CO3的溶解度小。
向不饱和的Na2CO3溶液中通入CO2不一定有晶体析出,因为Na2CO3与NaHCO3都属于易溶物。
