11-12版高中化学全程学习方略配套课件:2.2.4镁的提取及应用(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:2.2.4镁的提取及应用(苏教版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-11 00:00:00 | ||
图片预览







文档简介
(共77张PPT)
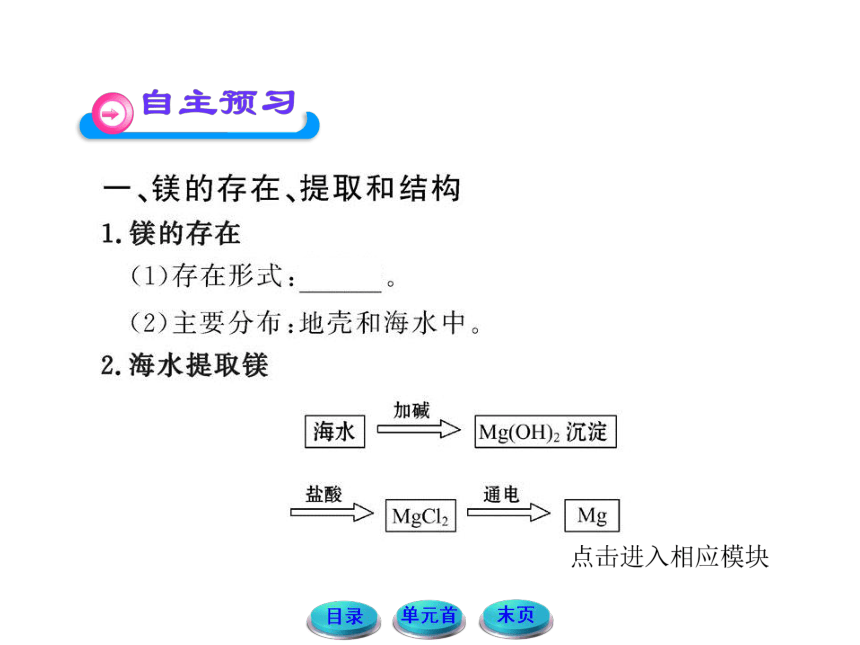
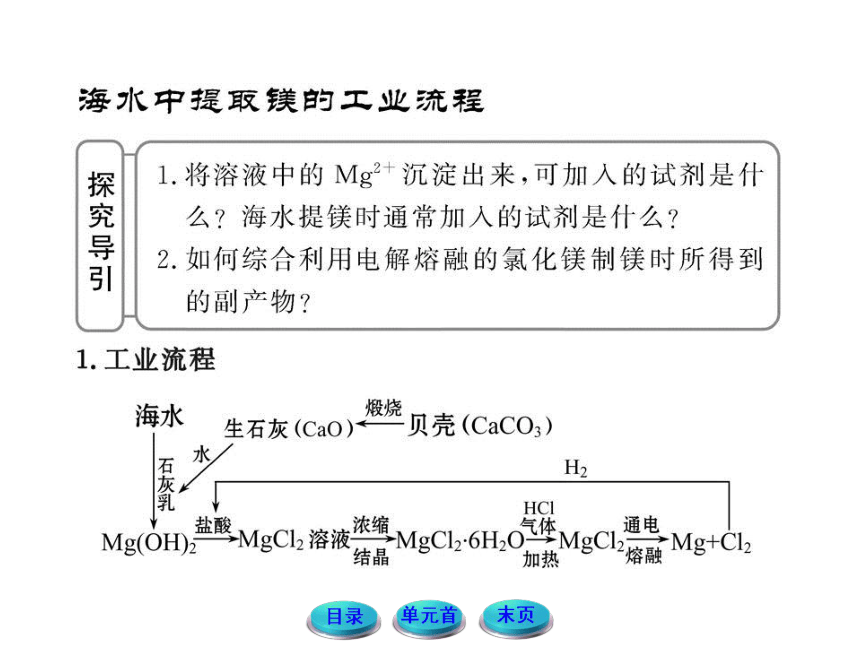
【典例】(双选)海水中含氯化镁,是镁和氯气
的重要来源之一,从海水中提镁,可按如下步骤进行:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳进行反应,沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤、干燥产物;
④将得到的产物熔融后电解。
下列关于提取镁的说法正确的是
A.此法的优点之一是原料来源丰富
B.进行步骤①②的目的是从海水中提取氯化镁
C.以上提取镁的过程中涉及的反应类型有3种
D.第④步电解时会产生氯气
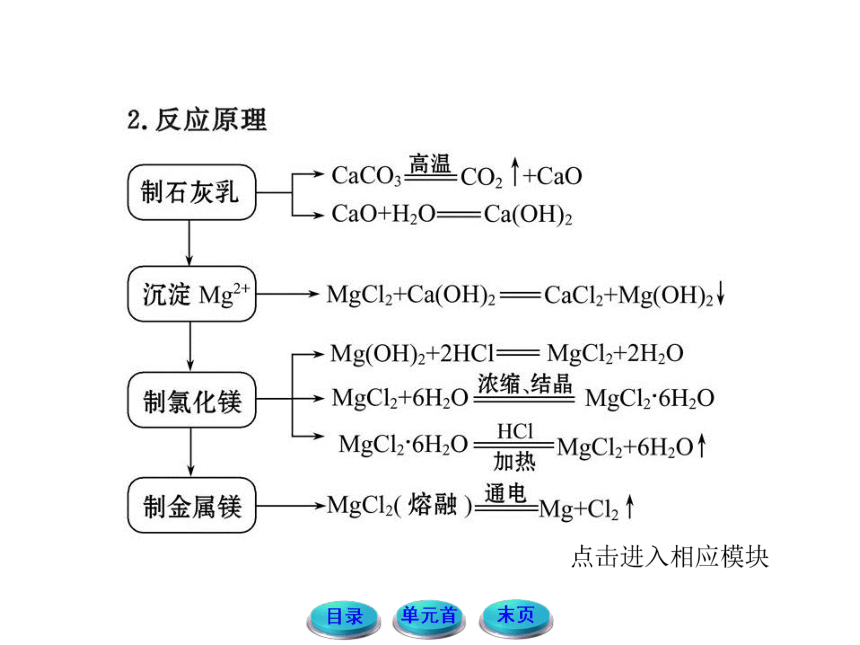
【思路点拨】海水提镁流程:
【自主解答】选A、D。步骤①②的目的是为了得到氢氧化镁;提取镁的过程中贝壳煅烧是分解反应,氧化钙与水反应是化合反应,氢氧化钙与氯化镁反应是复分解反应,电解氯化镁是氧化还原反应,共四种反应类型。
【互动探究】1.为什么把贝壳制成石灰乳而不是石灰水?
提示:石灰水浓度太小,不利于氯化镁转化成氢氧化镁。
2.实验室中如何洗涤沉淀
提示:向漏斗中加少量蒸馏水至没过沉淀,滤干后重复操作2~3次。
【误区警示】因为海水提镁用的是石灰乳,不是澄清石灰水,所以反应MgCl2+Ca(OH)2====CaCl2+Mg(OH)2↓的离子方程式应该写成Mg2++Ca(OH)2====Ca2++Mg(OH)2↓的形式。
【变式训练】某化学兴趣小组设计了四种从海水中提取镁单质的工业流程,你认为合理的是( )
A.海水 Mg(OH)2 Mg
B.海水 MgCl2(熔融) Mg
C.海水 Mg(OH)2 Mg
D.海水 Mg(OH)2 MgCl2(熔融) Mg
NaOH
蒸发
通电
通电
通电
石灰乳
盐酸
通电
石灰乳
【解析】选D。海水蒸发得到多种盐的混合物,包括氯化钠、氯化钙、氯化镁等;海水中加入碱可生成氢氧化镁,石灰乳比氢氧化钠廉价得多,所以应选择石灰乳;欲电解氢氧化镁,须先加热,而氢氧化镁受热易分解,生成氧化镁,氧化镁熔点很高,很难熔融;氯化镁熔点较低,电解熔融氯化镁节约成本。
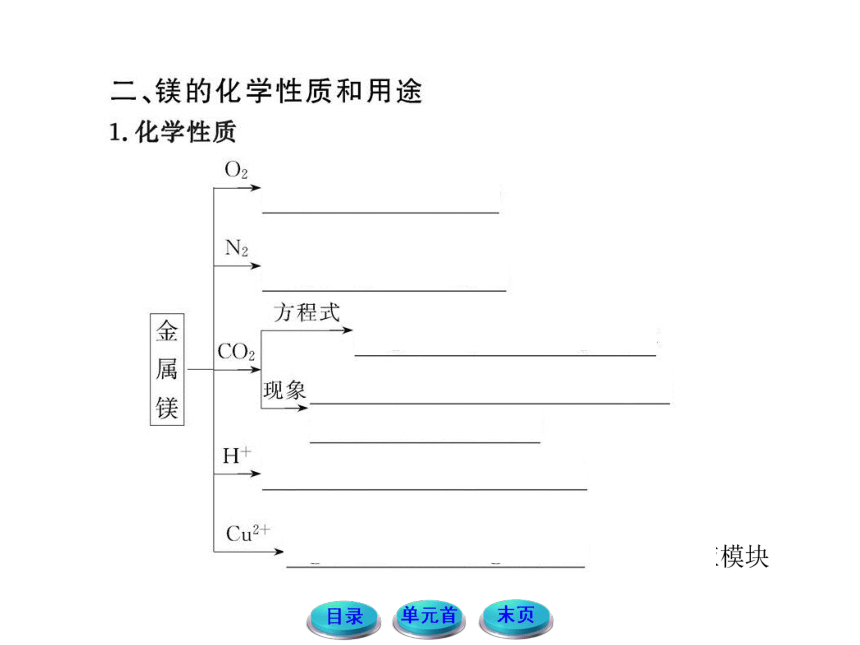
【典例】镁在空气里点燃可以燃烧,放出大量的热并发出耀眼的白光,生成白色的氧化镁,同时,镁在高温条件下,还可与空气中的另一种主要成分反应,生成少量的物质A,气体C能够使湿润的红色石蕊试纸变蓝。已知A有下列一系列变化:
(1)写出A、C、D的化学式:
A_________、C_________、D_________。
(2)写出下列变化的化学方程式:
①__________________________________,
②__________________________________。
【思路点拨】解答本题要明确以下两点:
【自主解答】镁在空气里燃烧时,主要和氧气反应生成MgO,还可以和氮气反应生成Mg3N2,所以A为Mg3N2。Mg3N2和盐酸反应得到的溶液B中一定含有Mg2+和Cl-,所以沉淀D一定是Mg(OH)2,能够使湿润的红色石蕊试纸变蓝的气体是氨气,NH4+能够和NaOH溶液反应放出NH3,所以溶液B中还含有NH4+,即它为MgCl2和NH4Cl的混合物。
答案:(1)Mg3N2 NH3 Mg(OH)2
(2)①Mg3N2+8HCl====3MgCl2+2NH4Cl
②MgCl2+2NaOH====Mg(OH)2↓+2NaCl,
NH4Cl+NaOH NaCl+H2O+NH3↑
△
====
【互动探究】一定量的镁分别在氧气、氮气、CO2中完全燃烧,生成固体的质量按照由大到小的顺序如何?
提示:1 mol Mg在O2中燃烧生成1 mol MgO,増重16 g,1mol
Mg在N2中燃烧生成 mol Mg3N2,増重 mol×28 g/mol=
9.33 g,1 mol Mg在CO2中燃烧反应为2Mg+CO2 2MgO+C,会生成1 mol MgO和0.5 mol C,増重22 g,所以在CO2中燃烧增重最大,在氧气中燃烧增重次之,在氮气中燃烧增重最小。
点燃
====
【变式训练】已知锂和镁的单质及其化合物在很多性质上具有相似性,由此可以推断下列关于锂及其化合物的叙述中,正确的是( )
A.LiOH加热时,不会分解
B.Li2CO3加热时,不会分解
C.Li在氧气中燃烧生成Li2O2
D.Li与稀硫酸反应生成Li2SO4
【解析】选D。类比镁及其化合物的性质:Mg(OH)2和MgCO3受热都容易分解,LiOH与Li2CO3受热也容易分解,A和B选项错误;Mg在氧气中燃烧生成普通的氧化物MgO,所以Li在氧气中燃烧生成Li2O,C选项错误;Mg与稀硫酸反应生成MgSO4和氢气,Li与稀硫酸反应生成Li2SO4和氢气,D选项正确。
【典例】工业“从海水中提取镁”的流程如图所示:
其步骤为:
①将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
②将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
④将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
⑤电解熔融的氯化镁可得到Mg。
请回答下列问题:
(1)步骤③中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有_________。
(2)上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中两点:___________________。
(3)有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什么?
你的观点是_______________________________。
理由是___________________________________。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的目的:
溶解时:__________________________________;
过滤时:__________________________________;
蒸发时:__________________________________。
(5)取上面制得的三份等质量的镁使其分别在足量的
①氮气②氧气③二氧化碳中燃烧,则剩余固体质量从大到小的排列顺序是__________(填序号)。
【错因剖析】
【标准答案】(1)蒸发皿、玻璃棒、酒精灯、铁架台
(2)①电解产生的Cl2用于制取HCl气体 ②利用贝壳作为原料制备石灰乳
(3)不同意 因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本
(4)搅拌,加速溶解
引流,使待过滤液体沿玻璃棒流入漏斗,防止外洒
搅拌,防止因局部过热,产生液滴或晶体飞溅
(5)③>②>①
1.下列离子或分子中,不能与金属镁反应的是( )
A.H+ B.OH- C.N2 D.CO2
【解析】选B。金属镁和H+、N2、CO2反应的方程式分别为:Mg+2H+====Mg2++H2↑、3Mg+N2 Mg3N2、2Mg+CO2 2MgO+C。
点燃
====
点燃
====
2.下列叙述镁的性质中,正确的是( )
A.在氮气中不能燃烧
B.与水不能反应释放出氢气
C.在氯气中燃烧会产生白烟
D.镁条可在二氧化碳气体中燃烧只生成白色固体
【解析】选C。镁活泼,能在氮气中燃烧。镁可与沸水反应生成Mg(OH)2和H2。镁与氯气反应生成MgCl2(白色固体)。镁可与 CO2 反应生成MgO和C,C为黑色固体。
3.广州亚运会开幕式上的礼花,让广州显得更加辉煌、浪漫。其中镁粉可用来制造焰火,工业上制取镁粉的方法是将镁的蒸气进行冷却,其中最适宜的方法是( )
A.在氮气的容器内冷却
B.在水中冷却
C.在氢气的环境里冷却
D.在二氧化碳气体里冷却
【解析】选C。镁性质活泼且镁蒸气温度较高,易与氮气、二氧化碳、冷水发生反应,故选C。
4.除去溶液中的Mg2+,应该选用的试剂是( )
A.AgNO3溶液 B.NaOH溶液
C.Na2SO4溶液 D.NaCl溶液
【解析】选B。AgNO3溶液、Na2SO4溶液、NaCl溶液和Mg2+都不能发生反应,NaOH溶液除去Mg2+反应的离子方程式为Mg2++2OH-====Mg(OH)2↓。
5.镁及其化合物在生产和生活中有着广泛的应用,试回答下列问题:
(1)常用作耐火材料的镁的化合物的化学式是_________。
(2)在军事上金属镁可以用于制造信号弹和焰火,其反应原理用化学方程式可以表示为___________。
(3)Mg(OH)2是治疗胃酸过多药品的重要成分之一,其反应原理用离子方程式可以表示为___________。
(4)用于“点豆腐”的氯化镁结晶水合物化学式是MgCl2·
nH2O,取10.15 g此结晶水合物溶于水,加入足量的AgNO3溶液,得到氯化银沉淀14.35 g。则n的值是______。
【解析】本题考查了镁及其化合物的用途、性质、化学方程式及离子方程式的书写以及利用关系式进行简单的计算等知识。第(4)问:MgCl2·nH2O~2AgCl,
n(MgCl2·nH2O)= n(AgCl)= =0.05 mol,M(MgCl2·nH2O)= =203 g/mol,所以24+71+18n=203,n=6。
答案:(1)MgO
(2)2Mg+O2 2MgO
(3)Mg(OH)2+2H+====Mg2++2H2O (4)6
点燃
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.已知MgO和MgCl2的熔点分别为2 800 ℃、604 ℃,将MgO和MgCl2加热至熔融后再电解,都可以得到金属镁。海水中含有MgCl2,从海水中提取金属镁,正确的方法是( )
【解析】选D。从海水中提取金属镁,应该先加碱将镁离子富集,但是使用NaOH溶液成本高,而且Mg(OH)2加热时会分解生成MgO,得不到Mg,所以A项错误。海水中加HCl无法得到MgCl2,B项错误。MgO的熔点远高于MgCl2的熔点,电解熔融的MgO耗能大,经济效益差,所以应该用电解熔融的MgCl2制金属镁,所以C项错,D项正确。
2.(2011·杭州高一检测)下列有关镁及其化合物的离子方程式书写正确的是( )
A.MgCO3与盐酸反应:CO32-+2H+====CO2↑+H2O
B.Mg(OH)2与H2SO4反应:
Mg2++2OH-+2H++SO42-====MgSO4↓+2H2O
C.镁与醋酸反应:Mg+2H+====Mg2++H2↑
D.工业上以海水为原料制备Mg(OH)2:
Ca(OH)2+Mg2+====Mg(OH)2↓+Ca2+
【解析】选D。MgCO3和Mg(OH)2都是难溶性物质,醋酸为弱电解质,在写离子方程式时不能拆成离子形式,MgSO4是可溶性的盐,在写离子方程式时要拆成Mg2+和SO42-的形式,A、B、C选项中的方程式都错误;工业上以海水为原料制备Mg(OH)2时,要在海水中加入石灰乳,而不是石灰水,所以Ca(OH)2不能拆成离子的形式。
3.下列关于镁和钠及其合金的比较结论正确的是( )
A.铝镁合金的硬度较大,钠钾合金的硬度较小
B.因为钠的金属性比镁要强,所以钠的熔点比镁要高
C.镁能置换硫酸铜中的铜,钠也能置换硫酸铜中的铜
D.在空气中都能被点燃,生成的产物都是氧化物,无过氧化物
【解析】选A。钠钾合金常温下呈液态,故A项正确;熔点与金属性强弱无关,故B项错;由于钠可以与水反应,故钠不能置换出CuSO4中的铜,C项错;钠在空气中点燃会生成Na2O2,D项错。
【方法技巧】钠和镁性质的比较
(1)钠和冷水剧烈反应,镁和冷水反应缓慢。
(2)钠和镁着火时均不能用水或CO2灭火,因为镁与CO2反应,钠燃烧的产物Na2O2和CO2反应。镁和钠都能够和水反应放出氢气,能够引起爆炸。
(3)制备镁和钠时都能用电解其熔融的氯化物的方法。
(4)二者在自然界中都以化合态形式存在。
4.(2011·盐城高一检测)某溶液中可能含Na2CO3、MgCl2、NaHCO3和BaCl2中的一种或几种。向该溶液中加入NaOH溶液出现白色沉淀,若加稀硫酸也出现白色沉淀并放出气体。下列判断正确的是( )
A.肯定含BaCl2 B.肯定含MgCl2
C.肯定有Na2CO3 D.肯定没有NaHCO3
【解析】选A。加稀硫酸出现的白色沉淀一定是BaSO4,所以溶液中一定含有BaCl2;BaCl2能够和Na2CO3溶液反应,所以一定没有Na2CO3,而放出的气体一定是CO2,所以一定含有NaHCO3;MgCl2能够和NaOH溶液反应生成Mg(OH)2沉淀,NaHCO3能够和NaOH溶液反应生成Na2CO3,Na2CO3能够和BaCl2溶液反应生成BaCO3沉淀,它们都能够溶于稀硫酸,所以无法判断溶液中是否有MgCl2的存在。
5.某碱式盐的化学式为Mg(1+x)(CO3)x(OH)2,取1.55 g该固体恰好与10 mL 4 mol·L-1硝酸完全反应,所得溶液仅为Mg(NO3)2溶液,则x值为( )
A.1 B.2 C.3 D.5
【解析】选C。n(HNO3)=4 mol/L×0.01 L=0.04 mol,
由于Mg(NO3)2~2HNO3,所以n[Mg(NO3)2]= n(HNO3)=
0.02 mol,假设该碱式碳酸镁的物质的量为a,则有:a×(24+24x+60x+17×2) g/mol=1.55 g,a+ax=0.02 mol,解得:a=0.005 mol,x=3。
二、非选择题(本题包括3小题,共30分)
6.(10分)干粉灭火器的主要原料为NaHCO3,是一种常用的灭火器,回答下列问题:
(1)干粉灭火器的灭火原理是________________________
(用化学方程式表示)。
(2)镁失火时,_________________(填“能”或“不能”)用干粉灭火器的灭火,其原因是(用化学方程式表示)
________________________________________________。
【解析】(1)NaHCO3受热分解产生的CO2不能支持燃烧,密度比空气的大,可以隔绝空气,所以可以用来灭火;(2)镁能够在CO2中燃烧,所以不能用干粉灭火器灭火,应该用沙土盖灭。
答案:(1)2NaHCO3 Na2CO3+CO2↑+H2O
(2)不能 2Mg+CO2 2MgO+C
△
====
点燃
====
7.(10分)氢氧化镁是一种重要的绿色阻燃剂,还可以用于制药工业。
(1)治疗胃酸过多的药物Stmoache的有效成分为Mg(OH)2。该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式:____________________________________。
(2)氢氧化镁可以作为阻燃剂的原因__________________
___________________。(写一条即可)
【解析】(1)Mg(OH)2是一种难溶性碱,能够中和胃酸中过多的盐酸而达到治疗胃酸的目的。(2)“阻燃剂”顾名思义就是能够阻止火继续燃烧的试剂,着火时Mg(OH)2受热分解,吸收热量,可以降低火焰的温度,使温度达到着火点以下,从而灭火。
答案:(1)Mg(OH)2+2H+====Mg2++2H2O
(2)氢氧化镁分解要吸收大量的热
8.(10分)(挑战能力)镁及其合金是一种用途很广的金属材料,海水中镁的含量约为1.8×1015 t,目前世界上60%的镁是从海水中提取的。主要步骤如下:
(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用_____________________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_______________________________________。
(3)试剂②可以选用_____________,其反应的离子方程式为____________。
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式______________________________。
【解析】(1)使MgSO4完全转化为Mg(OH)2,可以加入Ca(OH)2、KOH、NaOH和Ba(OH)2等碱,由于Ca(OH)2可以用海边大量的贝壳制得而且价廉,所以试剂①最好选用Ca(OH)2;(2)从溶液中分离出固体可以采用过滤的方法;(3)将Mg(OH)2沉淀转化为MgCl2溶液可加入盐酸,其反应的离子方程式为Mg(OH)2+2H+====Mg2++2H2O;
答案:(1)Ca(OH)2 (2)过滤
(3)盐酸 Mg(OH)2+2H+====Mg2++2H2O
(4)MgCl2(熔融) Mg+Cl2↑
通电
====
有一包含有少量碳酸钙的氧化镁粉末,某课外活动小组通过下面的实验来测定混合粉末中氧化镁的质量分数。请你根据他们设计的下列操作步骤进行补充,并回答有关问题。
(1)称取3.3 g样品放入锥形瓶中,缓慢滴入60 mL
3.0 mol·L-1的盐酸。滴加盐酸过程中,锥形瓶内可观察到的现象是___________。
(2)加入足量的NaOH溶液。
(3)称量一张滤纸(其质量为W1 g)安装过滤器,过滤。
(4)__________________,目的是___________________。
(5)取滤渣连同滤纸放在坩埚内进行干燥与灼烧至恒重W3 g
(已知坩埚的质量为W2 g),滤渣经灼烧后,固体物质的成分(不考虑滤纸灰)是___________(填化学式)。
(6)取另一张质量与过滤时所使用的相同的滤纸放在另一坩埚(质量为W4 g)内干燥与灼烧至恒重W5 g。则该样品中氧化镁的质量分数为_____________。
【解析】本实验的设计思路如下:
反应的化学方程式为CaCO3+2HCl====CaCl2+CO2↑+H2O、MgO+
2HCl====MgCl2+H2O,MgCl2+2NaOH====Mg(OH)2↓+2NaCl,
Mg(OH)2 MgO+H2O。所以滤渣经灼烧后,得到的固体为
MgO,MgO和滤纸灰的质量为(W3-W2) g,滤纸灰的质量为(W5
-W4) g,所以MgO的质量为(W3-W2) g-(W5-W4) g,所以样
品中氧化镁的质量分数为
△
====
答案:(1)有无色气泡冒出;粉末逐渐溶解,直至全部消失
(4)用水洗涤沉淀2~3次洗去沉淀中可溶性杂质
(5)MgO
(6)
【典例】(双选)海水中含氯化镁,是镁和氯气
的重要来源之一,从海水中提镁,可按如下步骤进行:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳进行反应,沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤、干燥产物;
④将得到的产物熔融后电解。
下列关于提取镁的说法正确的是
A.此法的优点之一是原料来源丰富
B.进行步骤①②的目的是从海水中提取氯化镁
C.以上提取镁的过程中涉及的反应类型有3种
D.第④步电解时会产生氯气
【思路点拨】海水提镁流程:
【自主解答】选A、D。步骤①②的目的是为了得到氢氧化镁;提取镁的过程中贝壳煅烧是分解反应,氧化钙与水反应是化合反应,氢氧化钙与氯化镁反应是复分解反应,电解氯化镁是氧化还原反应,共四种反应类型。
【互动探究】1.为什么把贝壳制成石灰乳而不是石灰水?
提示:石灰水浓度太小,不利于氯化镁转化成氢氧化镁。
2.实验室中如何洗涤沉淀
提示:向漏斗中加少量蒸馏水至没过沉淀,滤干后重复操作2~3次。
【误区警示】因为海水提镁用的是石灰乳,不是澄清石灰水,所以反应MgCl2+Ca(OH)2====CaCl2+Mg(OH)2↓的离子方程式应该写成Mg2++Ca(OH)2====Ca2++Mg(OH)2↓的形式。
【变式训练】某化学兴趣小组设计了四种从海水中提取镁单质的工业流程,你认为合理的是( )
A.海水 Mg(OH)2 Mg
B.海水 MgCl2(熔融) Mg
C.海水 Mg(OH)2 Mg
D.海水 Mg(OH)2 MgCl2(熔融) Mg
NaOH
蒸发
通电
通电
通电
石灰乳
盐酸
通电
石灰乳
【解析】选D。海水蒸发得到多种盐的混合物,包括氯化钠、氯化钙、氯化镁等;海水中加入碱可生成氢氧化镁,石灰乳比氢氧化钠廉价得多,所以应选择石灰乳;欲电解氢氧化镁,须先加热,而氢氧化镁受热易分解,生成氧化镁,氧化镁熔点很高,很难熔融;氯化镁熔点较低,电解熔融氯化镁节约成本。
【典例】镁在空气里点燃可以燃烧,放出大量的热并发出耀眼的白光,生成白色的氧化镁,同时,镁在高温条件下,还可与空气中的另一种主要成分反应,生成少量的物质A,气体C能够使湿润的红色石蕊试纸变蓝。已知A有下列一系列变化:
(1)写出A、C、D的化学式:
A_________、C_________、D_________。
(2)写出下列变化的化学方程式:
①__________________________________,
②__________________________________。
【思路点拨】解答本题要明确以下两点:
【自主解答】镁在空气里燃烧时,主要和氧气反应生成MgO,还可以和氮气反应生成Mg3N2,所以A为Mg3N2。Mg3N2和盐酸反应得到的溶液B中一定含有Mg2+和Cl-,所以沉淀D一定是Mg(OH)2,能够使湿润的红色石蕊试纸变蓝的气体是氨气,NH4+能够和NaOH溶液反应放出NH3,所以溶液B中还含有NH4+,即它为MgCl2和NH4Cl的混合物。
答案:(1)Mg3N2 NH3 Mg(OH)2
(2)①Mg3N2+8HCl====3MgCl2+2NH4Cl
②MgCl2+2NaOH====Mg(OH)2↓+2NaCl,
NH4Cl+NaOH NaCl+H2O+NH3↑
△
====
【互动探究】一定量的镁分别在氧气、氮气、CO2中完全燃烧,生成固体的质量按照由大到小的顺序如何?
提示:1 mol Mg在O2中燃烧生成1 mol MgO,増重16 g,1mol
Mg在N2中燃烧生成 mol Mg3N2,増重 mol×28 g/mol=
9.33 g,1 mol Mg在CO2中燃烧反应为2Mg+CO2 2MgO+C,会生成1 mol MgO和0.5 mol C,増重22 g,所以在CO2中燃烧增重最大,在氧气中燃烧增重次之,在氮气中燃烧增重最小。
点燃
====
【变式训练】已知锂和镁的单质及其化合物在很多性质上具有相似性,由此可以推断下列关于锂及其化合物的叙述中,正确的是( )
A.LiOH加热时,不会分解
B.Li2CO3加热时,不会分解
C.Li在氧气中燃烧生成Li2O2
D.Li与稀硫酸反应生成Li2SO4
【解析】选D。类比镁及其化合物的性质:Mg(OH)2和MgCO3受热都容易分解,LiOH与Li2CO3受热也容易分解,A和B选项错误;Mg在氧气中燃烧生成普通的氧化物MgO,所以Li在氧气中燃烧生成Li2O,C选项错误;Mg与稀硫酸反应生成MgSO4和氢气,Li与稀硫酸反应生成Li2SO4和氢气,D选项正确。
【典例】工业“从海水中提取镁”的流程如图所示:
其步骤为:
①将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
②将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
④将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
⑤电解熔融的氯化镁可得到Mg。
请回答下列问题:
(1)步骤③中的蒸发是利用风吹日晒来完成的,而在实验室中进行蒸发操作需要的主要仪器有_________。
(2)上述提取镁的流程中,在降低成本、减少污染方面做了一些工作,请写出其中两点:___________________。
(3)有同学认为:步骤②后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你同意该同学的想法吗?为什么?
你的观点是_______________________________。
理由是___________________________________。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的目的:
溶解时:__________________________________;
过滤时:__________________________________;
蒸发时:__________________________________。
(5)取上面制得的三份等质量的镁使其分别在足量的
①氮气②氧气③二氧化碳中燃烧,则剩余固体质量从大到小的排列顺序是__________(填序号)。
【错因剖析】
【标准答案】(1)蒸发皿、玻璃棒、酒精灯、铁架台
(2)①电解产生的Cl2用于制取HCl气体 ②利用贝壳作为原料制备石灰乳
(3)不同意 因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本
(4)搅拌,加速溶解
引流,使待过滤液体沿玻璃棒流入漏斗,防止外洒
搅拌,防止因局部过热,产生液滴或晶体飞溅
(5)③>②>①
1.下列离子或分子中,不能与金属镁反应的是( )
A.H+ B.OH- C.N2 D.CO2
【解析】选B。金属镁和H+、N2、CO2反应的方程式分别为:Mg+2H+====Mg2++H2↑、3Mg+N2 Mg3N2、2Mg+CO2 2MgO+C。
点燃
====
点燃
====
2.下列叙述镁的性质中,正确的是( )
A.在氮气中不能燃烧
B.与水不能反应释放出氢气
C.在氯气中燃烧会产生白烟
D.镁条可在二氧化碳气体中燃烧只生成白色固体
【解析】选C。镁活泼,能在氮气中燃烧。镁可与沸水反应生成Mg(OH)2和H2。镁与氯气反应生成MgCl2(白色固体)。镁可与 CO2 反应生成MgO和C,C为黑色固体。
3.广州亚运会开幕式上的礼花,让广州显得更加辉煌、浪漫。其中镁粉可用来制造焰火,工业上制取镁粉的方法是将镁的蒸气进行冷却,其中最适宜的方法是( )
A.在氮气的容器内冷却
B.在水中冷却
C.在氢气的环境里冷却
D.在二氧化碳气体里冷却
【解析】选C。镁性质活泼且镁蒸气温度较高,易与氮气、二氧化碳、冷水发生反应,故选C。
4.除去溶液中的Mg2+,应该选用的试剂是( )
A.AgNO3溶液 B.NaOH溶液
C.Na2SO4溶液 D.NaCl溶液
【解析】选B。AgNO3溶液、Na2SO4溶液、NaCl溶液和Mg2+都不能发生反应,NaOH溶液除去Mg2+反应的离子方程式为Mg2++2OH-====Mg(OH)2↓。
5.镁及其化合物在生产和生活中有着广泛的应用,试回答下列问题:
(1)常用作耐火材料的镁的化合物的化学式是_________。
(2)在军事上金属镁可以用于制造信号弹和焰火,其反应原理用化学方程式可以表示为___________。
(3)Mg(OH)2是治疗胃酸过多药品的重要成分之一,其反应原理用离子方程式可以表示为___________。
(4)用于“点豆腐”的氯化镁结晶水合物化学式是MgCl2·
nH2O,取10.15 g此结晶水合物溶于水,加入足量的AgNO3溶液,得到氯化银沉淀14.35 g。则n的值是______。
【解析】本题考查了镁及其化合物的用途、性质、化学方程式及离子方程式的书写以及利用关系式进行简单的计算等知识。第(4)问:MgCl2·nH2O~2AgCl,
n(MgCl2·nH2O)= n(AgCl)= =0.05 mol,M(MgCl2·nH2O)= =203 g/mol,所以24+71+18n=203,n=6。
答案:(1)MgO
(2)2Mg+O2 2MgO
(3)Mg(OH)2+2H+====Mg2++2H2O (4)6
点燃
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.已知MgO和MgCl2的熔点分别为2 800 ℃、604 ℃,将MgO和MgCl2加热至熔融后再电解,都可以得到金属镁。海水中含有MgCl2,从海水中提取金属镁,正确的方法是( )
【解析】选D。从海水中提取金属镁,应该先加碱将镁离子富集,但是使用NaOH溶液成本高,而且Mg(OH)2加热时会分解生成MgO,得不到Mg,所以A项错误。海水中加HCl无法得到MgCl2,B项错误。MgO的熔点远高于MgCl2的熔点,电解熔融的MgO耗能大,经济效益差,所以应该用电解熔融的MgCl2制金属镁,所以C项错,D项正确。
2.(2011·杭州高一检测)下列有关镁及其化合物的离子方程式书写正确的是( )
A.MgCO3与盐酸反应:CO32-+2H+====CO2↑+H2O
B.Mg(OH)2与H2SO4反应:
Mg2++2OH-+2H++SO42-====MgSO4↓+2H2O
C.镁与醋酸反应:Mg+2H+====Mg2++H2↑
D.工业上以海水为原料制备Mg(OH)2:
Ca(OH)2+Mg2+====Mg(OH)2↓+Ca2+
【解析】选D。MgCO3和Mg(OH)2都是难溶性物质,醋酸为弱电解质,在写离子方程式时不能拆成离子形式,MgSO4是可溶性的盐,在写离子方程式时要拆成Mg2+和SO42-的形式,A、B、C选项中的方程式都错误;工业上以海水为原料制备Mg(OH)2时,要在海水中加入石灰乳,而不是石灰水,所以Ca(OH)2不能拆成离子的形式。
3.下列关于镁和钠及其合金的比较结论正确的是( )
A.铝镁合金的硬度较大,钠钾合金的硬度较小
B.因为钠的金属性比镁要强,所以钠的熔点比镁要高
C.镁能置换硫酸铜中的铜,钠也能置换硫酸铜中的铜
D.在空气中都能被点燃,生成的产物都是氧化物,无过氧化物
【解析】选A。钠钾合金常温下呈液态,故A项正确;熔点与金属性强弱无关,故B项错;由于钠可以与水反应,故钠不能置换出CuSO4中的铜,C项错;钠在空气中点燃会生成Na2O2,D项错。
【方法技巧】钠和镁性质的比较
(1)钠和冷水剧烈反应,镁和冷水反应缓慢。
(2)钠和镁着火时均不能用水或CO2灭火,因为镁与CO2反应,钠燃烧的产物Na2O2和CO2反应。镁和钠都能够和水反应放出氢气,能够引起爆炸。
(3)制备镁和钠时都能用电解其熔融的氯化物的方法。
(4)二者在自然界中都以化合态形式存在。
4.(2011·盐城高一检测)某溶液中可能含Na2CO3、MgCl2、NaHCO3和BaCl2中的一种或几种。向该溶液中加入NaOH溶液出现白色沉淀,若加稀硫酸也出现白色沉淀并放出气体。下列判断正确的是( )
A.肯定含BaCl2 B.肯定含MgCl2
C.肯定有Na2CO3 D.肯定没有NaHCO3
【解析】选A。加稀硫酸出现的白色沉淀一定是BaSO4,所以溶液中一定含有BaCl2;BaCl2能够和Na2CO3溶液反应,所以一定没有Na2CO3,而放出的气体一定是CO2,所以一定含有NaHCO3;MgCl2能够和NaOH溶液反应生成Mg(OH)2沉淀,NaHCO3能够和NaOH溶液反应生成Na2CO3,Na2CO3能够和BaCl2溶液反应生成BaCO3沉淀,它们都能够溶于稀硫酸,所以无法判断溶液中是否有MgCl2的存在。
5.某碱式盐的化学式为Mg(1+x)(CO3)x(OH)2,取1.55 g该固体恰好与10 mL 4 mol·L-1硝酸完全反应,所得溶液仅为Mg(NO3)2溶液,则x值为( )
A.1 B.2 C.3 D.5
【解析】选C。n(HNO3)=4 mol/L×0.01 L=0.04 mol,
由于Mg(NO3)2~2HNO3,所以n[Mg(NO3)2]= n(HNO3)=
0.02 mol,假设该碱式碳酸镁的物质的量为a,则有:a×(24+24x+60x+17×2) g/mol=1.55 g,a+ax=0.02 mol,解得:a=0.005 mol,x=3。
二、非选择题(本题包括3小题,共30分)
6.(10分)干粉灭火器的主要原料为NaHCO3,是一种常用的灭火器,回答下列问题:
(1)干粉灭火器的灭火原理是________________________
(用化学方程式表示)。
(2)镁失火时,_________________(填“能”或“不能”)用干粉灭火器的灭火,其原因是(用化学方程式表示)
________________________________________________。
【解析】(1)NaHCO3受热分解产生的CO2不能支持燃烧,密度比空气的大,可以隔绝空气,所以可以用来灭火;(2)镁能够在CO2中燃烧,所以不能用干粉灭火器灭火,应该用沙土盖灭。
答案:(1)2NaHCO3 Na2CO3+CO2↑+H2O
(2)不能 2Mg+CO2 2MgO+C
△
====
点燃
====
7.(10分)氢氧化镁是一种重要的绿色阻燃剂,还可以用于制药工业。
(1)治疗胃酸过多的药物Stmoache的有效成分为Mg(OH)2。该药物治疗胃酸(主要成分为盐酸)过多症时反应的离子方程式:____________________________________。
(2)氢氧化镁可以作为阻燃剂的原因__________________
___________________。(写一条即可)
【解析】(1)Mg(OH)2是一种难溶性碱,能够中和胃酸中过多的盐酸而达到治疗胃酸的目的。(2)“阻燃剂”顾名思义就是能够阻止火继续燃烧的试剂,着火时Mg(OH)2受热分解,吸收热量,可以降低火焰的温度,使温度达到着火点以下,从而灭火。
答案:(1)Mg(OH)2+2H+====Mg2++2H2O
(2)氢氧化镁分解要吸收大量的热
8.(10分)(挑战能力)镁及其合金是一种用途很广的金属材料,海水中镁的含量约为1.8×1015 t,目前世界上60%的镁是从海水中提取的。主要步骤如下:
(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用_____________________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_______________________________________。
(3)试剂②可以选用_____________,其反应的离子方程式为____________。
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式______________________________。
【解析】(1)使MgSO4完全转化为Mg(OH)2,可以加入Ca(OH)2、KOH、NaOH和Ba(OH)2等碱,由于Ca(OH)2可以用海边大量的贝壳制得而且价廉,所以试剂①最好选用Ca(OH)2;(2)从溶液中分离出固体可以采用过滤的方法;(3)将Mg(OH)2沉淀转化为MgCl2溶液可加入盐酸,其反应的离子方程式为Mg(OH)2+2H+====Mg2++2H2O;
答案:(1)Ca(OH)2 (2)过滤
(3)盐酸 Mg(OH)2+2H+====Mg2++2H2O
(4)MgCl2(熔融) Mg+Cl2↑
通电
====
有一包含有少量碳酸钙的氧化镁粉末,某课外活动小组通过下面的实验来测定混合粉末中氧化镁的质量分数。请你根据他们设计的下列操作步骤进行补充,并回答有关问题。
(1)称取3.3 g样品放入锥形瓶中,缓慢滴入60 mL
3.0 mol·L-1的盐酸。滴加盐酸过程中,锥形瓶内可观察到的现象是___________。
(2)加入足量的NaOH溶液。
(3)称量一张滤纸(其质量为W1 g)安装过滤器,过滤。
(4)__________________,目的是___________________。
(5)取滤渣连同滤纸放在坩埚内进行干燥与灼烧至恒重W3 g
(已知坩埚的质量为W2 g),滤渣经灼烧后,固体物质的成分(不考虑滤纸灰)是___________(填化学式)。
(6)取另一张质量与过滤时所使用的相同的滤纸放在另一坩埚(质量为W4 g)内干燥与灼烧至恒重W5 g。则该样品中氧化镁的质量分数为_____________。
【解析】本实验的设计思路如下:
反应的化学方程式为CaCO3+2HCl====CaCl2+CO2↑+H2O、MgO+
2HCl====MgCl2+H2O,MgCl2+2NaOH====Mg(OH)2↓+2NaCl,
Mg(OH)2 MgO+H2O。所以滤渣经灼烧后,得到的固体为
MgO,MgO和滤纸灰的质量为(W3-W2) g,滤纸灰的质量为(W5
-W4) g,所以MgO的质量为(W3-W2) g-(W5-W4) g,所以样
品中氧化镁的质量分数为
△
====
答案:(1)有无色气泡冒出;粉末逐渐溶解,直至全部消失
(4)用水洗涤沉淀2~3次洗去沉淀中可溶性杂质
(5)MgO
(6)
