11-12版高中化学全程学习方略配套课件:3.2.2铁、铜的化合物的应用(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:3.2.2铁、铜的化合物的应用(苏教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-11 08:26:08 | ||
图片预览










文档简介
(共87张PPT)
【典例1】下列物质反应后一定有+3价铁生成的是
①过量的Fe与Cl2反应;
②Fe与过量稀硫酸反应后,再向其中加KNO3;
③Fe(NO3)2溶液中加少量盐酸;
④Fe和Fe2O3的混合物溶于盐酸中。
A.只有① B.只有①②
C.只有①②③ D.全部
【思路点拨】解答本题时应注意以下三点:
【自主解答】选C。本题涉及0价铁变为+3价铁、+2价铁变为+3价铁及+3价铁变为+2价铁,应从氧化剂的强弱、反应条件及反应物间的相对量进行分析。
①中的Cl2氧化性强,它能将铁氧化为+3价,由于不是在溶液中反应,因此过量的铁不会将氯化铁还原。
②中Fe与稀硫酸反应只能生成Fe2+,但要注意,由于稀硫酸过量,加入KNO3后,H+、NO3-能将Fe2+氧化成Fe3+。
③中不会发生复分解反应,但发生了Fe2+被NO3-氧化的反应,有Fe3+生成。
④中首先发生Fe与盐酸生成FeCl2、Fe2O3与盐酸生成FeCl3的反应,但题中未给出反应物间相对量的关系,若铁是足量的,则能将生成的FeCl3全部还原为FeCl2。
【互动探究】如何检验④中反应后的溶液中是否含有Fe3+?说出可能的方法。
提示:(1)在反应后的溶液中加适量的KSCN溶液,看是否变血红色;(2)加入单质铜,看铜是否被腐蚀。(3)也可用碘化钾淀粉试纸检验。
【变式训练】在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
【解析】选C。解此题要掌握单质铁有还原性,能和Cu2+、H+、Fe3+反应。另外,铁能被磁铁吸引是铁的一种重要物理性质。现在Fe单质有剩余则Cu2+、H+、Fe3+分别被还原为Cu、H2、Fe2+,故溶液中Fe2+最多,答案为C。
【典例2】将几滴KSCN(SCN-是“类卤离子”)溶液加入酸性的含有Fe3+的溶液中,溶液变成血红色,将该血红色溶液分为两份,①一份中加入适量KMnO4溶液,血红色褪去;②向另一份中通入SO2,血红色也褪去。下列说法不正确的是
A.①血红色褪去的原因是KMnO4将SCN-氧化,使Fe(SCN)3消失
B.②血红色褪去的原因是SO2将Fe3+还原为Fe2+
C.②血红色褪去的原因是SO2将SCN-还原
D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
【思路点拨】解答本题时应注意以下两方面问题
【自主解答】选C。由于SCN-是“类卤离子”,与卤素离子性质相似,可以被KMnO4(H+)氧化为(SCN)2,而使血红色消失。Fe3+具有氧化性,可被SO2还原为Fe2+,也可使血红色消失。综上分析可知C项错误。
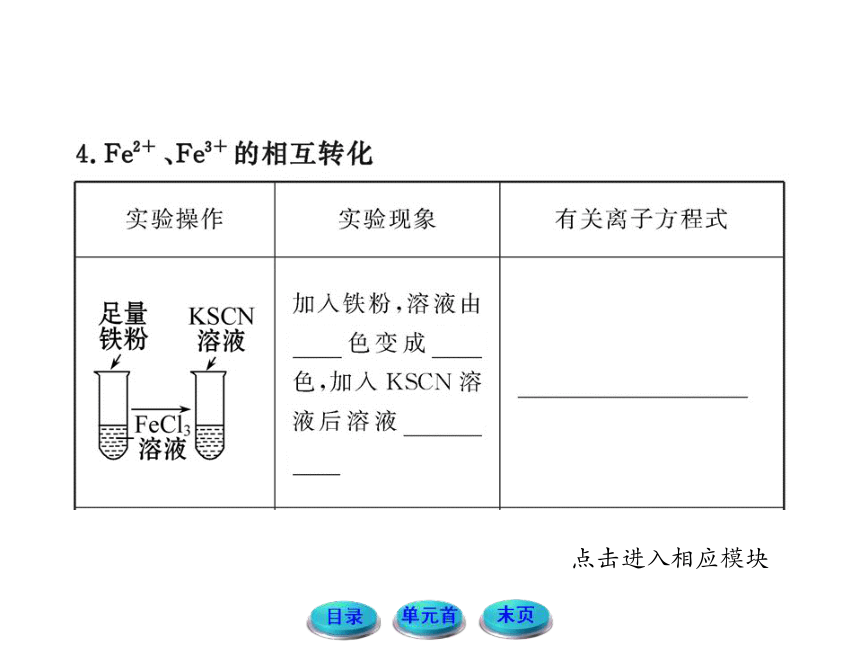
【互动探究】若加入KSCN溶液后,溶液变血红色,能否判断溶液中存在Fe2+?
提示:溶液变血红只是说明溶液中存在Fe3+,但不能说明溶液中是否存在Fe2+。
【规律方法】检验Fe2+时,要注意以下三点:
(1)试剂加入的先后顺序,防止Fe2+被氧化成Fe3+而干扰检验。
(2)防止加入强氧化性物质将Fe2+氧化,如酸性的NO3-、酸性的ClO-等。
(3)防止加入一些有色溶液,如酸性高锰酸钾溶液。
试液 不变色 血红色
KSCN溶液
氯水或双氧水
【变式训练】要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,最佳顺序为( )
①加入足量氯水
②加入足量酸性KMnO4溶液
③加入少量NH4SCN溶液
A.①③ B.③② C.③① D.①②③
【解析】选C。在该溶液中先加入少量NH4SCN溶液,溶液不变血红色,无Fe3+存在,再加入氯水,将Fe2+氧化成Fe3+,溶液变为血红色。酸性KMnO4溶液呈紫红色,溶液颜色变化不明显,所以这里不用酸性KMnO4溶液。
【典例】由于Fe(OH)2在空气中易被氧化,
同学们为了观察到白色的Fe(OH)2固体想
了很多方法。甲同学:在如图所示的装置
中,用NaOH溶液、铁屑、稀硫酸等制备。
(1)在试管Ⅰ里加入的试剂是________。
(2)Ⅱ中的试剂加入前应如何处理:
____________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧橡胶塞后的实验步骤是_________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________。
乙同学:只是将甲同学所用药品中的铁屑改为FeS固体,其余都与甲相同。
(5)对乙同学的这一改变请你作出评价:_____________。
【思路点拨】解答本题时应注意以下两方面问题
【自主解答】用FeSO4溶液与NaOH溶液反应制备Fe(OH)2并观察沉淀的颜色变化是中学化学中重要的演示实验。Fe(OH)2、FeSO4均易被氧化,应避免生成的Fe(OH)2沉淀接触到O2,可得答案。
乙同学将药品中的铁屑改为FeS固体,与稀硫酸反应生成H2S,H2S有强还原性。
答案:(1)稀硫酸和铁屑
(2)煮沸 (3)稍等片刻后关闭止水夹
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不易进入
(5)反应中生成的H2S也能防止Fe(OH)2被氧化,白色沉淀能存在较长时间,但易产生空气污染
【互动探究】试思考有没有一个更简单的防止Fe(OH)2被氧化的方法?
提示:在液面上加隔氧剂:用密度比水小的且不溶于水的有机溶剂,如汽油、植物油等物质滴加在反应液面上进行液封,以减少Fe(OH)2与O2接触。(不能用四氯化碳,因为四氯化碳密度比水大,加入后它会处于试管底部,起不到隔离空气的作用)
【变式训练】下列实验能达到实验目的且符合安全要求的是( )
【解析】选B。氢氧化亚铁易被O2氧化,盛NaOH的胶头滴管必须插入溶液中,故A项错;O2难溶于水,故可以用排水法收集,故B项正确;点燃可燃性气体前必须验纯,故C项错;浓硫酸的稀释应将浓硫酸加入水中并不断搅拌,以防止暴沸,故D项错。
【典例】工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,
10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_______。
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
甲同学认为X中除Fe3+外还可能含有Fe2+。
①证明溶液中含有Fe3+的操作方法是________。
②若要确认其中的Fe2+,应先用_______(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
③若要除去上述溶液中的Fe2+应选用______(选填序号)
a.酸性KMnO4溶液 b.KSCN溶液 c.双氧水
④乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O====2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为_______________。
【错因剖析】
【标准答案】(1)铁钉表面被钝化
(2)①取少量溶液于试管中,加入KSCN溶液,若溶液变血红色则证明溶液中含有Fe3+
②d ③c ④66.7%
1.铁画是中国工艺美术百花园中的一朵奇葩。它以钢材为主料,经锻打、焊接、酸洗、上漆等多道工艺制成。下列关于铁画的叙述不正确的是( )
A.铁画应悬挂在干燥的环境中
B.所用材料上的铁锈可用稀盐酸清洗掉
C.给打制成型的铁画喷漆既美观又可以防锈蚀
D.所用的主要材料——低碳钢,有较好的锻轧性能,它不属于铁的合金
【解析】选D。本题考查的是有关金属的特性,A、B、C答案中都讲到了金属的某一点特性,而D中也讲到了金属的特性,惟一错误的地方就是“它不属于铁的合金”,事实上钢和生铁都是铁的合金。
2.为了检验某氯化亚铁溶液是否变质,最好向溶液中加入
( )
A.NaOH溶液 B.铁片
C.KSCN溶液 D.石蕊试液
【解析】选C。氯化亚铁溶液如果变质,溶液中会出现Fe3+,加入KSCN溶液后溶液变血红色,现象也明显,虽然
A、B理论上也可以,但现象不明显。
3.为了除去FeSO4溶液中少量的Fe2(SO4)3和CuSO4杂质,可选用的试剂是( )
A.Fe B.氨水 C.NaOH D.氯水
【解析】选A。可加入过量的铁,然后过滤即可,其中发
生的反应为:Fe2(SO4)3+Fe====3FeSO4,CuSO4+Fe====
FeSO4+Cu;氨水、NaOH、氯水均与FeSO4发生反应,故选A。
4.下列能与Fe3+反应且能证明Fe3+具有氧化性的物质是 ( )
A.Cu B. KSCN
C.NaOH D. FeCl2
【解析】选A。Fe3+与Cu可发生离子反应2Fe3++Cu ====Cu2+
+2Fe2+,在该反应中Fe3+为氧化剂,表现氧化性;KSCN、
NaOH均可与Fe3+发生反应,但不是氧化还原反应;FeCl2与
Fe3+不反应。
5.某化学兴趣小组利用下列试剂:铁粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结果解决一些问题。
(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式____________________________。
(2)设计实验方案,完成下列表格。
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________。
(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是__________。
【解析】(1)根据题意选用的试剂应具有氧化性,选新制氯水。(2)加入铁粉与FeCl3反应生成FeCl2。溶液为浅绿色。反应后无Fe3+,加入KSCN不变色。(3)锌与Fe2+发生置换反应。(4)FeCl3可与铜发生氧化还原反应,其离子方程式为:2Fe3++Cu====2Fe2++Cu2+
答案:(1)2FeCl2+Cl2====2FeCl3
(2)浅绿色 不变色
(3)Fe2++Zn====Zn2++Fe
(4)2Fe3++Cu====2Fe2++Cu2+
一、选择题(本题包括5小题,每小题4分,共20分)
1.把铁片分别放入下列溶液后,铁片溶解而溶液质量增加,但无气体产生,此溶液是( )
A.稀盐酸 B.AgNO3溶液
C.FeCl3溶液 D.Cu(NO3)2溶液
【解析】选C。铁和稀盐酸反应生成气体,铁和AgNO3溶液、Cu(NO3)2溶液反应后溶液质量均减小:Fe(56) ~2Ag(216),Fe(56) ~Cu(64),而铁和FeCl3溶液反应的离子方程式为2Fe3++Fe====3Fe2+,反应后单质铁进入溶液中而使溶液的质量增加。
2.向某溶液中加入含Fe2+的溶液后,无明显变化,当再滴加几滴新制氯水后,混合液变成血红色,则下列结论中错误的是( )
A.该溶液中一定含有SCN-
B.氧化性:Fe3+> Cl2
C.Fe2+与SCN-不能形成血红色物质
D.Fe2+被氯水氧化为Fe3+
【解析】选B。加入几滴新制氯水后,混合液变成血红色,说明原溶液中存在SCN-;并且Fe2+被氯水氧化为Fe3+;加入含Fe2+的溶液后,无明显变化,说明Fe2+与SCN-不能形成血红色物质;加入氯水后发生反应:2Fe2++Cl2====2Fe3++2Cl-,在该反应中Cl2为氧化剂,氧化性:Cl2>Fe3+。
3.(2011·福州高一检测)将铁屑溶于过量的稀盐酸后,再加入下列物质,会有Fe3+生成的是( )
A.硫酸 B.氯水 C.硫酸锌 D.氯化铜
【解析】选B。铁屑溶于过量的稀盐酸得到FeCl2溶液,氯水中的Cl2可与FeCl2溶液中的Fe2+发生如下反应:
Cl2+2Fe2+====2Cl-+2Fe3+。
4.在CuO和Cu2O的混合物中,铜元素和氧元素的质量比为5∶1,则CuO和Cu2O的物质的量之比为( )
A.2∶3 B.1∶3 C.1∶4 D.3∶1
【解析】选D。在CuO和Cu2O的混合物中,仅含铜和氧两种元素。设其中CuO和Cu2O的物质的量之比为x∶y,则依题意列比例式: 化简可得:x∶y=3∶1。
5.下列除去杂质的方法正确的是( )
A.除去FeCl3中混有的CuCl2:加入过量铁粉,过滤
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
【解析】选C。A中铁粉先还原Fe3+;B中最后得到的不是BaCO3;D项中Cu与稀硝酸发生反应,形成溶液,不符题意。
二、非选择题(本题包括3小题,共30分)
6.(8分)(2011·宁波高一检测)将Fe粉、Cu粉、FeCl3溶液、FeCl2溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应),试判断下列情况下溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能存在的离子是_____;
(2)若氯化铜有剩余,则容器中一定存在的离子是_____,可能存在的离子是________________________________;
(3)若氯化铁有剩余,则容器中不可能有_____________,一定存在的离子是________________________________。
【解析】该题考查物质共存问题,答题时要弄清物质间可能发生的反应,相互间能发生反应的物质不可能共存,而本题涉及的反应有:①Fe+2FeCl3====3FeCl2
②Fe+CuCl2====Cu+FeCl2
③Cu+2FeCl3====2FeCl2+CuCl2
答案:(1)Fe3+、Cu2+ (2)Cu2+、Fe2+ Fe3+
(3)Fe、Cu Fe2+、Fe3+、Cu2+
7.(10分)有一包铁粉和氧化铁粉的混合物共19.2克,溶于150 mL稀硫酸中,反应完毕后不留残渣,向溶液中滴入KSCN溶液也不显血红色,反应过程中共放出3.36 L标准状况下的H2。求:
(1)混合物中铁粉的质量为______________________。
(2)原稀硫酸的物质的量浓度至少是______________。
【解析】放出3.36 L标准状况下的H2的物质的量是
0.15 mol,则有
Fe + H2SO4 ==== FeSO4 + H2↑
1 1 1
0.15 mol 0.15 mol 0.15 mol
Fe + Fe2O3 + 3H2SO4 ==== 3FeSO4+3H2O
1 1 3
x mol x mol 3x mol
即:56(0.15+x)+160x=19.2
解得:x=0.05
所以(1)混合物中铁粉的质量为:m(Fe)=56×(0.15+x) g=56×(0.15+0.05) g=11.2 g
(2)原稀硫酸的物质的量浓度至少为:
c(H2SO4)=(0.15+3x)mol/0.15 L=(0.15+3×0.05)mol / 0.15 L=2.0 mol/L
答案:(1)11.2 g (2)2.0 mol/L
8.(12分)(挑战能力)A是一种红棕色金属氧化物,B、D是金属
单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
(1)写出下列物质的化学式:
A:________;E:________;
J:________;G:________。
(2)按要求写方程式:
①A+B→C+D的化学方程式:________________________;
②F→G的化学方程式:____________________________;
③C→I的离子方程式:____________________________。
【解析】本题的突破口是“G为红褐色沉淀”、“A为红棕色金属氧化物”,结合题中的转化关系,可以得到如下的转化图:
答案:(1)Fe2O3 FeCl2 Al(OH)3 Fe(OH)3
(2)①2Al+Fe2O3 2Fe+Al2O3
②4Fe(OH)2+O2+2H2O====4Fe(OH)3
③Al2O3+2OH-====2AlO2-+H2O
高温
====
【方法技巧】制备纯净的Fe(OH)2沉淀常用的方法
关键在于除去无孔不入的O2和Fe3+。
①驱氧法:如用煮沸过的NaOH溶液。
②隔氧法:如用长滴管吸取NaOH溶液后插入亚铁盐溶液液面以下加入;又如在液面上加某些合适的有机溶剂进行液封。
③还原法:在FeSO4溶液中加入铁钉,或者用Fe与稀硫酸反应制FeSO4溶液,生成的H2又可驱赶O2。
为了“探究铁及其化合物的氧化性或还原性”,某同学甲设计了如下的实验方案。
(1)实验前甲同学预测:Fe2+肯定既有还原性又有氧化性。你认为甲同学预测的依据是:_____________。
(2)甲同学欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水。
①若甲同学计划将0.1 mol·L-1 FeCl2溶液滴入新制氯水探究Fe2+的还原性,你预计可能发生的反应是:_________
(写离子方程式),现象是:溶液由浅绿色变________色。
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选上述试剂中______________滴入甲同学所得的混合液中,并通过__________________
现象证明甲同学的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,甲同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没有变化,锌粒逐渐变小。由此说明三种金属的还原性由强到弱的顺序为:__________。
(3)甲同学分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2反应时,Fe2+是作还原剂还是作氧化剂呢?
①请你为甲同学梳理相关问题:若Fe2+在反应中表现出氧化性应转化成_________(填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成________________。
②实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质。除杂的方法是:___________________,
相关反应的离子方程式:___________________。
【解析】(1)Fe2+中铁元素化合价处于中间价态。
(2)① 氯水中的氯气将FeCl2溶液中的Fe2+氧化成Fe3+。②Fe3+一般用KSCN溶液检验,溶液呈血红色即可证明溶液中Fe3+的存在。③由题意,铜片与FeCl2溶液不反应,锌粒可与FeCl2溶液反应,再由还原剂的还原性大于还原产物的还原性即可得出结论。
(3)①若Fe2+在反应中表现出氧化性,则会得到电子,化合价降低,产物为铁;若Fe2+在反应中表现出还原性,则会失去电子,化合价升高,产物为Fe3+。②加入适量铁粉,可发生如下反应:2Fe3++Fe====3Fe2+。
答案:(1)因为Fe2+中铁元素价态可以升高也可以降低
(2)①Cl2+2Fe2+====2Cl-+2Fe3+ 棕黄
②KSCN溶液 溶液呈血红色 ③Zn>Fe>Cu
(3)①Fe Fe3+
②加入适量铁粉 2Fe3++Fe====3Fe2+
【典例1】下列物质反应后一定有+3价铁生成的是
①过量的Fe与Cl2反应;
②Fe与过量稀硫酸反应后,再向其中加KNO3;
③Fe(NO3)2溶液中加少量盐酸;
④Fe和Fe2O3的混合物溶于盐酸中。
A.只有① B.只有①②
C.只有①②③ D.全部
【思路点拨】解答本题时应注意以下三点:
【自主解答】选C。本题涉及0价铁变为+3价铁、+2价铁变为+3价铁及+3价铁变为+2价铁,应从氧化剂的强弱、反应条件及反应物间的相对量进行分析。
①中的Cl2氧化性强,它能将铁氧化为+3价,由于不是在溶液中反应,因此过量的铁不会将氯化铁还原。
②中Fe与稀硫酸反应只能生成Fe2+,但要注意,由于稀硫酸过量,加入KNO3后,H+、NO3-能将Fe2+氧化成Fe3+。
③中不会发生复分解反应,但发生了Fe2+被NO3-氧化的反应,有Fe3+生成。
④中首先发生Fe与盐酸生成FeCl2、Fe2O3与盐酸生成FeCl3的反应,但题中未给出反应物间相对量的关系,若铁是足量的,则能将生成的FeCl3全部还原为FeCl2。
【互动探究】如何检验④中反应后的溶液中是否含有Fe3+?说出可能的方法。
提示:(1)在反应后的溶液中加适量的KSCN溶液,看是否变血红色;(2)加入单质铜,看铜是否被腐蚀。(3)也可用碘化钾淀粉试纸检验。
【变式训练】在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.Cu2+ B.Fe3+ C.Fe2+ D.H+
【解析】选C。解此题要掌握单质铁有还原性,能和Cu2+、H+、Fe3+反应。另外,铁能被磁铁吸引是铁的一种重要物理性质。现在Fe单质有剩余则Cu2+、H+、Fe3+分别被还原为Cu、H2、Fe2+,故溶液中Fe2+最多,答案为C。
【典例2】将几滴KSCN(SCN-是“类卤离子”)溶液加入酸性的含有Fe3+的溶液中,溶液变成血红色,将该血红色溶液分为两份,①一份中加入适量KMnO4溶液,血红色褪去;②向另一份中通入SO2,血红色也褪去。下列说法不正确的是
A.①血红色褪去的原因是KMnO4将SCN-氧化,使Fe(SCN)3消失
B.②血红色褪去的原因是SO2将Fe3+还原为Fe2+
C.②血红色褪去的原因是SO2将SCN-还原
D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
【思路点拨】解答本题时应注意以下两方面问题
【自主解答】选C。由于SCN-是“类卤离子”,与卤素离子性质相似,可以被KMnO4(H+)氧化为(SCN)2,而使血红色消失。Fe3+具有氧化性,可被SO2还原为Fe2+,也可使血红色消失。综上分析可知C项错误。
【互动探究】若加入KSCN溶液后,溶液变血红色,能否判断溶液中存在Fe2+?
提示:溶液变血红只是说明溶液中存在Fe3+,但不能说明溶液中是否存在Fe2+。
【规律方法】检验Fe2+时,要注意以下三点:
(1)试剂加入的先后顺序,防止Fe2+被氧化成Fe3+而干扰检验。
(2)防止加入强氧化性物质将Fe2+氧化,如酸性的NO3-、酸性的ClO-等。
(3)防止加入一些有色溶液,如酸性高锰酸钾溶液。
试液 不变色 血红色
KSCN溶液
氯水或双氧水
【变式训练】要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,最佳顺序为( )
①加入足量氯水
②加入足量酸性KMnO4溶液
③加入少量NH4SCN溶液
A.①③ B.③② C.③① D.①②③
【解析】选C。在该溶液中先加入少量NH4SCN溶液,溶液不变血红色,无Fe3+存在,再加入氯水,将Fe2+氧化成Fe3+,溶液变为血红色。酸性KMnO4溶液呈紫红色,溶液颜色变化不明显,所以这里不用酸性KMnO4溶液。
【典例】由于Fe(OH)2在空气中易被氧化,
同学们为了观察到白色的Fe(OH)2固体想
了很多方法。甲同学:在如图所示的装置
中,用NaOH溶液、铁屑、稀硫酸等制备。
(1)在试管Ⅰ里加入的试剂是________。
(2)Ⅱ中的试剂加入前应如何处理:
____________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧橡胶塞后的实验步骤是_________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________。
乙同学:只是将甲同学所用药品中的铁屑改为FeS固体,其余都与甲相同。
(5)对乙同学的这一改变请你作出评价:_____________。
【思路点拨】解答本题时应注意以下两方面问题
【自主解答】用FeSO4溶液与NaOH溶液反应制备Fe(OH)2并观察沉淀的颜色变化是中学化学中重要的演示实验。Fe(OH)2、FeSO4均易被氧化,应避免生成的Fe(OH)2沉淀接触到O2,可得答案。
乙同学将药品中的铁屑改为FeS固体,与稀硫酸反应生成H2S,H2S有强还原性。
答案:(1)稀硫酸和铁屑
(2)煮沸 (3)稍等片刻后关闭止水夹
(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不易进入
(5)反应中生成的H2S也能防止Fe(OH)2被氧化,白色沉淀能存在较长时间,但易产生空气污染
【互动探究】试思考有没有一个更简单的防止Fe(OH)2被氧化的方法?
提示:在液面上加隔氧剂:用密度比水小的且不溶于水的有机溶剂,如汽油、植物油等物质滴加在反应液面上进行液封,以减少Fe(OH)2与O2接触。(不能用四氯化碳,因为四氯化碳密度比水大,加入后它会处于试管底部,起不到隔离空气的作用)
【变式训练】下列实验能达到实验目的且符合安全要求的是( )
【解析】选B。氢氧化亚铁易被O2氧化,盛NaOH的胶头滴管必须插入溶液中,故A项错;O2难溶于水,故可以用排水法收集,故B项正确;点燃可燃性气体前必须验纯,故C项错;浓硫酸的稀释应将浓硫酸加入水中并不断搅拌,以防止暴沸,故D项错。
【典例】工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,
10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_______。
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
甲同学认为X中除Fe3+外还可能含有Fe2+。
①证明溶液中含有Fe3+的操作方法是________。
②若要确认其中的Fe2+,应先用_______(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.酸性KMnO4溶液
③若要除去上述溶液中的Fe2+应选用______(选填序号)
a.酸性KMnO4溶液 b.KSCN溶液 c.双氧水
④乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O====2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为_______________。
【错因剖析】
【标准答案】(1)铁钉表面被钝化
(2)①取少量溶液于试管中,加入KSCN溶液,若溶液变血红色则证明溶液中含有Fe3+
②d ③c ④66.7%
1.铁画是中国工艺美术百花园中的一朵奇葩。它以钢材为主料,经锻打、焊接、酸洗、上漆等多道工艺制成。下列关于铁画的叙述不正确的是( )
A.铁画应悬挂在干燥的环境中
B.所用材料上的铁锈可用稀盐酸清洗掉
C.给打制成型的铁画喷漆既美观又可以防锈蚀
D.所用的主要材料——低碳钢,有较好的锻轧性能,它不属于铁的合金
【解析】选D。本题考查的是有关金属的特性,A、B、C答案中都讲到了金属的某一点特性,而D中也讲到了金属的特性,惟一错误的地方就是“它不属于铁的合金”,事实上钢和生铁都是铁的合金。
2.为了检验某氯化亚铁溶液是否变质,最好向溶液中加入
( )
A.NaOH溶液 B.铁片
C.KSCN溶液 D.石蕊试液
【解析】选C。氯化亚铁溶液如果变质,溶液中会出现Fe3+,加入KSCN溶液后溶液变血红色,现象也明显,虽然
A、B理论上也可以,但现象不明显。
3.为了除去FeSO4溶液中少量的Fe2(SO4)3和CuSO4杂质,可选用的试剂是( )
A.Fe B.氨水 C.NaOH D.氯水
【解析】选A。可加入过量的铁,然后过滤即可,其中发
生的反应为:Fe2(SO4)3+Fe====3FeSO4,CuSO4+Fe====
FeSO4+Cu;氨水、NaOH、氯水均与FeSO4发生反应,故选A。
4.下列能与Fe3+反应且能证明Fe3+具有氧化性的物质是 ( )
A.Cu B. KSCN
C.NaOH D. FeCl2
【解析】选A。Fe3+与Cu可发生离子反应2Fe3++Cu ====Cu2+
+2Fe2+,在该反应中Fe3+为氧化剂,表现氧化性;KSCN、
NaOH均可与Fe3+发生反应,但不是氧化还原反应;FeCl2与
Fe3+不反应。
5.某化学兴趣小组利用下列试剂:铁粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结果解决一些问题。
(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式____________________________。
(2)设计实验方案,完成下列表格。
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为_________________。
(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是__________。
【解析】(1)根据题意选用的试剂应具有氧化性,选新制氯水。(2)加入铁粉与FeCl3反应生成FeCl2。溶液为浅绿色。反应后无Fe3+,加入KSCN不变色。(3)锌与Fe2+发生置换反应。(4)FeCl3可与铜发生氧化还原反应,其离子方程式为:2Fe3++Cu====2Fe2++Cu2+
答案:(1)2FeCl2+Cl2====2FeCl3
(2)浅绿色 不变色
(3)Fe2++Zn====Zn2++Fe
(4)2Fe3++Cu====2Fe2++Cu2+
一、选择题(本题包括5小题,每小题4分,共20分)
1.把铁片分别放入下列溶液后,铁片溶解而溶液质量增加,但无气体产生,此溶液是( )
A.稀盐酸 B.AgNO3溶液
C.FeCl3溶液 D.Cu(NO3)2溶液
【解析】选C。铁和稀盐酸反应生成气体,铁和AgNO3溶液、Cu(NO3)2溶液反应后溶液质量均减小:Fe(56) ~2Ag(216),Fe(56) ~Cu(64),而铁和FeCl3溶液反应的离子方程式为2Fe3++Fe====3Fe2+,反应后单质铁进入溶液中而使溶液的质量增加。
2.向某溶液中加入含Fe2+的溶液后,无明显变化,当再滴加几滴新制氯水后,混合液变成血红色,则下列结论中错误的是( )
A.该溶液中一定含有SCN-
B.氧化性:Fe3+> Cl2
C.Fe2+与SCN-不能形成血红色物质
D.Fe2+被氯水氧化为Fe3+
【解析】选B。加入几滴新制氯水后,混合液变成血红色,说明原溶液中存在SCN-;并且Fe2+被氯水氧化为Fe3+;加入含Fe2+的溶液后,无明显变化,说明Fe2+与SCN-不能形成血红色物质;加入氯水后发生反应:2Fe2++Cl2====2Fe3++2Cl-,在该反应中Cl2为氧化剂,氧化性:Cl2>Fe3+。
3.(2011·福州高一检测)将铁屑溶于过量的稀盐酸后,再加入下列物质,会有Fe3+生成的是( )
A.硫酸 B.氯水 C.硫酸锌 D.氯化铜
【解析】选B。铁屑溶于过量的稀盐酸得到FeCl2溶液,氯水中的Cl2可与FeCl2溶液中的Fe2+发生如下反应:
Cl2+2Fe2+====2Cl-+2Fe3+。
4.在CuO和Cu2O的混合物中,铜元素和氧元素的质量比为5∶1,则CuO和Cu2O的物质的量之比为( )
A.2∶3 B.1∶3 C.1∶4 D.3∶1
【解析】选D。在CuO和Cu2O的混合物中,仅含铜和氧两种元素。设其中CuO和Cu2O的物质的量之比为x∶y,则依题意列比例式: 化简可得:x∶y=3∶1。
5.下列除去杂质的方法正确的是( )
A.除去FeCl3中混有的CuCl2:加入过量铁粉,过滤
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
【解析】选C。A中铁粉先还原Fe3+;B中最后得到的不是BaCO3;D项中Cu与稀硝酸发生反应,形成溶液,不符题意。
二、非选择题(本题包括3小题,共30分)
6.(8分)(2011·宁波高一检测)将Fe粉、Cu粉、FeCl3溶液、FeCl2溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应),试判断下列情况下溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能存在的离子是_____;
(2)若氯化铜有剩余,则容器中一定存在的离子是_____,可能存在的离子是________________________________;
(3)若氯化铁有剩余,则容器中不可能有_____________,一定存在的离子是________________________________。
【解析】该题考查物质共存问题,答题时要弄清物质间可能发生的反应,相互间能发生反应的物质不可能共存,而本题涉及的反应有:①Fe+2FeCl3====3FeCl2
②Fe+CuCl2====Cu+FeCl2
③Cu+2FeCl3====2FeCl2+CuCl2
答案:(1)Fe3+、Cu2+ (2)Cu2+、Fe2+ Fe3+
(3)Fe、Cu Fe2+、Fe3+、Cu2+
7.(10分)有一包铁粉和氧化铁粉的混合物共19.2克,溶于150 mL稀硫酸中,反应完毕后不留残渣,向溶液中滴入KSCN溶液也不显血红色,反应过程中共放出3.36 L标准状况下的H2。求:
(1)混合物中铁粉的质量为______________________。
(2)原稀硫酸的物质的量浓度至少是______________。
【解析】放出3.36 L标准状况下的H2的物质的量是
0.15 mol,则有
Fe + H2SO4 ==== FeSO4 + H2↑
1 1 1
0.15 mol 0.15 mol 0.15 mol
Fe + Fe2O3 + 3H2SO4 ==== 3FeSO4+3H2O
1 1 3
x mol x mol 3x mol
即:56(0.15+x)+160x=19.2
解得:x=0.05
所以(1)混合物中铁粉的质量为:m(Fe)=56×(0.15+x) g=56×(0.15+0.05) g=11.2 g
(2)原稀硫酸的物质的量浓度至少为:
c(H2SO4)=(0.15+3x)mol/0.15 L=(0.15+3×0.05)mol / 0.15 L=2.0 mol/L
答案:(1)11.2 g (2)2.0 mol/L
8.(12分)(挑战能力)A是一种红棕色金属氧化物,B、D是金属
单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
(1)写出下列物质的化学式:
A:________;E:________;
J:________;G:________。
(2)按要求写方程式:
①A+B→C+D的化学方程式:________________________;
②F→G的化学方程式:____________________________;
③C→I的离子方程式:____________________________。
【解析】本题的突破口是“G为红褐色沉淀”、“A为红棕色金属氧化物”,结合题中的转化关系,可以得到如下的转化图:
答案:(1)Fe2O3 FeCl2 Al(OH)3 Fe(OH)3
(2)①2Al+Fe2O3 2Fe+Al2O3
②4Fe(OH)2+O2+2H2O====4Fe(OH)3
③Al2O3+2OH-====2AlO2-+H2O
高温
====
【方法技巧】制备纯净的Fe(OH)2沉淀常用的方法
关键在于除去无孔不入的O2和Fe3+。
①驱氧法:如用煮沸过的NaOH溶液。
②隔氧法:如用长滴管吸取NaOH溶液后插入亚铁盐溶液液面以下加入;又如在液面上加某些合适的有机溶剂进行液封。
③还原法:在FeSO4溶液中加入铁钉,或者用Fe与稀硫酸反应制FeSO4溶液,生成的H2又可驱赶O2。
为了“探究铁及其化合物的氧化性或还原性”,某同学甲设计了如下的实验方案。
(1)实验前甲同学预测:Fe2+肯定既有还原性又有氧化性。你认为甲同学预测的依据是:_____________。
(2)甲同学欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水。
①若甲同学计划将0.1 mol·L-1 FeCl2溶液滴入新制氯水探究Fe2+的还原性,你预计可能发生的反应是:_________
(写离子方程式),现象是:溶液由浅绿色变________色。
②实验中,甲同学发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选上述试剂中______________滴入甲同学所得的混合液中,并通过__________________
现象证明甲同学的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,甲同学认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没有变化,锌粒逐渐变小。由此说明三种金属的还原性由强到弱的顺序为:__________。
(3)甲同学分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2反应时,Fe2+是作还原剂还是作氧化剂呢?
①请你为甲同学梳理相关问题:若Fe2+在反应中表现出氧化性应转化成_________(填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成________________。
②实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质。除杂的方法是:___________________,
相关反应的离子方程式:___________________。
【解析】(1)Fe2+中铁元素化合价处于中间价态。
(2)① 氯水中的氯气将FeCl2溶液中的Fe2+氧化成Fe3+。②Fe3+一般用KSCN溶液检验,溶液呈血红色即可证明溶液中Fe3+的存在。③由题意,铜片与FeCl2溶液不反应,锌粒可与FeCl2溶液反应,再由还原剂的还原性大于还原产物的还原性即可得出结论。
(3)①若Fe2+在反应中表现出氧化性,则会得到电子,化合价降低,产物为铁;若Fe2+在反应中表现出还原性,则会失去电子,化合价升高,产物为Fe3+。②加入适量铁粉,可发生如下反应:2Fe3++Fe====3Fe2+。
答案:(1)因为Fe2+中铁元素价态可以升高也可以降低
(2)①Cl2+2Fe2+====2Cl-+2Fe3+ 棕黄
②KSCN溶液 溶液呈血红色 ③Zn>Fe>Cu
(3)①Fe Fe3+
②加入适量铁粉 2Fe3++Fe====3Fe2+
