11-12版高中化学全程学习方略配套课件:3.2.1从自然界获取铁和铜 铁和铜的应用(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:3.2.1从自然界获取铁和铜 铁和铜的应用(苏教版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-11 08:26:08 | ||
图片预览











文档简介
(共63张PPT)
【典例】下列金属冶炼的反应原理,错误的是
【思路点拨】解答本题时应注意以下两点:
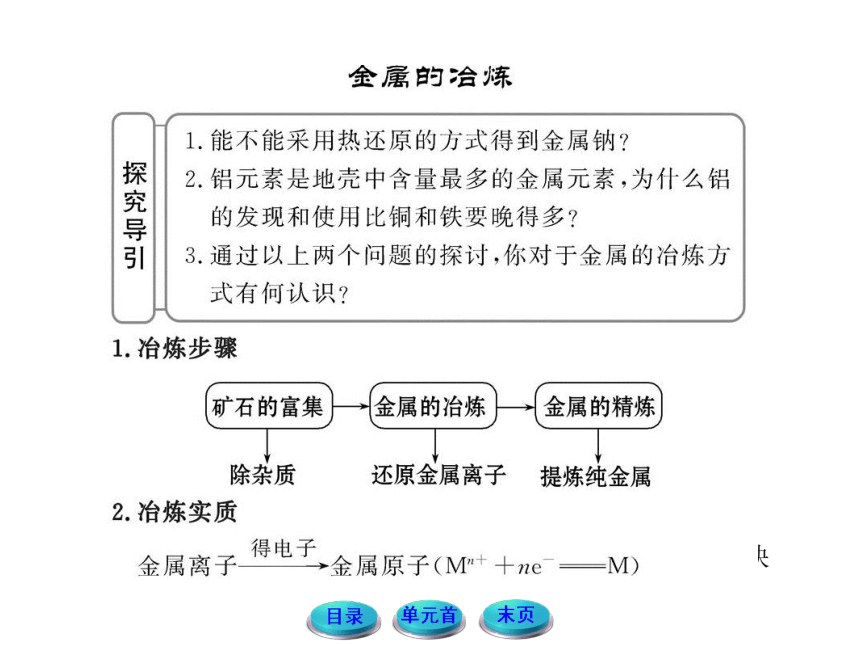
【自主解答】选B。在金属活动性顺序表中,K~Al等活泼金属不能用普通的还原剂把它们还原出来,一般采用的是电解熔融盐或氧化物的方法冶炼,而Zn~Cu等金属可以用还原剂(如CO、H2、 C等)高温还原的方法冶炼,必要时再用其他方法(比如铜的精炼)进一步精炼,更不活泼的金属由于它们的化合物更不稳定,因此一般采用热分解法冶炼。
【互动探究】(1)要想得到金属镁,你认为原料是用MgO好还是MgCl2好,可结合MgO和MgCl2的物理性质进行考虑。
(2)C项中要想由Fe3O4得到Fe还有没有其他的方法?如果有,试写出其化学方程式。
提示:(1)金属镁的冶炼采用电解MgCl2的方法较好,因为MgO的熔点较MgCl2的高得多,电解MgO耗能多,成本较高。
(2)可采用铝热反应得到Fe,化学方程式:3Fe3O4+8Al
9Fe+4Al2O3。
高温
====
【规律方法】(1)选择金属冶炼的方法要依据金属在自然界中的存在形态和金属的活泼性。金属活动性顺序表中,金属的位置越靠后,越容易被还原;金属的位置越靠前,越难被还原。
(2)活泼金属的阳离子氧化性非常弱,在反应中很难得到电子转化为金属单质;故活泼金属一般采用最强的氧化还原手段——电解法冶炼。
【变式训练】冶炼金属一般有下列四种方法:①焦炭还原法;②水煤气(氢气或一氧化碳)还原法;③活泼金属置换法;④电解法。四种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜;现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石(MgCl2·KCl·6H2O)中炼镁,对它们的冶炼方法的分析不正确的是( )
A.(Ⅰ)用① B.(Ⅱ)用②
C.(Ⅲ)用③ D.(Ⅳ)用④
【解析】选B。对于(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)发生的反应分别是:
(Ⅰ)Cu2(OH)2CO3 2CuO+H2O+CO2↑,
2CuO+C 2Cu+CO2↑,适合用①;
(Ⅱ)CuSO4+Fe====FeSO4+Cu,适合用③;
(Ⅲ)2Al+Cr2O3 2Cr+Al2O3,适合用③;
(Ⅳ)先从光卤石中提取MgCl2,再电解MgCl2,MgCl2(熔融)
Mg+Cl2↑,适合用④。综上分析,答案为B。
△
====
△
====
高温
====
通电
====
【典例】冶炼金属时用氢气作还原剂和用金属作还原剂相比,所得金属的纯度的说法正确的是
A.用氢气的高 B.用金属的高
C.二者相同 D.无法比较
【思路点拨】解答本题应注意以下两点:
【自主解答】选A。用金属作还原剂,含杂质较多;H2作还原剂被氧化,产物H2O在高温下挥发出去,得到的金属较纯。
【互动探究】铁的工业冶炼方法的优缺点是什么?
提示:优点是:生产成本较低;缺点是:炼得的金属为合金,纯度较低。
【变式训练】(双选)下列各种方法中,适用于炼制相应金属的是( )
A.加热氧化铜 B.氧化镁跟铝粉共热
C.用焦炭还原氧化铜 D.电解熔融氯化钠
【解析】选C、D。氧化铜高温分解得不到铜,氧化镁跟铝粉共热不反应。
【典例】下列说法正确的是
A.高炉炼铁用于还原氧化铁的还原剂是焦炭
B.炼铁时,加入石灰石的作用是促进氧化铁的还原
C.我国最先应用的金属是铜
D.用于电气工业的铜是由黄铜矿冶炼得到的
【易错选项】A
【易错剖析】
(1)易错选项分析
本题易错选A的原因在于对工业炼铁的原理不明确。高炉炼铁用于还原氧化铁的还原剂是一氧化碳。
(2)其他错误选项分析
【标准答案】C
1.金属材料在人类社会的发展史上一直发挥着重要作用。人类历史上使用最早的金属是( )
A.铜 B.铁 C.铝 D.钛
【解析】选A。化学史上金、银、铜等重金属发现较早,而轻金属发现较晚。青铜是人类历史上最早冶炼使用的合金,已有三千多年的历史;冶铁技术在我国春秋初期开始发展起来;钛作为新型金属是近十几年来发展迅速的宇航、飞机、造船等工业使用的重要金属。
2.冶炼Na、Al等活泼金属通常采用的方法是( )
A.电解其熔融盐或氧化物
B.电解其盐的水溶液
C.热分解法
D.热还原法
【解析】选A。Na、Al的化学性质活泼,一般采用电解其熔融盐或氧化物的方法冶炼。
3.(双选)制造货币,应该根据下列哪些性质而选材( )
A.从化学性质来看,金属材料化学性质应稳定
B.从物理性质来看,金属材料应有较低的熔点
C.从物理性质来看,金属材料应有一定的强度、硬度
D.制造货币的金属本身的价值应高于货币的面值
【解析】选A、C。货币要在市面上长时间流通,因此要求制造货币的金属具有化学性质稳定、耐磨、硬度大等特点。
4.下列说法错误的是( )
A.金属越活泼,冶炼难度越大
B.可采用电解熔融氧化铝的方法冶炼铝
C.可采用电解NaCl溶液的方法冶炼金属钠
D.可采用热还原法冶炼铜
【解析】选C。电解NaCl溶液得不到金属钠,金属钠应该用电解熔融NaCl的方法制取,C项错。
5.Fe是地壳中含量很丰富的元素,也是生物体所必需的元素。自然界中铁矿石主要有赤铁矿和磁铁矿。金属铁是在高炉中冶炼的,高炉炼铁除了加入铁矿石外,还需加入焦炭和石灰石。请填空:
(1)写出磁铁矿主要成分的化学式:__________。
(2)写出赤铁矿被还原成铁的化学方程式:_________。
(3)写出焦炭在高炉中所参与反应的两个化学方程式:
____________________________________。
(4)写出CaCO3所参与反应的两个化学方程式:_________。
【解析】本题考查的是铁的冶炼的有关知识,特别要注意两点:(1)还原剂实际上是CO而不是C;(2)CaCO3的作用为分解产生CaO,以除去铁矿石中的脉石(SiO2)。
答案:(1)Fe3O4
(2)Fe2O3+3CO 2Fe+3CO2
(写成Fe2O3+3C 2Fe+3CO↑也可)
(3)C+O2 CO2,CO2+C 2CO
(4)CaCO3 CaO+CO2↑,
CaO+SiO2 CaSiO3
高温
====
高温
====
高温
====
点燃
====
高温
====
高温
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.已知一些金属单质的发现与其金属活动性存在着某种必
然的联系,你认为下列事件发生在铁器时代之前的是( )
①金属铝的冶炼
②青铜器时代
③金银的使用
④戴维发现金属钠
⑤15世纪中国使用锌铸币
A.②③⑤ B.②③
C.①②③ D.①④⑤
【解析】选B。金属的冶炼就是使化合态的阳离子还原成游离态的金属单质,金属越活泼,对应离子得电子的能力越弱,越难被还原,冶炼时所需要的条件越高,开发利用年代越晚。金、银、铜的金属性比铁的弱,开发利用年代比铁的早,锌、铝、钠比铁活泼,开发利用年代比铁的晚。
2.下列能用热分解法制得的金属是( )
A.Fe B.Na C.Mg D.Ag
【解析】选D。热分解法一般用于很不活泼的银、汞等金属的冶炼,它们的化合物大多不稳定,比如氧化银受热时能够分解为相应的金属单质,而活泼金属的化合物一般相当稳定,加热时很难分解。因此,比较活泼的钠、铁和镁不能够通过热分解法制得。
3.(2011·常州高一检测)下列有关金属冶炼的说法不正确的是( )
A.工业上是利用焦炭还原氧化铁而得到铁
B.生铁和钢都属于合金,为混合物
C.工业上采用高温灼烧黄铜矿的方式冶炼铜
D.金属的冶炼方法与金属的活动性有关
【解析】选A。工业上是利用CO还原氧化铁而得到铁。
4.高炉炼铁的反应方程式是Fe2O3+3CO 2Fe+3CO2,
当有560 g铁生成时,电子转移了( )
A.90 mol B.60 mol C.30 mol D.20 mol
【解析】选C。每生成1 mol Fe,电子转移3 mol,生成
560 g铁时,n(Fe)= 故电子转移了
30 mol。
高温
====
5.合金有许多特点,如Na-K合金为液体,而Na和K的单质均为固体。据此试推断:生铁(铁-碳合金)、纯铁、碳三种物质中,熔点最低的是( )
A.纯铁 B.生铁 C.碳 D.无法确定
【解析】选B。根据题目所给信息,可以得知合金的熔点低于其各组成成分的熔点,生铁是由铁、碳熔合而成的合金,因此生铁的熔点最低。
【方法技巧】化学信息题的解题方法
解答信息题的关键是准确理解信息的含义,灵活的进行信息迁移。信息题往往起点高,落点低,信息是生疏的,但多数可直接迁移应用。关于信息题的解题思路,分析如下:
1.细心审题,对题目所给的信息进行提炼、筛选,从中得到有价值的信息。并挖掘出题目中隐蔽性较强的新信息,保证接收信息的全面性;
2.要广泛建立联系,善于知识迁移,将接收到的信息与平时学过的知识结合起来,形成新的知识体系重新接收;
3.要结合题目的要求,应用已有知识判断新信息的意向,经过分析、比较、归纳为新的规律;
4.要理解所给新信息的实质,将新信息向深层拓宽,排除干扰信息,为正确解答创造条件。
二、非选择题(本题包括3小题,共30分)
6.(9分)已知Al、Cu、Hg三种金属分别用如下方法冶炼:2Al2O3(熔融) 4Al+3O2↑
H2+CuO Cu+H2O
2HgO 2Hg+O2↑
(1)分析以上信息,可总结出金属的冶炼方法与其金属性强弱之间的关系是______________________。
通电
====
△
====
△
====
(2)利用(1)中的结论,并结合题目信息,写出工业上用CaCl2冶炼金属钙的化学方程式__________________。
(3)在某些特殊环境下,往往用铝热反应来冶炼一些难熔金属,请写出据此法用MnO2冶炼金属锰的化学方程式_______。
【解析】(1)金属的冶炼方法与金属在自然界中的存在状态、金属活泼性有关。一般来说,非常活泼的金属一般采用电解法冶炼(如K、Ca、Na、Mg、Al等),中等活泼的金属一般用热还原法冶炼(如Zn、Fe、Sn、Pb、Cu等),不活泼的金属一般用热分解法冶炼(如Hg、Ag等)。
(2)Ca是非常活泼的金属,工业上用电解熔融CaCl2的方法冶炼。
(3)金属铝和MnO2发生置换反应生成单质锰和氧化铝。
答案:(1)非常活泼的金属一般采用电解法冶炼,中等活泼的金属一般采用热还原法冶炼,不活泼的金属一般采用热分解法冶炼
(2)CaCl2(熔融) Ca+Cl2↑
(3)4Al+3MnO2 2Al2O3+3Mn
通电
====
△
====
7.(9分)(2011·温州高一检测)根据CO还原铁的氧化物的实验装置图(如图所示),回答下列问题:
(1)怎样知道硬质玻璃管中Fe2O3已开始反应?
______________________________________________。
(2)在A处点燃尾气,可观察到什么现象 为什么要点燃
______________________________________________。
(3)实验结束时应注意的操作是___________________。
①先停止通入CO。
②先熄灭酒精灯,并继续通入CO。
③熄灭酒精灯,同时停止通入CO。
④先熄灭酒精灯,继续通入CO至被还原的铁粉冷却,并点燃排出的CO气体。
【解析】CO还原Fe2O3实验与H2还原CuO实验的原理、操作都很相似。可结合初中H2还原CuO的知识和前一节铁的氧化物的性质解决第一问;从A口出来的尾气主要为CO,CO有毒,最好的办法就是将其点燃以防止污染空气;第三问考查了实验的基本操作。
答案:(1)当硬质玻璃管中红色物质开始变黑,B中澄清石灰水开始变浑浊时,说明Fe2O3已开始发生反应
(2)可见浅蓝色的火焰,因为CO有毒,为防止CO污染空气,必须点燃或用其他方法处理未反应的CO
(3)④
8.(12分)(挑战能力)在一定条件下可实现如图所示物质之间的转化:
请填写以下空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,上图中的F是_____________________。
(2)写出明矾溶液与过量的NaOH溶液反应的离子方程式__________________________________________。
(3)图中所得G和D都是固体,混合后在高温下可发生反应,写出该反应的化学方程式:__________________。
(4)每生成1 mol D,同时生成________________mol E。
【解析】根据不活泼金属碳酸盐受热易分解成金属氧化物和CO2,以及不活泼金属的氢氧化物受热易分解成金属氧化物和H2O的规律,可推知孔雀石的分解产物为CuO、CO2和H2O,由题意知G为固体即CuO,则F为气体CO2。根据明矾的组成以及Al的性质可知A为含有NaAlO2的溶液。根据电解冶炼铝可以得到金属铝,推知D为Al,E为O2,用 Al作还原剂可以还原CuO。
答案:(1)CO2 (2)Al3++4OH-====AlO2-+2H2O
(3)2Al+3CuO 3Cu+Al2O3
(4)0.75
高温
====
某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案。
(1)甲、乙、丙提出的实验方案能否得到纯净的金属铜?
(填“能”或“不能”)
甲__________,乙_________,丙___________。
(2)在能制得铜的方案中,哪一步操作会导致环境污染?__________。应增加哪些措施防止污染?____________。
【解析】(1)甲实验方案中滤渣的成分是Mg(OH)2、
Fe(OH)3、Cu(OH)2、Hg(OH)2,加热后的残渣为MgO、
Fe2O3、CuO[Hg(OH)2分解成汞蒸气],经H2还原得到的铜中
含有MgO、Fe。乙实验方案中滤渣的成分是Cu、Fe、Hg,加热后的残渣为CuO、Fe3O4,经H2还原得到的铜含有Fe。丙实验方案中加入过量铁粉后的滤渣的成分是Cu、Fe、Hg,加入盐酸后的滤渣为Cu、Hg,加热后Hg蒸发,残渣为CuO,经H2还原得到的铜不含杂质。
(2)丙实验方案能得到纯净的金属铜,其步骤③中产生有毒的汞蒸气,应增加冷凝回收装置。
答案:(1)不能 不能 能
(2)丙方案的第③步 增加冷凝回收装置
【典例】下列金属冶炼的反应原理,错误的是
【思路点拨】解答本题时应注意以下两点:
【自主解答】选B。在金属活动性顺序表中,K~Al等活泼金属不能用普通的还原剂把它们还原出来,一般采用的是电解熔融盐或氧化物的方法冶炼,而Zn~Cu等金属可以用还原剂(如CO、H2、 C等)高温还原的方法冶炼,必要时再用其他方法(比如铜的精炼)进一步精炼,更不活泼的金属由于它们的化合物更不稳定,因此一般采用热分解法冶炼。
【互动探究】(1)要想得到金属镁,你认为原料是用MgO好还是MgCl2好,可结合MgO和MgCl2的物理性质进行考虑。
(2)C项中要想由Fe3O4得到Fe还有没有其他的方法?如果有,试写出其化学方程式。
提示:(1)金属镁的冶炼采用电解MgCl2的方法较好,因为MgO的熔点较MgCl2的高得多,电解MgO耗能多,成本较高。
(2)可采用铝热反应得到Fe,化学方程式:3Fe3O4+8Al
9Fe+4Al2O3。
高温
====
【规律方法】(1)选择金属冶炼的方法要依据金属在自然界中的存在形态和金属的活泼性。金属活动性顺序表中,金属的位置越靠后,越容易被还原;金属的位置越靠前,越难被还原。
(2)活泼金属的阳离子氧化性非常弱,在反应中很难得到电子转化为金属单质;故活泼金属一般采用最强的氧化还原手段——电解法冶炼。
【变式训练】冶炼金属一般有下列四种方法:①焦炭还原法;②水煤气(氢气或一氧化碳)还原法;③活泼金属置换法;④电解法。四种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜;现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石(MgCl2·KCl·6H2O)中炼镁,对它们的冶炼方法的分析不正确的是( )
A.(Ⅰ)用① B.(Ⅱ)用②
C.(Ⅲ)用③ D.(Ⅳ)用④
【解析】选B。对于(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)发生的反应分别是:
(Ⅰ)Cu2(OH)2CO3 2CuO+H2O+CO2↑,
2CuO+C 2Cu+CO2↑,适合用①;
(Ⅱ)CuSO4+Fe====FeSO4+Cu,适合用③;
(Ⅲ)2Al+Cr2O3 2Cr+Al2O3,适合用③;
(Ⅳ)先从光卤石中提取MgCl2,再电解MgCl2,MgCl2(熔融)
Mg+Cl2↑,适合用④。综上分析,答案为B。
△
====
△
====
高温
====
通电
====
【典例】冶炼金属时用氢气作还原剂和用金属作还原剂相比,所得金属的纯度的说法正确的是
A.用氢气的高 B.用金属的高
C.二者相同 D.无法比较
【思路点拨】解答本题应注意以下两点:
【自主解答】选A。用金属作还原剂,含杂质较多;H2作还原剂被氧化,产物H2O在高温下挥发出去,得到的金属较纯。
【互动探究】铁的工业冶炼方法的优缺点是什么?
提示:优点是:生产成本较低;缺点是:炼得的金属为合金,纯度较低。
【变式训练】(双选)下列各种方法中,适用于炼制相应金属的是( )
A.加热氧化铜 B.氧化镁跟铝粉共热
C.用焦炭还原氧化铜 D.电解熔融氯化钠
【解析】选C、D。氧化铜高温分解得不到铜,氧化镁跟铝粉共热不反应。
【典例】下列说法正确的是
A.高炉炼铁用于还原氧化铁的还原剂是焦炭
B.炼铁时,加入石灰石的作用是促进氧化铁的还原
C.我国最先应用的金属是铜
D.用于电气工业的铜是由黄铜矿冶炼得到的
【易错选项】A
【易错剖析】
(1)易错选项分析
本题易错选A的原因在于对工业炼铁的原理不明确。高炉炼铁用于还原氧化铁的还原剂是一氧化碳。
(2)其他错误选项分析
【标准答案】C
1.金属材料在人类社会的发展史上一直发挥着重要作用。人类历史上使用最早的金属是( )
A.铜 B.铁 C.铝 D.钛
【解析】选A。化学史上金、银、铜等重金属发现较早,而轻金属发现较晚。青铜是人类历史上最早冶炼使用的合金,已有三千多年的历史;冶铁技术在我国春秋初期开始发展起来;钛作为新型金属是近十几年来发展迅速的宇航、飞机、造船等工业使用的重要金属。
2.冶炼Na、Al等活泼金属通常采用的方法是( )
A.电解其熔融盐或氧化物
B.电解其盐的水溶液
C.热分解法
D.热还原法
【解析】选A。Na、Al的化学性质活泼,一般采用电解其熔融盐或氧化物的方法冶炼。
3.(双选)制造货币,应该根据下列哪些性质而选材( )
A.从化学性质来看,金属材料化学性质应稳定
B.从物理性质来看,金属材料应有较低的熔点
C.从物理性质来看,金属材料应有一定的强度、硬度
D.制造货币的金属本身的价值应高于货币的面值
【解析】选A、C。货币要在市面上长时间流通,因此要求制造货币的金属具有化学性质稳定、耐磨、硬度大等特点。
4.下列说法错误的是( )
A.金属越活泼,冶炼难度越大
B.可采用电解熔融氧化铝的方法冶炼铝
C.可采用电解NaCl溶液的方法冶炼金属钠
D.可采用热还原法冶炼铜
【解析】选C。电解NaCl溶液得不到金属钠,金属钠应该用电解熔融NaCl的方法制取,C项错。
5.Fe是地壳中含量很丰富的元素,也是生物体所必需的元素。自然界中铁矿石主要有赤铁矿和磁铁矿。金属铁是在高炉中冶炼的,高炉炼铁除了加入铁矿石外,还需加入焦炭和石灰石。请填空:
(1)写出磁铁矿主要成分的化学式:__________。
(2)写出赤铁矿被还原成铁的化学方程式:_________。
(3)写出焦炭在高炉中所参与反应的两个化学方程式:
____________________________________。
(4)写出CaCO3所参与反应的两个化学方程式:_________。
【解析】本题考查的是铁的冶炼的有关知识,特别要注意两点:(1)还原剂实际上是CO而不是C;(2)CaCO3的作用为分解产生CaO,以除去铁矿石中的脉石(SiO2)。
答案:(1)Fe3O4
(2)Fe2O3+3CO 2Fe+3CO2
(写成Fe2O3+3C 2Fe+3CO↑也可)
(3)C+O2 CO2,CO2+C 2CO
(4)CaCO3 CaO+CO2↑,
CaO+SiO2 CaSiO3
高温
====
高温
====
高温
====
点燃
====
高温
====
高温
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.已知一些金属单质的发现与其金属活动性存在着某种必
然的联系,你认为下列事件发生在铁器时代之前的是( )
①金属铝的冶炼
②青铜器时代
③金银的使用
④戴维发现金属钠
⑤15世纪中国使用锌铸币
A.②③⑤ B.②③
C.①②③ D.①④⑤
【解析】选B。金属的冶炼就是使化合态的阳离子还原成游离态的金属单质,金属越活泼,对应离子得电子的能力越弱,越难被还原,冶炼时所需要的条件越高,开发利用年代越晚。金、银、铜的金属性比铁的弱,开发利用年代比铁的早,锌、铝、钠比铁活泼,开发利用年代比铁的晚。
2.下列能用热分解法制得的金属是( )
A.Fe B.Na C.Mg D.Ag
【解析】选D。热分解法一般用于很不活泼的银、汞等金属的冶炼,它们的化合物大多不稳定,比如氧化银受热时能够分解为相应的金属单质,而活泼金属的化合物一般相当稳定,加热时很难分解。因此,比较活泼的钠、铁和镁不能够通过热分解法制得。
3.(2011·常州高一检测)下列有关金属冶炼的说法不正确的是( )
A.工业上是利用焦炭还原氧化铁而得到铁
B.生铁和钢都属于合金,为混合物
C.工业上采用高温灼烧黄铜矿的方式冶炼铜
D.金属的冶炼方法与金属的活动性有关
【解析】选A。工业上是利用CO还原氧化铁而得到铁。
4.高炉炼铁的反应方程式是Fe2O3+3CO 2Fe+3CO2,
当有560 g铁生成时,电子转移了( )
A.90 mol B.60 mol C.30 mol D.20 mol
【解析】选C。每生成1 mol Fe,电子转移3 mol,生成
560 g铁时,n(Fe)= 故电子转移了
30 mol。
高温
====
5.合金有许多特点,如Na-K合金为液体,而Na和K的单质均为固体。据此试推断:生铁(铁-碳合金)、纯铁、碳三种物质中,熔点最低的是( )
A.纯铁 B.生铁 C.碳 D.无法确定
【解析】选B。根据题目所给信息,可以得知合金的熔点低于其各组成成分的熔点,生铁是由铁、碳熔合而成的合金,因此生铁的熔点最低。
【方法技巧】化学信息题的解题方法
解答信息题的关键是准确理解信息的含义,灵活的进行信息迁移。信息题往往起点高,落点低,信息是生疏的,但多数可直接迁移应用。关于信息题的解题思路,分析如下:
1.细心审题,对题目所给的信息进行提炼、筛选,从中得到有价值的信息。并挖掘出题目中隐蔽性较强的新信息,保证接收信息的全面性;
2.要广泛建立联系,善于知识迁移,将接收到的信息与平时学过的知识结合起来,形成新的知识体系重新接收;
3.要结合题目的要求,应用已有知识判断新信息的意向,经过分析、比较、归纳为新的规律;
4.要理解所给新信息的实质,将新信息向深层拓宽,排除干扰信息,为正确解答创造条件。
二、非选择题(本题包括3小题,共30分)
6.(9分)已知Al、Cu、Hg三种金属分别用如下方法冶炼:2Al2O3(熔融) 4Al+3O2↑
H2+CuO Cu+H2O
2HgO 2Hg+O2↑
(1)分析以上信息,可总结出金属的冶炼方法与其金属性强弱之间的关系是______________________。
通电
====
△
====
△
====
(2)利用(1)中的结论,并结合题目信息,写出工业上用CaCl2冶炼金属钙的化学方程式__________________。
(3)在某些特殊环境下,往往用铝热反应来冶炼一些难熔金属,请写出据此法用MnO2冶炼金属锰的化学方程式_______。
【解析】(1)金属的冶炼方法与金属在自然界中的存在状态、金属活泼性有关。一般来说,非常活泼的金属一般采用电解法冶炼(如K、Ca、Na、Mg、Al等),中等活泼的金属一般用热还原法冶炼(如Zn、Fe、Sn、Pb、Cu等),不活泼的金属一般用热分解法冶炼(如Hg、Ag等)。
(2)Ca是非常活泼的金属,工业上用电解熔融CaCl2的方法冶炼。
(3)金属铝和MnO2发生置换反应生成单质锰和氧化铝。
答案:(1)非常活泼的金属一般采用电解法冶炼,中等活泼的金属一般采用热还原法冶炼,不活泼的金属一般采用热分解法冶炼
(2)CaCl2(熔融) Ca+Cl2↑
(3)4Al+3MnO2 2Al2O3+3Mn
通电
====
△
====
7.(9分)(2011·温州高一检测)根据CO还原铁的氧化物的实验装置图(如图所示),回答下列问题:
(1)怎样知道硬质玻璃管中Fe2O3已开始反应?
______________________________________________。
(2)在A处点燃尾气,可观察到什么现象 为什么要点燃
______________________________________________。
(3)实验结束时应注意的操作是___________________。
①先停止通入CO。
②先熄灭酒精灯,并继续通入CO。
③熄灭酒精灯,同时停止通入CO。
④先熄灭酒精灯,继续通入CO至被还原的铁粉冷却,并点燃排出的CO气体。
【解析】CO还原Fe2O3实验与H2还原CuO实验的原理、操作都很相似。可结合初中H2还原CuO的知识和前一节铁的氧化物的性质解决第一问;从A口出来的尾气主要为CO,CO有毒,最好的办法就是将其点燃以防止污染空气;第三问考查了实验的基本操作。
答案:(1)当硬质玻璃管中红色物质开始变黑,B中澄清石灰水开始变浑浊时,说明Fe2O3已开始发生反应
(2)可见浅蓝色的火焰,因为CO有毒,为防止CO污染空气,必须点燃或用其他方法处理未反应的CO
(3)④
8.(12分)(挑战能力)在一定条件下可实现如图所示物质之间的转化:
请填写以下空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解,上图中的F是_____________________。
(2)写出明矾溶液与过量的NaOH溶液反应的离子方程式__________________________________________。
(3)图中所得G和D都是固体,混合后在高温下可发生反应,写出该反应的化学方程式:__________________。
(4)每生成1 mol D,同时生成________________mol E。
【解析】根据不活泼金属碳酸盐受热易分解成金属氧化物和CO2,以及不活泼金属的氢氧化物受热易分解成金属氧化物和H2O的规律,可推知孔雀石的分解产物为CuO、CO2和H2O,由题意知G为固体即CuO,则F为气体CO2。根据明矾的组成以及Al的性质可知A为含有NaAlO2的溶液。根据电解冶炼铝可以得到金属铝,推知D为Al,E为O2,用 Al作还原剂可以还原CuO。
答案:(1)CO2 (2)Al3++4OH-====AlO2-+2H2O
(3)2Al+3CuO 3Cu+Al2O3
(4)0.75
高温
====
某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案。
(1)甲、乙、丙提出的实验方案能否得到纯净的金属铜?
(填“能”或“不能”)
甲__________,乙_________,丙___________。
(2)在能制得铜的方案中,哪一步操作会导致环境污染?__________。应增加哪些措施防止污染?____________。
【解析】(1)甲实验方案中滤渣的成分是Mg(OH)2、
Fe(OH)3、Cu(OH)2、Hg(OH)2,加热后的残渣为MgO、
Fe2O3、CuO[Hg(OH)2分解成汞蒸气],经H2还原得到的铜中
含有MgO、Fe。乙实验方案中滤渣的成分是Cu、Fe、Hg,加热后的残渣为CuO、Fe3O4,经H2还原得到的铜含有Fe。丙实验方案中加入过量铁粉后的滤渣的成分是Cu、Fe、Hg,加入盐酸后的滤渣为Cu、Hg,加热后Hg蒸发,残渣为CuO,经H2还原得到的铜不含杂质。
(2)丙实验方案能得到纯净的金属铜,其步骤③中产生有毒的汞蒸气,应增加冷凝回收装置。
答案:(1)不能 不能 能
(2)丙方案的第③步 增加冷凝回收装置
