11-12版高中化学全程学习方略配套课件:3.3.2二氧化硅与信息材料(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:3.3.2二氧化硅与信息材料(苏教版必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-11 00:00:00 | ||
图片预览







文档简介
(共78张PPT)
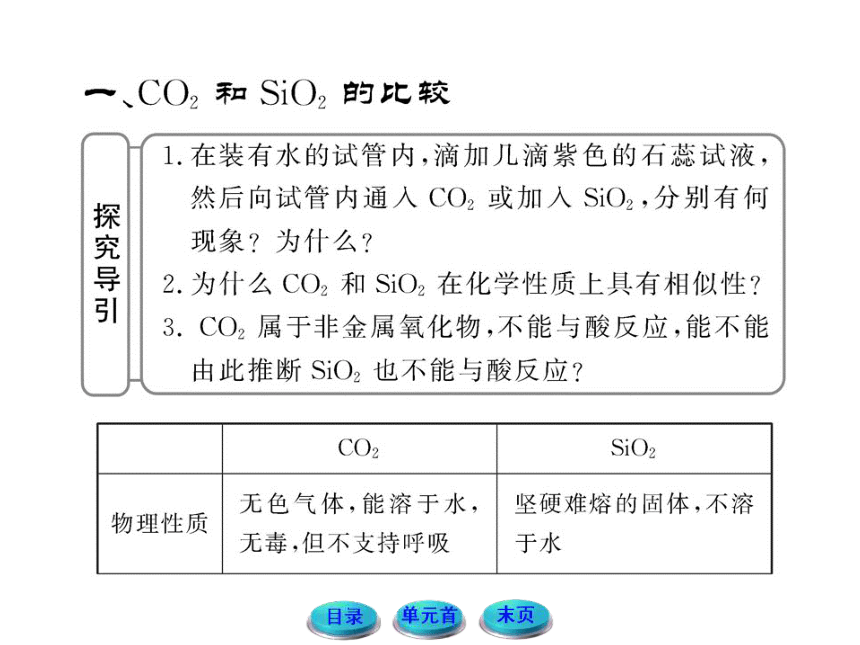
【典例1】下列说法正确的是
A.碳和硅都是非金属元素,原子结构相似,
所以二氧化碳和二氧化硅的物理性质相似
B.因为CaCO3+SiO2 CaSiO3+CO2↑,所以硅酸的酸性比
碳酸强
C.二氧化硅既溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅属于两性氧化物
D.二氧化碳和二氧化硅均属于酸性氧化物,但二氧化硅不能与水反应生成硅酸
高温
====
【思路点拨】解答本题时应注意以下两点:
【自主解答】选D。由于二氧化碳和二氧化硅结构的不同,在物理性质上有较大差异,A错;利用酸式盐之间复分解反应进行的方向判断酸性强弱一般是在水溶液中,事实是碳酸的酸性强于硅酸,故B错;SiO2与氢氟酸反应并没有产生盐,不符合两性氧化物的定义,C错;二氧化硅虽然属于酸性氧化物,但二氧化硅不能与水反应生成硅酸,D正确。
【互动探究】(1)如何证明碳酸的酸性强于硅酸?
(2)实验室怎样制得硅酸?
提示:(1)在硅酸钠溶液中通入CO2,有白色浑浊产生即可证明碳酸的酸性强于硅酸。
(2)向硅酸钠溶液中加入稀盐酸或通入CO2。
【规律方法】对于①Na2CO3+SiO2 Na2SiO3+CO2↑和
②Na2SiO3+CO2+H2O====Na2CO3+H2SiO3↓这两个反应,我们应从不同的角度来理解,反应①是在高温条件下进行,且高温下生成的CO2气体挥发,促进了反应的进行,它符合在高温下由不挥发性酸酐置换挥发性酸酐的反应规律,而反应②,把CO2气体通入Na2SiO3溶液中,由于H2SiO3的酸性比H2CO3的酸性弱,且硅酸的溶解度很小,因而促进了反应的进行,此反应是在溶液中进行的复分解反应,符合强酸制弱酸的规律。
高温
====
【变式训练】SiO2和CO2的共同点是( )
A.都能与水化合生成相应的酸
B.都能与强碱溶液反应生成盐和水
C.熔点都比较低
D.常温下都是固体
【解析】选B。CO2常温下为气体,熔点低,能与水化合生成相应的酸;而SiO2则为固体,熔点很高,但不能与水化合生成相应的酸。二者都能与强碱溶液反应生成盐和水。
【典例2】下列各单质和化合物之间有以下转化关系,而且各单质和化合物组成的元素皆为1~18号元素。
根据上述关系判断:
(1)单质A只可能是__________(填名称)。
(2)单质B一定是_______(填“金属”或“非金属”)单质。
(3)各化合物的化学式为:
甲___________,乙______________。
(4)单质A和NaOH溶液反应的离子方程式为___________。
(5)化合物乙与过量盐酸反应的离子方程式为_________。
【思路点拨】解答本题时应注意以下两点:
【自主解答】本题是元素及化合物推断题,解题的突破口是1~18号元素的单质A与NaOH溶液反应生成氢气C,此元素可能是Al或Si,而产生的化合物乙与过量盐酸反应,生成的化合物丁能失去化合物丙生成化合物甲,则进一步推断出A单质不是金属Al,而只能是Si。又由于单质A和化合物甲都能跟NaOH溶液反应,都生成化合物乙(Na2SiO3),只不过A的另一种产物是氢气,而化合物甲的另一种产物为化合物丙,丙又可通过氢气与单质B反应生成,故单质B为O2,其他的各种化合物也就能推断出来了。
答案:(1)硅 (2)非金属 (3)SiO2 Na2SiO3
(4)Si+2OH-+H2O====SiO32-+2H2↑
(5)SiO32-+2H+====H2SiO3↓
【互动探究】(1)如何除去硅中混有的铝单质?
(2)写出丁生成甲的化学方程式。
提示:(1)加入足量盐酸,过滤即可。
(2)H2SiO3 SiO2+H2O
△
====
【变式训练】地壳中含量第一和第二的两种元素形成的化合物,不具有的性质是( )
A.熔点很高
B.能与水反应生成对应的酸
C.可与纯碱反应
D.与碳在高温下反应可制取两种元素中的一种单质
【解析】选B。地壳中含量第一和第二的两种元素分别为氧、硅,形成的化合物为SiO2,SiO2熔点很高,难溶于水,不能与水反应,但与纯碱反应生成硅酸钠和二氧化碳,与单质碳发生反应SiO2+2C Si+2CO↑,故选B。
高温
====
【典例】氮化硅是一种高温结构陶瓷,它的硬度大,熔点高,化学性质稳定,工业上普遍采用高纯度硅和纯氮在
1 300℃时反应获得。请回答下列问题:
(1)根据性质,推测氮化硅陶瓷的用途:
A.制气轮机叶片 B.制有色玻璃
C.制永久性模型 D.制柴油机
(2)氮化硅陶瓷抗腐蚀性能强,除氢氟酸外,它不跟其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式
______________________________。
【思路点拨】解答本题时应注意以下两点
【自主解答】(1)氮化硅熔点高,硬度大,化学性质稳定,故可用于制造气轮机叶片、永久性模型、柴油机等。(2)该反应可由二氧化硅与氢氟酸的反应类比得出。
答案:(1)A、C、D (2)Si3N4+12HF====3SiF4↑+4NH3↑
【互动探究】用SiCl4在氢气中与氮气反应(加强热)可制得高纯度的氮化硅,试写出反应的化学方程式。
提示:反应物已经知道,生成物的一种为氮化硅,另一种根据反应物中所含元素可推断为氯化氢,然后依据得失电子以及反应前后原子个数守恒配平即可。3SiCl4+2N2+6H2
Si3N4+12HCl。
高温
====
【变式训练】下列关于材料的分类中,正确的是( )
A.硅酸盐材料属于新型无机非金属材料
B.高温结构陶瓷属于新型无机非金属材料
C.水泥属于新型无机非金属材料
D.钢化玻璃属于新型非金属材料
【解析】选B。硅酸盐材料、水泥、钢化玻璃均属于传统无机非金属材料。
【典例】下列说法正确的是
A.SiO2是酸性氧化物不跟任何酸反应
B.不能用玻璃瓶盛放氢氧化钠溶液
C.硅单质是重要的半导体材料
D.SiO2和CO2化学性质相似,都很容易与碱性氧化物反应
【易错选项】B
【易错剖析】
(1)易错选项分析
本题易错选B的原因在于对识记知识掌握不牢固,将“不能用带玻璃塞的玻璃瓶盛放氢氧化钠溶液”记为“不能用玻璃瓶盛放氢氧化钠溶液”。
(2)其他错误选项分析:
【标准答案】C
1.2010年10月1日我国的“嫦娥二号”探月卫星在西昌卫星发射中心成功升空,中国探月工程二期揭开序幕。卫星正常工作的能源有的来自于太阳能,晶体硅可以使这一能量转化顺利完成,下列有关硅的说法错误的是( )
A.硅是一种良好的半导体材料,广泛应用于电子工业的各个领域
B.硅元素在地壳中的含量仅次于氧
C.硅的化学性质不活泼,在自然界中可以以游离态形式存在
D.加热到一定温度时,硅能与氢气、氧气等非金属单质发生反应
【解析】选C。虽然硅的化学性质稳定,但自然界中并不存在单质硅。
2.被誉为“光纤之父”的华人科学家高锟荣获2009年诺贝尔物理奖。下列叙述不正确的是( )
A.SiO2是生产光导纤维和粗硅的主要原料
B.SiO2与CO2都属于酸性氧化物,都不能与酸反应
C.SiO2与CO2都能够与氢氧化钠溶液反应
D.水晶的主要成分是SiO2
【解析】选B。酸性氧化物一般不溶于酸能溶于碱,但SiO2可溶于氢氟酸(HF),因此HF可用来在玻璃上雕花或刻字,其反应的化学方程式为:SiO2+4HF====SiF4↑+2H2O。
3.下列物质中能与二氧化硅起化学反应的是( )
①浓硝酸 ②水 ③氢氟酸 ④KOH溶液
A.①② B.②④ C.①④ D.③④
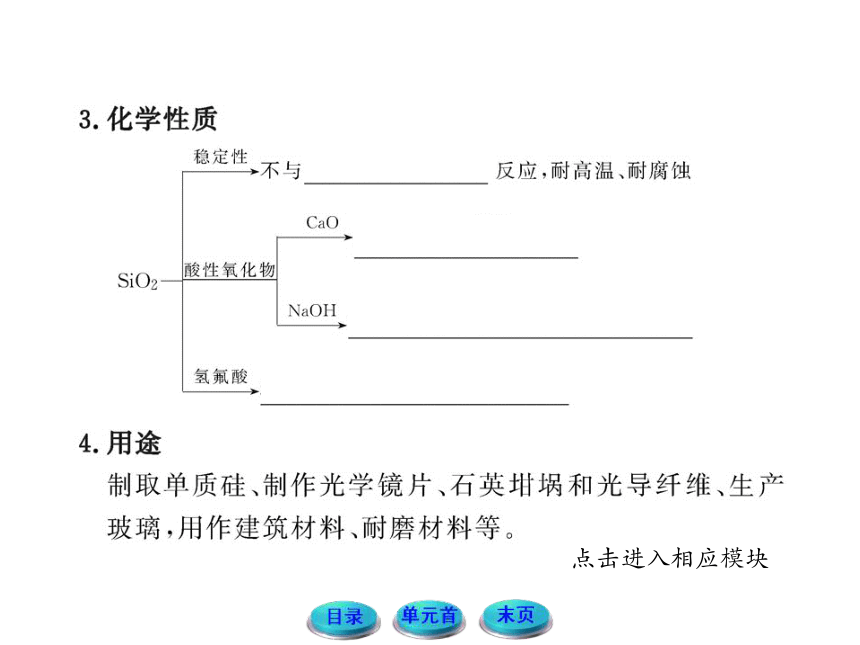
【解析】选D。常温下二氧化硅性质很稳定,除强碱和氢氟酸外,很难与其他物质反应,且不溶于水,不与强氧化剂等反应,故本题中③④能与二氧化硅发生化学反应。
4.熔融烧碱应选用的器皿是( )
A.石英坩埚 B.普通玻璃坩埚
C.生铁坩埚 D.陶瓷坩埚
【解析】选C。石英、普通玻璃、陶瓷中均含有SiO2,高温下,烧碱能与SiO2反应而使坩埚腐蚀:SiO2+2NaOH ==== Na2SiO3+H2O,铁在高温下不与NaOH反应。
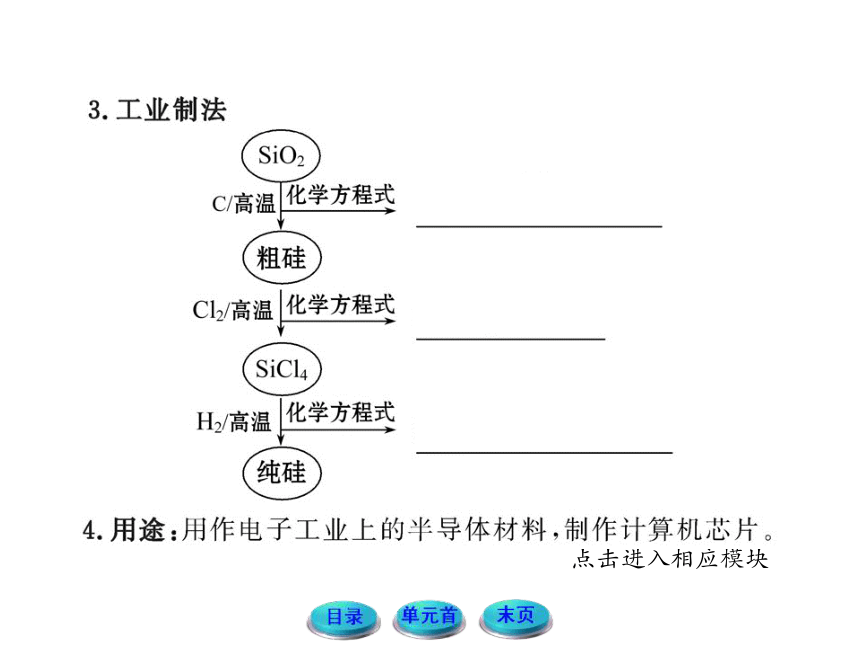
5.工业上可用碳在高温下还原二氧化硅的方法制取少量粗硅:SiO2+2C Si+2CO↑。
(1)在该反应中,作为氧化剂的物质是______(填化学式),作为还原剂的物质是_______(填化学式);
(2)若反应中生成了1 mol Si,则需消耗______mol SiO2。
(3)由粗硅制纯硅时,粗硅与氯气反应后得到沸点较低的液态四氯化硅中常混有一些高沸点、难挥发性杂质,必须进行分离提纯。其提纯方法为__________。(填序号)
A.蒸馏 B.过滤 C.萃取 D.蒸发
(4)向四氯化硅中通入氢气得到高纯硅和氯化氢气体,写出该反应的化学方程式:______________。
高温
====
【解析】根据反应SiO2+2C Si+2CO↑由SiO2到Si得电子,SiO2为氧化剂;由C到CO失电子,C为还原剂,反应中生成了1 mol Si,则需消耗1mol SiO2。分离液体混合物时,可以利用它们沸点的不同采用蒸馏的方法。
答案:(1)SiO2 C (2)1 (3)A
(4)SiCl4+2H2 Si+4HCl
高温
====
高温
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.(2011·延边高一检测)制取下列物质时,不需用石灰石作原料的是( )
A.硅酸 B.水泥 C.玻璃 D.生石灰
【解析】选A。硅酸一般是利用可溶性硅酸盐溶液与酸反应制取,用不到石灰石。
2.下列相关说法正确的是( )
A.水泥的主要成分有硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)及其他一些成分,所以硅酸盐都是氧化物
B.水泥、普通玻璃都是混合物
C.硅酸盐工业使用的每一种原料都含有硅元素
D.水泥、玻璃、陶瓷等硅酸盐材料都不溶于水,所以所有的硅酸盐都不溶于水
【解析】选B。由于硅酸盐的组成相当复杂,因此通常人们以氧化物的形式来表示它们的组成,但硅酸盐并不是氧化物,A错;比如生产玻璃的原料有石灰石、纯碱、石英,可见有的原料并不含硅元素,C错;绝大多数硅酸盐不溶于水,但少数可溶,如硅酸钠易溶于水,D错。
3.(2011·东城高一检测)下列关于硅材料的说法正确的是
( )
A.二氧化硅是电子工业中重要的半导体材料
B.制普通玻璃的原料是石灰石、纯碱和石英砂
C.光导纤维的主要成分是晶体硅
D.水晶项链、玻璃、水泥和陶瓷都是硅酸盐制品
【解析】选B。硅是电子工业中重要的半导体材料,光导纤维的主要成分是二氧化硅,故A、C错;水晶属于天然存在的二氧化硅,故D错。
4.下列说法:
①硅的化学性质很稳定,因此硅在自然界中以游离态形式存在;
②硅和二氧化硅都能与NaOH溶液反应;
③二氧化硅和二氧化碳在物理性质上有很大的差异;
④二氧化硅是一种酸性氧化物,它不与任何酸发生反应。
正确的是 ( )
A.①②③④ B.①②④
C.①④ D.②③
【解析】选D。硅的化学性质虽然稳定,但在自然界中只以化合态的形式存在;二氧化硅可与氢氟酸发生反应,所以①④均错,故选D。
5.(2011·日照高一检测)除去SiO2中混有的少量生石灰和石灰石,有如下操作:①加水溶解 ②加水煮沸
③过滤 ④加稀盐酸 ⑤加稀硫酸,
正确的操作顺序是( )
A.①③ B.④③
C.⑤③ D.②③
【解析】选B。该题考查SiO2、生石灰和石灰石的性质及应用。SiO2不与盐酸反应,CaO、CaCO3与盐酸反应生成可溶性的物质。
二、非选择题(本题包括3小题,共30分)
6.(9分)露置于空气中一段时间后的水玻璃会变浑浊。向此浑浊溶液中加入稀盐酸,会生成白色沉淀,同时伴随有气泡产生。用化学方程式解释产生上述现象的原因:
(1)溶液变浑浊:________________________________;
(2)生成白色沉淀:______________________________;
(3)产生气泡:__________________________________。
【解析】水玻璃露置于空气中一段时间后,会和空气中CO2反应产生少量硅酸沉淀和碳酸钠,加入盐酸后,盐酸和硅酸钠反应产生硅酸沉淀,同时和碳酸钠反应产生气体。
答案:(1)Na2SiO3+CO2+H2O====Na2CO3+H2SiO3↓
(2)Na2SiO3+2HCl====2NaCl+H2SiO3↓
(3)Na2CO3+2HCl====2NaCl+CO2↑+H2O
7.(9分)石棉是一类具有压伸强度大,柔韧性大、耐热、耐高温、耐酸碱腐蚀,而且价格低廉的硅酸盐。石棉有毒,能使人患肺癌,有一种矿青石棉,它的化学式为Na2Fe5Si8O22(OH)2。
(1)该石棉中与5个铁原子形成氧化物的氧原子数目是_________________个;
(2)矿青石棉化学式中铁元素的“平均化合价(或氧化数)”可视为_________________;
(3)将该石棉的化学式改写为氧化物的形式:
____________________________________。
(4)这种石棉属于传统的无机非金属材料,下列哪些不属于传统的无机非金属材料________________。
A.光导纤维 B.水泥 C.耐高温的金属钛
D.氧化铝陶瓷 E.混凝土
【解析】(1)该石棉中与5个铁原子形成氧化物的氧原子数目,等于总氧原子数与Na、Si、H对应氧化物中氧原子数之差,共有6个。
(2)设铁元素的平均化合价为x,则
5x=6×2,x=
(4)光导纤维、氧化铝陶瓷属新型无机非金属材料;水泥、混凝土属传统无机非金属材料,耐高温的金属钛属金属材料。
答案:(1)6 (2)
(3)Na2O·3FeO·Fe2O3·8SiO2·H2O (4)A、C、D
8.(12分)(挑战能力)A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
请填空:
(1)形成单质A的元素的原子结构示意图为___________,
它的最高化合价为____________________。
(2)B的化学式为______________。B和碳反应生成A和E的
化学方程式是____________________。
(3)C的化学式为___________,D的化学式为_________。
【解析】地壳中含量占第二位的元素为Si,我们所学过的制备单质硅的反应是:SiO2+2C Si+2CO↑,所以可以
推断B为SiO2,E为CO;SiO2和CaO反应生成CaSiO3,所以C为CaSiO3;SiO2和NaOH反应生成Na2SiO3和H2O,所以D为Na2SiO3。
答案:(1) +4价
(2)SiO2 SiO2+2C Si+2CO↑
(3)CaSiO3 Na2SiO3
高温
====
高温
====
【方法技巧】单质之间的置换反应类型
反应类型常做无机推断题的突破口之一,现将单质之间的置换归纳如下:
元素可以分为金属元素和非金属元素,所以从元素的角度分析置换反应可以分为如下类型:
(1)金属→金属
金属+盐→金属+盐
铝热反应
(2)金属→非金属
活泼金属(Na、Mg、Fe) H2↑
2Mg+CO2 2MgO+C
(3)非金属→非金属
2F2+2H2O====4HF+O2↑
2C+SiO2 Si+2CO↑
C+H2O CO+H2
Cl2(Br2、I2)+H2S====S+2HCl(HBr、HI)
高温
====
高温
====
点燃
====
H+或H2O
某化学兴趣小组的成员捡到一块矿石,观察外观发现该矿石坚硬且呈红褐色,投入水中没有任何变化,再向水中加浓盐酸至过量,矿石部分溶解,并有大量无色气体生成。学生猜测该矿石可能由CaCO3、SiO2、Fe2O3三种成分组成,试设计实验证明CaCO3以外的两种成分。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗、漏斗架;2 mol/L盐酸、2 mol/L NaOH溶液、2% KSCN溶液。
设计实验方案如下:
(1)选用的试剂为Ⅰ________,Ⅱ________,Ⅲ________。
(2)如果猜测是成立的,试根据上述实验方案,叙述实验操作,预期现象和结论。
【解析】Fe2O3可溶于盐酸,在溶液中存在Fe3+,可用SCN-检验其存在,从而说明矿石中含Fe2O3;SiO2不溶于盐酸,作为残渣被滤出。为进一步确认,加入NaOH溶液,充分反应后,再加盐酸,如果生成白色胶状沉淀则说明矿石中有SiO2。
答案:(1)2%KSCN溶液 2 mol/L NaOH溶液
2 mol/L盐酸
(2)
【典例1】下列说法正确的是
A.碳和硅都是非金属元素,原子结构相似,
所以二氧化碳和二氧化硅的物理性质相似
B.因为CaCO3+SiO2 CaSiO3+CO2↑,所以硅酸的酸性比
碳酸强
C.二氧化硅既溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅属于两性氧化物
D.二氧化碳和二氧化硅均属于酸性氧化物,但二氧化硅不能与水反应生成硅酸
高温
====
【思路点拨】解答本题时应注意以下两点:
【自主解答】选D。由于二氧化碳和二氧化硅结构的不同,在物理性质上有较大差异,A错;利用酸式盐之间复分解反应进行的方向判断酸性强弱一般是在水溶液中,事实是碳酸的酸性强于硅酸,故B错;SiO2与氢氟酸反应并没有产生盐,不符合两性氧化物的定义,C错;二氧化硅虽然属于酸性氧化物,但二氧化硅不能与水反应生成硅酸,D正确。
【互动探究】(1)如何证明碳酸的酸性强于硅酸?
(2)实验室怎样制得硅酸?
提示:(1)在硅酸钠溶液中通入CO2,有白色浑浊产生即可证明碳酸的酸性强于硅酸。
(2)向硅酸钠溶液中加入稀盐酸或通入CO2。
【规律方法】对于①Na2CO3+SiO2 Na2SiO3+CO2↑和
②Na2SiO3+CO2+H2O====Na2CO3+H2SiO3↓这两个反应,我们应从不同的角度来理解,反应①是在高温条件下进行,且高温下生成的CO2气体挥发,促进了反应的进行,它符合在高温下由不挥发性酸酐置换挥发性酸酐的反应规律,而反应②,把CO2气体通入Na2SiO3溶液中,由于H2SiO3的酸性比H2CO3的酸性弱,且硅酸的溶解度很小,因而促进了反应的进行,此反应是在溶液中进行的复分解反应,符合强酸制弱酸的规律。
高温
====
【变式训练】SiO2和CO2的共同点是( )
A.都能与水化合生成相应的酸
B.都能与强碱溶液反应生成盐和水
C.熔点都比较低
D.常温下都是固体
【解析】选B。CO2常温下为气体,熔点低,能与水化合生成相应的酸;而SiO2则为固体,熔点很高,但不能与水化合生成相应的酸。二者都能与强碱溶液反应生成盐和水。
【典例2】下列各单质和化合物之间有以下转化关系,而且各单质和化合物组成的元素皆为1~18号元素。
根据上述关系判断:
(1)单质A只可能是__________(填名称)。
(2)单质B一定是_______(填“金属”或“非金属”)单质。
(3)各化合物的化学式为:
甲___________,乙______________。
(4)单质A和NaOH溶液反应的离子方程式为___________。
(5)化合物乙与过量盐酸反应的离子方程式为_________。
【思路点拨】解答本题时应注意以下两点:
【自主解答】本题是元素及化合物推断题,解题的突破口是1~18号元素的单质A与NaOH溶液反应生成氢气C,此元素可能是Al或Si,而产生的化合物乙与过量盐酸反应,生成的化合物丁能失去化合物丙生成化合物甲,则进一步推断出A单质不是金属Al,而只能是Si。又由于单质A和化合物甲都能跟NaOH溶液反应,都生成化合物乙(Na2SiO3),只不过A的另一种产物是氢气,而化合物甲的另一种产物为化合物丙,丙又可通过氢气与单质B反应生成,故单质B为O2,其他的各种化合物也就能推断出来了。
答案:(1)硅 (2)非金属 (3)SiO2 Na2SiO3
(4)Si+2OH-+H2O====SiO32-+2H2↑
(5)SiO32-+2H+====H2SiO3↓
【互动探究】(1)如何除去硅中混有的铝单质?
(2)写出丁生成甲的化学方程式。
提示:(1)加入足量盐酸,过滤即可。
(2)H2SiO3 SiO2+H2O
△
====
【变式训练】地壳中含量第一和第二的两种元素形成的化合物,不具有的性质是( )
A.熔点很高
B.能与水反应生成对应的酸
C.可与纯碱反应
D.与碳在高温下反应可制取两种元素中的一种单质
【解析】选B。地壳中含量第一和第二的两种元素分别为氧、硅,形成的化合物为SiO2,SiO2熔点很高,难溶于水,不能与水反应,但与纯碱反应生成硅酸钠和二氧化碳,与单质碳发生反应SiO2+2C Si+2CO↑,故选B。
高温
====
【典例】氮化硅是一种高温结构陶瓷,它的硬度大,熔点高,化学性质稳定,工业上普遍采用高纯度硅和纯氮在
1 300℃时反应获得。请回答下列问题:
(1)根据性质,推测氮化硅陶瓷的用途:
A.制气轮机叶片 B.制有色玻璃
C.制永久性模型 D.制柴油机
(2)氮化硅陶瓷抗腐蚀性能强,除氢氟酸外,它不跟其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式
______________________________。
【思路点拨】解答本题时应注意以下两点
【自主解答】(1)氮化硅熔点高,硬度大,化学性质稳定,故可用于制造气轮机叶片、永久性模型、柴油机等。(2)该反应可由二氧化硅与氢氟酸的反应类比得出。
答案:(1)A、C、D (2)Si3N4+12HF====3SiF4↑+4NH3↑
【互动探究】用SiCl4在氢气中与氮气反应(加强热)可制得高纯度的氮化硅,试写出反应的化学方程式。
提示:反应物已经知道,生成物的一种为氮化硅,另一种根据反应物中所含元素可推断为氯化氢,然后依据得失电子以及反应前后原子个数守恒配平即可。3SiCl4+2N2+6H2
Si3N4+12HCl。
高温
====
【变式训练】下列关于材料的分类中,正确的是( )
A.硅酸盐材料属于新型无机非金属材料
B.高温结构陶瓷属于新型无机非金属材料
C.水泥属于新型无机非金属材料
D.钢化玻璃属于新型非金属材料
【解析】选B。硅酸盐材料、水泥、钢化玻璃均属于传统无机非金属材料。
【典例】下列说法正确的是
A.SiO2是酸性氧化物不跟任何酸反应
B.不能用玻璃瓶盛放氢氧化钠溶液
C.硅单质是重要的半导体材料
D.SiO2和CO2化学性质相似,都很容易与碱性氧化物反应
【易错选项】B
【易错剖析】
(1)易错选项分析
本题易错选B的原因在于对识记知识掌握不牢固,将“不能用带玻璃塞的玻璃瓶盛放氢氧化钠溶液”记为“不能用玻璃瓶盛放氢氧化钠溶液”。
(2)其他错误选项分析:
【标准答案】C
1.2010年10月1日我国的“嫦娥二号”探月卫星在西昌卫星发射中心成功升空,中国探月工程二期揭开序幕。卫星正常工作的能源有的来自于太阳能,晶体硅可以使这一能量转化顺利完成,下列有关硅的说法错误的是( )
A.硅是一种良好的半导体材料,广泛应用于电子工业的各个领域
B.硅元素在地壳中的含量仅次于氧
C.硅的化学性质不活泼,在自然界中可以以游离态形式存在
D.加热到一定温度时,硅能与氢气、氧气等非金属单质发生反应
【解析】选C。虽然硅的化学性质稳定,但自然界中并不存在单质硅。
2.被誉为“光纤之父”的华人科学家高锟荣获2009年诺贝尔物理奖。下列叙述不正确的是( )
A.SiO2是生产光导纤维和粗硅的主要原料
B.SiO2与CO2都属于酸性氧化物,都不能与酸反应
C.SiO2与CO2都能够与氢氧化钠溶液反应
D.水晶的主要成分是SiO2
【解析】选B。酸性氧化物一般不溶于酸能溶于碱,但SiO2可溶于氢氟酸(HF),因此HF可用来在玻璃上雕花或刻字,其反应的化学方程式为:SiO2+4HF====SiF4↑+2H2O。
3.下列物质中能与二氧化硅起化学反应的是( )
①浓硝酸 ②水 ③氢氟酸 ④KOH溶液
A.①② B.②④ C.①④ D.③④
【解析】选D。常温下二氧化硅性质很稳定,除强碱和氢氟酸外,很难与其他物质反应,且不溶于水,不与强氧化剂等反应,故本题中③④能与二氧化硅发生化学反应。
4.熔融烧碱应选用的器皿是( )
A.石英坩埚 B.普通玻璃坩埚
C.生铁坩埚 D.陶瓷坩埚
【解析】选C。石英、普通玻璃、陶瓷中均含有SiO2,高温下,烧碱能与SiO2反应而使坩埚腐蚀:SiO2+2NaOH ==== Na2SiO3+H2O,铁在高温下不与NaOH反应。
5.工业上可用碳在高温下还原二氧化硅的方法制取少量粗硅:SiO2+2C Si+2CO↑。
(1)在该反应中,作为氧化剂的物质是______(填化学式),作为还原剂的物质是_______(填化学式);
(2)若反应中生成了1 mol Si,则需消耗______mol SiO2。
(3)由粗硅制纯硅时,粗硅与氯气反应后得到沸点较低的液态四氯化硅中常混有一些高沸点、难挥发性杂质,必须进行分离提纯。其提纯方法为__________。(填序号)
A.蒸馏 B.过滤 C.萃取 D.蒸发
(4)向四氯化硅中通入氢气得到高纯硅和氯化氢气体,写出该反应的化学方程式:______________。
高温
====
【解析】根据反应SiO2+2C Si+2CO↑由SiO2到Si得电子,SiO2为氧化剂;由C到CO失电子,C为还原剂,反应中生成了1 mol Si,则需消耗1mol SiO2。分离液体混合物时,可以利用它们沸点的不同采用蒸馏的方法。
答案:(1)SiO2 C (2)1 (3)A
(4)SiCl4+2H2 Si+4HCl
高温
====
高温
====
一、选择题(本题包括5小题,每小题4分,共20分)
1.(2011·延边高一检测)制取下列物质时,不需用石灰石作原料的是( )
A.硅酸 B.水泥 C.玻璃 D.生石灰
【解析】选A。硅酸一般是利用可溶性硅酸盐溶液与酸反应制取,用不到石灰石。
2.下列相关说法正确的是( )
A.水泥的主要成分有硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)及其他一些成分,所以硅酸盐都是氧化物
B.水泥、普通玻璃都是混合物
C.硅酸盐工业使用的每一种原料都含有硅元素
D.水泥、玻璃、陶瓷等硅酸盐材料都不溶于水,所以所有的硅酸盐都不溶于水
【解析】选B。由于硅酸盐的组成相当复杂,因此通常人们以氧化物的形式来表示它们的组成,但硅酸盐并不是氧化物,A错;比如生产玻璃的原料有石灰石、纯碱、石英,可见有的原料并不含硅元素,C错;绝大多数硅酸盐不溶于水,但少数可溶,如硅酸钠易溶于水,D错。
3.(2011·东城高一检测)下列关于硅材料的说法正确的是
( )
A.二氧化硅是电子工业中重要的半导体材料
B.制普通玻璃的原料是石灰石、纯碱和石英砂
C.光导纤维的主要成分是晶体硅
D.水晶项链、玻璃、水泥和陶瓷都是硅酸盐制品
【解析】选B。硅是电子工业中重要的半导体材料,光导纤维的主要成分是二氧化硅,故A、C错;水晶属于天然存在的二氧化硅,故D错。
4.下列说法:
①硅的化学性质很稳定,因此硅在自然界中以游离态形式存在;
②硅和二氧化硅都能与NaOH溶液反应;
③二氧化硅和二氧化碳在物理性质上有很大的差异;
④二氧化硅是一种酸性氧化物,它不与任何酸发生反应。
正确的是 ( )
A.①②③④ B.①②④
C.①④ D.②③
【解析】选D。硅的化学性质虽然稳定,但在自然界中只以化合态的形式存在;二氧化硅可与氢氟酸发生反应,所以①④均错,故选D。
5.(2011·日照高一检测)除去SiO2中混有的少量生石灰和石灰石,有如下操作:①加水溶解 ②加水煮沸
③过滤 ④加稀盐酸 ⑤加稀硫酸,
正确的操作顺序是( )
A.①③ B.④③
C.⑤③ D.②③
【解析】选B。该题考查SiO2、生石灰和石灰石的性质及应用。SiO2不与盐酸反应,CaO、CaCO3与盐酸反应生成可溶性的物质。
二、非选择题(本题包括3小题,共30分)
6.(9分)露置于空气中一段时间后的水玻璃会变浑浊。向此浑浊溶液中加入稀盐酸,会生成白色沉淀,同时伴随有气泡产生。用化学方程式解释产生上述现象的原因:
(1)溶液变浑浊:________________________________;
(2)生成白色沉淀:______________________________;
(3)产生气泡:__________________________________。
【解析】水玻璃露置于空气中一段时间后,会和空气中CO2反应产生少量硅酸沉淀和碳酸钠,加入盐酸后,盐酸和硅酸钠反应产生硅酸沉淀,同时和碳酸钠反应产生气体。
答案:(1)Na2SiO3+CO2+H2O====Na2CO3+H2SiO3↓
(2)Na2SiO3+2HCl====2NaCl+H2SiO3↓
(3)Na2CO3+2HCl====2NaCl+CO2↑+H2O
7.(9分)石棉是一类具有压伸强度大,柔韧性大、耐热、耐高温、耐酸碱腐蚀,而且价格低廉的硅酸盐。石棉有毒,能使人患肺癌,有一种矿青石棉,它的化学式为Na2Fe5Si8O22(OH)2。
(1)该石棉中与5个铁原子形成氧化物的氧原子数目是_________________个;
(2)矿青石棉化学式中铁元素的“平均化合价(或氧化数)”可视为_________________;
(3)将该石棉的化学式改写为氧化物的形式:
____________________________________。
(4)这种石棉属于传统的无机非金属材料,下列哪些不属于传统的无机非金属材料________________。
A.光导纤维 B.水泥 C.耐高温的金属钛
D.氧化铝陶瓷 E.混凝土
【解析】(1)该石棉中与5个铁原子形成氧化物的氧原子数目,等于总氧原子数与Na、Si、H对应氧化物中氧原子数之差,共有6个。
(2)设铁元素的平均化合价为x,则
5x=6×2,x=
(4)光导纤维、氧化铝陶瓷属新型无机非金属材料;水泥、混凝土属传统无机非金属材料,耐高温的金属钛属金属材料。
答案:(1)6 (2)
(3)Na2O·3FeO·Fe2O3·8SiO2·H2O (4)A、C、D
8.(12分)(挑战能力)A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如图所示。A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
请填空:
(1)形成单质A的元素的原子结构示意图为___________,
它的最高化合价为____________________。
(2)B的化学式为______________。B和碳反应生成A和E的
化学方程式是____________________。
(3)C的化学式为___________,D的化学式为_________。
【解析】地壳中含量占第二位的元素为Si,我们所学过的制备单质硅的反应是:SiO2+2C Si+2CO↑,所以可以
推断B为SiO2,E为CO;SiO2和CaO反应生成CaSiO3,所以C为CaSiO3;SiO2和NaOH反应生成Na2SiO3和H2O,所以D为Na2SiO3。
答案:(1) +4价
(2)SiO2 SiO2+2C Si+2CO↑
(3)CaSiO3 Na2SiO3
高温
====
高温
====
【方法技巧】单质之间的置换反应类型
反应类型常做无机推断题的突破口之一,现将单质之间的置换归纳如下:
元素可以分为金属元素和非金属元素,所以从元素的角度分析置换反应可以分为如下类型:
(1)金属→金属
金属+盐→金属+盐
铝热反应
(2)金属→非金属
活泼金属(Na、Mg、Fe) H2↑
2Mg+CO2 2MgO+C
(3)非金属→非金属
2F2+2H2O====4HF+O2↑
2C+SiO2 Si+2CO↑
C+H2O CO+H2
Cl2(Br2、I2)+H2S====S+2HCl(HBr、HI)
高温
====
高温
====
点燃
====
H+或H2O
某化学兴趣小组的成员捡到一块矿石,观察外观发现该矿石坚硬且呈红褐色,投入水中没有任何变化,再向水中加浓盐酸至过量,矿石部分溶解,并有大量无色气体生成。学生猜测该矿石可能由CaCO3、SiO2、Fe2O3三种成分组成,试设计实验证明CaCO3以外的两种成分。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、滴管、药匙、漏斗、漏斗架;2 mol/L盐酸、2 mol/L NaOH溶液、2% KSCN溶液。
设计实验方案如下:
(1)选用的试剂为Ⅰ________,Ⅱ________,Ⅲ________。
(2)如果猜测是成立的,试根据上述实验方案,叙述实验操作,预期现象和结论。
【解析】Fe2O3可溶于盐酸,在溶液中存在Fe3+,可用SCN-检验其存在,从而说明矿石中含Fe2O3;SiO2不溶于盐酸,作为残渣被滤出。为进一步确认,加入NaOH溶液,充分反应后,再加盐酸,如果生成白色胶状沉淀则说明矿石中有SiO2。
答案:(1)2%KSCN溶液 2 mol/L NaOH溶液
2 mol/L盐酸
(2)
