11-12版高中化学全程学习方略配套课件:专题质量评估(二)(苏教版必修1)
文档属性
| 名称 | 11-12版高中化学全程学习方略配套课件:专题质量评估(二)(苏教版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 350.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-11 00:00:00 | ||
图片预览










文档简介
(共37张PPT)
(二)
专题2 从海水中获得的化学物质
(45分钟 100分)
一、选择题(本题包括12小题,每小题4分,
共48分)
1.下列说法中正确的是( )
①两种溶液中,导电能力较强的就是强电解质
②不是强电解质的物质也不一定是弱电解质
③固体硫酸钡不导电,它是非电解质
④两种溶液中,溶质的量越多,导电能力越强
⑤浓溶液比稀溶液导电能力强
⑥液态氯、氯化氢都不导电,但其水溶液能导电,则二者应是电解质
A.①④⑥ B.①②③④⑤
C.只有② D.全部
【解析】选C。①导电能力不取决于电解质的强弱,由电解质电离的阴、阳离子的浓度大小决定;③BaSO4熔融状态,能完全电离,故为强电解质;④⑤中溶液的浓度不是决定导电能力的直接因素;⑥液氯是单质,因此不是电解质,也不是非电解质。
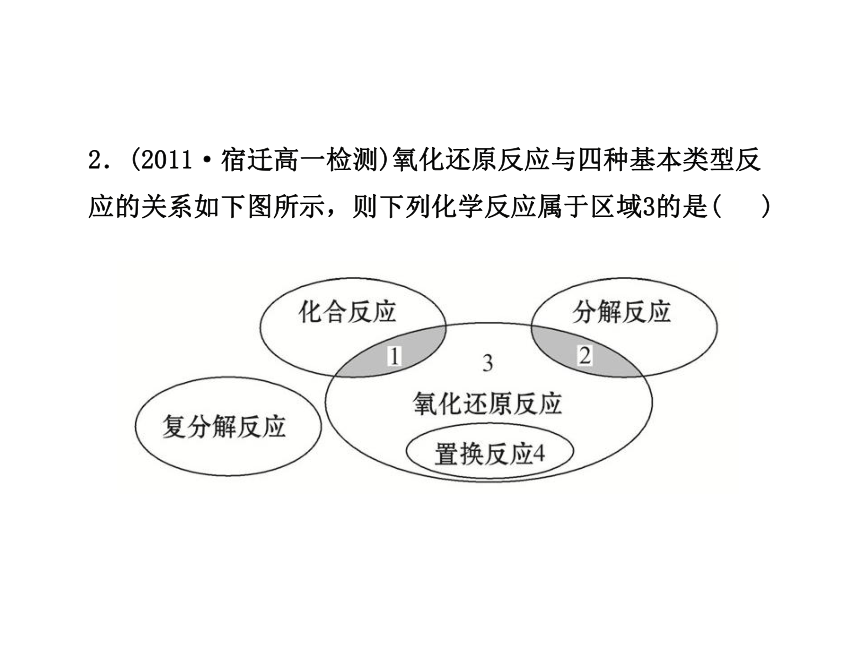
2.(2011·宿迁高一检测)氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是( )
【解析】选B。区域3表示的为不是置换、分解和化合的氧化还原反应。A是置换反应,C是分解反应,D是化合反应。
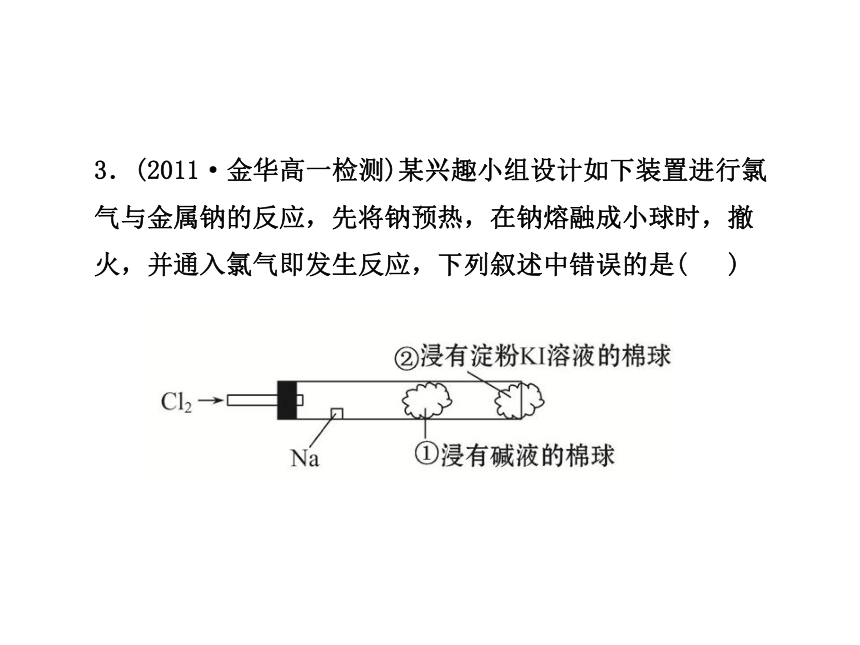
3.(2011·金华高一检测)某兴趣小组设计如下装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是( )
A.钠着火剧烈燃烧产生黄色的火焰
B.反应产生的大量白烟是氯化钠固体
C.棉球①的作用是吸收过量氯气防止产生污染
D.棉球②变蓝色则证明氯气已被碱液完全吸收
【解析】选D。金属钠在氯气中燃烧,产生白烟和黄色火焰,且生成白色的氯化钠固体,无苍白色火焰,碱液可以吸收多余的氯气防止产生污染,淀粉碘化钾溶液的作用是检验氯气是否被碱液吸收完全,因为淀粉碘化钾溶液遇到氯气变蓝,棉球②变蓝则说明碱液没有将氯气吸收完全。
4.(双选)下列说法正确的是( )
A.通过电解熔融的无水MgCl2可以制得金属镁
B.镁条在空气中燃烧所得的固体物质是氧化镁
C.氧化镁是优质的耐火材料
D.金属镁质地柔软,不适宜制作高强度的合金材料
【解析】选A、C。电解熔融无水MgCl2可制得镁;镁条在空气中燃烧会生成Mg3N2、MgO、C等固体物质;MgO的熔点很高,可作耐火材料;虽然金属镁质地柔软,但是它能够和许多金属形成合金,这些合金密度小,硬度和强度都比较大,被大量用于制造火箭、导弹和飞机的部件等。
5.(2011·延边高一检测)已知N元素的最低化合价是-3价,最高化合价是+5价,那么下列物质中的N元素只具有氧化性的是( )
A.NH3 B.N2 C.NO2 D.HNO3
【解析】选D。N元素只具有氧化性,说明N元素处于最高价。
6.下列物质中含有的杂质(括号内为杂质),可以用加热的方法除去的是( )
A.CaCO3(CaO) B.Cu(CuO)
C.Na2CO3(NaHCO3) D.NaHCO3(Na2CO3)
【解析】选C。
【方法技巧】含氧酸盐的热稳定性:
(1)酸不稳定,其对应的盐也不稳定。例如硝酸较稳定,其对应的盐也较稳定,但是H2CO3不稳定,Na2CO3和K2CO3却很稳定,是一个例外。
(2)同一种酸的盐,热稳定性:正盐>酸式盐>酸。
例如,热稳定性:Na2CO3>NaHCO3>H2CO3
(3)同一酸根的盐的热稳定性顺序是:碱金属盐>过渡金属盐>铵盐。
(4)同一成酸元素,其高价含氧酸比低价含氧酸稳定,其相应含氧酸盐的稳定性顺序也是如此。
7.(双选)已知还原性:SO32->I->Br-,则向NaBr、NaI、Na2SO3混合液中通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
A.NaCl Na2SO4
B.NaCl NaBr Na2SO4
C.NaCl Na2SO4 I2
D.NaCl NaI Na2SO4
【解析】选A、B。由于Cl2、Br2、I2均可将SO32-氧化,亦即还原性SO32->I->Br-,所以通入Cl2少量时,先氧化Na2SO3为Na2SO4,剩余固体组成为NaBr、NaI、Na2SO4;随Cl2的增加NaI被氧化,剩余固体组成为NaCl、NaBr、Na2SO4;Cl2再增加,则NaBr被氧化,剩余固体组成为NaCl、Na2SO4。
8.用下图所示方法,检验某固体中是否含有Cl-。关于溶液①和溶液②,下列说法正确的是( )
A.①是BaCl2溶液,②是稀盐酸
B.①是AgNO3,②是HNO3溶液
C.①是稀硝酸,②是AgNO3溶液
D.①是稀硫酸,②是AgNO3溶液
【解析】选C。检验Cl-所用的试剂是AgNO3溶液和稀硝酸,若先加入AgNO3溶液,则第一个试管中将产生白色沉淀,再向沉淀上加稀硝酸看沉淀是否溶解,与图中的操作不相符;若先加入稀硝酸溶液,则可以排除第一个试管中CO32-等离子的干扰,Cl-仍然存在于溶液中,然后取上层清液加AgNO3溶液看有无白色沉淀生成,与图中的操作相符。
9.下列离子方程式与化学反应事实一致的是( )
A.石灰石溶于盐酸:CO32-+2H+====H2O+CO2↑
B.硫酸铜溶液与氢氧化钡溶液反应:
Cu2++2OH-====Cu(OH)2↓
C.硫酸氢钠溶液与氢氧化钾溶液反应:
H++OH-====H2O
D.硝酸银溶液与氯化钠溶液反应:
AgNO3+Cl-====AgCl↓+NO3-
【解析】选C。石灰石难溶于水,书写离子方程式时应保留分子式的形式,A错;CuSO4与Ba(OH)2反应时除生成Cu(OH)2沉淀外,还生成BaSO4沉淀,B错;AgNO3易电离,与NaCl溶液反应的离子方程式为Ag++Cl-====AgCl↓,D错。
10.同浓度同体积的Na2SO4、MgSO4、Al2(SO4)3溶液与同浓度的BaCl2溶液反应,消耗BaCl2溶液的体积比为( )
A.1∶2∶3 B.1∶1∶3
C.6∶3∶2 D.1∶1∶1
【解析】选B。此题可以写出三个反应的化学方程式,根据化学计量数的关系,求出三者的体积比。但是更为简便的是,三个反应的离子方程式均为Ba2++SO42-====BaSO4↓,从式中可以看出,SO42-和Ba2+是按1∶1进行反应的,三个同浓度同体积的溶液其SO42-的物质的量之比为1∶1∶3,所以消耗Ba2+的量也为1∶1∶3。
11.将AgNO3、Na2SO4、BaCl2三种物质按分子数为2∶1∶1的比例混合后溶于足量水中,最终溶液中大量存在的离子是( )
A.Ba2+和NO3- B.Na+和Cl-
C.Na+和NO3- D.Ag+和SO42-
【解析】选C。将三种物质按分子数为2∶1∶1的比例混合后溶于足量水中,Ag+和Cl-、SO42-和Ba2+恰好完全反应转化成AgCl和BaSO4沉淀,最终溶液中大量存在的离子是Na+和NO3-。
12.按如图所示的装置分别进行如下实验,各组物质反应后,溶液的导电性比反应前明显增强的是( )
A.向亚硫酸钠溶液中通入氯气:
Na2SO3+Cl2+H2O====Na2SO4+2HCl
B.向硝酸银溶液中通入少量氯化氢:
AgNO3+HCl====AgCl↓+HNO3
C.向硫化氢饱和溶液中通入少量氧气:
2H2S+O2====2H2O+2S↓
D.向NaOH溶液中通入少量氯气:
2NaOH+Cl2====NaCl+NaClO+H2O
【解析】选A。溶液导电性的强弱与离子浓度及离子所带的电荷数有关。A项中反应明显增加了离子浓度,生成了强电解质;B、D项离子浓度几乎不变,导电性几乎没有变化;
C项反应生成更弱的电解质,因此离子浓度减小,导电能力明显减弱。
二、非选择题(本题包括4小题,共52分)
13.(14分)海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子(I-)的形式存在。实验室里从海洋植物海藻中提取碘的流程如下:
某课外小组将上述流程②③设计如图所示:
已知②中发生反应的化学方程式为:2KI+Cl2====I2+2KCl。
回答下列问题:
(1)写出提取过程①③中实验操作名称:
①_____________,③________________。
(2)F中下层液体的颜色为______________色,上层液体中溶质的主要成分为_________________。
(3)从F中得到固态碘还需进行的操作是__________。
(4)在灼烧过程中,将使用到的(除泥三角外)实验仪器有_____________。
A.试管 B.瓷坩埚 C.坩埚钳
D.蒸发皿 E.酒精灯
【解析】(1)分离不溶性固体与溶液的方法是过滤,用四氯化碳从水溶液中提取碘的方法是萃取。(2)C中溶液的溶质是碘和KCl,向C中加入与水互不相溶的四氯化碳,因碘在四氯化碳中的溶解度远大于在水中的溶解度,且CCl4比水重,故F中下层溶液是碘的四氯化碳溶液,溶液呈紫红色;KCl易溶于水而不溶于有机溶剂四氯化碳,故上层是KCl的水溶液。(3)先将F中的液体进行分液,得到碘的CCl4溶液,然后采用蒸馏法蒸出CCl4得固态碘。(4)灼烧固体应用瓷坩埚,此外还需用坩埚钳、酒精灯。
答案:(1)①过滤 ③萃取
(2)紫红(或紫色) KCl
(3)分液、蒸馏
(4)B、C、E
14.(12分)某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是____________________________。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定存在的离子是_____________,离子方程式为______________。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有_________________。
(4)原溶液中可能大量存在的阴离子是下列A~D中的(填序号)_________________。
A.Cl- B.NO3-
C.CO32- D.OH-
【解析】(1)由于Cu2+在溶液中为蓝色,因此排除Cu2+的存在。
(2)Ag+、Mg2+中Ag+遇到稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失。
(3)Mg2+遇NaOH溶液,出现白色沉淀,肯定存在Mg2+。
(4)由于溶液中存在Ag+和Mg2+,Cl-、CO32-、OH-会反应生成沉淀,但NO3- 能够存在。
答案:(1)Cu2+
(2)Ag+ Ag++Cl-====AgCl↓
(3)Mg2+
(4)B
15.(12分)有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W X+H2O+CO2↑
②Z+CO2 →X+O2
③Z+H2O→Y+O2↑
④X+Ca(OH)2→Y+CaCO3↓
△
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:
W:_______、X:______、Y:_______、Z:________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是__________(写化学式),还原剂是___________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式:
__________________________________________。
【解析】①反应可认定为NaHCO3的分解反应:2NaHCO3
Na2CO3+H2O+CO2↑,该反应是非氧化还原反应。由X(Na2CO3)
逆推可知Z为Na2O2,Y为NaOH:2Na2O2+2CO2====
2Na2CO3+O2,2Na2O2+2H2O====4NaOH+O2↑,以上两反应都
是氧化还原反应,且Na2O2既是氧化剂又是还原剂。这样,
④反应为Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH,其离子反
应为CO32-+Ca2+====CaCO3↓。其反应不是氧化还原反应。
答案:(1)NaHCO3 Na2CO3 NaOH Na2O2
(2)②③ Na2O2 Na2O2
(3)Ca2++CO32-====CaCO3↓
△
====
16.(14分)(2011·苏州高一检测)海水是一个非常丰富的化学资源,以海水为原料可制取Mg、氯气、Br2、碘等。
(1)写出镁在二氧化碳中燃烧的化学方程式__________。
(2)工业上用电解饱和食盐水的方法制取氢氧化钠、氯气和氢气。但电解前要进行粗盐精制。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是( )
①过滤
②加过量NaOH溶液
③加适量盐酸
④加过量Na2CO3溶液
⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤②④①③
(3)液溴呈_________色,提取单质溴时常将氯气通入苦卤(海水晒盐后得到的母液)中将其中的溴离子氧化,反应的离子方程式为________________。
(4)加碘食盐中的含碘物质是___________,碘加热时变成紫色的蒸气,这一过程叫_______________。
【解析】粗盐精制时加过量NaOH溶液是为使Mg2+转化为Mg(OH)2沉淀从而除去;加过量Na2CO3溶液是为使Ca2+转化为CaCO3沉淀除去;加过量BaCl2溶液是为使SO42-转化为BaSO4沉淀除去,但在除杂过程中不能引入新的杂质离子,所以Na2CO3溶液必须加在BaCl2溶液之后以除去过量的Ba2+,最后加入适量盐酸除去过量的OH-、CO32-。
答案:(1)2Mg+CO2 2MgO+C
(2)C、D
(3)深红棕 Cl2+2Br-====2Cl-+Br2
(4)KIO3 升华
点燃
====
(二)
专题2 从海水中获得的化学物质
(45分钟 100分)
一、选择题(本题包括12小题,每小题4分,
共48分)
1.下列说法中正确的是( )
①两种溶液中,导电能力较强的就是强电解质
②不是强电解质的物质也不一定是弱电解质
③固体硫酸钡不导电,它是非电解质
④两种溶液中,溶质的量越多,导电能力越强
⑤浓溶液比稀溶液导电能力强
⑥液态氯、氯化氢都不导电,但其水溶液能导电,则二者应是电解质
A.①④⑥ B.①②③④⑤
C.只有② D.全部
【解析】选C。①导电能力不取决于电解质的强弱,由电解质电离的阴、阳离子的浓度大小决定;③BaSO4熔融状态,能完全电离,故为强电解质;④⑤中溶液的浓度不是决定导电能力的直接因素;⑥液氯是单质,因此不是电解质,也不是非电解质。
2.(2011·宿迁高一检测)氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是( )
【解析】选B。区域3表示的为不是置换、分解和化合的氧化还原反应。A是置换反应,C是分解反应,D是化合反应。
3.(2011·金华高一检测)某兴趣小组设计如下装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是( )
A.钠着火剧烈燃烧产生黄色的火焰
B.反应产生的大量白烟是氯化钠固体
C.棉球①的作用是吸收过量氯气防止产生污染
D.棉球②变蓝色则证明氯气已被碱液完全吸收
【解析】选D。金属钠在氯气中燃烧,产生白烟和黄色火焰,且生成白色的氯化钠固体,无苍白色火焰,碱液可以吸收多余的氯气防止产生污染,淀粉碘化钾溶液的作用是检验氯气是否被碱液吸收完全,因为淀粉碘化钾溶液遇到氯气变蓝,棉球②变蓝则说明碱液没有将氯气吸收完全。
4.(双选)下列说法正确的是( )
A.通过电解熔融的无水MgCl2可以制得金属镁
B.镁条在空气中燃烧所得的固体物质是氧化镁
C.氧化镁是优质的耐火材料
D.金属镁质地柔软,不适宜制作高强度的合金材料
【解析】选A、C。电解熔融无水MgCl2可制得镁;镁条在空气中燃烧会生成Mg3N2、MgO、C等固体物质;MgO的熔点很高,可作耐火材料;虽然金属镁质地柔软,但是它能够和许多金属形成合金,这些合金密度小,硬度和强度都比较大,被大量用于制造火箭、导弹和飞机的部件等。
5.(2011·延边高一检测)已知N元素的最低化合价是-3价,最高化合价是+5价,那么下列物质中的N元素只具有氧化性的是( )
A.NH3 B.N2 C.NO2 D.HNO3
【解析】选D。N元素只具有氧化性,说明N元素处于最高价。
6.下列物质中含有的杂质(括号内为杂质),可以用加热的方法除去的是( )
A.CaCO3(CaO) B.Cu(CuO)
C.Na2CO3(NaHCO3) D.NaHCO3(Na2CO3)
【解析】选C。
【方法技巧】含氧酸盐的热稳定性:
(1)酸不稳定,其对应的盐也不稳定。例如硝酸较稳定,其对应的盐也较稳定,但是H2CO3不稳定,Na2CO3和K2CO3却很稳定,是一个例外。
(2)同一种酸的盐,热稳定性:正盐>酸式盐>酸。
例如,热稳定性:Na2CO3>NaHCO3>H2CO3
(3)同一酸根的盐的热稳定性顺序是:碱金属盐>过渡金属盐>铵盐。
(4)同一成酸元素,其高价含氧酸比低价含氧酸稳定,其相应含氧酸盐的稳定性顺序也是如此。
7.(双选)已知还原性:SO32->I->Br-,则向NaBr、NaI、Na2SO3混合液中通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
A.NaCl Na2SO4
B.NaCl NaBr Na2SO4
C.NaCl Na2SO4 I2
D.NaCl NaI Na2SO4
【解析】选A、B。由于Cl2、Br2、I2均可将SO32-氧化,亦即还原性SO32->I->Br-,所以通入Cl2少量时,先氧化Na2SO3为Na2SO4,剩余固体组成为NaBr、NaI、Na2SO4;随Cl2的增加NaI被氧化,剩余固体组成为NaCl、NaBr、Na2SO4;Cl2再增加,则NaBr被氧化,剩余固体组成为NaCl、Na2SO4。
8.用下图所示方法,检验某固体中是否含有Cl-。关于溶液①和溶液②,下列说法正确的是( )
A.①是BaCl2溶液,②是稀盐酸
B.①是AgNO3,②是HNO3溶液
C.①是稀硝酸,②是AgNO3溶液
D.①是稀硫酸,②是AgNO3溶液
【解析】选C。检验Cl-所用的试剂是AgNO3溶液和稀硝酸,若先加入AgNO3溶液,则第一个试管中将产生白色沉淀,再向沉淀上加稀硝酸看沉淀是否溶解,与图中的操作不相符;若先加入稀硝酸溶液,则可以排除第一个试管中CO32-等离子的干扰,Cl-仍然存在于溶液中,然后取上层清液加AgNO3溶液看有无白色沉淀生成,与图中的操作相符。
9.下列离子方程式与化学反应事实一致的是( )
A.石灰石溶于盐酸:CO32-+2H+====H2O+CO2↑
B.硫酸铜溶液与氢氧化钡溶液反应:
Cu2++2OH-====Cu(OH)2↓
C.硫酸氢钠溶液与氢氧化钾溶液反应:
H++OH-====H2O
D.硝酸银溶液与氯化钠溶液反应:
AgNO3+Cl-====AgCl↓+NO3-
【解析】选C。石灰石难溶于水,书写离子方程式时应保留分子式的形式,A错;CuSO4与Ba(OH)2反应时除生成Cu(OH)2沉淀外,还生成BaSO4沉淀,B错;AgNO3易电离,与NaCl溶液反应的离子方程式为Ag++Cl-====AgCl↓,D错。
10.同浓度同体积的Na2SO4、MgSO4、Al2(SO4)3溶液与同浓度的BaCl2溶液反应,消耗BaCl2溶液的体积比为( )
A.1∶2∶3 B.1∶1∶3
C.6∶3∶2 D.1∶1∶1
【解析】选B。此题可以写出三个反应的化学方程式,根据化学计量数的关系,求出三者的体积比。但是更为简便的是,三个反应的离子方程式均为Ba2++SO42-====BaSO4↓,从式中可以看出,SO42-和Ba2+是按1∶1进行反应的,三个同浓度同体积的溶液其SO42-的物质的量之比为1∶1∶3,所以消耗Ba2+的量也为1∶1∶3。
11.将AgNO3、Na2SO4、BaCl2三种物质按分子数为2∶1∶1的比例混合后溶于足量水中,最终溶液中大量存在的离子是( )
A.Ba2+和NO3- B.Na+和Cl-
C.Na+和NO3- D.Ag+和SO42-
【解析】选C。将三种物质按分子数为2∶1∶1的比例混合后溶于足量水中,Ag+和Cl-、SO42-和Ba2+恰好完全反应转化成AgCl和BaSO4沉淀,最终溶液中大量存在的离子是Na+和NO3-。
12.按如图所示的装置分别进行如下实验,各组物质反应后,溶液的导电性比反应前明显增强的是( )
A.向亚硫酸钠溶液中通入氯气:
Na2SO3+Cl2+H2O====Na2SO4+2HCl
B.向硝酸银溶液中通入少量氯化氢:
AgNO3+HCl====AgCl↓+HNO3
C.向硫化氢饱和溶液中通入少量氧气:
2H2S+O2====2H2O+2S↓
D.向NaOH溶液中通入少量氯气:
2NaOH+Cl2====NaCl+NaClO+H2O
【解析】选A。溶液导电性的强弱与离子浓度及离子所带的电荷数有关。A项中反应明显增加了离子浓度,生成了强电解质;B、D项离子浓度几乎不变,导电性几乎没有变化;
C项反应生成更弱的电解质,因此离子浓度减小,导电能力明显减弱。
二、非选择题(本题包括4小题,共52分)
13.(14分)海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子(I-)的形式存在。实验室里从海洋植物海藻中提取碘的流程如下:
某课外小组将上述流程②③设计如图所示:
已知②中发生反应的化学方程式为:2KI+Cl2====I2+2KCl。
回答下列问题:
(1)写出提取过程①③中实验操作名称:
①_____________,③________________。
(2)F中下层液体的颜色为______________色,上层液体中溶质的主要成分为_________________。
(3)从F中得到固态碘还需进行的操作是__________。
(4)在灼烧过程中,将使用到的(除泥三角外)实验仪器有_____________。
A.试管 B.瓷坩埚 C.坩埚钳
D.蒸发皿 E.酒精灯
【解析】(1)分离不溶性固体与溶液的方法是过滤,用四氯化碳从水溶液中提取碘的方法是萃取。(2)C中溶液的溶质是碘和KCl,向C中加入与水互不相溶的四氯化碳,因碘在四氯化碳中的溶解度远大于在水中的溶解度,且CCl4比水重,故F中下层溶液是碘的四氯化碳溶液,溶液呈紫红色;KCl易溶于水而不溶于有机溶剂四氯化碳,故上层是KCl的水溶液。(3)先将F中的液体进行分液,得到碘的CCl4溶液,然后采用蒸馏法蒸出CCl4得固态碘。(4)灼烧固体应用瓷坩埚,此外还需用坩埚钳、酒精灯。
答案:(1)①过滤 ③萃取
(2)紫红(或紫色) KCl
(3)分液、蒸馏
(4)B、C、E
14.(12分)某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+中的几种离子。
(1)不做任何实验就可以肯定原溶液中不存在的离子是____________________________。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定存在的离子是_____________,离子方程式为______________。
(3)取(2)的滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有_________________。
(4)原溶液中可能大量存在的阴离子是下列A~D中的(填序号)_________________。
A.Cl- B.NO3-
C.CO32- D.OH-
【解析】(1)由于Cu2+在溶液中为蓝色,因此排除Cu2+的存在。
(2)Ag+、Mg2+中Ag+遇到稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失。
(3)Mg2+遇NaOH溶液,出现白色沉淀,肯定存在Mg2+。
(4)由于溶液中存在Ag+和Mg2+,Cl-、CO32-、OH-会反应生成沉淀,但NO3- 能够存在。
答案:(1)Cu2+
(2)Ag+ Ag++Cl-====AgCl↓
(3)Mg2+
(4)B
15.(12分)有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W X+H2O+CO2↑
②Z+CO2 →X+O2
③Z+H2O→Y+O2↑
④X+Ca(OH)2→Y+CaCO3↓
△
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:
W:_______、X:______、Y:_______、Z:________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是__________(写化学式),还原剂是___________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式:
__________________________________________。
【解析】①反应可认定为NaHCO3的分解反应:2NaHCO3
Na2CO3+H2O+CO2↑,该反应是非氧化还原反应。由X(Na2CO3)
逆推可知Z为Na2O2,Y为NaOH:2Na2O2+2CO2====
2Na2CO3+O2,2Na2O2+2H2O====4NaOH+O2↑,以上两反应都
是氧化还原反应,且Na2O2既是氧化剂又是还原剂。这样,
④反应为Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH,其离子反
应为CO32-+Ca2+====CaCO3↓。其反应不是氧化还原反应。
答案:(1)NaHCO3 Na2CO3 NaOH Na2O2
(2)②③ Na2O2 Na2O2
(3)Ca2++CO32-====CaCO3↓
△
====
16.(14分)(2011·苏州高一检测)海水是一个非常丰富的化学资源,以海水为原料可制取Mg、氯气、Br2、碘等。
(1)写出镁在二氧化碳中燃烧的化学方程式__________。
(2)工业上用电解饱和食盐水的方法制取氢氧化钠、氯气和氢气。但电解前要进行粗盐精制。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是( )
①过滤
②加过量NaOH溶液
③加适量盐酸
④加过量Na2CO3溶液
⑤加过量BaCl2溶液
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③ D.⑤②④①③
(3)液溴呈_________色,提取单质溴时常将氯气通入苦卤(海水晒盐后得到的母液)中将其中的溴离子氧化,反应的离子方程式为________________。
(4)加碘食盐中的含碘物质是___________,碘加热时变成紫色的蒸气,这一过程叫_______________。
【解析】粗盐精制时加过量NaOH溶液是为使Mg2+转化为Mg(OH)2沉淀从而除去;加过量Na2CO3溶液是为使Ca2+转化为CaCO3沉淀除去;加过量BaCl2溶液是为使SO42-转化为BaSO4沉淀除去,但在除杂过程中不能引入新的杂质离子,所以Na2CO3溶液必须加在BaCl2溶液之后以除去过量的Ba2+,最后加入适量盐酸除去过量的OH-、CO32-。
答案:(1)2Mg+CO2 2MgO+C
(2)C、D
(3)深红棕 Cl2+2Br-====2Cl-+Br2
(4)KIO3 升华
点燃
====
